肺宁颗粒对放射性肺损伤大鼠细胞因子表达的影响
石磊,穆懿,马虎,李列,柏玉举△,陈红
(1.遵义医学院附属医院 胸部肿瘤科,贵州 遵义 563003;2.贵州省生物治疗人才基地,贵州 遵义 563003;3.安顺市人民医院 肿瘤科,贵州 安顺 561000)
肺宁颗粒对放射性肺损伤大鼠细胞因子表达的影响
石磊1,2,穆懿1,2,马虎1,2,李列1,2,柏玉举1,2△,陈红3
(1.遵义医学院附属医院 胸部肿瘤科,贵州 遵义 563003;2.贵州省生物治疗人才基地,贵州 遵义 563003;3.安顺市人民医院 肿瘤科,贵州 安顺 561000)
目的 探讨肺宁颗粒防治大鼠急性放射性肺损伤(radiation induced lung injur,RILI)及对细胞因子转化生长因子β1(transforming growth factor-β1,TGF-β1)、白介素-1(interleukin-1,IL-1)、白介素-6(interleukin-6,IL-6)的影响。方法 选取105只雌性SD大鼠,根据随机数字表法将大鼠分成7组,分别为正常组、模型组、地塞米松组(阳性药物)、肺宁颗粒低剂量组、肺宁颗粒中剂量组、肺宁颗粒高剂量组、肺宁颗粒预防组,每组各15只。除去正常组,余各组均全胸接受X线单次照射15 Gy,DT30Gy/2f/1w。肺宁颗粒预防组于放射治疗前1周起开始灌胃肺宁颗粒;余组在照射后48 h起灌胃。于2、4、6周分别采用随机法每组取出5只大鼠,处死后取右肺,采用免疫组化法检测放疗后不同时段各组大鼠肺组织TGF-β1、IL-1、IL-6的含量。结果 放疗后第2、4、6周模型组大鼠肺组织TGF-β1、IL-1、IL-6强表达,显著高于正常组 (P<0.05)。经肺宁颗粒干预后各时间点大鼠肺组织中TGF-β1、IL-1、IL-6表达显著低于同时点模型组(P<0.05),且呈一定浓度依赖性。但肺宁颗粒高、中、低剂量组TGF-β1、IL-1、IL-6表达均不同程度高于地塞米松组(P<0.05),而肺宁颗粒预防组上述指标表达低于地塞米松组(P<0.05)。结论 肺宁颗粒能够通过降低TGF-β1、IL-1、IL-6的表达防治放射性肺损伤。肺宁颗粒各治疗组疗效不如地塞米松,但肺宁颗粒预防的疗效优于地塞米松。
放射性肺损伤;肺宁颗粒;转化生长因子-β1;白介素-1;白介素-6
肺是一个放射敏感器官,由于在肺癌和其他胸部肿瘤的放疗过程中常引发放射性肺损伤又名放射性肺炎(radiation-induced lung injury,RILI)而限制了其在肿瘤治疗中的有效实施,尤其是后期放射性肺纤维化国内外目前尚无有效的应对治疗方法,严重影响了肿瘤放疗疗效和患者生存质量,患者常因医治无效而死亡。临床上常规使用大剂量糖皮质激素冲击治疗,然而不良反应较大,故探究放射性肺损伤的预防机制是目前临床上十分关注的问题。大量的临床及实验研究结果表明[1-3],对放射性肺损伤机体进行中成药治疗能减轻疾病慢性症状,对于促进受体生活质量提高,减少死亡现象具有重要意义,因此对中药防治放射性肺损伤的机制进行研究和探索显得尤为必要。本研究所选用的中成药“肺宁颗粒”重要成分为返魂草,中医典籍认为返魂草具有温肺、止咳、下气、化痰的功能。前期实验已成功建立大鼠放射性肺损伤模型[4],并初步证实肺宁颗粒能有效地预防大鼠放射性肺损伤的发生,但是具体作用机制尚未清楚。目前众多的研究表明[5-7],细胞因子的异常释放和激活是导致放射性肺损伤发生的重要原因之一,体现在放射性肺损伤发生的全过程。与放射性肺损伤的发生发展密切相关的细胞因子主要有细胞因子转化生长因子β1(transforming growth factor-β1,TGF-β1)、白介素-1(interleukin-1,IL-1)、白介素-6(interleukin-6,IL-6)等。本研究拟通过免疫组化检测大鼠肺组织TGF-β1、IL-1、IL-6的表达以探讨肺宁颗粒防治放射性肺损伤的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康雌性7周龄SPF级SD大鼠105只,购于重庆第三军医大学实验动物中心,体质量(210±20)g。在清洁动物房常规饲养1周,大鼠饲养环境温度22 ℃~24 ℃,湿度40%~70%,自然光照。观察无异常纳入实验计划组。
1.1.2 药物:肺宁颗粒(返魂草,吉林益民堂制药有限公司,国药准字:Z22023003);醋酸地塞米松片(浙江琚制药股份有限公司,国药准字:H33020822;产品批号:09072)。24片溶于90 mL蒸馏水中制成浓度为0.2 mg/mL悬液。
1.1.3 仪器: SIMULIX HQ X线模拟定位机(核通公司),TREAMENT SYSTEM直线加速器(Elekta Precise),RM2235型病理切片机(莱卡),ckx 41显微镜(Olympus),FA214型电子天平(上海海康电子仪器厂)。
1.2 方法
1.2.1 动物分组:选取105只成年、雌性SD大鼠,根据随机数字表法随机分为7组,即正常组、模型组、肺宁颗粒预防组、肺宁颗粒高剂量组、肺宁颗粒中剂量组、肺宁颗粒低剂量组、地塞米松组(阳性药物),各组均为15只。
1.2.2 模型建立:按穆懿等[4]方法建立急性放射性肺损伤大鼠模型。全部大鼠同时以7%水合氯醛(2 mL/kg)腹腔注射麻醉,正常组麻醉后不进行照射。余各组将大鼠保持仰卧位,固定在自制的泡沫模具内,铅挡保护头和腰,于模拟机下定位,行直线加速器6MV-X线行全胸单次照射,照射野上至大鼠前肢两腋窝中点线,下至剑突水平,照射野4.5 cm×4 cm,源靶距100 cm,照射剂量各组分别为单次全胸15 Gy/次,1周内照射2次(周二、周五)结束,DT30Gy/2f/1w。于遵义医学院附属医院肿瘤放疗中心进行,照射前加速器室用紫外线照射消毒,照射完常规饲养。
1.2.3 灌药方法:药物用量的计算参照《中药药理研究方法学》[8],根据成人临床用量,按大鼠的等效剂量折算系数,换算为大鼠给药量。所有药物均使用蒸馏水溶解,各组均灌胃约2 mL溶液。各组药物剂量分别为:正常组(蒸馏水)、模型组(蒸馏水)、肺宁颗粒预防组(0.1 g/kg肺宁颗粒溶液)、肺宁颗粒高剂量组(0.2 g/kg肺宁颗粒溶液)、肺宁颗粒中剂量组(0.1 g/kg肺宁颗粒溶液)、肺宁颗粒低剂量组(0.05 g/kg肺宁颗粒溶液)、地塞米松组(1.04 mg/kg地塞米松溶液)。肺宁颗粒预防组大鼠则在照射前7 d开始灌胃,其余各组均在照射后第2天开始灌药,1天1次,药物灌胃持续至处死。每周对大鼠的体质量实施1次测量,并依据体质量变化情况实时调整灌胃的药量。
1.2.4 取材方法与指标检测:于2、4、6周3个时间点,各组随机取5只大鼠。7%水合氯醛2 mL/kg对大鼠进行腹腔麻醉后处死,取大鼠右肺中叶,10%福尔马林溶液固定24 h,石蜡包埋,5 μm连续切片,其后行免疫组化检验,应用酶标二步法对肺组织中相关指标(TGF-β、IL-1及IL- 6)的表达水平进行检测。检测方法如下:
① 脱蜡:将石蜡切片在60 ℃恒温烤箱中烘烤20 min,后立即放入二甲苯中15 min,再放入二甲苯II中15 min;
② 水化:将肺组织切片取出,在100%无水乙醇中静置5 min,其后依次在95%、80%及50%乙醇中分别静置2 min。然后将切片取出,放置在双蒸馏水浸洗3 min×2次,再用PBS缓冲液漂洗2次后置于3%过氧化氢甲醇闭光10 min,将肺组织切片取出,并将其周围的液体擦干,最后于湿盒中平放,采用PBS缓冲液漂洗3 min×3次;
③ 修复:肺组织切片静置于柠檬酸盐缓冲液中行微波修复,采用中火煮沸后断电,并在间隔10 min后采用低火行二次煮沸。其后将肺组织切片取出,并将其周围的液体擦干,于湿盒中平放,待自然冷却后PBS(pH7.4)洗3次,每次5 min;
④ 封闭:加血清封闭液6%山羊血清于切片组织上置于保湿盒,室温下30~60 min;
⑤ 加一抗:将肺组织切片取出,并将其周围的液体擦干,于湿盒中平放,向其内滴加稀释过的一抗(稀释比例为1:100),4 ℃过夜;
⑥ 加二抗:取出切片在37 ℃恒温烤箱中复温30 min;取出切片,甩掉并擦干组织周围的液体,平放于湿盒中,用PBS缓冲液漂洗5 min×3次;向组织中滴加稀释过的二抗(稀释比例为1:1000),在室温下进行孵育,时间60 min,其后静置在PBS缓冲液中行PBS冲洗,时间5 min,连续进行3次,最后将肺组织切片取出,并将其周围的液体擦干,于湿盒中平放。
⑦ 显色:向肺组织切片中滴加事先准备好的显色剂,剂量50~100 μL,并于室温下进行孵育,时间5~30 min,也可在光镜下对显色实施控制。待显色完全后,使用蒸馏水冲洗显色剂,其后经9 min PBS缓冲液冲洗,1 min苏木素复染,1s1%盐酸酒精分化及自来水冲洗,氨水返蓝,流水冲洗(6 min)等步骤,确保显色剂完全冲洗干净。
⑧ 脱水:将肺组织切片依次在50%、80%、100%乙醇中脱水,取出切片置入二甲苯10 min。
⑨ 封片,拍照:对获得的图片进行分析,采用Image-Pro Plus 6.0软件,计算累积光密度值(IOD)。

2 结果
2.1 不同时期内各组大鼠肺组织内的TGF-β1表达量比较 结果显示放疗后第2、4、6周模型组大鼠肺组织TGF-β1在肺泡间隔、细支气管平滑肌、血管平滑肌、血管内皮、血管周围呈强表达,阳性面积大,与正常组比较差异有统计学意义(P<0.05)。经肺宁颗粒干预后各时间点大鼠肺组织中TGF-β1表达仅呈弱表达或不表达,阳性面积少,均低于各时点模型组(P<0.05),且呈一定浓度依赖性。但肺宁颗粒高、中、低剂量组TGF-β1表达均不同程度高于地塞米松组(P<0.05),而肺宁颗粒预防组上述指标表达低于地塞米松组(P<0.05)。见图1、表1。
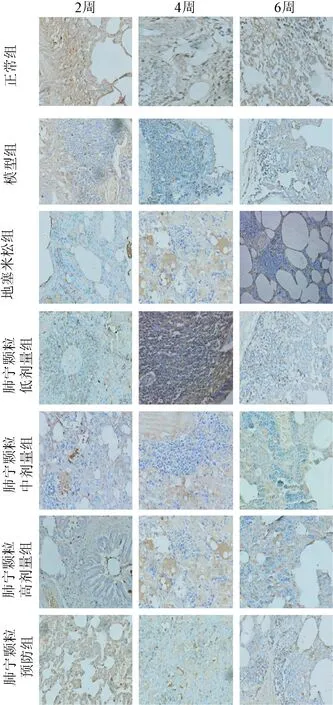
图1 TGF-β1免疫组化图(DAB,×200)Fig.1 Immunohistochemical staining of TGF-β1(DAB,×200)


组别2周4周6周正常组335.74±18.3346.70±20.45329.64±17.50模型组535.30±23.9*849.70±30.47*964.70±42.2*地塞米松组450.51±27.31#495.07±10.79#428.90±22.35#肺宁颗粒低剂量组499.75±13.82#△543.45±25.63#△543.88±26.63#△肺宁颗粒中剂量组476.24±31.69#517.91±28.82#454.43±32.78#▲肺宁颗粒高剂量组448.43±32.79#▲509.67±26.99#▲438.63±31.98#▲肺宁颗粒预防组439.83±31.38#▲▽492.67±16.79#▲427.83±24.14#▲
*P<0.05,与正常组比较,compared with normal group;#P<0.05,与模型组比较,compared with model group;△P<0.05,与地塞米松组比较,compared with dexamethasone group;▲P<0.05,与肺宁颗粒低剂量组比较,compared with Feining granule low dose group;▽P<0.05,与肺宁颗粒中剂量组比较,compared with Feining granule middle dose group
2.2 不同时期内各组大鼠肺组织内的IL-1表达检测 结果显示放疗后第2、4、6周模型组大鼠肺组织IL-1在肺泡间隔、细支气管平滑肌、血管平滑肌、血管内皮、血管周围呈强表达,阳性面积大,与正常组比较差异有统计学意义(P<0.05)。经肺宁颗粒干预后各时间点大鼠肺组织中IL-1表达仅呈弱表达或不表达,阳性面积少,均低于各时点模型组(P<0.05),且呈一定浓度依赖性。但肺宁颗粒高、中、低剂量组IL-1表达均不同程度高于地塞米松组(P<0.05),而肺宁颗粒预防组上述指标表达低于地塞米松组(P<0.05)。见图2、表2。

图2 IL-1免疫组化图(DAB,×200)Fig.2 Immunohistochemical staining of IL-1(DAB,×200)

组别2周4周6周正常组450.19±39.41544.28±29.93523.35±64.99模型组994.60±92.11*1105.90±104.59*1427.60±113.56*地塞米松组660.88±13.62#859.02±22.99#646.16±26.58#肺宁颗粒低剂量组862.51±31.17#△946.24±16.04#△980.49±20.47#△肺宁颗粒中剂量组795.96±75.11#△866.98±33.66*▲754.05±21.96#△▲肺宁颗粒高剂量组758.06±25.67#△▲852.95±20.11#▲729.44±21.96#△▲肺宁颗粒预防组671.10±59.14#▲▽▼849.15±27.51#▲685.95±84.48#▲
*P<0.05,与正常组比较,compared with normal group;#P<0.05,与模型组比较,compared with model group;△P<0.05,与地塞米松组比较,compared with dexamethasone group;▲P<0.05,与肺宁颗粒低剂量组比较,compared with Feining granule low dose group;▽P<0.05,与肺宁颗粒中剂量组比较,compared with Feining granule middle dose group;▼P<0.05,与肺宁颗粒高剂量组比较,compared with Feining granule high dose group
2.3 不同时期内各组大鼠肺组织内的IL-6的表达量检测 结果显示放疗后第2、4、6周模型组大鼠肺组织IL-6在肺泡间隔、细支气管平滑肌、血管平滑肌、血管内皮、血管周围呈强表达,阳性面积大,与正常组比较差异有统计学意义(P<0.05)。经肺宁颗粒干预后各时间点大鼠肺组织中IL-6表达仅呈弱表达或不表达,阳性面积少,均低于各时点模型组(P<0.05),且呈一定浓度依赖性。但肺宁颗粒高、中、低剂量组IL-6表达均不同程度高于地塞米松组(P<0.05),而肺宁颗粒预防组上述指标表达低于地塞米松组(P<0.05)。见图3、表3。
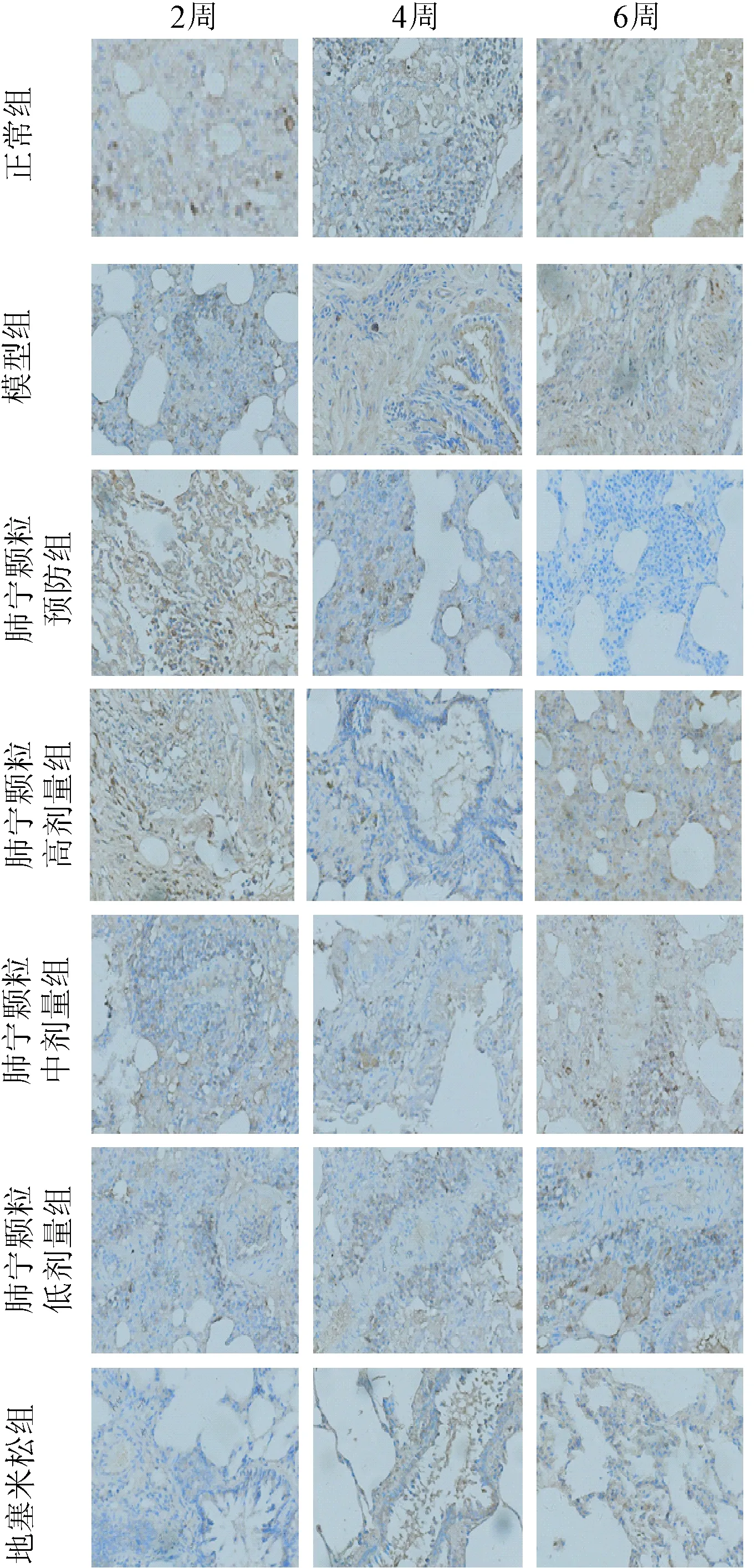
图3 IL-6免疫组化图(DAB,×200)Fig.3 Immunohistochemical staining of IL-6(DAB,×200)

组别2周4周6周正常组555.45±55.55586.61±53.20580.78±34.97模型组920.60±20.00*1058.10±40.6*1201.20±121.90*地塞米松组834.55±19.65#842.30±20.36#561.72±54.27#肺宁颗粒低剂量组908.55±43.33△990.73±24.59#△989.53±22.89#△肺宁颗粒中剂量组858.55±35.67#▲979.13±39.70#△850.15±44.98#▲△肺宁颗粒高剂量组822.55±16.95#▲965.13±37.23#△830.45±37.93#▲△肺宁颗粒预防组753.49±18.20#△▲▽▼846.9±20.45#▲▽572.32±50.95#▲▽▼
*P<0.05,与正常组比较,compared with normal group;#P<0.05,与模型组比较,compared with model group;△P<0.05,与地塞米松组比较,compared with dexamethasone group;▲P<0.05,与肺宁颗粒低剂量组比较,compared with Feining granule low dose group;▽P<0.05,与肺宁颗粒中剂量组比较,compared with Feining granule middle dose group;▼P<0.05,与肺宁颗粒高剂量组比较,compared with Feining granule high dose group
3 讨论
放射性肺损伤是恶性胸部肿瘤在接受放射照射治疗后出现的常见治疗并发症。RILI存在多细胞-因子的级联效应,多种细胞因子参与其中,其中被研究证实最为密切的包括2类[9-10]:第一类为调节细胞外基质代谢、促进成纤维细胞增殖分化的转化生长因子-β,JGF-β第二类为介导炎性反应的白介素-1、白介素-6及肿瘤坏死因子(tumor necrosis factor-α,TNF-α)。TGF-β作为重要的生长因子之一,其检测值增高预示着放射性肺损伤的发生[11]。Madani I[12]通过对临床肺癌放疗患者血浆TGF-β含量的研究,发现其持续升高常存在于放疗结束时发生放射性肺损伤的患者中,因此提出了用TGF-β作为放射性肺损伤的危险预测因子。IL是由巨噬细胞分泌的多肽类细胞因子,尤其是IL-1和IL-6 2者既是炎症性细胞因子,也是重要的免疫调节因子,都通过免疫细胞介导发热和调节免疫及纤维化应答,能够刺激成纤维细胞的增殖和胶原合成,从而促进肺纤维化形成。
在前期疗效观察研究中经胸部CT、HE染色结果证实肺宁颗粒能明显减轻模型大鼠肺组织炎症、肺水肿,且照射后6周的疗效明显优于激素;而预防药物干预的效果优于治疗,治疗中的高、中剂量用药优于低剂量。基于肺宁颗粒对大鼠急性放射性肺损伤的有较好防治效果,其防治RILI是否也与细胞因子TGF-β1、IL-1、IL-6有关。本实验通过免疫组化法检测不同时相各组大鼠肺组织TGF-β1、IL-6、IL-1的表达量,结果显示放疗后第2、4、6周模型组大鼠肺组织TGF-β1、IL-6、IL-1在肺泡间隔、细支气管平滑肌、血管平滑肌、血管内皮、血管周围呈强表达,阳性面积大,与正常对照组比较,差异有统计学意义(P<0.05) ,说明放射性肺损伤小鼠模型建立成功。肺宁颗粒高剂量组、中剂量组、低剂量组、地塞米松治疗组各种炎性因子也一样呈弱表达或不表达,均低于模型组(P<0.05),说明上述干预措施均能不同程度减轻放疗后肺损伤。地塞米松治疗组各时间点TGF-β1、IL-6、IL-1表达均高、中、低剂量组(P<0.05),说明地塞米松的疗效可能优于肺宁颗粒产品剂量组,但是没有肺宁颗粒预防组的疗效佳,提前使用肺宁颗粒预防能够减少炎性因子的释放,从而减轻放疗后肺组织损伤。以上结果说明肺宁颗粒可以降低大鼠肺组织TGF-β1、IL-6、IL-1的表达量,且呈一定浓度依赖性关系,从而减少肺组织的炎性渗出,最终降低放射性肺损伤的发生,肺宁颗粒对放射性肺损伤有防治作用。
综上所述,肺宁颗粒具有防治大鼠急性放射性肺损伤的作用,预防效果优于激素,但治疗效果较之略差。值得注意的是,肺宁颗粒是中成药物,其毒副反应低,相较于激素而言,其临床运用前景较广。其防治急性放射性肺损伤的机制可能与降低肺组织中的TGF-β1、IL-1、IL-6细胞因子表达有关,是否还与其他因素有关待进一步的研究。
[1] 窦永起,杨明会,林明雄,等.放射性肺损伤中医证候学特点及其演变规律的实验研究[J].中华中医药杂志,2010,24(6):706-708.
[2] 王文成.放射性肺炎中医辨识初探[J].浙江中医药大学学报,2006,30(5):482-483.
[3] 李兰群,张纾难,晁恩祥.急性放射性肺炎中医辨识附35例临床分析[J]北京中医药大学学报,1999,22(2):44-45.
[4] 穆懿,罗世政,柏玉举,等.急性放射性肺损伤大鼠模型建立的探讨[J].吉林医学,2014,35(12):2499-2500.
[5] 曹京旭,张旭志.细胞因子与放射性肺损伤[J].国外医学放射医学核医学册,2001,25(4):181-185.
[6] 蒋恒,杨伟志.细胞因子与放射性肺损伤[J].中华放射肿瘤学杂志,2006,15(6):512-515.
[7] 李凤玉,刘秀芳,张建宇.放射性肺损伤发生机制的研究进展[J].现代肿瘤医学,2009,17(3):576-578.
[8] 赵一,孙瑞元.常用实验动物的基本知识和方法//陈奇,主编.中药药理研究方法学[M].3版.北京:人民卫生出版社,2011:63-78.
[9] Rube CE,Uthe D,Schmid KW,et al.Dose dependent induction of transforming growth factor beta(TGF-beta)in the lung tissue of fibrosis-p rone mice after thoracicir radiation[J].Int J RadiatOn-col Biol Phys,2000,47(4):1033-1042.
[10] 孙苏平,金怡宁,魏怡,等.转化生长因子β1的表达与肺放射性损伤关系研究[J].中华放射肿瘤学杂志,1999,8(3):155-157.
[11] 唐求,王鹏,胡绍.放射性肺炎的发生机制及其应对[J].临床肺科杂志,2005,10(5):634-636.
[12] Madani I,De Ruyck K,Goeminne H,et al.Predicting risk of radiation-induced lung injury[J].J Thorac Oncol,2007,2(9):864-874.
(编校:王俨俨)
Effect of Feining granule on expression of cytokines in rats with radiation-induced lung injury
SHI Lei1,2, MU Yi1,2, MA Hu1,2, LI Lie1,2, BAI Yu-ju1,2Δ, CHEN Hong3
(1.Department of Thoracic Cancer, Affiliated Hospital of Zunyi Medical University, Zunyi 563003, China; 2.Talent Base of Biotherapy in Guizhou Province, Zunyi 563003, China; 3.Department of Oncology, People’s Hospital of Anshun City, Anshun 561000, China)
ObjectiveTo investigate Feining granule on prevention and treatment of rat with radiation-induced lung injur (RILI) and its effect on cytokine transforming growth factor-β1(TGF-β1), interleukin-1 (IL-1), interleukin-6 (IL-6).Methods105 SD female rats were selected, according to random number table, and divided into seven groups: normal group, model group, dexamethasone group(positive drug), Feining granule low-dose group (FN low-dose group), FN medial-dose group, FN high-dose group and FN prevention group, 15 rats in each group. Except for normal group, all remaining groups received the X-ray irradiation of 15Gy, DT30Gy/2f/1w. FN prevention group were intragastric infused with FN granule one week before irradiation, and the other groups 48 h after irradiation. Five rats were sacrificed randomly at 2, 4, 6 weeks respectively, and right lung tissues were taken out. The contents of TGF-β1, IL-1 and IL-6 were detected by immunohistochemical method.ResultsTGF-β1, IL-1 and IL-6 contents in lung tissue of model group at 2, 4, 6 weeks were higher than those of normal group (P<0.05). The above indicators after treated by Feining granule were lower than those of model group at each time (P<0.05),with a concentration-dependence manner to some extent.The above indicators in FN high-, medial- and low-dose group were higher than those in dexamethasone group (P<0.05), to some extent. However, the above indicators in FN prevention group were lower than those in dexamethasone group (P<0.05).ConclusionFeining granule could prevent and cure radiation induced lung injury through decreasing TGF-β1, IL-1 and IL-6 content. The efficacy of dexamethasone is stronger than FN treatment groups, but is weaker than FN prevention.
radiation-induced lung injury; Feining granule; transforming growth factor-β1; interleukin-1; interleukin-6
贵州省中医药管理局(QZYY2010-66)
石磊,男,硕士,主治医师,研究方向:肺癌放射治疗的基础与临床研究,E-mail:sl4772@sina.com;柏玉举,通讯作者,男,教授,硕士生导师,研究方向:胸部肿瘤放射治疗的基础与临床研究,E-mail:byj6618@163.com。
R563.1
A
1005-1678(2015)08-0023-05

