肝移植术后无激素免疫抑制方案研究进展
段鑫 郑树森
自1963 年Starzl 等[1]完成人类第1 例肝移植以来,经过50 多年的发展,肝移植外科技术得到了长足的进步,而作为肝移植术后保驾护航重要手段的免疫抑制方案也发生了巨大的变化。糖皮质激素有较强的抗炎作用[2],但缺乏特异性,且长期应用会引起大量不良反应,例如易感染、高脂血症、高血压、糖尿病、骨质疏松症、股骨头坏死和库欣综合征等,对肝移植受者的生理及心理状态产生严重影响[3]。此外,糖皮质激素的应用与肝移植术后丙型肝炎的复发密切相关[4]。糖皮质激素的使用越来越有争议,使得许多移植中心开始探索无激素免疫抑制方案的有效性及安全性。从理论上讲无激素方案有以下优点[5]:(1)完全避免激素暴露;(2)限制潜在激素相关不良反应的发生;(3)避免激素停药后急性排斥反应的发生;(4)避免影响诱导免疫耐受的过程。然而,在实际临床应用中,无激素方案是否安全、有效?是否能使肝移植受者获益?本文将就相关问题作一综述。
1 糖皮质激素在肝移植中的作用及机制
自1953 年Dempster 等[6]应用犬类模型首次证实糖皮质激素可作为免疫抑制剂以来,其免疫抑制机制逐渐被认识,主要包括以下几个方面[7-8]:封存CD4+T 细胞中的网状内皮系统;通过抑制淋巴因子和细胞因子(IL-1、IL-2、IL-6 等),抑制淋巴细胞的增殖和功能;抑制抗原处理和呈递;激活核酸内切酶,从而导致淋巴细胞凋亡加速;抑制细胞粘附分子的表达,从而抑制白细胞的迁移;抑制白三烯、前列腺素、组胺、缓激肽等炎症介质的释放;抑制巨噬细胞移动抑制因子表达。糖皮质激素能够作用于免疫反应的各个环节,具有广泛的免疫抑制作用,更是控制急性排斥反应的首选药物[9]。
2 无激素免疫抑制方案安全性评价
糖皮质激素应用于肝移植免疫抑制方案的主要目的是预防和减少移植后排斥反应的发生,因此评判无激素方案的安全性主要在于其是否会增加排斥反应的发生,是否会影响移植受者生存率,国内外各移植中心就此问题进行了大量研究。早在20 世纪90 年代初,英国伯明翰肝移植中心就将使用低剂量糖皮质激素并在术后3 个月停用作为肝移植术后标准免疫抑制方案,并无证据表明该方案引起肝移植术后急/慢性排斥反应的增加[10]。Tisone 等[11]在1999 年报道了肝移植术后无激素免疫抑制方案(环孢素+硫唑嘌呤)的成功应用,使用无激素方案与使用含激素方案的受者急性排斥反应发生率、术后2 年生存率差异均无统计学意义。Ringe 等[12]则报道了成人肝移植术后采用他克莫司+吗替麦考酚酯(mycophenolate mofetil,MMF)二联无激素方案,移植后急性排斥反应发生率为26%,但约有33%的受者发生急性肾功能衰竭需要行血液透析治疗,这可能与他克莫司的剂量有关。Segev 等[13]一项Meta分析结果证实,无激素方案能减少肝移植术后糖尿病、高脂血症、CMV 感染、高血压病、激素抵抗性排斥反应等情况的发生。但与此同时,有学者认为无激素免疫抑制方案并不优于传统方案。Reggiani等[14]研究发现,肝移植术后采用单药免疫抑制方案(他克莫司或环孢素)急性排斥反应发生率高达65%,因而建议在无激素方案中应当联合抗代谢抑制剂(硫唑嘌呤或MMF)。Liu 等[15]研究发现,与标准免疫抑制方案相比,无激素方案并未在肝移植术后生存率、肿瘤复发率等方面使受者获益,但却与胆道并发症、移植肝早期功能衰竭、大量胸水的发生密切相关。可见目前肝移植术后无激素免疫抑制方案虽然已被国内外大多数移植中心认可,认为该方案并不会影响移植肝功能、急/慢性排斥反应的发生以及受者生存率[3,5,16-17],但适用人群的选择和具体方案的制定仍存有争议。
3 无激素免疫抑制方案种类及应用
目前临床应用的非糖皮质激素免疫抑制剂基本上分为4 类[18-19]:(1)CNI,常用的有环孢素和他克莫司;(2)抗代谢药物,常用的有硫唑嘌呤、MMF等;(3)哺乳动物雷帕霉素靶蛋白,雷帕霉素;(4)抗淋巴细胞抗体,分为多克隆抗体和单克隆抗体,目前临床应用的多克隆抗体有抗胸腺细胞球蛋白和抗淋巴细胞球蛋白,单克隆抗体有抗CD3 单克隆抗体、抗IL-2 受体单克隆抗体(达利珠单抗)以及抗CD25单克隆抗体(巴利昔单抗)等。国外各移植中心不同无激素免疫抑制方案研究结果见表1。
3.1 单药他克莫司无激素方案
单药他克莫司无激素方案是符合免疫抑制方案种类最小化原则的,因而国外许多移植中心就此方案的可行性进行了研究。Margarit 等[20]根据肝移植术后免疫抑制方案的不同将60 例受者分为他克莫司组和他克莫司+糖皮质激素组,随访发现两组受者急性排斥反应和严重排斥反应发生率相似(39%和32%,14%和9%,P 均>0.05),他克莫司+糖皮质激素组受者丙型肝炎复发率更高,但差异无统计学意义(71%和53%,P >0.05)。研究者考虑到部分他克莫司组受者在发生急性排斥反应时也使用了糖皮质激素治疗,因此剔除该部分病例数据后进一步比较了无激素暴露的实际他克莫司组和未调整免疫抑制方案的实际他克莫司+糖皮质激素组,随访结果发现前者肝移植术后2 周至3 个月HCV 病毒载量明显低于后者。在3 年随访结束时,实际他克莫司+糖皮质激素组中约45%的受者发生了肝硬化或HCV 相关的死亡,这一结果在实际他克莫司组为9%(P <0.05);同时,实际他克莫司+糖皮质激素组受者肝硬化评分也显著高于实际他克莫司组[(3.73 ±1.94)分和(1.78±1)分,P <0.05)]。Samonakis 等[21]对丙型肝炎肝硬化的肝移植受者研究显示,采用单药他克莫司方案(单药组)和他克莫司+硫唑嘌呤+泼尼松三联方案(激素组)的两组受者,急性排斥反应的发生率分别为18.5%和27.5%;术后3 个月移植肝活检发现激素组慢性排斥反应发生率更高,但这一结果差异无统计学意义(86%和70%,P >0.05)。Lerut 等[22]对156 例成人肝移植受者研究发现,与采用单药他克莫司方案的受者相比,接受他克莫司+糖皮质激素方案的受者术后1 年移植肝病理检查结果显示出更高的HCV 相关肝硬化倾向。类似的结果在Weiler 等[29]的研究中也被证实,该研究发现大剂量糖皮质激素治疗与HCV 阳性受者移植后肝硬化迅速复发明显相关(P <0.05)。
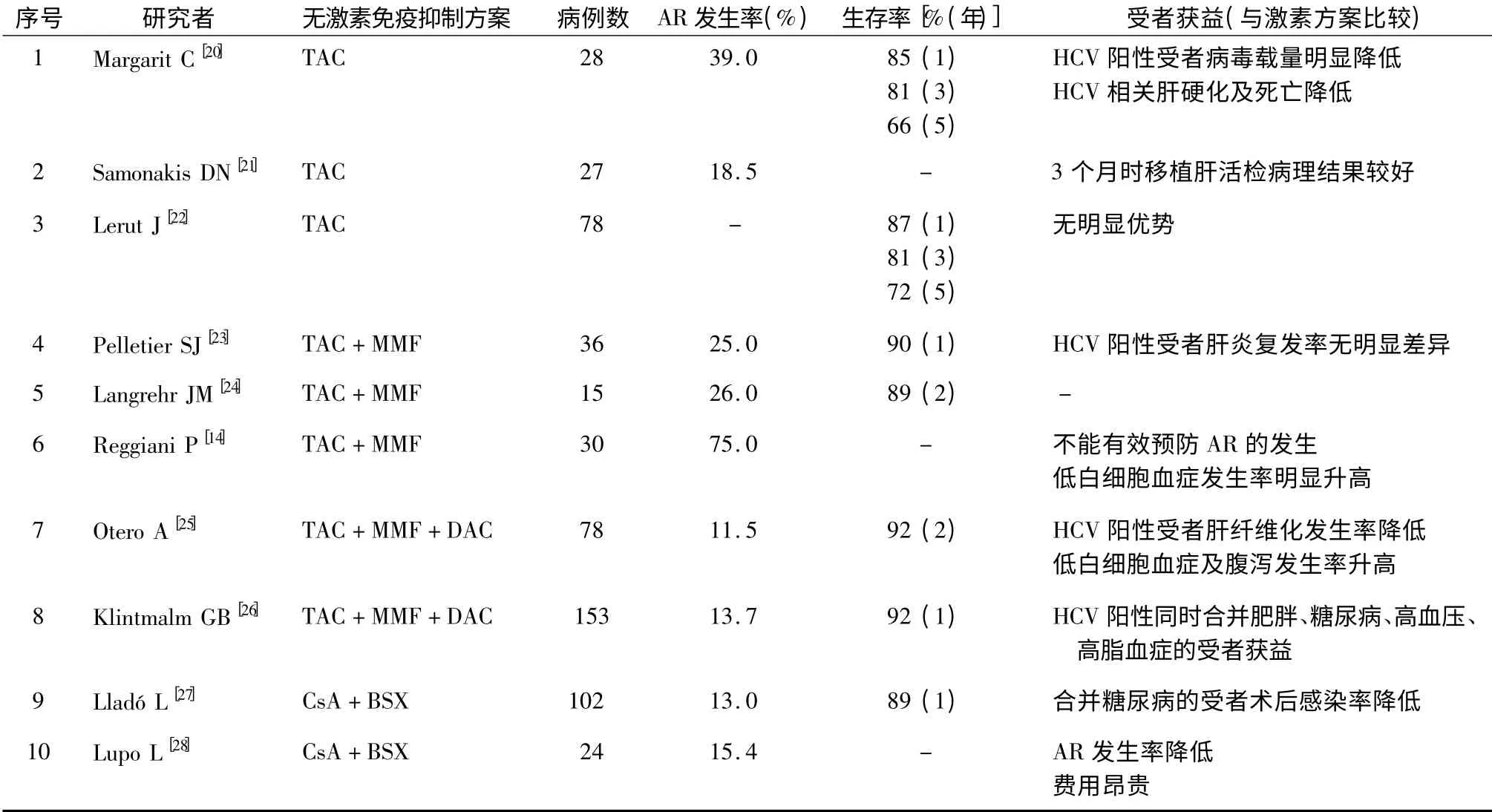
表1 国外不同无激素免疫抑制方案研究结果
同时也有学者研究了早期糖皮质激素撤离的单药他克莫司方案的可行性[30]。110 例原位肝移植受者分为两组,术后均接受短期(14 d)甲泼尼龙治疗,随后分别接受他克莫司+安慰剂(安慰剂组)和他克莫司+ 甲泼尼龙(激素组)治疗,激素组术后6 个月逐渐停用甲泼尼龙,两组受者均随访1 年。随访结果显示,安慰剂组和激素组急性排斥反应发生率分别为48.2%和35.2%(P >0.05);两组激素相关不良反应发生率进行比较,安慰剂组和激素组CMV 感染、高血压发生率差异无统计学意义(25%和33%,39%和52%,P 均>0.05),激素组移植术后糖尿病、高胆固醇血症、高甘油三酯血症的发生率均高于安慰剂组(30%和53%,10%和41%,32%和54%,P 均<0.05)。
根据以上研究结果,单药他克莫司无激素方案对于大部分受者是安全可行的,并未明显增加急性排斥反应的发生率,同时有效减少了激素相关不良反应,尤其是可以使HCV 阳性肝移植受者获益。但对于年轻受者、自身免疫性肝病和胆汁淤积等免疫反应活跃的人群,单药他克莫司无激素方案的可行性仍需要进一步验证[31]。
3.2 他克莫司+MMF 无激素方案
他克莫司+MMF 无激素方案作为标准三联方案的改进,其应用仍存在不少争议。Pelletier 等[23]随访了72 例肝移植受者,术后分别接受他克莫司+MMF+类固醇方案(标准组)和他克莫司+MMF 方案(无激素组),发现标准组和无激素组急性排斥反应发生率、受者和移植肝1 年生存率差异均无统计学意义(25%和14%,90%和83%,90%和81%,P均>0.05),丙型肝炎复发率也无差异。
他克莫司+MMF 方案对HCV 阳性受者的影响也是各移植中心关注的热点。Langrehr 等[24]对因终末期丙型肝炎首次行原位肝移植的受者进行随访,发现接受他克莫司+MMF 方案和他克莫司+泼尼松方案的两组受者急性排斥反应发生率(26%和46%)和术后2 年生存率并无明显差异。值得一提的是,该研究所有受者在肝移植术中移植肝再灌注前和再灌注后6 h 分别接受了500、250 mg 类固醇激素。日本爱媛大学移植中心则对75 例HCV 阳性的活体肝移植受者进行了随访,结果显示接受他克莫司+MMF 方案和他克莫司+类固醇激素方案的受者术后1、3、5 年无事件生存率差异均无统计学意义(38. 2% 和25. 0%,11. 8% 和17. 5%,5. 9% 和14.6%,P 均>0.05),术后1、3 年HCV 复发并肝纤维化F1 期的发生率差异亦无统计学意义(59.4%和74.2%,85.9%和81.9%,P 均>0.05)[32]。
此外,研究者对完全避免使用激素是否会增加免疫抑制剂相关不良反应的发生也较为关注。Reggiani 等[14]就此问题进行了研究,60 例肝移植受者分别接受他克莫司+小剂量MMF 方案(无激素组)和他克莫司+小剂量MMF +类固醇激素方案(激素组),经过平均(31 ±7)个月的随访发现,两组受者免疫抑制剂相关不良反应如消化道症状、肾功能受损、低血小板血症、高血压、糖尿病等发病率无明显差异,仅低白细胞血症发生率无激素组明显高于激素组(50%和11.1%,P <0.05);无激素组受者术后1 周内急性排斥反应发生率为75%,急性排斥指数评分为(5.0 ±3.2)分,明显高于激素组[16.7%和(1.8 ±2.5)分,P 均<0.05]。
总体来说,目前国外大部分学者认为他克莫司+MMF 无激素方案具有可行性,但并不能有效预防急性排斥反应的发生,同时如何控制免疫抑制剂相关不良反应的发生仍需进一步的研究。
3.3 达利珠单抗诱导无激素方案
近年来,随着达利珠单抗诱导方案的推广和应用,无激素免疫抑制方案获得了较大的进步。Otero等[25]比较了标准方案(他克莫司+类固醇激素)与改进方案(他克莫司+MMF +达利珠单抗)对肝移植术后急性排斥反应发生率的影响,对157 例受者进行24 周的随访发现,标准方案组活检证实的急性排斥反应发生率明显高于改进方案组(26. 6% 和11.5%,P <0.05),其中标准方案组和改进方案组分别有20.2%和7.7%的受者在发生急性排斥反应后接受了类固醇激素冲击治疗。同时,该研究中慢性丙型肝炎受者在术后52 周接受了活检,改进方案组中该类受者经活检证实未发生肝纤维化的比例明显高于标准方案组(62.5%和12.5%,P <0.05)。此外,该研究对肝移植术后不良事件的发生率也进行了比较,改进方案组低白细胞血症和腹泻的发生率明显高于标准方案组(34.6%和7.6%,23.1%和10.1%,P 均<0.05)。
Klintmalm 等[26]以312 例HCV 阳性肝移植受者为研究对象,根据接受免疫抑制方案的不同分为3 组:组1 采用他克莫司+类固醇激素方案;组2 采用他克莫司+MMF+类固醇激素方案;组3 采用达利珠单抗诱导+他克莫司+MMF 方案。3 组受者和移植肝1 年生存率无明显差异;组3 未发生急性排斥反应的受者比例明显高于组1 和组2(93.0% ±2.2%、81. 9% ±4. 4% 和86. 2% ±3. 2%,P 均<0.05);3 组受者术后1 年HCV 感染复发率无明显差异。该研究第2 年的随访结果显示,3 组受者急性排 斥 反 应 发 生 率 分 别 为14. 3%、12. 5% 和13.7%,但差异无统计学意义;经活检证实的HCV感染复发和复发程度3 组间差异亦无统计学意义[33]。同时,该研究还进行了肝移植术后重度丙型肝炎复发的相关因素回归分析,单因素分析发现,类固醇剂量累积和组织损伤的早期证据是独立高危因素;多因素分析显示,男性供/受者、活体供肝、冷缺血时间、急性排斥反应和早期丙型肝炎组织学复发与重度肝炎的发生密切相关;对与重度肝炎纤维化相关的危险因素回归分析显示,高龄供者和早期丙型肝炎组织学复发是其独立高危因素。
上述研究结果提示,达利珠单抗诱导无激素方案能有效减少急性排斥反应发生,虽然没有证据表明该方案能明显减少肝移植术后丙型肝炎的复发,但对于HCV 阳性同时合并肥胖、糖尿病、高血压、高脂血症的受者,该方案能使其获益,是安全、可行的。
3.4 巴利昔单抗诱导无激素方案
巴利昔单抗作为免疫抑制剂越来越多地被应用于临床,环孢素+巴利昔单抗诱导无激素方案逐渐受到移植医师重视。Lladó 等[27]研究了上述方案的效果,198 例受者分别接受巴利昔单抗+环孢素方案(无激素组)和巴利昔单抗+环孢素+泼尼松方案(激素组),随访结果发现两组受者急性排斥反应发生率差异无统计学意义(18%和13%,P >0.05);两组受者术后感染发生率相似,但对于合并糖尿病的受者,激素组该类受者术后感染发生率明显高于无激素组(54% 和14%,P <0. 05)。类似结果在Lupo 等[28]的研究中也得到进一步证实,其发现采用环孢素+巴利昔单抗方案和环孢素+类固醇方案的两组肝移植受者术后90 d 无排斥反应发生的生存率分别为80.8%和68.6%,差异无统计学意义;多因素分析结果表明,使用巴利昔单抗和冷缺血时间<10 h 能减少急性排斥反应的发生。
由此可见,环孢素+巴利昔单抗无激素方案安全、可行,同时在降低感染、代谢并发症发生率等方面使受者获益[34];但研究者也指出,与激素方案相比,巴利昔单抗方案相对高昂的费用可能会影响其推广使用。
4 总 结
目前无激素免疫抑制方案已被越来越多的移植中心所采用,因其能有效避免激素相关的不良反应,降低术后丙型肝炎的复发,提高肝移植受者的生存质量,但如何在众多方案中取舍以达到免疫抑制方案最低剂量、最少组合毒性和最优疗效,仍然需要进一步的探索和尝试。
1 Starzl TE,Marchioro TL,Vonkaulla KN,et al. Homotransplantation of the liver in humans[J]. Surg Gynecol Obstet,1963,117:659.
2 Kuramitsu K,Fukumoto T,Fukushima K,et al. Severe posttransplant lymphoproliferative disorder after living donor liver transplantation[J]. Hepatol Res,2015,45(3):356-362.
3 Zaydfudim V,Feurer ID,Landman MP,et al. Reduction in corticosteroids is associated with better health-related quality of life after liver transplantation[J]. J Am Coll Surg,2012,214(2):164-173.
4 Marubashi S,Dono K,Nagano H,et al. Steroid-free living donor liver transplantation in adults:impact on hepatitis C recurrence[J].Clin Transplant,2009,23(6):904-913.
5 Sgourakis G,Dedemadi G. Corticosteroid-free immunosuppression in liver transplantation:an evidence-based review[J]. World J Gastroenterol,2014,20(31):10703-10714.
6 Dempster WJ. The effects of cortisone on the homotransplanted kidney[J]. Arch Int Pharmacodyn Ther,1953,95(3-4):253-282.
7 Ashokkumar C,Sun Q,Ningappa M,et al. Antithymocyte globulin facilitates alloreactive T-cell apoptosis by means of caspase-3:potential implications for monitoring rejection-free outcomes[J].Transplantation,2015,99(1):164-170.
8 Nishida S,Pinna A,Verzaro R,et al. Sirolimus(rapamycin)-based rescue treatment following chronic rejection after liver transplantation[J]. Transplant Proc,2001,33(1-2):1495.
9 Xing T,Huang L,Yu Z,et al. Comparison of steroid-free immunosuppression and standard immunosuppression for liver transplant patients with hepatocellular carcinoma[J]. PLoS One,2013,8(8):e71251.
10 Padbury RT,Gunson BK,Dousset B,et al. Steroid withdrawal from long-term immunosuppression in liver allograft recipients[J].Transplantation,1993,55(4):789-794.
11 Tisone G,Angelico M,Palmieri G,et al. A pilot study on the safety and effectiveness of immunosuppression without prednisone after liver transplantation[J]. Transplantation,1999,67(10):1308-1313.
12 Ringe B,Braun F,Schütz E,et al. A novel management strategy of steroid-free immunosuppression after liver transplantation:efficacy and safety of tacrolimus and mycophenolate mofetil [J].Transplantation,2001,71(4):508-515.
13 Segev DL,Sozio SM,Shin EJ,et al. Steroid avoidance in liver transplantation:meta-analysis and meta-regression of randomized trials[J]. Liver Transpl,2008,14(4):512-525.
14 Reggiani P,Arru M,Regazzi M,et al. A“steroidfree”tacrolimus and low-dose mycophenolate mofetil primary immunosuppression does not prevent early acute rejection after liver transplantation[J].Transplant Proc,2005,37(4):1697-1699.
15 Liu YY,Li CP,Huai MS,et al. Comprehensive comparison of three different immunosuppressive regimens for liver transplant patients with hepatocellular carcinoma:steroid-free immunosuppression,induction immunosuppression and standard immunosuppression[J]. PLoS One,2015,10(3):e0120939.
16 Miyagi S,Kawagishi N,Sekiguchi S,et al. The relationship between recurrences and immunosuppression on living donor liver transplantation for hepatocellular carcinoma[J]. Transplant Proc,2012,44(3):797-801.
17 Thangarajah D,O' Meara M,Dhawan A. Management of acute rejection in paediatric liver transplantation[J]. Paediatr Drugs,2013,15(6):459-471.
18 Lerut JP,Pinheiro RS,Lai Q,et al. Is minimal,[almost]steroidfree immunosuppression a safe approach in adult liver transplantation?Long-term outcome of a prospective, double blind, placebocontrolled,randomized,investigator-driven study[J]. Ann Surg,2014,260(5):886-891.
19 夏瑾,夏洋,龚建平. 肝移植免疫抑制治疗临床应用进展[J/CD].中华移植杂志:电子版,2013,7(3):162-167.
20 Margarit C,Bilbao I,Castells L,et al. A prospective randomized trial comparing tacrolimus and steroids with tacrolimus monotherapy in liver transplantation:the impact on recurrence of hepatitis C[J].Transpl Int,2005,18 (12):1336-1345.
21 Samonakis DN,Mela M,Quaglia A,et al. Rejection rates in a randomized trial of tacrolimus monotherapy versus triple therapy in liver transplant recipients with hepatitis C virus cirrhosis[J]. Transpl Infect Dis,2006,8(1):3-12.
22 Lerut J,Mathys J,Verbaandert C,et al. Tacrolimus monotherapy in liver transplantation:one-year results of a prospective,randomized,double-blind,placebo-controlled study[J]. Ann Surg,2008,248(6):956-967.
23 Pelletier SJ,Vanderwall K,Debroy MA,et al. Preliminary analysis of early outcomes of a prospective,randomized trial of complete steroid avoidance in liver transplantation[J]. Transplant Proc,2005,37(2):1214-1216.
24 Langrehr JM,Neumann UP,Lang M,et al. First results from a prospective randomized trial comparing steroid-free induction therapy with tacrolimus and MMF versus tacrolimus and steroids in patients after liver transplantation for HCV[J]. Transplant Proc,2002,34(5):1565-1566.
25 Otero A,Varo E,de Urbina JO,et al. A prospective randomized open study in liver transplant recipients:daclizumab,mycophenolate mofetil,and tacrolimus versus tacrolimus and steroids[J]. Liver Transpl,2009,15(11):1542-1552.
26 Klintmalm GB,Washburn WK,Rudich SM,et al. Corticosteroidfree immunosuppression with daclizumab in HCV(+)liver transplant recipients:1-year interim results of the HCV-3 study[J]. Liver Transpl,2007,13(11):1521-1531.
27 Lladó L,Xiol X,Figueras J,et al. Immunosuppression without steroids in liver transplantation is safe and reduces infection and metabolic complications: results from a prospective multicenter randomized study[J]. J Hepatol,2006,44(4):710-716.
28 Lupo L,Panzera P,Tandoi F,et al. Basiliximab versus steroids in double therapy immunosuppression in liver transplantation: a prospective randomized clinical trial[J]. Transplantation,2008,86(7):925-931.
29 Weiler N,Thrun I,Hoppe-Lotichius M,et al. Early steroid-free immunosuppression with FK506 after liver transplantation:long-term results of a prospectively randomized double-blinded trial[J].Transplantation,2010,90(12):1562-1566.
30 Moench C,Barreiros AP, Schuchmann M, et al. Tacrolimus monotherapy without steroids after liver transplantation—a prospective randomized double-blinded placebo-controlled trial[J]. Am J Transplant,2007,7(6):1616-1623.
31 Strassburg CP. Autoimmune hepatitis[J]. Dig Dis,2013,31(1):155-163.
32 Takada Y,Kaido T,Asonuma K,et al. Randomized,multicenter trial comparing tacrolimus plus mycophenolate mofetil to tacrolimus plus steroids in hepatitis C virus-positive recipients of living donor liver transplantation[J]. Liver Transpl,2013,19(8):896-906.
33 Klintmalm GB,Davis GL,Teperman L,et al. A randomized,multicenter study comparing steroid-free immunosuppression and standard immunosuppression for liver transplant recipients with chronic hepatitis C[J]. Liver Transpl,2011,17(12):1394-1403.
34 Hibi T, Shinoda M, Itano O, et al. Steroid minimization immunosuppression protocol using basiliximab in adult living donor liver transplantation for hepatitis C virus-related cirrhosis[J].Hepatol Res,2015. [Epub ahead of print]

