浙江南部地区汉族人群肾移植术后糖尿病患者KIR 基因多态性分析
高小民 吴琦 张岩 梁勇 戚小刚 陈必成 蔡勇 杨亦荣 郑少玲 夏鹏
移植术后糖尿病(post-transplantation diabetes mellitus,PTDM)是肾移植术后长期并发症之一,发病率为2.5% ~24.0%[1-2],其发生发展将会引起移植肾排斥反应及败血症的发生,严重影响移植肾存活,导致肾移植受者病死率及心血管事件发生率升高。因此,随着肾移植受者生存期的不断延长,PTDM 作为影响受者预后的重要因素之一,日益受到关注[3]。PTDM 具有2 型糖尿病的高度遗传异质性特点[4],因此推测2 型糖尿病的易感基因也有可能是PTDM 的易感基因。2 型糖尿病的易感性被认为与复杂的遗传因素相关,其发病机制与炎症和免疫反应密不可分,国外文献报道在免疫应答中起重要作用的自然杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR)基因多态性与2 型糖尿病发病相关[5]。本研究采用病例对照研究的方法,探讨浙江南部地区汉族人群肾移植受者KIR 基因多态性与PTDM 的相关性。
1 资料与方法
1.1 临床资料
选取在温州医科大学附属第一医院器官移植中心行肾移植,且2009 年12 月至2010 年12 月期间在本中心随访的170 例浙江南部地区汉族肾移植受者。排除标准:少数民族,移植术前已确诊糖尿病,多器官移植或再次肾移植,处于急性应激期、感染状态或极度衰弱状态,移植术后1 年后确诊糖尿病的受者。共有146 例受者入组本研究。研究方案经本院医学伦理委员会批准,研究对象均签署了知情同意书。
采用1999 年世界卫生组织或美国糖尿病协会的糖尿病诊断标准[6-7]:肾移植术前无糖尿病,移植术后血糖持续升高,且达到一天中任意时刻血糖≥11.1 mmol/L,或空腹至少8 h 后血糖≥7.0 mmol/L,即诊断为PTDM。如受者无明显糖尿病症状,可行口服葡萄糖耐量试验,服用后2 h 血糖≥11.1 mmol/L即诊断为PTDM。结果需在非同日重复测量核实。
146 例肾移植受者术后均使用甲泼尼龙冲击治疗3 d,剂量分别为500、300、200 mg。术后免疫抑制维持期,25 例受者采用环孢素+ 吗替麦考酚酯(mycophenolate mofetil,MMF)+甲泼尼龙三联免疫抑制方案,121 例受者采用他克莫司+MMF +甲泼尼龙三联免疫抑制方案。环孢素起始剂量为6 ~8 mg·kg-1·d-1,他 克 莫 司 起 始 剂 量 为0. 05 ~0.15 mg·kg-1·d-1,随后根据血药浓度谷值调整剂量。MMF 起始剂量为1.5 ~2.0 g/d,最后维持在0.5 ~1.0 g/d。甲泼尼龙起始剂量为64 mg,随后每日递减8 mg,最后维持在4 ~6 mg/d。
1.2 研究方法
1.2.1 肾移植受者血液标本基因组DNA 抽提
抽取受者前臂静脉血2 mL,置于乙二胺四乙酸二钾抗凝管中,用DNAfast200 微量基因组DNA 极速抽提试剂盒(购自上海飞捷生物技术有限公司)提取外周血总DNA,置于-20 ℃下保存备用。
1.2.2 KIR 基因分型检测和计算
采用聚合酶链反应-序列特异性引物技术(PCRSSP)进行KIR 基因分型检测,共检测16 个KIR 基因,包括KIR 2DL1 ~5、2DS1 ~5、3DL1 ~3、3DS1、2DP1 和3DP1。根据NCBI Gen Bank 2009 年公布的KIR 等位基因编码序列设计,并经过BLAST 验证;依据人类生长激素基因保守片段设计内参引物;引物均由上海捷瑞生物工程有限公司公司合成(见表1)。
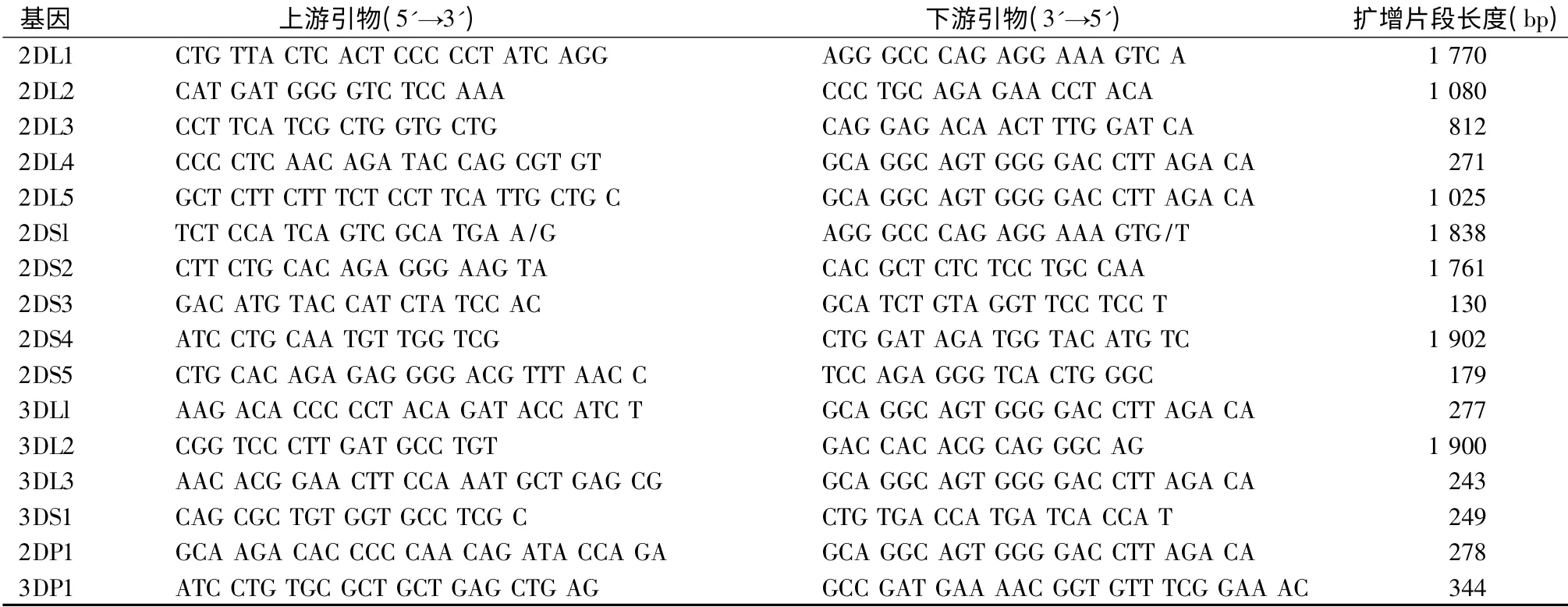
表1 KIR 基因PCR-SSP 分型法引物
取KIR 基因分型检测试剂盒(天津市秀鹏生物技术开发有限公司)配套的浓缩Buffer 70 μL,加90 μL 去离子水,6 U Taq DNA 酶和10 μL DNA,混匀离心后分别向16 个孔中(孔内含引物)加入10 μL 上述混合液,封膜后进行PCR 反应。
PCR 循环参数:96 ℃预变性2 min;96 ℃变性20 s,62 ℃退火60 s,72 ℃延伸45 s,35 个循环;72 ℃延伸5 min。将PCR 产物转移到2%的琼脂糖凝胶孔中电泳,在紫外凝胶成像系统(美国UVP 公司)下观察电泳结果并拍摄成像,保存结果。
KIR 基因型频率(f)=观察到的KIR 基因阳性个数/被研究人数;KIR 基因频率(gene frequency,GF)=1 -。
1.3 统计学方法
采用SPSS 19.0 统计软件处理数据。正态分布计量资料以均数±标准差()表示,采用t 检验进行比较;非正态分布计量资料以中位数表示。计数资料以百分数表示,采用χ2检验进行比较。P <0.05 为差异有统计学意义。
2 结 果
截至2010 年12 月,146 例肾移植受者共确诊PTDM 45 例,余101 例受者未发现血糖异常,作为正常对照组。PTDM 组45 例患者男性30 例,女性15 例,平均年龄(51 ±9)岁,中位确诊时间为肾移植术后3.8 个月(1 ~12 月);8 例患者采用环孢素+MMF+甲泼尼龙三联免疫抑制方案,37 例采用他克莫司+MMF +甲泼尼龙三联免疫抑制方案。正常对照组101 例受者男性71 例,女性30 例,平均年龄(49 ±9)岁;中位随访时间为4.5 年(1 ~10 年);17 例采用环孢素+MMF +甲泼尼龙三联免疫抑制方案,84 例采用他克莫司+MMF+甲泼尼龙三联免疫抑制方案。两组患者性别、年龄、免疫抑制方案比较差异均无统计学意义(t =0.34、χ2=0.192、χ2=0.020,P 均>0.05)。
两组患者KIR 基因频率及基因型频率见表2。其中,KIR 2DL4、3DL2、3DL3 和3DP1 为框架基因,在两组所有个体中均表达,基因频率和基因型频率均为100%。KIR 2DL1、2DL3、2DS4、3DL1 和2DP1在两组受体中的基因型频率均超过90%。KIR 2DS2、2DS3 和2DS5 在两组受体中的基因型频率均小于30%。与正常对照组相比,PTDM 组KIR 2DL2、2DS2、2DS4 基因型频率增高,其中KIR 2DL2 基因型频率差异有统计学意义(χ2=5.004,P <0.05)。与正常对照组比较,PTDM 组KIR 2DL1、2DL3、2DL5、2DS1、2DS3、2DS5、3DL1、3DS1 和2DP1 基因型频率均降低,但差异均无统计学意义(P 均>0.05)。KIR基因扩增产物琼脂糖凝胶电泳图结果示例见图1。

图1 KIR 基因扩增产物琼脂糖凝胶电泳图示例

表2 PTDM 组患者与正常对照组患者KIR 基因频率和基因型频率分布(%)
3 讨 论
PTDM 的发病机制主要与使用免疫抑制剂导致胰岛B 细胞受损、胰岛素分泌减少和胰岛素抵抗等因素有关,涉及复杂的免疫和炎症反应过程,因其病理生理学特点与2 型糖尿病相似,且具有高度遗传异质性,可以将其视为2 型糖尿病[8-9]。研究认为,2 型糖尿病实质是一种全身性、慢性、低度炎症状态,炎性标志物能预测2 型糖尿病及其相关代谢紊乱的发生[10-11],提示2 型糖尿病的发生发展与免疫和炎症反应密不可分。同时,2 型糖尿病是一种具有明显遗传易感性的多基因复杂性疾病。既往研究表明,与其发病相关的易感基因主要包括钙蛋白酶10基因、葡萄糖转运蛋白10 基因、胰岛素受体基因、胰岛素受体底物-1 基因、脂联素基因及胰岛素降解酶基因等[12-15]。近年来,天然免疫及NK 细胞在1 型糖尿病发病机制中的作用得到广泛研究[16-18],而在2 型糖尿病或PTDM 方面的研究甚少。NK 细胞是来源于骨髓的大颗粒淋巴细胞,是天然免疫系统的核心,同时也是获得性免疫应答重要的调节细胞,在炎症和免疫反应过程中起重要作用,故NK 细胞数量或功能异常可能参与2 型糖尿病或PTDM 的发生。
KIR 基因定位于人类染色体19q13.4 的白细胞受体复合物中[19],有着高度多态性,KIR 基因数目在不同NK 细胞克隆和不同个体有差异,其编码产物KIR 主要表达于NK 细胞及部分T 细胞表面,通过特异性识别靶细胞表面HLA-Ⅰ类分子(HLA-A/B/C,主要为HLA-C)[20],传递活化或抑制信号,从而调节NK 细胞和相应T 细胞的活性,使机体处于不同的免疫应答状态。关于KIR 与疾病相关性的研究发现,1 型糖尿病、强直性脊柱炎、系统性红斑狼疮、硬皮病、银屑病等自身免疫性疾病和肾癌、乳腺癌、黑色素瘤、肺癌等肿瘤相关性疾病,以及病毒感染等疾病的发生发展均与KIR 基因多态性相关[21-23]。Zuniga 等[5]对95 例患有2 型糖尿病的波多黎各患者进行KIR 基因分型,发现KIR 2DL3/2DL3 纯合基因型频率增加,提示KIR 2DL3 可能为2 型糖尿病的易感基因;此外,研究结果还提示在2 型糖尿病患者中抑制性KIR 受体增加。
本研究结果显示,PTDM 组患者KIR 2DL2 基因型频率显著升高,提示KIR 2DL2 可能为浙江南部地区汉族人群患PTDM 的易感基因。结合Zuniga等的研究,推测NK 细胞及部分T 细胞表面的KIR受体可能是以抑制性受体为主导参与PTDM 的发生,并通过抑制NK 细胞和T 细胞的活性,降低其抗感染和免疫应答的能力,导致免疫调节紊乱,从而促进疾病的发生发展。然而,鉴于佐证文献过少及本研究样本量较小,且缺少KIR 配体研究,使结果存在一定误差,因此在下一步研究中我们需要扩大研究人群的样本例数并结合KIR 配体进行多层次分析。
1 Cosio FG,Pesavento TE,Osei K,et al. Post-transplant diabetes mellitus:increasing incidence in renal allograft recipients transplanted in recent years[J]. Kidney Int,2001,59(2):732-737.
2 Numakura K,Satoh S,Tsuchiya N,et al. Clinical and genetic risk factors for post-transplant diabetes mellitus in adult renal transplant recipients treated with tacrolimus[J]. Transplantation,2005,80(10):1419-1424.
3 Hoban R,Gielda B,Temkit M,et al. Utility of HbAlc in the detection of subclinical post renal transplant diabetes [J].Transplantation,2006,81(3):379-383.
4 翁国斌,张曙伟,李毛毛,等. 浙东地区汉族人群TCF7L2 基因与肾移植后糖尿病的相关性研究[J]. 中华器官移植杂志,2013,34(6):353-357.
5 Zuniga J,Romero V,Azocar J,et al. Interaction of KIR genes and G1M immunoglobulin allotypes confer susceptibility to type 2 diabetes in Puerto Rican Americans[J]. Hum Immunol,2006,67(11):907-914.
6 Duclos A,Flechner LM,Faiman C,et al. Post-transplant diabetes mellitus:risk reduction strategies in the elderly[J]. Drugs Aging,2006,23(10):781-793.
7 Wilkinson A,Davidson J,Dotta F,et al. Guidelines for the treatment and management of new-onset diabetes after transplantation[J]. Clin Transplant,2005,19(3):291-298.
8 余少杰,彭龙开,谢续标,等. 湘赣地区汉族人群人类白细胞抗原与肾移植后糖尿病的相关性[J]. 中国组织工程研究与临床康复,2009,13(53):10443-10451.
9 Campise M. Post-transplant diabetes mellitus: diagnosis and treatment[J]. G Ital Nefrol,2007,24(6):547-557.
10 Okano K, Araki M, Yamamoto M, et al. Exploration of hematological and immunological changes associated with the severity of type 2 diabetes mellitus in Japan[J]. Nurs Health Sci,2008,10(1):65-69.
11 Shi FD,Zhou Q. Natural killer cells as indispensable players and therapeutic targets in autoimmunity[J]. Autoimmunity,2011,44(1):3-10.
12 杨丽霞,刘铜华,牛洁,等. 2 型糖尿病相关基因的研究进展[J]. 疑难病杂志,2008,7(1):56-58.
13 Sesti G. Searching for type 2 diabetes genes: prospects in pharmacotherapy[J]. Pharmacogenomics J,2002,2(1):25-29.
14 Hanis CL,Boerwinkle E,Chakraborty R,et al. A genome-wide search for human non-insulin-dependent (type 2)diabetes genes reveals a major susceptibility locus on chromosome 2[J]. Nat Genet,1996,13(2):161-166.
15 O'Rahilly S,Barroso I,Wareham NJ. Genetic factors in type 2 diabetes:the end of the beginning?[J]. Science,2005,307(5708):370-373.
16 Rodacki M,Milech A,de Oliveira JE. NK cells and type 1 diabetes[J]. Clin Dev Immunol,2006,13(2-4):101-107.
17 van der Slik AR,Koeleman BP,Verduijn W,et al. KIR in type 1 diabetes:disparate distribution of activating and inhibitory natural killer cell receptors in patients versus HLA-matched control subjects[J]. Diabetes,2003,52(10):2639-2642.
18 Nikitina-Zake L,Rajalingham R,Rumba I,et al. Killer cell immunoglobulin-like receptor genes in Latvian patients with type 1 diabetes mellitus and healthy controls[J]. Ann N Y Acad Sci,2004,1037:161-169.
19 Trowsdale J. Genetic and functional relationships between MHC and NK receptor genes[J]. Immunity,2001,15(3):363-374.
20 Yu J,Heller G,Chewning J,et al. Hierarchy of the human natural killer cell response is determined by class and quantity of inhibitory receptors for self-HLA-B and HLA-C ligands[J]. J Immunol,2007,179(9):5977-5989.
21 张炳昌,刘芸,焦玉莲,等. 强直性脊柱炎患者杀伤细胞免疫球蛋白样受体基因型和单倍型分析[J]. 中华医学杂志,2009,89(2):91-95.
22 侯岩峰,张源潮,焦玉莲,等. 系统性红斑狼疮患者杀伤细胞免疫球蛋白样受体基因型分析[J]. 中华风湿病学杂志,2007,11(2):65-69.
23 Gagne K,Brizard G,Gueglio B,et al. Relevance of KIR gene polymorphisms in bone marrow transplantation outcome[J]. Hum Immunol,2002,63(4):271-280.

