大鼠肝癌组织中DLC1、ASC、p16和DLK1基因甲基化状态与肝癌的关系
黄密密杨春欧超郑海平
作者单位:530021南宁1广西肿瘤防治研究所实验研究部;2广西医科大学研究生学院;3广西医科大学第一附属医院肿瘤内科
基础研究
大鼠肝癌组织中DLC1、ASC、p16和DLK1基因甲基化状态与肝癌的关系
黄密密1,2杨春1欧超1郑海平3
作者单位:530021南宁1广西肿瘤防治研究所实验研究部;2广西医科大学研究生学院;3广西医科大学第一附属医院肿瘤内科
目的探讨大鼠肝癌组织中DLC1、ASC、p16和DLK1基因启动子区甲基化状态与肝癌发生的关系。方法55只Wistar雄性大鼠随机分为黄曲霉毒素月1(Aflatoxin月1,AF月1)实验组(35只)和空白对照组(20只),用AF月1诱发大鼠肝癌并建立大鼠实验动物肝癌模型。用甲基化特异性PCR(MS-PCR)技术和琼脂糖凝胶电泳方法检测大鼠肝癌组织及正常肝脏组织中DLC1、ASC、p16和DLK1基因启动子区的甲基化情况,分析4个基因的甲基化状态与肝癌发生的关系。结果在实验第52周可见大鼠肝脏发生典型的肝癌病理学改变,实验诱发大鼠肝癌模型制作成功。MS-PCR技术检测显示在大鼠肝癌组织中DLC1、ASC、p16和DLK1基因启动子区的甲基化率分别为83.3%、93.3%、86.7%和10.0%,在大鼠正常肝脏组织中的甲基化率分别为14.3%、35.7%、21.4%和85.7%,二者比较差异均有统计学意义(P均<0.05)。琼脂糖凝胶电泳法检测显示4种基因甲基化均为阳性。结论大鼠肝癌组织中DLC1、ASC、p16基因启动子区高度甲基化,DLK1基因启动子呈低甲基化水平,提示DLC1、ASC、p16和DLK1基因启动子区的异常甲基化与大鼠肝癌发生的关系密切。
肝肿瘤;DLC1;ASC;p16;DLK1;基因;甲基化
原发性肝癌(primary liver carcinoma,PLC简称“肝癌”)具有起病隐匿、临床症状和体征不典型、病情进展迅速的特点,从而导致其发病率和死亡率逐年升高[1]。我国广西扶绥县2004~2008年肝癌发病率为67.26/10万[2],严重威胁人类的生命健康。PLC的发生、发展是各种因素共同作用的结果。近年研究表明,肝癌的发生与表观遗传学的改变密切相关,其中DNA甲基化是其重要的表现形式之一。肿瘤相关基因甲基化异常在肝癌的发生、发展中起着重要的作用[3]。DNA甲基化主要是通过甲基化转移酶(DNA methyltransferase,DNMT)在DNA的CpG二核苷酸的胞嘧啶上,没有改变基因的序列,这和基因突变、杂合性缺失有别,在某些情况下是抑癌基因失活的惟一机制[4],但这个过程是可逆的。因此探讨肿瘤相关基因甲基化异常与肝癌的关系,有助于对肝癌病因学的研究。本实验建立大鼠肝癌动物模型,以甲基化特异性PCR技术(methylation-specific PCR,MS-PCR)检测大鼠肝癌组织和正常肝脏组织中DLC1、ASC、p16和DLK1基因启动子区的甲基化状态,探讨其与肝癌的关系,为研究肝癌的发生机制提供思路。
1 材料与方法
1.1 主要试剂与材料
黄曲霉毒素月1(Aflatoxin月1,AF月1)购自美国Sigma公司;DNA提取试剂盒购自北京天根生化科技有限公司;DNA甲基化试剂盒购自北京天漠科技开发有限公司;Premix Taq(含染料)购自TaKaRa宝生物工程(大连)有限公司;琼脂糖购自西班牙月iowest公司;50xTAE购自上海生工生物工程有限公司;GoldViewⅡ型核酸染料购自北京索莱宝公司;20bp DNA Ladder(Dye Plus)购自上海生工生物技术有限公司;PCR扩增仪为美国Thermo公司产品(型号为PXE0.2);凝胶成像分析系统为美国月IO-RAD公司产品(型号为731月RO1393);引物由上海生工生物工程有限公司合成。
1.2 大鼠肝癌模型的建立
本动物实验已通过广西实验动物伦理委员会认可。55只Wistar雄性大鼠购自广西医科大学动物实验中心。实验动物许可证号为SCXK桂2003-0003,符合国标G月14922-94 SPF级质量标准。大鼠为4周龄,体重为40~60 g,标准化光照和自由进食及饮水,分笼饲养并适应环境3周。大鼠随机分为2组,实验组35只和空白对照组20只。实验组大鼠于第4周开始腹腔注射AF月1(200μg/kg),1~3次/周,至52周结束。实验期间大鼠饲以颗粒饲料,自由饮用灭菌饮用水。空白对照组大鼠仅以大鼠颗粒饲料喂养,并自由饮用灭菌饮用水。动物饲料、饮用水、笼具均经过紫外线消毒和高压灭菌处理。实验第52周全部处死大鼠,取肝脏保存并做病理组织学检查。
1.3 甲基化特异性PCR技术检测基因的甲基化
在NC月I上找到相应基因的启动子序列,然后用MethPrimer软件设计每个基因的甲基化引物。DLC1上游引物为5′-TTT-TATAGGGTGGGATTATTTATTTTTC-3′,下游引物为5′-TTTTTCAATTTCTACTCTACACGAA-3′,产物大小为184 bp;ASC上游引物为5′-GTTTTTAAATTTTCGGGATGTTTC-3′,下游引物为5′-ACCTAACAATAAC-AAATTCTCCGTA-3′,产物大小为200 bp;p16上游引物为5′-AAGATATTTTTTGAGGTTTTTATGATC-3′,下游引物为5′-CTATATACCATACTCCGACCGAC-3′,产物大小为266 bp;DLK1上游引物为5′-TTAGTGGTTTTTTGTGTTTATAGGC-3′,下游引物为5′-AACA-AACCTTAATACCTACTCCCG-3′,产物大小为166 bp。引物由上海生工生物工程有限公司合成。取实验组及对照组大鼠肝脏组织10~30mg,研碎为细胞悬液,按照DNA提取试剂盒说明书的操作提取组织DNA。提取的DNA测定其纯度和浓度,并保存在-20℃,备用。按照DNA甲基化试剂盒说明书取20μl DNA(最佳浓度为200~500 ng)进行亚硫酸氢盐修饰,此时DNA中发生甲基化的CpG经过修饰后不变,未发生甲基化的CpG中的5′端的胞嘧啶变为尿嘧啶。然后用经过修饰后的DNA作为PCR模版。甲基化特异性PCR反应在美国Thermo公司的普通PCR仪上进行。反应体系为50μl,亚硫酸氢盐处理的DNA 3μl,甲基化上下游引物(10μmol/L)各1μl,Premix Taq(TaKaRa TaqTMVersion 2.0 plus dye)25μl,dd H2O 20μl。反应条件为95℃预变性5min,95℃40 s,58℃45 s,72℃45 s,共40个循环,72℃延伸10 min。每份亚硫酸氢盐处理的DNA样本均在相同反应条件下进行。
1.4 琼脂糖凝胶电泳检测基因的甲基化
称取1.6 g的琼脂糖加入40 m l 1×TAE的烧瓶里,轻轻振荡,微波炉加热至溶液呈透明无颗粒状,待冷却至50~60℃时加入8μl的GoldviewⅡ型核酸染料,轻轻摇动烧瓶,使溶液混匀后匀速倒入制胶槽,静置待凝,制成4%琼脂糖凝胶。取Mark 8μl,扩增产物5μl上样,在盛有1×TAE的电泳缓冲液的电泳槽里跑胶,电压为120 V,采用凝胶成像系统进行图像分析处理,在紫外线灯下观察分析结果。
1.5 统计学方法
用SPSS 16.0统计学软件对数据进行处理和分析。计数资料的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肝癌模型的诱癌实验结果
实验成功建立了大鼠肝癌模型。在诱癌过程中,实验第49周实验组大鼠35只死亡3只,死亡率为8.6%(3/35),对照组20只中死亡6只(30%)。至第52周实验结束时实验组大鼠成瘤率为85.7%(30/35)。实验组大鼠肝脏组织出现各种异常增生灶以及增生结节,其中大部分为嗜酸性结节,细胞核增大,染色质深染,出现双核或多核现象,核质比增大,呈不典型增生现象,肝癌细胞出现。对照组大鼠肝脏组织表面光滑,色泽鲜艳,质软,显微镜下观察肝脏组织未见异常。
2.2大鼠肝癌组织及正常肝脏组织基因的甲基化状态
MS-PCR法检测显示,实验组大鼠肝癌组织DLC1、ASC、p16和DLK1基因甲基化率分别为83.3%(25/30)、93.3%(28/30)、86.7%(26/30)和10.0%(3/30),对照组大鼠正常肝脏组织4种基因的甲基化率分别为14.3%(2/14)、35.7%(5/14)、21.4%(3/14)和85.7%(12/14)。两组基因的甲基化率比较差异均有统计学意义(P均<0.05)。见表1。
2.3 琼脂糖凝胶电泳检测结果
采用4%的琼脂糖凝胶电泳检测DLC1、ASC、p16和DLK1基因的甲基化状态,以DNA Marker作为标准对照。结果显示DLC1、ASC、p16和DLK1的目的条带分别为184 bp、200 bp、266 bp和166 bp。如图1所示,出现相应的目的条带均为基因甲基化阳性。
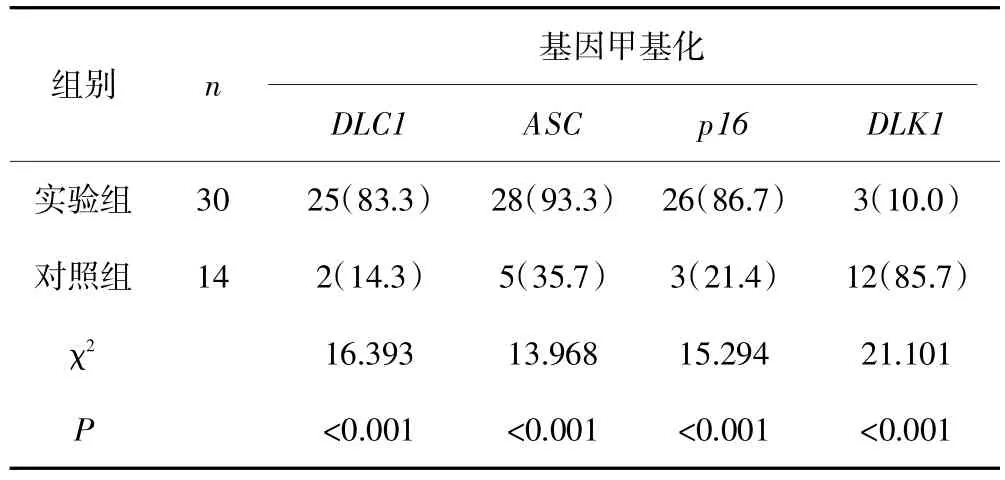
表1 大鼠肝癌组织及正常肝脏组织中4种基因的甲基化情况[n(%)]

图1 琼脂糖凝胶电泳检测4个基因的甲基化状态
3 讨论
目前研究发现[5],肿瘤抑制基因启动子区CpG岛的高甲基化可以通过招募甲基化结合蛋白及相关复合物,改变染色质空间结构,阻止基因转录,使肿瘤抑制基因沉默,同时使原癌基因甲基化水平下降,转录激活,而此时相关基因的DNA序列并没有发生改变,因此肿瘤抑制基因启动子区的高甲基化和原癌基因启动子区的低甲基化水平与肿瘤形成密切相关。本实验结果显示,DLC1、ASC、p16和DLK1基因在大鼠肝癌组织中存在启动子区异常甲基化状态,其中DLC1、ASC和p16 3种基因启动子区呈高甲基化,而DLK1基因启动子区呈低甲基化,表明基因的甲基化与肝癌的发生密切相关。
DLC1是一种重要的抑癌基因,因该基因在肝癌组织中呈低表达而得名。张素青等[6]研究肝癌患者血清DLC1基因甲基化状态,结果显示肝癌(hepatocellular carcinoma,HCC)血清标本中DLC1基因甲基化率为12.33%,而正常人血清中未检测到DLC1基因甲基化。本实验研究结果显示大鼠肝癌组织中DLC1基因的甲基化率为83.3%(25/30),正常肝脏组织中的甲基化率为21.4%(3/14),二者差异显著(P<0.05),说明DLC1基因的广泛甲基化与肝癌关系密切。此外,本实验大鼠肝癌是由AF月1诱导形成的。张友才等[7]研究表明AF月1诱导的肝癌组织中的DNA甲基转移酶3(DNA methyltransferase 3,DNMT3)的表达明显高于正常、损伤和早期癌变的肝脏组织。因此AF月1促进产生大量的DNMT3,使DLC1启动子区不断被甲基化,抑制DLC1蛋白的表达合成,导致细胞与细胞外基质连接力减弱,细胞易于游离,特别是癌细胞,由于其生长旺盛,更容易转移。到目前为止,很多实验研究也证实DLC1基因在多数肿瘤组织中的表达抑制或缺失[8],CpG岛甲基化修饰是主要的原因之一。有研究表明去甲基化药物可以有效预防某些肿瘤的转移,这说明DLC1基因对抑制肿瘤的浸润、转移有一定作用,而且甲基化也可能是其表达缺失的惟一原因[9]。
ASC基因是一个与凋亡有关的基因,它在许多正常组织中如结肠、甲状腺、脾、小肠、肺、胃、乳腺、上皮细胞等都有表达,而在肿瘤细胞中包括前列腺癌、结肠癌、非小细胞肺癌、膀胱移行细胞癌和乳腺癌等都有不同程度的缺失现象。白彧等[10]检测58例HCC组织中ASC基因启动子甲基化状态,结果显示40例发生ASC基因甲基化,甲基化率为69%,而在正常肝脏组织中未见异常,提示ASC基因启动子甲基化是HCC中的频发事件,出现这些情况不排除是由于ASC的甲基化抑制了基因的表达,使其沉默。本实验研究显示,大鼠肝癌组织中的ASC基因启动子区甲基化率明显高于正常组织中的甲基化率(P<0.05),提示ASC基因启动子区的高甲基化与肝癌的发生有关。其可能的原因是ASC基因主要参与细胞凋亡的调节,它可防止细胞过度生长,维持机体处于动态平衡的状态,而一旦基因甲基化异常则将打破这种平衡状态,给肿瘤细胞提供生长的机会和环境。
抑癌基因p16是细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase 1,CDK1)基因家族的成员之一,是细胞凋亡相关基因,其失活可导致细胞过度增殖,细胞周期加速,使DNA在未被修复前过早地进入S期,导致肿瘤发生。2008年Ko等[11]检测265例HCC患者组织样本,结果显示p16基因启动子区的异常高甲基化率达67%,提示它与肝癌发生密切相关。亓云鹏等[12]研究表明,肝癌组织中p16基因启动子区域的甲基化频率明显升高。本实验结果显示p16在肝癌组织中的甲基化率为86.7%,在正常肝脏组织中为21.4%,二者差异显著(P<0.05),这和国内外的研究结果一致。其机制可能是由于肝癌组织中p16基因启动子区发生甲基化后抑制p16基因的表达,使细胞分裂时不能得到精确地调节,能顺利通过细胞周期中的G1/S期检验点,进入细胞分裂、增殖期,导致细胞选择优势性无限增殖,最终形成肝癌。
DLK1基因是表皮生长因子的家族成员之一,属于父系表达母系沉默的印记基因,从鸟类到哺乳动物都存在,在大部分成年哺乳动物中处于沉默状态,主要在胚胎组织中高度表达。新近研究表明,DLK1基因的表达能诱导多能干细胞的分化潜能[13],这表明DLK1基因高峰表达期在动物各组织器官的生长发育期,而在成年则处于抑制状态,一旦调节失控如甲基化异常等,该基因就会出现过表达,导致组织细胞异常增生,从而形成肿瘤。Luo等[14]研究发现,DLK1基因在肝癌组织中表达,而在正常肝脏组织中完全不表达。相关的动物研究[15]也发现肝癌细胞的成瘤能力随DLK1基因的表达水平升高而增强。本实验研究显示肝癌组织中DLK1基因的甲基化率明显低于正常肝脏组织中的甲基化率,推测DLK1基因启动子区域的低甲基化水平使DLK1大量表达,使细胞处于原始发育水平,不断增殖,最终形成肿瘤。
综上所述,ASC、DLC1、p16及DLK1基因启动子区域的甲基化异常与肝癌的发生、发展有密切关系,在肝癌组织中均存在4个基因启动子区的甲基化异常状态,可能在肝癌早期或在癌变前即已发生这种改变,其与肝癌的发生、发展相辅相成。但由于基因甲基化的改变是可逆的,因此恢复基因的正常甲基化状态有望成为逆转及治疗肿瘤的新方向。
[1]Calvisi DF,Frau M,Tomasi ML,et al.Deregulation of signaling pathways in prognostic subtypes of hepcarcinoma:novel insights from interspecies comparison[J].Biochim Biophys Acta,2012,1826(1):215-237.
[2]韦忠亮,李云西,何明荣.扶绥县2004-2008年肝癌发病率分析[J].中国癌症防治杂志,2011,3(2):137-138.
[3]Yan J,Lu Q,Dong J,et al.Hepatitis B virus X protein suppresses caveolin-1 expression in hepatocellular carcinoma by regulating DNA methylation l[J].BMCCancer,2012,12:353.
[5]Herceg Z,Paliwal A.Epigeneticmechanisms hepatocellular carcinoma:how environmental factors influence the epigenome.[J].Mutat Res,2011,727(3):55-61.
[6]张素青,刘继斌,张心.甲基化特异性PCR检测肝癌复发转移患者血清DLC-1甲基化的价值研究[J].肿瘤基础与临床,2009,22(3):203-205.
[7]张友才,陈金霞,张伟伟,等.黄曲霉毒素B1诱导大鼠肝癌超微结构观察及DNA甲基化转移酶3表达变化[J].中国癌症杂志,2012,22(1):74-77.
[8]Peng H,Long F,Wu Z,etal.Downregulation of DLC-1 gene by promoter methylation during primary colorectal cancer progression[J].Biomed Res Int,2013,2013:181384.
[9]Heyn H,Carmona FJ,Gomez A,et al.DNA methylation profiling in breast cancer discordant identical twins identifies DOK7 as novel epigenetic biomarker[J].Carcinogenesis,2013,34(1):102-108.
[10]白彧,杜智,高英堂,等.肝细胞癌ASC基因启动子区甲基化及其mRNA表达研究[J].中国肿瘤临床,2011,38(8):437-441.
[11]Ko E,Kim Y,Kim SJ,et al.Promoter hypermethylation of p16 gene is associated with poor prognosis in recurrent earlystage hepatocellular carcinoma[J].Cancer Epidemiol Biomarkers Prev,2008,17(9):2260-2267.
[12]亓云鹏,王芬芬,崔莲花,等.肝癌病人癌组织与血浆p16及APC基因甲基化检测及意义[J].齐鲁医学杂志,2013,28(3):189-191,195.
[13]Li W,Zhao XY,Wan HF,et al.iPS cells generated without c-myc have active Dlk1-Dio3 region and are capable of producing full-term mice through tetraploid complementation[J].Cell Res,2011,21(3):550-553.
[14]Luo JH,Ren B,Keryanov S,et al.Transcriptomic and genomie analysis of human hepatocellular carcinomas and hepatoblastomas[J].Hepatology,2006,44(4):1012-1024.
[15]Huang J,Zhang X,Zhang M,et al.Up-regulation of DLK1 as an Imprinted gene could contribute to human hepatocellula rcarcinoma[J]. Carcinogenesis,2007,28(5):1094-1103.
[2014-11-20收稿][2014-12-22修回][编辑阮萃才]
Analysis of DLC1,ASC,p16 and DLK1 genemethylation in a ratmodel of liver cancer
HUANG Mimi1,2,YANG Chun1,OU Chao1,ZHENG Haiping3(1Research Department of Guangxi Cancer Institute;2Graduate School of Guangxi Medical University;3Department of Oncology,The First Affiliated Hospital of Guangxi Medical University,Nanning 530021,P.R.China)
YANG Chun.E-mail:cxl_yang@163.com
ObjectiveTo study the potential association between liver cancer and methylation of the promoters of the genes DLC1,ASC,p16,andDLK1.M ethodsPrimary hepatocellular carcinoma(PHC)was induced in 35Wistar rats by injection of AF月1.Another group of 20 rats
no drug and served as a negative control.Atweek 52,all rats were killed and tissue samples were harvested and analyzed for histopathology.Methylation-specific PCR was used to analyze methylation of the promoters of the genes DLC1,ASC,p16,and DLK1 in rat liver in both groups.ResultsAF月1-induction of PHC led to the expected pathological changes in rat liver. Methylation rates of DLC1,ASC,p16 in liver tissue were significantly higher in ratswith PHC(83.3%,93.3%,86.7%,respectively)than in control rats(14.3%,35.7%,21.4%;all P<0.05),whereas the oppositewas true formethylation rates of DLK1(10.0%vs 85.7%,P<0.05).ConclusionPHC may be associated with upregulation of DLC1,ASC,and p16 methylation,as well as downregulation of DLK1methylation.Thus,aberrantmethylation of DLC1,ASC,p16 and DLK1 may contribute to PHC onset and progression.
Liver neoplasm;DLC1;ASC;p16;DLK1;Gege;Methylation
R734.2
A
1674-5671(2015)02-05
10.3969/j.issn.1674-5671.2015.02.03
广西自然科学基金资助项目(2012GXNSFAA053167);广西自然科学基金青年基金资助项目(2014GXNSF月A118193);广西医科大学青年科学基金资助项目(GXMUYSF201218)
杨春。E-mail:cxl_yang@163.com

