一氧化氮对家榆种子老化的影响及其作用机制研究
何毓琦,汪晓峰
(北京林业大学 林木育种国家工程实验室,生物科学与技术学院,北京100083)
种子老化是指种子成熟后,活力逐渐下降的不可逆过程。这种自然现象一直是种质保存面临的一个严重问题。虽然低温保存是种子贮存相对理想的途径,但随着贮藏时间的延长,劣变仍会发生[1]。前人在种子老化机理方面已做了大量的研究工作,主要集中于种子抗氧化体系、膜质过氧化和染色体畸变 等 方 面[2-4]。但 仍 有 许 多 问 题 尚 不 清 楚。El-Maarouf-Bouteau等[5]在向日葵种子老化过程中发现了DNA 改变和细胞程序性死亡(programmed cell death,PCD)的发生,本实验室前期工作表明家榆种子老化过程中不仅发现了PCD 的发生,同时还发现活性氧(ROS)积累与PCD 的发生具有相关性[6]。至此,种子老化已进入细胞生物学与分子生物学等深层次研究阶段。
一氧化氮(NO)是一种重要的气体自由基分子,化学性质非常活泼,极易通过细胞质和细胞膜,是动植物细胞中的一种重要的信号分子[7]。研究表明,NO 参与植物生长发育的诸多生理过程,如光形态建成、叶片和根的生长、气孔运动等;在合适的浓度下可作为一种抗胁迫分子,阻止成熟和衰老的发生,且对植物PCD 有调控作用[8-11]。NO 在植物体内的产生途径主要有硝酸盐-亚硝酸盐依赖型途径(包括胞质硝酸还原酶途径和根特异性亚硝酸盐-NO 还原酶途径等)和L-精氨酸(L-Arg)依赖型途径(类一氧 化 氮 合 酶 途 径)[12-13]。研 究 表 明NO 在 植 物 体 内的作用方式有多种,如蛋白质亚硝基化、与Ca2+和H2O2等多种信号分子相互作用,以及多种抗氧化酶体系的调控等[14-16]。目前在种子上对NO 的研究主要集中于打破种子休眠和调控种子萌发等方面[17],其是否参与调控种子老化后活力的丧失,目前尚无报道。
家榆(Ulmus pumila L.)为北方常见树种,抗逆性较强;种子不易贮存,发芽迅速、整齐,个体差异较小,可视为林木种子老化研究的模式树种。本研究以家榆种子为试材,采用种子活力检测技术、激光共聚焦显微镜技术、蛋白质S-亚硝基化检测技术等,结合多种相关抑制剂的使用,从种子生理学和细胞学等角度阐述NO 对家榆种子老化的影响及可能的作用机制。
1 材料和方法
1.1 实验材料与试剂
实验用家榆种子于2013年4月底采摘于北京林业大学校园。初始发芽率为98.0%,初始含水量为7.05%,采后密闭贮藏于-20℃冰柜待用。实验主要试剂有NO 供体硝普钠(sodium nitroprusside,SNP)、类 一 氧 化 氮 合 酶(nitric oxide synthase,NOS)抑制剂L-NAME(Nw-nitro-L-arginine methyl ester hydrochloride)、一氧化氮清除剂cPTIO[2-(4-carboxyphenyl)-4,4,5,5-tetramethyl-imidazoline-1-1-oxyl-3-oxide]、硝酸还原酶抑制剂Na2WO4·2H2O、类一氧化氮合酶底物L-Arg、硝酸还原酶底物NaNO2。SNP、L-NAME、cPTIO 均购于Sigma公司,其它药品均为国产分析纯。
1.2 处理方法
1.2.1 药剂预处理 (1)SNP 处理 参考Bethke等[18]方法进行。如图1所示,在1个10cm 培养皿中,放入2个敞开的装有种子的3.5cm 培养皿作为接收皿,1个敞开的装有SNP溶液的3.5cm 培养皿作为供体皿。将10cm 培养皿用封口膜封好,放入光照培养箱中(温度25℃、光强为80μmol·m-2·s-1)培养12h。处理分两类:一类是分别用0、50、75、100、150、200μmol·L-1SNP 进行梯度浓度处理,考察种子萌发随SNP浓度变化特征,筛选出家榆种子预处理的最佳浓度;另一类是采用最佳浓度(100 μmol·L-1)SNP 与抑制剂进行共处理。然后将处理后种子于室温中晾干,随后进行老化处理。
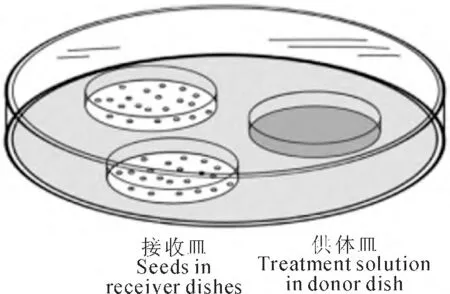
图1 SNP蒸气处理方法示意图Fig.1 An illustration of the experimental system used to apply vapours from SNP
(2)底物和抑制剂处理 实验所用抑制剂为50 μmol·L-1Na2WO4·2H2O、50μmol·L-1cPTIO、100μmol·L-1L-NAME;硝酸还原酶底物NaNO2的浓度分别为0、200、500、1 000和10 000 μmol·L-1,一氧化氮合成酶的底物L-Arg的浓度分别为0、50、100、200、500和1 000μmol·L-1。配制上述处理溶液后,将家榆种子分别置于溶液中,4℃浸种10h后取出,平铺于滤纸上,室温晾干至原始含水量。随后进行老化处理。
(3)SNP与抑制剂共处理 先将种子按上述抑制剂处理方法处理10h,晾干后再用SNP蒸气处理12h。晾干后进行老化处理。
1.2.2 人工控制老化处理 按本实验室前期建立的种子老化体系,将预处理及对照(未做药剂处理)种子置于37 ℃、100%相对湿度(RH)条件下进行老化处理。(1)将对照种子进行老化环境下平衡(post equilibrate,PE)24h(种子达到稳定含水量的时间)以及分别老化处理1、2、3、4、5d,考察种子发芽率和种子活力随老化时间的变化特征,选择后续实验种子的适宜老化处理时间。(2)将各类药剂预处理的种子进行老化处理3d,在室温下晾干至原始含水量后测定后续指标。
1.3 测定指标与方法
1.3.1 发芽率及活力指数 发芽床为9cm 培养皿加双层滤纸,用蒸馏水润湿,每皿放50粒老化处理种子,4次重复。发芽在光照培养箱中进行,温度为25 ℃,光强为80μmol·m-2·s-1,光暗时间各为12h。记录每天的发芽数及7d后全苗重。7d后总发芽数占种子总数百分率即为发芽率(germination rate,Gr),活力指数(VI)按按下式计算:
VI=G1×Sx
式中,G1为在时间t的发芽率,等于每天发芽种子数(Gt)同其相应发芽天数(Dt)之比的总和;Sx为发芽7d后全苗重[3]。
1.3.2 DAF-FM DA 原位荧光标记检测 利用震荡切片机在pH 7.4PBS缓冲液中将平衡24h及老化0(CK)、1、2、3、4、5d的种子切成50μm 的切片,然后于含10μmol·L-1DAF-FM DA 的PBS中避光染色40 min,再用PBS 漂洗2 次,然后压片、封片。用激光共聚焦显微镜(激发波长488nm,发射波长515nm)镜检。
1.3.3 蛋白质S-亚硝基化检测 采用Biotin Switch法进行蛋白质S-亚硝基化检测。分别用液氮研磨老化0(CK)、2、3和5d的种子20粒,用700μL HEN Buffer(250mmol·LHepes pH 7.7,1mmol·L-1EDTA,0.1 mmol·L-1Neocuproine)溶解 粉末,用Blocking Buffer(250 mmol·L-1Hepes pH 7.7,1mmol·L-1EDTA,0.1mmol·L-1Neocuproine,2.5%SDS,20mmol·L-1MMTS)重悬蛋白,50 ℃孵育30 min,每4 min振荡1 次。加入2倍体积预冷的丙酮,-20 ℃孵育1h,4 ℃、3 000g离心10min,弃上清。用HEN Buffer(250mmol·L-1Hepes pH 7.7,1mmol·L-1EDTA,0.1mmol·L-1Neocuproine,1%SDS)重悬蛋白,加入4mmol·L-1biotin-HPDP(用DMF 配制)和1 mmol·L-1抗坏血酸,室温孵育1h,每10min振荡1次。以不加biotin-HPDP和抗坏血酸的无生物素标记的CK蛋白组为阴性对照组,用以检测种子内源生物素蛋白。
生物素标记后进行Western blotting实验。将蛋白定量为统一浓度后,经10%SDS-PAGE,转移至硝酸纤维素膜上。将膜置于封闭液(含2% BSA的PBS缓冲液)中振荡1h,然后于含HRP的封闭液中杂交过夜(抗体稀释比例1∶3 000)。洗涤液(含0.5% Tween-20的PBS缓冲液)漂洗5 次,每次10min。将显色液A 和显色液B按1∶1比例混合后加到膜上反应5 min,铺上保鲜膜后置于压片夹中,暗室中显影、定影。
2 结果与分析
2.1 人工老化过程中家榆种子活力的变化特征
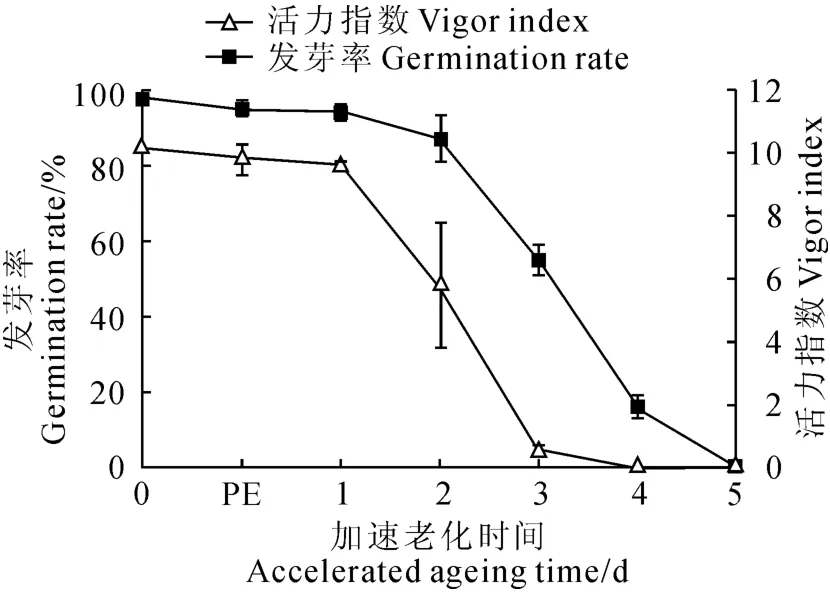
图2 人工控制老化家榆种子发芽率和活力指数PE.种子老化平衡期Fig.2 Germination rate and vigor index of elm seeds during artificial ageing PE.Post equilibrate
家榆种子为典型双子叶无胚乳种子,初始发芽率为98.0%。图2显示,种子在37 ℃、1 0 0%相对湿度条件下平衡24h后,发芽率小幅降至96.0%;老化2d后种子发芽率降至80.0%,活力指数下降了约50%;老化3d后发芽率急剧降至50.0%,种子活力降至0.5;老化4~5d后种子发芽率约2.0%,活力很低。综合上述结果,本研究选择未老化(对照)和老化3d(种子活力下降50%)的种子进行后续的药物学处理实验。
2.2 外源NO 供体SNP与NO 清除剂处理对家榆种子活力的影响
为研究NO 在家榆种子老化中所起作用,实验使用外源NO 供体SNP对家榆种子进行预处理,老化后检测种子活力的变化。结果表明,家榆种子发芽率和活力指数随SNP 浓度的升高而增高,当SNP浓度达到100μmol·L-1时,发芽率和活力指数均达到最高,此时发芽率达71.0%,与对照差异极显著;其后随SNP 浓度的继续增高,两项指标均呈下降趋势,当SNP 浓度达到200μmol·L-1时,发芽率降低至42.0%,已产生显著抑制作用(图3,A),表明100μmol·L-1SNP为家榆种子预处理的最佳浓度。另外,家榆种子单独用NO 清除剂cPTIO 处理后,再老化后的发芽率降至33.0%,而用抑制剂处理后再用SNP蒸气处理,老化种子发芽率回升为47.5%(图3,D)。说明外源NO 可显著提高种子抗老化能力;NO 清除剂cPTIO 可显著降低种子抗老化能力,而外源NO 可恢复cPTIO 产生的抑制效果,表明NO 可提高种子抗老化能力。
2.3 一氧化氮合酶、硝酸还原酶活性与家榆种子老化的关系
为研究NO 在家榆种子老化中的产生途径,实验使用硝酸还原酶底物亚硝酸钠、硝酸还原酶抑制剂钨酸钠、一氧化氮合酶底物L-Arg、一氧化氮合酶抑制剂L-NAME 进行预处理,老化后检测种子活力的变化。结果表明,老化后种子活力随亚硝酸钠浓度的升高而逐渐升高,当浓度达到500μmol·L-1时,发芽率达到最高值(64.0%),与对照差异达到极显著水平,其后随亚硝酸钠浓度的升高而下降;当浓度升高到1 000μmol·L-1时,亚硝酸钠对种子萌发开始产生抑制,当浓度升高至10 000μmol·L-1时发芽率降低至0.7%;同时,在亚硝酸钠处理前预先用硝酸还原酶抑制剂钨酸钠共处理,可显著减弱亚硝酸钠引起的老化后种子活力提升,发芽率降低为43.3%(图3,B)。随着L-Arg浓度的增加,家榆种子老化后种子发芽率呈现先增加后降低的趋势;当浓度为200μmol·L-1时种子发芽率达到最高(70.5%),随后,当浓度达到1mmol·L-1时,LArg 对种子萌发产生显著抑制,发芽率降低至27.0%(图3,C)。用类一氧化氮合酶(NOS)抑制剂L-NAME、硝酸还原酶抑制剂钨酸钠处理后,种子老化后的发芽率分别降低至40.5%、27.5%;而用2种抑制剂处理后再用SNP蒸气处理,发芽率分别回升为68.0%、43.0%(图3,D)。
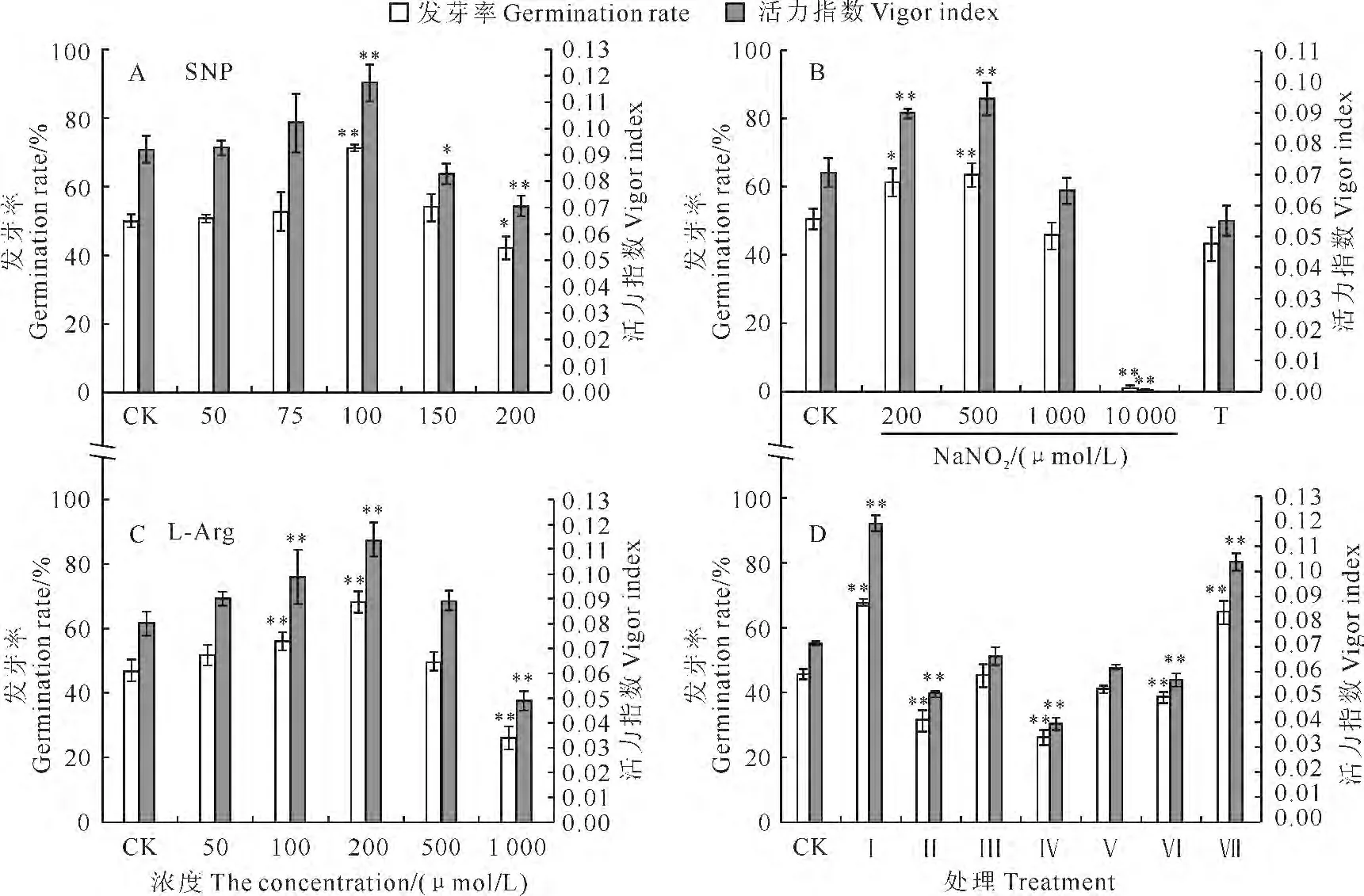
图3 多种药剂处理对家榆种子老化后种子活力的影响Fig.3 Effects of pharmaceutical treatment on seed vigor in elm seeds under controlled ageing T.50μmol·L-1 Na2WO4+500μmol·L-1 NaNO2;CK.H2O+H2O;Ⅰ.H2O+SNP;Ⅱ.cPTIO+H2O;Ⅲ.cPTIO+SNP;Ⅳ.Na2WO4+H2O;Ⅴ.Na2WO4+SNP;Ⅵ.L-NAME+H2O;Ⅶ.L-NAME+SNP

图4 DAF法检测不同老化处理家榆种子中NO 的含量Fig.4 DAF assay of content of NO in different parts of elm seeds during ageing
可见,一氧化氮合酶和硝酸还原酶的底物在一定浓度范围内均可提高家榆种子老化后的活力水平,两种酶的抑制剂均可显著降低种子老化后的活力,且抑制剂产生的抑制效果可被SNP 所恢复,说明硝酸还原酶与类一氧化氮合酶可参与家榆种子老化中NO 的产生。
2.4 家榆种子老化过程中细胞内NO 含量与蛋白质S-亚硝基化水平的变化
采用NO 特异性荧光染料DAF-FM DA 进行NO 荧光标记,激光共聚焦显微镜观察家榆种子老化过程中内源NO 的变化。如图4所示,老化处理后的家榆种子子叶中NO 含量先升高后降低,在种子老化平衡期达到最高值,而在发芽率为80.0%时次之;而胚根尖部NO 的含量逐渐升高,到发芽率为0时达到最高;生长点与下胚轴则在发芽率为2.0%时才有NO 出现。即种子老化过程中NO 水平发生了时空特异性变化,说明NO 与种子老化中活力的丧失具有不可忽视的联系。
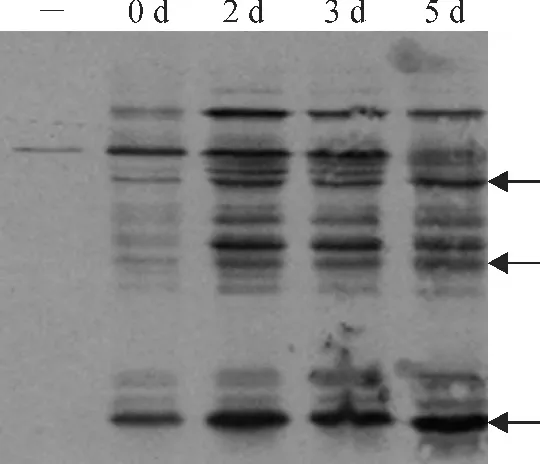
图5 Biotin swtich法检测不同老化处理家榆种子中S-亚硝基化水平-.内源生物素;0d、2d、3d、5d.老化不同天数种子S-亚硝基化蛋白;←.S-亚硝基化水平上升条带Fig.5 Biotin switch assay of S-nitrosylation level in elm seeds during ageing-.Endogenous biotin;0d,2d,3d,5d.S-nitrosylation protein of seeds ageing different time;←.The strips of S-nitrosyaltion level rise
家榆种子内源生物素蛋白[条带(-)]及发芽率80.0%(老化2d)、50.0%(老化3d)、2.0%(老化5 d)后种子中蛋白的S-亚硝基化情况如图5 所示。从图中可以发现,内源生物素化蛋白含量很低,基本可以忽略不计;S-亚硝基化水平在发芽率80.0%时显著升高,随后在发芽率50.0%时略有降低,发芽率为2.0%时部分条带略有上升(图中标记条带),但总体水平均高于未老化种子(CK)。这与图4中种子中NO 产生的时间特点相一致,说明种子体内蛋白质S-亚硝基化水平与其NO 的产生相关。
3 讨 论
NO 可调控植物的成熟和衰老。目前,已有较多的证据表明NO 和它的衍生物N2O 通过延缓组织衰老进程、抑制乙烯合成来提高果蔬贮藏过程中抵御逆境的能力,并改善果蔬采后贮藏的品质[19]。通过利用NO 清除剂(PTIO)清除积累的NO,水稻叶片细胞死亡都得到明显减轻,表明NO 介导了H2O2诱导的叶片细胞死亡[20]。本研究通过NO 供体和抑制剂综合处理,发现外源NO 处理可延缓家榆种子死亡,提高种子抗老化能力。
NO 在动物体内合成主要通过L-Arg依赖型途径,即通过一氧化氮合酶(NOS)将L-Arg转变为Lcit,进而产生NO。自从Corpas等在植物体内发现了一种L-Arg依赖型NO 合成途径后,NOS在植物界中的研究得到了广泛的关注[21]。目前,人们已发现NOS在盐胁迫、叶片衰老以及种子萌发等方面均可参与NO 的生成[22-24]。此外,Bright等[25]在 研究ABA 诱导的气孔关闭与NO 之间的关系时,发现拟南芥突变体nia1、nia2对ABA 的反应异常,即ABA 不能引起2种突变体中NO 的产生和气孔关闭,说明硝酸还原酶与ABA 诱导的气孔关闭中NO的产生密不可分。随后,Zhao等[26]在拟南芥叶片冰冻胁迫时也发现了硝酸还原酶产生NO。此后,硝酸还原酶依赖型NO 合成途径逐渐得到人们的重视。2011年,Bai等[27]在干旱胁迫下的种子胚轴中发现了NO 的产生,并且此NO 的产生可被类NOS酶抑制剂L-NAME和硝酸还原酶抑制剂钨酸钠所抑制,说明类NOS酶和硝酸还原酶与干旱胁迫下NO 的产生密切相关。本研究通过NO 相关药剂学处理,发现硝酸还原酶底物亚硝酸钠、类一氧化氮合酶底物L-Arg可提升种子活力,硝酸还原酶抑制剂钨酸钠、类一氧化氮合酶抑制剂L-NAME 可降低种子活力,且两种抑制剂的作用可被NO 供体SNP所恢复,说明硝酸还原酶途径和类一氧化氮合酶途径可参与种子老化中NO 的合成。
NO 在植物体内的作用方式有多种,研究比较多的主要包括其与多种信号分子如Ca2+、H2O2的相互作用,蛋白质亚硝基化以及其与多种抗氧化酶之间的关系等。其中,蛋白质S-亚硝基化由于其作用范围广而备受人们关注。自从Lindermayr等[28]于2005年在NO 孵育后的拟南芥叶片和悬浮细胞中发现S-亚硝基化蛋白后,S-亚硝基化在植物中的研究逐渐深入。目前,已发现S-亚硝基化蛋白可参与许多细胞响应,如物质代谢、光合作用、氧化还原反应、免疫反应与应激反应等。2011 年,Bai等[27]发现干旱胁迫下种子内的S-亚硝基化水平显著降低,同时抗氧化酶活性降低,种子活力减弱,说明S-亚硝基化可影响顽拗性种子的脱水耐性,至此S-亚硝基化在种子中的研究开始起步。本研究通过DAF-FM DA 荧光染色,在老化的家榆种子中发现了NO 的产生,种子在平衡过程(PE)和发芽率80.0%时,其子叶中NO 含量最高,而在发芽率为0时生长点与下胚轴才有NO 出现。通过Biotin switch结合Western blotting法,对不同老化处理家榆种子进行S-亚硝基化检测,发现S-亚硝基化水平与NO 在种子中产生的时间特点一致,说明体内蛋白质S-亚硝基化水平与NO 的产生相关。
综上所述,NO 在种子老化中具有不可忽视的作用。外源NO 供体可提升种子活力,NO 清除剂cPTIO 可降低种子活力,外源NO 供体可恢复NO清除剂的抑制效果,证明NO 可提高种子抗老化能力。硝酸还原酶和一氧化氮合酶底物在一定浓度范围内均可提高种子老化后的活力水平,2种酶的抑制剂均可显著降低种子老化后的活力,且抑制剂产生的抑制效果可被SNP所恢复,说明硝酸还原酶与类一氧化氮合酶可能参与种子老化中NO 的产生。种子老化过程中出现了蛋白质S-亚硝基化,且S-亚硝基化水平与NO 产生的时间特点一致,显示S-亚硝基化水平与NO 的产生有关。据此可以认为,NO可提高种子抗老化能力,其在种子内可通过硝酸还原酶途径和类一氧化氮合酶途径产生,且种子蛋白质S-亚硝基化水平与NO 的产生相关。
[1] WALTERS C,WHEELER L M,GROTENHUIS J M.Longevity of seeds stored in a genebank:species characteristics[J].Seed Science Research,2005,15(1):1-20.
[2] LI Y(李 颜),WANG Q(王 倩).The artificial aging of welsh onion seed and its relation to membrane lipid peroxidation[J].Seed(种子),2007,26(3):27-30(in Chinese).
[3] ZHANG H(张 晗),LU X X(卢新雄),ZHANG ZH E(张志娥),et al.Variation of chromosomal aberration of wheat and hordein induced by seed aging[J].Journal of Plant Genetic Resources(植物遗传资源学报),2004,5(1):56-61(in Chinese).
[4] LIU Y H(刘月辉),WANG D H(王登花),HUANG H L(黄海龙),et al.Physiological and biochemical analysis of artificially aged pepper seed[J].Seed(种子),2003,128(2):51-52(in Chinese).
[5] EL-MAAROUF-BOUTEAU H,MAZUY C,CORBINEAU F,et al.DNA alteration and programmed cell death during ageing of sunflower seed[J].Journal of Experimental Botany,2011,62(14):5 003-5 011.
[6] HU D,MA G,WANG Q,et al.Spatial and temporal nature of reactive oxygen species production and programmed cell death in elm(Ulmus pumila L.)seeds during controlled deterioration[J].Plant,Cell &Environment,2012,35(11):2 045-2 059.
[7] WANG P CH(王鹏程),DU Y Y(杜艳艳),SONG R P(宋纯鹏).Research progress on nitric oxide signaling in plant cells[J].Chinese Bulletin of Botany(植物学报),2009,44(5):517-525(in Chinese).
[8] REN X L(任小林),ZHANG SH Y(张少颖),YU J N(于建娜).Nitric oxide and its role in maturation and senescence in plant[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2004,24(1):167-171(in Chinese).
[9] BESSON-BARD A,GRAVOT A,RICHAUD P,et al.Nitric oxide contributes to cadmium toxicity in Arabidopsis by promoting cadmium accumulation in roots and by up-regulating genes related to iron uptake[J].Plant Physiology,2009,149(3):1 302-1 315.
[10] CHEN W W,YANG J L,QIN C,et al.Nitric oxide acts downstream of auxin to trigger root ferric-chelate reductase activity in response to iron deficiency in Arabidopsis[J].Plant Physiology,2010,154(2):810-819.
[11] MA W,XU W,XU H,et al.Nitric oxide modulates cadmium influx during cadmium-induced programmed cell death in tobacco BY-2cells[J].Planta,2010,232(2):325-335.
[12] ZHANG H Y(张洪艳),ZHAO X M(赵小明),BAI X F(白雪芳),et al.Nitric oxide biosynthesis pathway in plant[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2009,29(7):1 496-1 506(in Chinese).
[13] BESSON-BARD A,PUGIN A,et al.New insights into nitric oxide signaling in plants[J].Annu.Rev.Plant Biol.,2008,59:21-39.
[14] ASTIER J,LINDERMAYR C.Nitric oxide-dependent posttranslational modification in plants:an update[J].International Journal of Molecular Sciences,2012,13(11):15 193-208.
[15] WILKINS K A,BANCROFT J,BOSCH M,INGS J,et al.Reactive oxygen species and nitric oxide mediate actin reorganization and programmed cell death in the self-incompatibility response of Papaver[J].Plant Physiology,2011,156(1):404-416.
[16] BELIGNI M V,FATH A,BETHKE P C,et al.Nitric oxide acts as an antioxidant and delays programmed cell death in barley aleurone layers[J].Plant Physiology,2002,129(4):1 642-1 650.
[17] ARC E,GALLAND M,GODIN B,et al.Nitric oxide implication in the control of seed dormancy and germination[J].Frontiers in Plant Science,2013,4(346):1-13.
[18] BETHKE P C,LIBOUREL I G,et al.Nitric oxide reduces seed dormancy in Arabidopsis[J].Journal of Experimental Botany,2006,57(3):517-526.
[19] GUO Q(郭 芹),WU B(吴 斌),et al.Advances in the mechanism of physiological effect of nitric oxide on delaying ripening,senescence and disease-resistance of fruit and vegetables[J].Chinese Journal of Tropical Crops(热带作物学报),2010,31(7):1 212-1 217(in Chinese).
[20] LIN A,WANG Y,TANG J,et al.Nitric oxide and protein S-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice[J].Plant Physiology,2012,158:451-464.
[21] CORPAS F J,PALMA J M,DEL RÍO L A,et al.Evidence supporting the existence of l-arginine-dependent nitric oxide synthase activity in plants[J].New Phytologist,2009,184(1):9-14.
[22] JIN C W,DU S T,SHAMSI I H,et al.NO synthase-generated NO acts downstream of auxin in regulating Fe-deficiency-induced root branching that enhances Fe-deficiency tolerance in tomato plants[J].Journal of Experimental Botany,2011,62(11):3 875-3 884.
[23] GUO F Q,OKAMOTO M,CRAWFORD N M.Arabidopsis nitric oxide synthase1is targeted to mitochondria and protects against oxidative damage and dark-induced senescence[J].The Plant Cell Online,2005,17(12):3 436-3 450.
[24] CORPAS F J,BARROSO J B,CARRERAS A,et al.Constitutive arginine-dependent nitric oxide synthase activity in different organs of pea seedlings during plant development[J].Planta,2006,224(2):246-254.
[25] BRIGHT J,DESIKAN R,HANCOCK J T,et al.ABA-induced NO generation and stomatal closure in Arabidopsis are dependent on H2O2synthesis[J].The Plant Journal,2006,45(1):113-122.
[26] ZHAO M G,CHEN L,ZHANG L L,et al.Nitric reductase-dependent nitric oxide production is involved in cold acclimation and freezing tolerance in Arabidopsis[J].Plant Physiology,2009,151(2):755-767.
[27] BAI X,YANG L,TIAN M,et al.Nitric oxide enhances desiccation tolerance of recalcitrant Antiaris toxicariaseeds via protein S-nitrosylation and carbonylation[J].PLoS One,2011,6(6):20714.
[28] LINDERMAYR C,SAALBACH G,DURNER J.Proteomic identification of S-nitrosylated proteins in Arabidopsis[J].Plant Physiology,2005,137(3):921-930.

