外源硫化氢对冷胁迫下白菜幼苗生长和光合作用的影响
王鸿蕉,张丽萍,刘志强,刘旦梅,金竹萍,裴雁曦
(山西大学 生命科学学院,太原030006)
继一氧化氮(NO)、一氧化碳(CO)之后,硫化氢(H2S)被确认为生物体内第3种气体信号分子,成为近年来的一个研究热点[1]。植物内源H2S 是以半胱氨酸(Cys)为底物,由半胱氨酸脱巯基酶(cysteine desulfhydrases,CDes)催化产生[2]。目前植物中主要研究的CDes包括以L-Cys为底物的LCD、DES[3],和以D-Cys为底物的DCD[1]。已有研究表明,H2S参与调节植物生长发育的多种过程,如促进种子萌发、根形态建成、叶绿素含量增加、花期调节等[4-6]。此外,H2S在植物响应各种非生物胁迫中也发挥了重要作用。它可以调节植物对干旱、高盐、高热的耐受性[7-9],缓解由铜胁迫引起的小麦种子萌发抑制[10];通过与Ca2+的协同作用提高谷子对Cr6+的耐受性[11];缓解氧化胁迫引起的豌豆根尖细胞死亡[12]。
低温胁迫分为0℃以上的冷害和0℃以下的冻害。低温可造成植株生长发育减缓、组织丙二醛(MDA)和H2O2含量升高,以及光合作用的抑制[13],并诱发棉花叶片衰老[14]。光合作用是植物将光能转变为化学能的过程,光粒子的捕捉和电子传递是光合作用重要的过程,与此相关的基因的表达量直接影响光合作用的强弱。LHCB 基因编码捕光蛋白,LHCB2.1突变使拟南芥叶绿素含量显著降低[15]。铁氧还蛋白(Fd)是高等植物光合系统Ⅰ中一类独特的受体,拟南芥Fd 基因突变后可导致光合速率明显降低[16]。硫氧还蛋白(Trx)定位于叶绿体[17],能够激活果糖-1,6-二磷酸酶和NADH-苹果酸脱氢酶[18],对碳的同化起重要作用。白菜是中国北方重要蔬菜作物,低温胁迫会对白菜生产造成严重影响。目前植物对低温胁迫响应机制的深入研究还很有限。本实验希望通过研究生理浓度H2S对低温下白菜幼苗生长和光合作用的影响,从新的角度加深对植物响应冷胁迫生理机制的理解。
1 材料和方法
1.1 材料培养及处理
实验材料为‘津育75号’白菜,选择均匀饱满的种子,种植在土、珍珠岩、蛭石(体积比1∶1∶1)组成的混合基质中,于正常生长条件下培养:温度23℃,相对湿度60%,光照度3 000lx,光周期16/8h(昼/夜),10d后开始对白菜幼苗进行低温处理。
4 ℃处理0d的白菜幼苗在23 ℃生长13d,低温处理3d的幼苗于第11天置于4 ℃开始处理,测定CDes编码基因的表达水平及H2S产率。
在外源H2S对冷胁迫下白菜幼苗生长及光合作用影响的实验中,处理分6组。第11天 时将各组幼苗置于同等体积的密闭玻璃罩内,其中的第2、4组用5μmol·L-1硫氢化钠(NaHS)水溶液进行熏蒸处理24h,第12天将幼苗取出。其中的第5、6组用1 mmol·L-1的H2S 合成抑制剂羟胺(hydroxylamine,NH2OH)处理4h;之后将第3、4、5组共同置于4 ℃下处理3d,其余各组培养温度为23℃。即第1~6组分别为对照(CK,未做任何处理)、硫化氢处理(H2S,仅作NaHS熏蒸处理)、低温处理(4 ℃,仅 作4 ℃低 温 处 理)、硫 化 氢 和 低 温 处 理(H2S+4 ℃,NaHS熏蒸后进行4 ℃低温处理)、羟胺和低温处理(HA+4 ℃,NH2OH 处理4h后再进行4 ℃低温处理)、羟胺处理(HA,仅NH2OH 处理4h)。
1.2 生理指标的测定
相对含水量采用饱和含水量法检测[19]。H2S产率的测定参照Jin方法[8]。采用酸性茚三酮法测定脯氨酸含量[20],可溶性蛋白含量测定采用考马斯亮蓝染色法[21],叶绿素含量的测定参考Chen方法并加以修改[5]。幼苗气体交换参数净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间二氧化碳浓度(Ci)使用CB-1102便携式光合蒸腾仪(北京雅欣理仪科技有限公司)进行检测,测定时需光源充足且稳定,空气中CO2含量稳定。气孔开度观察方法参考Jin等[8]方法,使用Olympus BX 51显微镜进行观察。
1.3 基因表达检测
白菜幼苗总RNA 提取及基因表达检测参考Jin等[8]方法,用Bio-Rad CFX96荧光定量PCR 仪进行Real-time PCR 检 测,数 据 采 集 与 分 析 使 用IQ5软件。
1.4 统计分析
数据使用STATISTICA(Stat Soft Inc,Tulsa,OK)软件进行分析。数据用Mean+SE表示。
2 结果与分析
2.1 冷胁迫对白菜幼苗H2S合成相关基因及内源H2S产率的影响
LCD、DCD、DES 是植物体内产生H2S最主要的3个脱巯基酶编码基因,白菜幼苗在4 ℃低温处理3d后这3种基因的表达水平与未进行低温处理的对照组相比都极显著上调(图1,A),内源H2S产率也极显著升高(图1,B),即在受到低温胁迫时伴随着白菜幼苗体内H2S 含量升高,表明H2S 可能参与了白菜响应低温的过程。
2.2 外源H2S对冷胁迫下白菜幼苗生长的影响

图1 冷胁迫对白菜幼苗半胱氨酸脱巯基酶基因(CDes)表达量和H2S产率的影响**表示冷胁迫前(0d)和胁迫3d在0.01水平存在显著性差异Fig.1 The changes of cysteine desulfhydrases coding genes(CDes)expression and H2S production rate in cabbage seedlings under chilling stress**stand for significant difference between chilling stresses for 0dand 3dat 0.01level
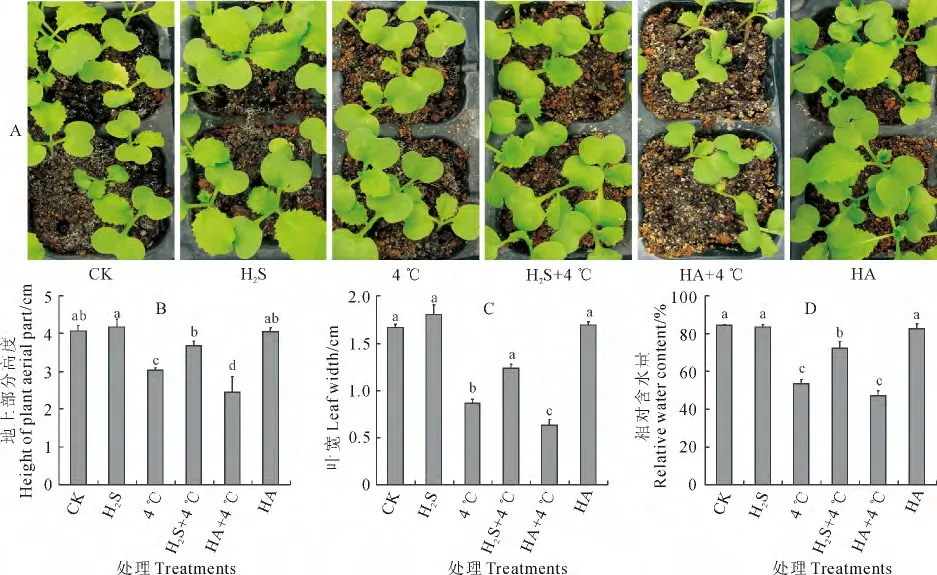
图2 H2S对冷胁迫下白菜幼苗生长状况的影响不同小写字母表示各处理组间在0.05水平存在显著性差异;下同Fig.2 Influence of H2S on cabbage seedlings growth status under chilling stress The different letters indicated significant difference among treatments at 0.05level;The same as below
为进一步研究H2S在植物抵御冷胁迫中的作用,用5μmol·L-1NaHS和1mmol·L-1H2S合成抑制剂羟胺(HA)对白菜幼苗进行预处理,观察冷胁迫对其生长状态的影响。图2 显示,与对照(CK)相比,4 ℃处理(4 ℃)的白菜幼苗长势相对弱小(图2,A),其地上部高度、叶宽和叶片相对含水量显著降低,而NaHS预处理(H2S)和NH2OH 处理预处理(HA)的白菜幼苗的生长则在一定程度上得到促进,但其地上部高度、叶宽和叶片相对含水量则无显著变化(图2,B~D)。与4 ℃处理相比较,HA预处理后再经4 ℃处理(HA+4 ℃)的白菜幼苗长势明显弱于单独低温处理组(4 ℃)和H2S 预处理后冷胁迫处理组(H2S+4 ℃)(图2,A),且其地上部高度、叶宽和叶片相对含水量显著降低(图2,B~D);H2S预处理后冷胁迫下(H2S+4 ℃)的幼苗长势较4 ℃处理稍有促进(图2,A),且其上述3个指标均显著提高;H2S+4 ℃的白菜幼苗长势明显强于HA+4 ℃处理,其3个生长指标也均显著大于HA+4 ℃处理(图2,B~D)。可见,常温条件下,H2S和HA 预处理对白菜幼苗生长没有显著影响;4 ℃冷胁迫显著抑制了白菜幼苗的生长,施加外源H2S可以显著促进低温下白菜幼苗的生长,即H2S在白菜幼苗抵抗冷胁迫过程中发挥重要作用,施用外源H2S能有效缓解冷胁迫对白菜幼苗生长造成的抑制。
2.3 外源H2S对冷胁迫下白菜幼苗脯氨酸和可溶性糖含量的影响
受到低温胁迫后,植物体内的渗透调节物质脯氨酸和可溶性糖含量会升高[22]。与CK 相比较,白菜幼苗叶片脯氨酸含量在H2S和HA 处理均有所降低,但未达到显著水平,而4 ℃、H2S+4 ℃、HA+4 ℃处理下均显著提高;与4 ℃冷胁迫相比,叶片的脯氨酸含量在H2S+4 ℃处理下显著提高,而在HA+4 ℃处理下无显著变化(图3,A)。白菜幼苗叶片可溶性糖含量在各处理下的变化趋势与脯氨酸含量相似,只是经过H2S预处理的幼苗叶片中可溶性糖含量显著高于CK(图3,B)。可见,在正常生长状态下,HA 处理对白菜幼苗叶片脯氨酸和可溶性糖的积累均没有显著影响,而H2S能够引起可溶性糖含量的显著增加;4 ℃冷胁迫及其与H2S、HA 共同处理均能显著提高白菜幼苗叶片可溶性糖和脯氨酸含量,并以H2S预处理表现最突出。即外源H2S在白菜幼苗抵御冷胁迫过程中能显著促进体内脯氨酸和可溶性糖的积累。
2.4 外源H2S 对冷胁迫下白菜幼苗光合特性的影响
有研究表明,植物在受到干旱和盐胁迫后其光合作用效率会显著降低,从而影响植物的生长状态[23]。与CK 相比,HA 对白菜幼苗叶片Pn无显著影响,而H2S 预处理则可使其显著升高,4 ℃冷胁迫可显著减弱Pn;与4℃冷胁迫相比,叶片Pn在H2S+4 ℃处理下显著提高,而在HA+4 ℃处理下无显著变化(图4,A)。白菜幼苗叶片Tr在H2S和HA 处理下与CK 相比未见显著变化,却受到4 ℃冷胁迫显著抑制;同时,H2S+4 ℃、HA+4 ℃处理幼苗叶片Tr与4℃冷胁迫相比未见明显变化,即外源H2S对Tr的影响在低温胁迫下并不显著(图4,B)。白菜幼苗在经过4℃处理后叶片气孔与CK 相比有一定程度的关闭,且其Gs与H2S+4 ℃、HA+4 ℃处理的白菜幼苗处于同一水平,正常生长状况下的3 个处理组Gs也无显著性变化(图4,C、F)。与CK 相比,H2S预处理可降低叶片Ci但未达到显著水平,HA 预处理对Ci无明显影响,4℃低温胁迫可显著提高Ci,以减弱白菜幼苗的光合作用,而H2S+4 ℃处理白菜幼苗的Ci与单独4 ℃和HA+4 ℃处理相比显著降低(图4,D)。另外,单独H2S预处理后白菜幼苗叶绿素含量显著高于CK 和HA处理组,4 ℃低温处理则可使其显著降低;经H2S预处理再进行冷胁迫处理白菜幼苗的叶绿素含量显著高于4℃低温胁迫和HA+4℃处理组(图4,E)。可 见,正常生长状况下,H2S对Tr,Gs和Ci并无显著影响,但可使Pn和叶绿素含量显著升高,而HA对以上5个指标均无显著作用;4 ℃低温胁迫显著抑制了白菜幼苗Pn、Tr和Gs,并减少叶片中叶绿素含量,同时使得Ci升高,而施加外源H2S则显著缓解了低温胁迫对Pn的抑制和叶绿素含量的减少,降低了Ci。即外源H2S预处理可以逆转白菜幼苗由低温引起的净光合速率的减缓、胞间二氧化碳浓度的升高和光合色素含量的降低。

图3 外源H2S对冷胁迫下白菜幼苗脯氨酸和可溶性糖含量的影响Fig.3 Influence of exogenous H2S on proline and soluble sugar content in cabbage seedlings under chilling stress
2.5 外源H2S对冷胁迫下白菜幼苗光合作用相关基因表达的影响
LHCB 基因编码捕光蛋白,参与光的捕获和传递过程,是光合作用起始过程中的一个重要组成部分[24]。正常培养温度下,外源H2S 处理可以显著提高白菜幼苗LHCB 基因家族中LHCB2.4、LHCB4、LHCB4.3、LHCB6的表达量;在4 ℃低温胁迫条件下,其LHCB2.4、LHCB4、LHCB4.3 的表达量与CK 相比被显著抑制,而H2S+4 ℃处理中LHCB2.4和LHCB4.3基因表达量显著高于4 ℃处理,HA+4 ℃对LHCB6基因表达的抑制作用较单独低温胁迫更为明显(图5,A)。即外源H2S可以显著提高LHCB 基因家族中LHCB2.4、LHCB4、LHCB4.3、LHCB6 的表达量,并且可以在一定程度上缓解由于低温而造成的表达量抑制,从而提高在冷胁迫下白菜幼苗的捕光效果,防止由低温对白菜幼苗光合作用所产生的抑制现象。
铁氧还蛋白和硫氧还蛋白在植物光合作用的电子传递过程发挥重要的作用,H2S预处理对于这两类蛋白编码基因表达不论在正常生长温度还是低温胁迫下均有极显著的上调作用,4 ℃低温胁迫对FC1、FD3、TRX-M4 和TRX-F1 基 因 表 达 的 抑 制更为显著,而H2S合成被抑制后低温对FC1、FD3表达的抑制作用更为明显(图5,B、C)。即H2S对白菜幼苗叶片光合作用电子传递链中铁氧还蛋白和硫氧还蛋白编码基因有显著的上调作用,能够缓解低温对其造成的抑制,并且H2S的缺失使得低温下FC1、FD3表达量的抑制现象更为突出。本实验结果表明,外源H2S预处理可以显著上调白菜幼苗捕光蛋白、铁氧还蛋白和硫氧化蛋白相关编码基因的表达量,从分子水平缓解由于低温所造成的光合作用的抑制。

图4 外源H2S对冷胁迫下白菜幼苗叶片光合作用相关指标(A~E)和气孔开度(F)的影响Fig.4 Influences of exogenous H2S on photosynthesis-related indicators(A-E)and stomatal aperture(F)in cabbage seedling leaves under chilling stress
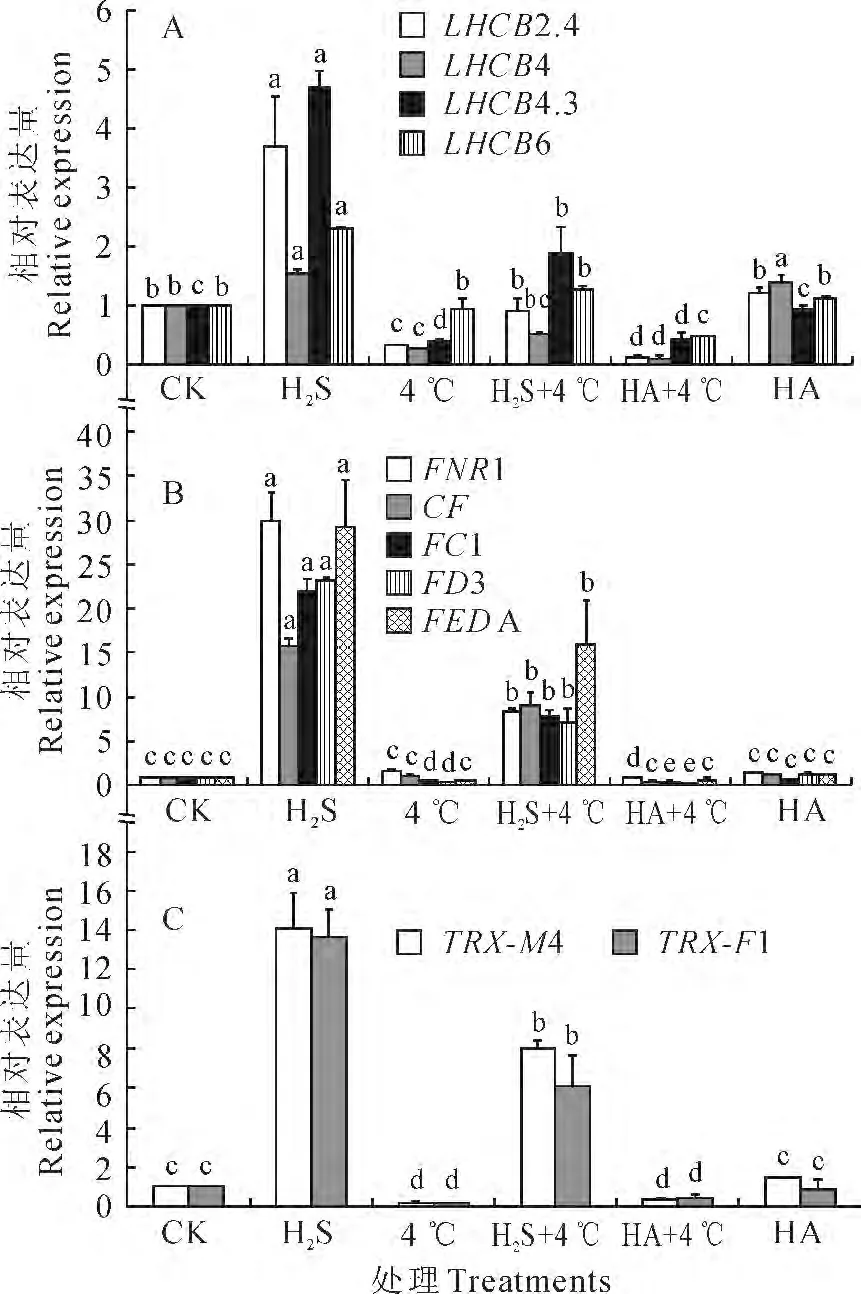
图5 H2S对冷胁迫下白菜幼苗叶片光合作用相关基因LHCB(A)、Fd(B)和Trx(C)表达的调节作用Fig.5 The regulation of H2S on the expression of photosynthesis-related genes LHCB(A),Fd(B)and Trx(C)in cabbage seedlings under chilling stress
3 讨 论
植物在冷胁迫过程中为了应对低温所造成的伤害,体内脯氨酸、可溶性糖等物质含量升高并积累[25],在一定低温处理时间内H2S 合成酶基因表达量以及产率均随处理时间逐渐升高,说明H2S可能参与到白菜幼苗应对冷胁迫的过程,但低温仍然造成白菜幼苗生长缓慢、萎蔫,这可能是由于内源H2S含量较少,不能够应对长时间低温胁迫所致,所以本实验加入外源H2S进行预处理以验证H2S对冷胁迫下白菜幼苗生长及光合作用的影响。根据本实验室已有研究结果,本实验采用NaHS处理浓度为5μmol·L-1,因为此浓度下白菜幼苗的生长状况最佳。
在本研究中H2S能显著提高白菜幼苗光合作用过程中捕光蛋白、铁氧化蛋白和硫氧还蛋白相关编码基因的表达量,这3类基因所编码的蛋白在植物光粒子捕捉和光合系统电子传递链过程中发挥着重 要 的 作 用[16-18,26],其 表 达 量 的 增 加 在 一 定 程 度 上可以增加叶绿体对光粒子的捕捉,增强光合系统中电子传递的效率,从而提高低温胁迫下白菜光合作用强度,促进白菜的生长。在光合特性相关指标中,植物气孔导度与温度和光照直接相关,在光照条件相同的情况下低温可使植物气孔关闭,蒸腾速率降低,光合作用强度减弱。本实验中H2S预处理后再进行4 ℃处理的幼苗气孔关闭,蒸腾速率并没有因为H2S预处理而升高,这一结果与Jin等[8]的研究结果H2S通过关闭气孔来增加抗旱性一致,但是在本研究数据统计中,并未看到H2S+4 ℃处理与单独4 ℃和HA+4 ℃处理叶片的蒸腾速率和气孔导度有明显差异,可能是H2S与4 ℃低温对气孔的关闭均有所作用,但这一作用并不能够叠加。而外源H2S能显著上调白菜叶片捕光蛋白等光合作用相关基因表达量,显著增强白菜叶片Pn,这一结果与Chen等[5]的研究中H2S提高光合作用的结果是一致的。所以,H2S提高冷胁迫下白菜幼苗的光合作用强度并不是通过增加气孔开度和增强蒸腾速率来实现的,而是通过直接影响白菜幼苗叶片的净光合速率和胞间二氧化碳浓度起作用。
依据本研究的数据,推测H2S提升白菜幼苗对冷的耐受能力可能至少涉及2个生理过程,一方面是通过调节光合作用相关基因的表达量,增加冷胁迫下叶片Pn来提升白菜幼苗光合强度。因为H2S可以提高1,5-二磷酸核酮糖羧化酶的活性,增加植物对碳的固定,进而促进从CO2到葡萄糖的合成过程[5]。因此无论有无低温胁迫H2S 均可增加白菜幼苗可溶性糖的含量,为其生长提供更多的有机物,当胁迫来临时也能够更好地应对以促进生长。另一方面H2S可增加低温胁迫下白菜幼苗体内脯氨酸含量,藉此调节叶片细胞的渗透性,减少水分的丧失,为细胞代谢提供相对稳定的环境,缓解冷胁迫带来的危害。
综上所述,在冷胁迫条件下,外源H2S 预处理能通过调节白菜幼苗光合作用相关基因的表达量,增强叶片光合作用强度,增加有机物的累积,同时调节叶片细胞的渗透性,减少水分的丧失,提高幼苗对冷胁迫的耐受能力,减轻损伤,缓解低温胁迫对白菜幼苗生长的影响。
[1] WANG R.Physiological implications of hydrogen sulfide:a whiff exploration that blossomed[J].Physiological Reviews,2012,92(2):791-896.
[2] RAUSCH T,WACHTER A.Sulfur metabolism:a versatile platform for launching defence operations[J].Trends in Plant Science,2005,10(10):503-509.
[3] ALVAREZ C,CALO L,ROMERO L C,et al.An O-acetylserine(thiol)lyase homolog with L-cysteine desulfhydrase activity regulates cysteine homeostasis in Arabidopsis[J].Plant Physiology,2010,152(2):656-669.
[4] ZHANG H,TANG J,LIU X P,et al.Hydrogen sulfide promotes root organogenesis in Ipomoea batatas,Salix matsudana and Glycine max[J].Journal of Integrative Plant Biology,2009,51(12):1 086-1 094.
[5] CHEN J,WU F H,WANG W H,et al.Hydrogen sulphide enhances photosynthesis through promoting chloroplast biogenesis,photosynthetic enzyme expression,and thiol redox modification in Spinaciaoleraceaseedlings[J].Journal of Experimental Botany,2011,62(13):4 481-4 493.
[6] ZHANG H,HU S L,ZHANG Z J,et al.Hydrogen sulfide acts as a regulator of flower senescence in plants[J].Postharvest Biology and Technology,2011,60(3):251-257.
[7] LAI D,MAO Y,ZHOU H,et al.Endogenous hydrogen sulfide enhances salt tolerance by coupling the reestablishment of redox homeostasis and preventing salt-induced K+loss in seedlings of Medicago sativa[J].Plant Science,2014,225:117-129.
[8] JIN Z P,SHEN J J,QIAO Z J,et al.Hydrogen sulfide improves drought resistance in Arabidopsis thaliana[J].Biochemical and Biophysical Research Communications,2011,414(3):481-486.
[9] LI Z G,DING X J,DU P F.Hydrogen sulfide donor sodium hydrosulfide-improved heat tolerance in maize and involvement of proline[J].Journal of Plant Physiology,2013,170(8):741-747.
[10] ZHANG H,HU L Y,HU K D,et al.Hydrogen sulfide promotes wheat seed germination and alleviates oxidative damage against copper stress[J].Journal of Integrative Plant Biology,2008,50(12):1 518-1 529.
[11] FANG H H(方慧慧),PEI Y X(裴雁曦),TIAN B H(田保华),et al.Ca2+participates in H2S induced Cr6+tolerance in Setaria italica[J].Chinese Journal of Cell Biology(中国细胞生物学学报),2014,36(6):1-8(in Chinese).
[12] CHENG W,ZHANG L,JIAO C,et al.Hydrogen sulfide alleviates hypoxia-induced root tip death in Pisum sativum[J].Plant Physiology and Biochemistry,2013,70:278-286.
[13] TAKAHASHI S,MURATA N.How do environmental stresses accelerate photoinhibition?[J].Trends in Plant Science,2008,13(4):178-182.
[14] ZHAO J,LI S,JIANG T,et al.Chilling stress——the key predisposing factor for causing Alternaria alternatainfection and leading to cotton(Gossypium hirsutum L.)leaf senescence[J].PloS One,2012,7(4):e36126.
[15] ANDERSSON J,WENTWORTH M,WALTERS R G,et al.Absence of the Lhcb1and Lhcb2proteins of the light-harvesting complex of photosystem Ⅱ——effects on photosynthesis,grana stacking and fitness[J].The Plant Journal,2003,35(3):350-361.
[16] VOSS I,GOSS T,MUROZUKA E,et al.FdC1,a novel ferredoxin protein capable of alternative electron partitioning,increases in conditions of acceptor limitation at photosystem I[J].The Journal of Biological Chemistry,2011,286(1):50-59.
[17] BALSERA M,UBEREGUI E,SCHURMANN P,et al.Evolutionary development of redox regulation in chloroplasts[J].Antioxidants &Redox Signaling,2014,21(9):1 327-1 355.
[18] CAIN P,HALL M,SCHRODER W P,et al.A novel extended family of stromal thioredoxins[J].Plant Molecular Biology,2009,70(3):273-281.
[19] COLEMAN W K.Evaluation of wild Solanumspecies for drought resistance:1.Solanum gandarillasii Cardenas[J].Environmental and Experimental Botany,2008,62(3):221-230.
[20] ZHANG D ZH(张殿忠),WANG P H(汪沛洪),ZHAO H X(赵会贤).Determination of the content of free proline in wheat leaves[J].Plant Physiology Communications(植物生理学通讯),1990,(4):62-65(in Chinese).
[21] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry,1976,72:248-254.
[22] XU B(徐 博),REN W(任 伟),XU A K(徐安 凯)et al.Physiological responses to chilling stress in transplastomic tobacco with PuP5CSgene[J].Acta Agriculturae Boreali-Sinica(华北农学报),2012,27(3):186-190(in Chinese).
[23] CHAVE M M,FLEXAS J,PINHEIRO C.Photosynthesis under drought and salt stress:regulation mechanisms from whole plant to cell[J].Ann.Bot.,2009,103(4):551-560.
[24] XU Y H,LIU R,YAN L,et al.Light-harvesting chlorophyll a/b-binding proteins are required for stomatal response to abscisic acid in Arabidopsis[J].Journal of Experimental Botany,2012,63(3):1 095-1 106.
[25] SINGH I,KUMAR U,SINGH S K,et al.Physiological and biochemical effect of 24-epibrassinoslide on cold tolerance in maize seedlings[J].Physiology and Molecular Biology of Plants,2012,18(3):229-236.
[26] BICHANAN B B.Regulation of CO2assimilation in oxygenic photosynthesis:the ferredoxin/thioredoxin system.Perspective on its discovery,present status,and future development[J].Archives of Biochemistry and Biophysics,1991,288(1):1-9.

