铅污染对青杨雌雄幼苗铅富集和营养特征的影响
胡相伟,张明锦,徐 睿,杨万勤,张 健,陈良华
(四川农业大学 生态林业研究所,四川林业生态工程重点实验室,成都611130)
随着工农业的快速发展,环境污染问题日益突出,是食品安全和人类健康的重大威胁。环境污染分为点源污染和面源污染,点源污染指具有固定污染排放源的一类污染,而面源污染也称非点源污染,没有固定的污染排放源,具有隐蔽性、分散性、不易监测性及受多因子影响等特点[1-2]。20世纪70 年代以后,发达国家开始对污染进行整治,工业三废和城市生活污染得到有效控制,即点源污染对环境的危害在逐步减小,而面源污染的影响则日益突显。目前,中国对点源污染也已逐渐加大控制力度,正处于污染构成的快速转变期,面源污染占污染的比重日益增加[3],但植物对面源水平污染的生理生态研究还相当缺乏,所以尤其需要进行一些低水平污染的环境修复研究。
植物修复技术是治理面源污染的重要技术之一。与其他方法相比,植物修复技术具有廉价易操作、生态环境友好和易受大众认可等优点[4]。传统的思维方式中,最佳的植物修复材料是超富集植物,这类植物因其具有超强的重金属积累能力和耐受力使其能在重金属浓度极高的土壤中生长繁衍。但是,绝大多数超富集植物都是草本植物,具有很多缺点,诸如生物量低、生长缓慢,对生物气候条件要求严格,不利于大范围推广,且专一性强,一般仅富集一种到两种特定的重金属。此外,这类植物如果没有及时收割回收,很容易因植物器官的凋落和腐烂,导致重金属重返土壤,降低了修复效率[5-7]。然而,选用对重金属具有一定耐性,但因巨大生物量使富集总量超过超富集植物的速生木本植物,也会产生良好的修复效果[8-9]。木本植物在修复土壤的同时,还能提供木材和生物能源,并通过根和茎大量固定重金属,阻碍其进入食物链[10-11]。杨柳科植物具有速生丰产、适应性强、根系发达、繁殖容易等优点,且不容易进入食物链,还具有可观的经济和生态价值,其在重金属修复方面的前景日益受到重视[12-13]。
本研究选用的速生木本植物青杨(Populus cathayana Rehd.),属于杨柳科(Salicaceae)杨属(Populus L.)植物,原产中国,分布广泛,是典型的雌雄异株植物,具有生长快、抗性强、易成活、适性广等优良特性[14]。已有的研究表明在温度适宜、气候湿润的生境中,青杨雌株比雄株生长上具有优势,然而受到环境胁迫(如干旱、高低温以及淹水等)后雄株则表现出更强的适应性和耐受性[15-19],但目前对环境污染条件下青杨性别间差异的研究还非常缺乏。初步的野外调查发现,不同污染的区域,青杨雌雄生长和分布情况有所不同,重度污染区青杨性比偏雄性,在轻度污染区则偏雌性。这说明污染区青杨雌雄株的空间分异和生殖格局也可能与环境污染程度相关。因此,有必要进行性别间重金属胁迫耐受性差异的研究,这类研究可以为重金属污染植物修复时的性别选择提供理论依据。
1 材料和方法
1.1 实验材料
扦插所用一年生青杨枝条来自青海省大通县国有林场(101°35′E;35°56′N)。实验用土取自四川农业大学成都校区附近的稻田土壤,土壤基本理化性质为:有机碳含量10.13g·kg-1,铵态氮含量3.32 mg·kg-1,硝态氮含量0.22 mg·kg-1,有效磷含量37.72mg·kg-1,速效钾含量11.47mg·kg-1,含水量22.30%,pH 7.56。实验采用盆栽方式,每盆装稻田土15kg,塑料花盆口径30cm,深25cm。
1.2 实验设计
本实验采用双因素(性别和铅处理)完全随机区组设计。根据中国土壤环境质量标准(GB15618-2008)中铅污染物的第二级标准值来设定本研究的污染梯度,即超过50mg·kg-1为污染土壤;本研究中每种性别各设置20.5mg·kg-1(土壤背景值,对照,CK)、50 mg·kg-1(轻度污染,T1)、100 mg·kg(中度污染,T2)3个铅浓度水平,均以干土质量计算;T1和T2是将Pb(NO3)2与去离子水配成50 μmol·L-1的浓度施入土壤,在充分混匀平衡1 月后用于盆栽实验。
2013年3 月选取健壮、无病害、粗细一致的一年生雌雄青杨枝条,剪成长度相当的小节,扦插在苗床上;待扦插苗萌发生长至6月初,选取长势一致的青杨幼苗(约15cm)移栽入各处理花盆土壤中,每盆1株,雌雄幼苗每个处理各9株,共54株。青杨幼苗移栽后,实验处理在仅遮蔽雨水的大棚中进行,对所有供试植株进行统一浇水、除草防虫和防病等管理,控制浇水量以避免多余水分流出塑料盆。
1.3 样品处理
2013年10 月中旬,每个处理随机选取雌雄幼苗各5株,全株收获并分为根、茎和叶,用去离子水擦净表面,先于105 ℃烘箱中杀青0.5h,然后调至65 ℃烘干至恒重,计算单株青杨根、茎、叶生物量和总生物量。将每一株根、茎和叶样品分别粉碎研磨后过筛混匀,以备植物营养元素和铅含量的测定。
植物样品经H2SO4-H2O2混合酸消煮后测定N 和P的含量,N 含量采用半微量凯氏定氮法,P含量采用钼锑抗比色法测定。植物样品经HNO3-HClO4混合酸消化后,使用岛津AA-7000 火焰原子吸收光谱仪测定Pb含量。
1.4 数据分析
应用SPSS 18.0 统计软件进行数据分析和处理,采用单因素方差分析(one-way ANOVA)计算均值和标准误;不同处理间的差异采用Tukey多重比较检验;采用多因素方差分析性别和铅处理间的交互作用;显著性水平设置为α=0.05。最后将以上操作所得的数据和分析结果录入Origin 8作图。
2 结果与分析
2.1 铅胁迫对青杨雌雄幼苗生物量的影响
如表1所示,与CK 相比,青杨雌雄幼苗叶生物量、根生物量和根冠比在两个升高的铅浓度下均无显著变化;雌雄幼苗茎生物量均随铅处理浓度的升高逐渐下降,雌株在T1和T2处理下分别比相应CK 减小13.9%和18.1%,雄株则分别减小15.4%和19.7%;雌株总生物量在T1和T2处理下分别比相应CK 显著降低了14.1%和17.8%,而雄株总生物量则在3种处理下无显著差异。同时,在相同铅胁迫处理条件下,根生物量和总生物量在不同性别间均表现出极显著差异,且雌株均显著高于雄株。此外,多因素方差分析表明,根生物量受到了铅与性别交互作用的显著影响,也就是说,对于根系生物量这一因变量而言,仅研究铅或者性别的单独效应是不够的,还须根据另一因素的不同水平研究该因素的作用大小。
2.2 铅胁迫对青杨雌雄幼苗营养元素的分配
青杨雌雄幼苗各器官N 浓度均未受铅处理的显著影响(图1,A)。但因铅处理导致的各器官生物量积累的变化,随着铅处理浓度的增加,青杨雌株幼苗叶和茎N 贮量逐渐降低,T2处理下茎部N 贮量显著低于CK 处理,而雄株各器官N 贮量受铅处理的影响不显著;同时,在相同铅处理条件下,青杨雌株的叶和根中N 的贮存总量显著高于雄株,而茎中氮贮存总量在雌雄株间无显著差异(图1,B)。
总体来看,青杨雌雄幼苗各器官P 浓度在T1和T2处理下比相应CK 有不同程度降低(在T1处理条件下叶片的变化除外);与CK 相比,雌株叶片P浓度在T1处理下显著增加,却在T2处理下显著减少,而雄株T2处理叶片的P浓度显著降低(图1,C)。与N 积累总量的变化趋势相似,雌雄青杨幼苗各个器官P积累量在T1和T2铅处理下表现出一定程度下降,尤其是对地上部分的器官;与CK 相比,T2处理显著减小了雌株茎和叶片中P的积累总量,但仅减小了雄株叶片中P的积累总量(图1,D)。多因素方差分析表明,青杨幼苗各器官P浓度和总量均受到铅处理的显著影响。
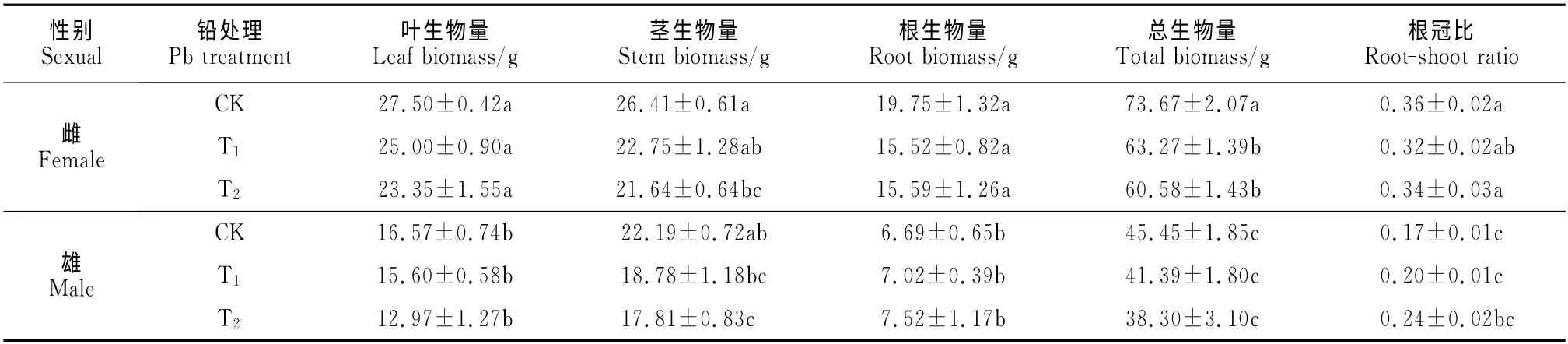
表1 面源污染水平铅处理下青杨雌雄幼苗生物量积累及分配Table 1 Dry matter of accumulation in different organs and its characteristic of allocation in females and males of P.cathayana when exposed to diffused levels of Pb pollution
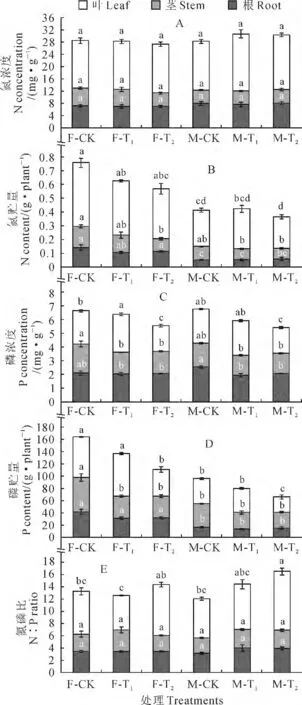
图1 铅污染环境下青杨雌雄幼苗各器官的氮磷含量及其比值变化F-CK、F-T1、F-T2 和M-CK、M-T1、M-T2 分别代表雌株和雄株CK、T1、T2 处理。同一器官不同字母表示处理间在0.05水平存在显著差异;下同Fig.1 The contents of N,P,and ratio of N to P in different organs of females and males of P.cathayana exposed to diffused levels of Pb pollution F-CK,F-T1,F-T2and M-CK,M-T1,M-T2represents for the treatments CK,T1,T2in females and males,respectively.The values with different letters within the same organ indicate significant difference between the treatments at 0.05level;The same as below
与CK 相比,雌雄青杨的茎和根中N/P在铅胁迫处理下均未发生显著的变化;雌株叶片中N/P在T1和T2处理下先降低后升高,但均未达到显著水平,而雄株叶片中N/P在T1和T2处理条件下逐渐增加,并在T2处理条件下达显著水平(图1,E)。多因素方差分析表明,仅青杨叶片的N/P受到铅胁迫的显著影响。
2.3 铅胁迫对青杨雌雄幼苗铅分布和积累的影响
从图2,A 可以看出,不同浓度铅处理对青杨幼苗根部铅浓度有显著影响,随着铅处理浓度的增加,两种性别幼苗根部铅浓度均显著升高;雌株叶片和茎中铅浓度也随着铅处理浓度的增加而有不同程度的升高,但雄株叶片和茎部铅浓度均没有显著的变化。另外,雄株叶片和茎中铅浓度在CK 和T1处理下均显著高于雌株,而在T2处理下与雌株无显著性差异;雄株根部铅浓度在CK 条件下显著高于雌株,在T1和T2处理条件下均低于雌株,并在T2处理下达到显著水平。多因素方差分析表明,青杨各器官铅浓度均受到性别、铅处理及性别和铅处理交互作用的显著影响。
同时,与器官铅浓度的变化规律相似,青杨雌雄幼苗根部铅贮量在T1和T2处理下均比CK 显著升高(雄株T1处理除外);雌株叶部铅贮量仅在T2处理下显著高于CK,而雄株叶片的铅贮量在各处理间差异均不显著;雌雄幼苗茎部铅贮量在各处理间差异均不显著(图2,B)。与CK 相比,T1和T2处理均显著增加了雌株铅总积累量,且T2处理显著高于T1处理;雄株铅总积累量在3 种处理间差异均不显著。在相同铅胁迫条件下,雌株总铅贮量只有在CK 处理下低于雄株,在T1和T2处理下均明显高于雄株,尤其是在T2处理条件下是雄株的1.93倍(图2,C)。多因素方差分析表明,性别和铅处理的交互作用对青杨各器官及总铅积累量有显著影响。
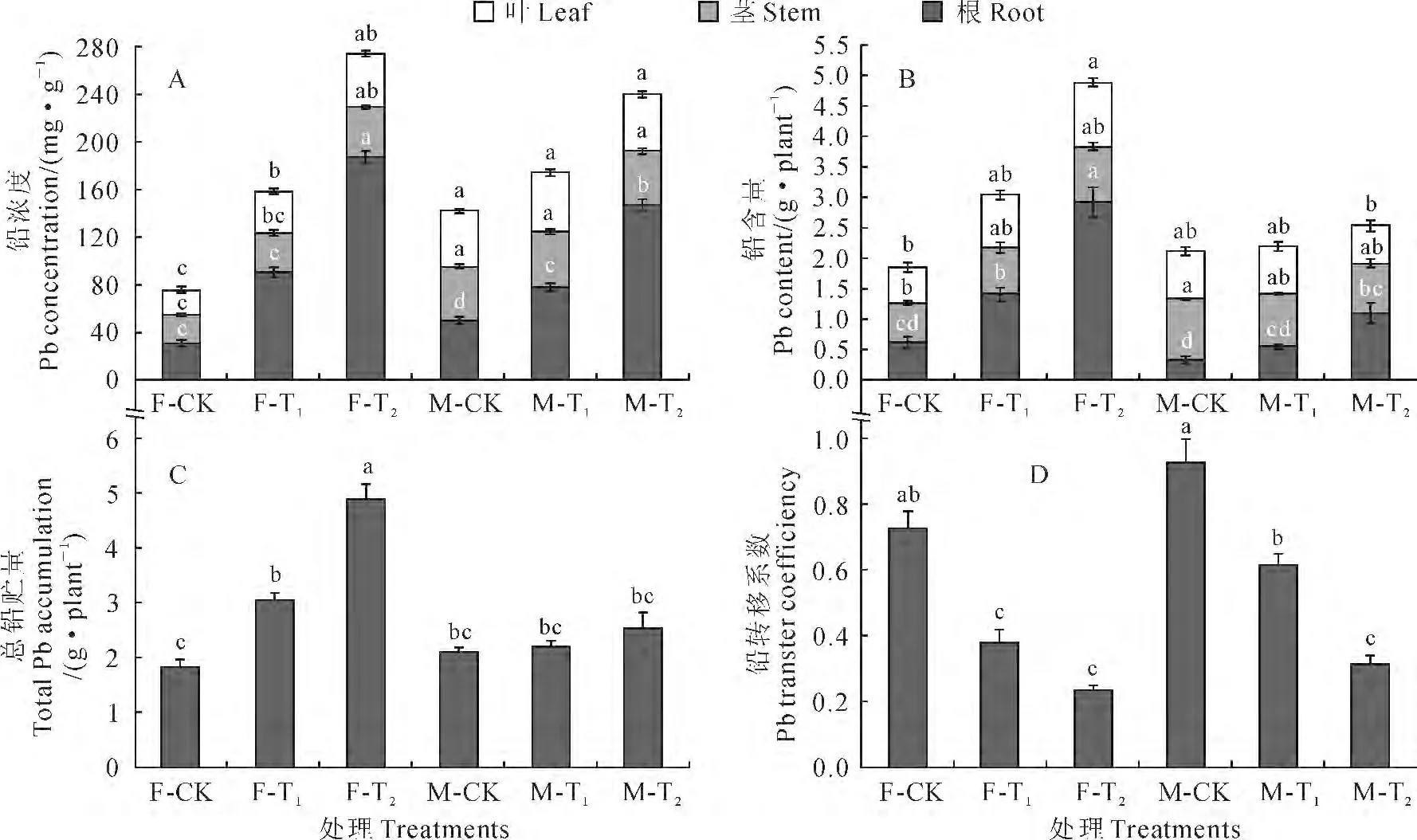
图2 铅污染环境下青杨雌雄幼苗铅的积累与分配的变化Fig.2 The Pb accumulation and allocation in different organs of females and males of P.cathayana under Pb pollution
此外,转移系数是植物地上部分重金属浓度与地下部分重金属浓度的比值[20]。从图2,D可以看出,随着铅处理浓度的增加,青杨两种性别幼苗铅转移系数均比CK 显著下降,T2处理又比T1处理明显下降,并在雄株中达到显著水平。在相同铅处理条件下,雄株各器官铅转移系数均高于相应雌株,但仅在T1处理条件下达到显著水平。多因素方差分析表明,青杨幼苗铅转移系数受到性别和铅处理的显著影响。
3 讨 论
铅是植物的非必需元素,当植物体内铅离子过量时就会对自身细胞产生毒害作用,进而对其生长产生一定的负面影响,如抑制植物生物量生产,改变了生物量分配格局等[21]。本研究表明,即使在很低的铅污染水平,如面源污染水平(50 mg·kg-1干土)同样对青杨两种性别的茎生长产生了一定的负面影响。同时,前人的研究表明,雌雄异株植物因其繁殖成本的差异和在不同生境中的长期适应进化,导致其在分布、存活、生长、生理和资源分配等方面表现出明显的性别差异[22],当受到逆境胁迫时,这种 差 异 会 更 为 明 显[15-17,23],且 雌 株 的 环 境 适 应 性 更差,对资源具有较高的要求[24]。本研究发现,低水平铅污染对青杨雄株幼苗的生物量未造成显著影响,却显著降低了雌株生物量,这些结果说明雌株对铅污染更加敏感,青杨雄株则具有更强的铅污染适应性。另外,根冠比是衡量生物量分配的重要指标。杨鹏等[17]对青杨幼苗进行淹水和铝胁迫处理,发现其根冠比显著下降,表明这些逆境条件显著抑制了青杨幼苗生物量向根系的正常分配,进而影响了植株对水分和矿质营养的吸收。本研究中,面源水平铅处理对青杨幼苗的根冠比无显著影响,说明面源铅污染并没有对青杨生物量的分配产生负面影响,但从营养元素的测定来看,面源铅污染同样造成了青杨的营养失衡,尤其是P。该研究结果表明虽然面源铅污染没有改变生物量在地上与地下部分的分配,但可能影响到了根的结构与功能,这值得进一步深入研究。
植物各器官养分浓度的差异一定程度上表征了植物受逆境伤害的程度。N 是植物体内蛋白质、核酸、叶绿素以及多种酶的重要组成成分,在植物生命活动中占有重要地位,因此其在代谢旺盛器官中(如叶片)的分配相当关键,而P 在ATP 反应、糖类代谢、蛋白质代谢、脂类代谢中起重要作用,并对细胞分裂和植物各器官分化发育,特别是开花结实具有重要作用[25]。本实验中,与CK 相比,各铅污染处理对青杨幼苗各器官的N 浓度无显著影响,说明这一水平的铅污染并没有对青杨N 的吸收以及同化产生显著的负面影响。与N 浓度的变化相比,铅污染对青杨P 浓度产生了一定的抑制,尤其是雌株,雌株P的失衡可以是影响其正常生长的重要原因,可以预见的是,由铅污染导致的长期P失衡很可能会降低其代谢速率,影响雌株正常的生长发育。此外,N 和P在植物体内的积累和分配格局可以更为直观地表征植物对环境的响应[26],植物N/P 可用做N 饱和的诊断指标,可用来确定养分限制的阈值;有研究表明,N/P低于14可以反映植物受N 限制,高于16时表明植物受P限制,介于14和16之间时受N 和P协同限制[27]。本研究中的土壤背景下,经过一个生长季的生长,生长季末期青杨两种性别幼苗各器官的N/P 均低于10,说明此时土壤养分供应不充足,植物主要是缺N,导致青杨幼苗的生长受到N 的限制。铅污染条件下,雌株通过降低生物量,使其各器官中N/P维持在一个相对稳定的水平,但对雄株而言,叶片N/P 随着铅处理浓度的升高逐渐增加,可能是因为在铅污染条件下雄株的正常生长引起了由N 限制向P限制转变的趋势。
已有研究表明,植物不同器官对重金属的吸收、积累能力存在着较大的差异[28],本研究表明青杨不同性别间对重金属的积累与分配同样存在差异,随着铅处理浓度的增加,青杨雌雄幼苗根部对铅的吸收和积累量显著增加,并且雌株增加的幅度要大于雄株;对于地上部分而言,铅处理条件下雄株地上部分铅浓度并未显著增加,而雌株地上部分器官均显著增加(尤其是T2处理)。这些结果说明,铅在青杨雌株幼苗体内容易向地上部分运输和积累,但是叶片作为光合作用的主要器官,同样也是植物最为敏感的器官,铅的过量积累可能会产生毒理作用,这可能是其生物量下降的主要原因。从植物修复的角度来看,雌株在两个铅污染浓度处理条件下,雌株幼苗总铅积累量均高于雄株,且随着铅污染水平的提高有进一步的增加趋势,说明两种性别对铅污染的适应策略不相同,雌株高积累的特性能够促进土壤中更多有效态铅被固定在雌株生物体内,有利于铅的植物修复,但对其生长必然产生一定的负面影响,雄株则采取了排斥的策略[29],以保证它的正常生长。从铅转移系数来看,随着铅污染强度的增大,青杨雄株的铅转移系数进一步减小,这就有效限制了铅向其地上部敏感器官的运输和分配,可以减轻雄株的地上部分器官受到的铅离子毒害,有利于其保持较好的生长[30]。
综上所述,在面源水平铅污染情况下,青杨雄株幼苗生物量与正常状况相比无显著差异,而雌株生物量受到铅的显著负面影响,表明青杨雌株受到铅污染的负面影响更大,雌株对环境胁迫更为敏感。两个梯度的铅污染均未对青杨两种性别的N 营养造成显著影响,但对P 营养的影响显著,雄株在污染条件下较为正常的生长可能会导致它更为缺P。虽然雌株生物量在受到铅污染后显著降低,但各污染条件下雌株的总生物均显著高于雄株,加之雌株具有更强的铅吸收和积累能力(尤其是根部),使得雌株根部对铅的积累总量显著高于雄株。值得注意的,虽然面源铅污染导致了雌株生物量一定程度的下降,但在外观上并没有表现出一定的毒理症状。因此,从污染修复的角度来讲,青杨雌株对受铅污染土地的修复能力要强于雄株,但对于污染较为严重的地区,雄株较强的适应能力使得其更适应该地区的生态恢复。
[1] ZHANG SH L(张水龙),ZHUANG J P(庄季屏).Current situation and development tendency of researches of non-point source pollution in agriculture[J].Chinese Journal of Ecology(生态学杂志),1998,17(6):51-55(in Chinese).
[2] SONG J Y(宋家永),LI Y T(李英涛),SONG Y(宋 宇),et al.Research and prospect on non-point pollution from agriculture[J].Chinese Agriculture Science Bulletin(中国农学通报),2010,26(11):362-365(in Chinese).
[3] ZHAO Y H(赵永宏),DENG X ZH(邓祥征),ZHAN J Y(战金艳),et al.Study on current situation and controlling technologies of agricultural non-point source pollution in China[J].Journal of Anhui Agriculture Science(安徽农业科学),2010,38(5):2 548-2 552(in Chinese).
[4] SAIFULLAH,MEERS E,QADIR M,et al.EDTA-assisted Pb phytoextraction[J].Chemosphere,2009,74(10):1 279-1 291.
[5] HAMMER D,KAYSER A,KELLER C.Phytoextraction of Cd and Zn with Salix viminalis in field trials[J].Soil Use and Management,2003,19(3):187-192.
[6] ZHOU ZH M(周振民),ZHU Y Y(朱彦云).Research progress of phytoremediation technology of large biomass plant[J].Journal of Irrigation and Drainage(灌溉排水学报),2009,28(6):26-29(in Chinese).
[7] YE Z H,SHU W S,ZHANG Z Q,et al.Evaluation of major constraints to revegetation of lead/zinc mine tailings using bioassay techniques J.Chemosphere200247101 103-1 111.
[8] WEI X W(韦秀文),YAO B(姚 斌),LIU H W(刘慧文),et al.Application of dendroremediation to the soil contaminated soil by heavy metals and organic pollutants[J].Scientia Silvae Sinicae(林业科学),2011,47(5):124-130(in Chinese).
[9] CHEN L H,GAO S,ZHU P,et al.Comparative study of metal resistance and accumulation of lead and zinc in two poplars[J].Physiologia Plantarum,2014,151(4):390-405.
[10] ZHANG D W(张东为),CUI J G(崔建国),GE S F(戈素芬),et al.Effect of Cd contamination in soil on growth of poplar of different varieties[J].Bulletin of Soil and Water Conservation(水土保持通报),2008,28(3):59-64(in Chinese).
[11] SHI X(施 翔),CHEN Y T(陈益泰),WANG SH F(王树凤),et al.Growth and metal uptake of three woody species in lead/zinc copper mine tailing[J].Acta Ecologica Sinica(生态学报),2011,31(7):1 818-1 826(in Chinese).
[12] SEBASTIANI L,SCEBBA F,TOGNETTI R.Heavy metal accumulation and growth responses in poplar clones Eridano(Populus deltoides×maximowiczii)and I-214(P.×euramericana)exposed to industrial waste[J].Environmental and Experimental Botany,2004,52(1):79-88.
[13] LIU W T(刘维涛),ZHANG Y L(张银龙),CHEN K M(陈枯敏),et al.Cadmium and zinc adsorption and distribution in various tree species in a mining area[J].Chinese Journal of Applied Ecology(应用生态学报),2008,19(4):752-756(in Chinese).
[14] QI L W(齐力旺),ZHANG SH G(张守攻),HAN S Y(韩素英),et al.Karyotype comparison of Populus Sect.Tacamahaca[J].Acta Botanica Yunnanica(云南植物研究),2004,26(5):537-542(in Chinese).
[15] XU X,YANG F,XIAO X W,et al.Sex-specific responses of Populus cathayanato drought and elevated temperatures[J].Plant,Cell &Environment,2008,31(6):850-860.
[16] ZHANG S,JIANG H,PENG S M,et al.Sex-related differences in morphological,physiological,and ultrastructural responses of Populus cathayanato chilling[J].Journal of Experimental Botany,2011,62(2):675-686.
[17] YANG P(杨 鹏),XU X(胥 晓).Effects of waterlogging stress on the growth and physiological characteristics of male and female Populus cathayana seedlings[J].Chinese Journal of Plant Ecology(植物生态学报),2012,36(1):81-87(in Chinese).
[18] CHEN L H,WANG L,CHEN F G,et al.The effects of exogenous putrescine on sex-specific responses of Populus cathayanato copper stress[J].Ecotoxicology and Environmental Safety,2013,97:94-102.
[19] CHEN L H,ZHANG L,TU L H,et al.Sex-related differences in physiological and ultrastructural responses of Populus cathayanato Ni toxicity[J].Acta Physiologiae Plantarum,2014,36(7):1 937-1 946.
[20] MATTINA M I,LANNUCCI-BERGER W,MUSANTE C,et al.Concurrent plant uptake of heavy metals and persistent organic pollutants from soil[J].Environmental Pollution,2003,124(3):375-378.
[21] KANG L N(康丽娜),WU F ZH(吴福忠),HE ZH H(何振华),et al.Effects of Pb stress on biomass distribution pattern and Pb accumulation in(Populus deltoides×Populus nigra)[J].Journal of Agro-Environment Science(农业环境科学学报),2012,31(3):484-490(in Chinese).
[22] DAWSON T E,EHLERINGER J R.Gender-specific physiology,carbon isotope discrimination,and habitat distribution in Boxelder,Acer Negundo[J].Ecology,1993,74:798-815.
[23] LI J Y(李俊钰),XU X(胥 晓),YANG P(杨 鹏),et al.Effects of aluminum stress on ecophysiological characteristics of male and female Populus cathayana seedlings[J].Chinese Journal of Applied Ecology,2012,23(1):45-50(in Chinese).
[24] CHEN L H,DONG T F,DUAN B L.Sex-specific carbon and nitrogen partitioning under N deposition in Populus cathayana[J].Trees-Structure and Function,2014,28(3):793-806.
[25] PATTERSON T B,GUY R D,DANG Q L.Whole-plant nitrogen-and water-relations traits,and their associated trade-offs,in adjacent muskeg and upland boreal spruce species[J].Oecologia,1997,110(2):160-168.
[26] WU F Z,YANG W Q,WANG K Y,et al.Effect of stem density on leaf nutrient dynamics and nutrient use efficiency of dwarf bamboo[J].Pedosphere,2009,19(4):496-504.
[27] KOERSELMAN W,MEULEMAN A F M.The vegetation N P ratio a new tool to detect the nature of nutrient limitation[J].Journal of Applied Ecology,1996,33(6):1 441-1 450.
[28] SUN Y B,ZHOU Q X,XU Y M,et al.Phytoremediation for co-contaminated soils of benzo[a]pyrene(B[a]P)and heavy metals using ornamental plant Tagetes patula[J].Journal of Hazardous Materials,2011,186(2-3):2 075-2 082.
[29] BAKER A J M.Metal tolerance[J].New Phytologist,1987,106(S1):93-111.
[30] WOZNY A,KRZESLOWSKA M,TOMASZEWSKA B.Lead in Plant Cells[M].Sorus,Poznan,Poland,1995.

