转DAS/DAK 基因天竺葵甲醛代谢途径与吸收能力研究
周升恩,肖素勤,韩 双,轩秀霞,孙 振,李昆志,陈丽梅
(昆明理工大学 生命科学与技术学院生物工程技术研究中心,昆明650500)
甲醛(HCHO)污染以其来源广、污染重、治理难而成为一个重要的环境问题。在众多治理HCHO 污染的方法中,生物净化法以其简单自然、经济、科学以及持久有效等优点受到广泛关注。对生物净化法的机理研究发现微生物和植物都能吸收和 代 谢HCHO[1-5]。虽 然 植 物 能 够 吸 收 并 代 谢HCHO,但环境中极低浓度的气体HCHO 就会对植物产生胁迫,导致叶片气孔传导率下降,无法快速有效吸收HCHO 供植物代谢[6]。在植物体中过量表达HCHO 同化途径的相关酶能够提高植物吸收和代谢HCHO 的能力[7-10]。甲基型营养酵母的木酮糖单磷酸途径(XuMP)能够同化HCHO,在该途径中同化HCHO 的关键酶是二羟基丙酮激酶(DAS)和二羟基丙酮合酶(DAK),在DAS作用下,5-磷酸木酮糖(Xu5P)可以固定HCHO,生成三磷酸甘油醛(GAP)和二羟丙酮(DHA),DHA 对细胞有毒,但可以通过DAK 的作用形成无毒的磷酸二羟基 丙 酮(DHAP)[11]。该HCHO 固 定 途 径 中 的Xu5P、GAP和DHAP是植物卡尔文循环途径中的关键中间代谢产物。因此,如果在植物叶绿体中过量表达来自于甲基型营养酵母中的DAS/DAK 基因,也许可以在植物叶绿体中构建一条光合HCHO同化途径(图1)。为此,Xiao等[12]在模式植物烟草的叶绿体中过量表达DAS/DAK 基因,结果表明该途径能够在烟草的叶绿体中发挥作用,并提高了转基因烟草吸收和同化HCHO 的能力。

图1 在植物叶绿体中过表达DAS/DAK基因安装光合HCHO 同化途径策略Xu5P.5-磷酸木酮糖;DHA.二羟基丙酮;DHAP.磷酸二羟丙酮;RuBP.核酮糖-1,5-二磷酸;GAP.3-磷酸甘油醛;FBP.果糖-1,6-二磷酸;E4P.赤鲜糖-4-磷酸;SBP.景天庚酮糖-1,7-二磷酸;S7P.景天庚糖酮糖-7-磷酸;Gluc.葡萄糖;Fruc.果糖Fig.1 Diagram of strategy for installation of a photosynthetic HCHO-assimilation pathway by overexpressioning DAS/DAK genes in chloroplasts of plant Xu5P.Xylulose-5-phosphate;DHA.Dihydroxyacetone;DHAP.Dihydroxyacetone phosphate;RuBP.Ribulose 1,5-bisphosphate;GAP.Glyceraldehyde3-phosphate,FBP.Fructose-1,6-bisphosphate;E4P.Erythrose-4-phosphate,SBP.Sedoheptulose-1,7-bisphosphate,S7P.Sedoheptulose-7-phosphate;Gluc.Glucose;Fruc.Fructose
天竺葵以其娇艳的花色、多变的花瓣和较长的花期而逐渐成为室内装饰及露天花坛使用的主要材料之一。它能够通过组织培养快速繁殖,常被用作转基因操作的材料。本研究以天竺葵为材料,在野生型天竺葵的叶绿体中过量表达DAS 和DAK 基因,利用13C-NMR 技 术 对 液 体H13CHO 胁 迫 下 野生型和转基因天竺葵叶片H13CHO 代谢产物进行比较分析,并通过测定气体HCHO 胁迫下野生型和转基因天竺葵的生理生化指标,分析其对天竺葵HCHO 抗性、HCHO 吸收效率以及气孔传导率的影响,为利用DAS/DAK 基因开发转基因观赏植物治理气体HCHO 污染的技术提供理论依据。
1 材料和方法
1.1 天竺葵的转化和培养
无菌野生型天竺葵在MS 培养基(pH 5.7)上培养。天竺葵的转化参照Song等[10]的方法进行。含 有pKm-35S-PrbcS-*T-DAK-PROLD-PrbcS-*T-DAS[12]表达载体 的农杆菌[Agrobacterium tumefaciens C58C1(pMP90)]培养于含有100μg·mL-1Spe液体LB 培养基中。天竺葵的转化采用农杆菌介导的叶柄共培养方法[13]。在含有50μg·mL-1卡那霉素(Km)的MS(含有1%蔗糖,W/V)培养基上筛选转基因天竺葵小苗。
为了得到天竺葵的无菌苗,抗性芽首先在含有50μg·mL-1Kan的MS培养基上筛选,然后转移到含有3%蔗糖的MS 培养基,并且在25 ℃100 μmol·m-2·s-1恒定光照下培养。将筛选到的具有Km 抗性的天竺葵小苗转移到含有3%蔗糖的MS培养基上继续培养,获得无菌转基因天竺葵幼苗。此外,获得的具有Km 抗性且生根的天竺葵小苗转移到含有1/2珍珠岩和1/2有机土的花盆中培养,获得土壤栽培的转基因天竺葵植株。
1.2 基因组PCR 和Western blot分析
用CTAB 法[14]从野生型和T1代转基因株系叶片中提取基因组DNA 作为模板。分别用DAS的上下游引物(DAS-F:5′-CATTATCTAGACATGAAGTTCCAC-3′/DAS-R:5′-TAAATGATTTTGATCATGTTTTGG-3′)和DAK的上下游(DAKF:5′-CTGAAGGAAAGCTTGATCTC-3′/DAK-R:5′-CTACAACTTGGTTTCAGATTTG-3′)进行PCR扩增,检测DAS 和DAK 基因在转基因株系基因组的整合情况。
用Plant Total Protein Extraction kit(Sigma)提取野生型和转基因株系新鲜叶片组织的总蛋白。取15 μg总蛋白通过SDS-PAGE(浓度为12%)分离后转移至PVDF-P膜上。分别以假丝酵母(Candida boidinii S2)和毕赤酵母(Pichia pastoris GS115)制备的粗蛋白(5μg)为阳性对照(PCK),随后用C.boidinii S2和P.pastoris GS115的DAS和DAK 蛋白的鼠抗[12]作一抗孵育过夜,再用辣根过氧化酶标记的羊抗鼠二抗室温孵育2h,洗膜后加入1 mL Luminol/Enhancer solution和1 mL CL Peroxide solution(PIERCE),混匀,浸润整个PVDF膜,在凝胶成像系统上用ChemidoeXRS(BIO-RAD)观测结果。
1.3 H13CHO、NaH13CO3 标记与13C-NMR分析
H13CHO 和NaH13CO3购 于 美 国CIL 公 司,液体H13CHO 和NaH13CO3处理在组培瓶中进行,从无菌培养的天竺葵植株上分别取叶片2g,用2 mmol·L-1液体H13CHO(含5 mmol·L-1KHCO3,0.1% MES,W/V)处理野生型天竺葵(H13CHO/WT)和转基因天竺葵植株PSK5(H13CHO/PSK5)叶片4h,用5 mmol·L-1NaH13CO3(含5 mmol·L-1KHCO3,0.1% MES)溶液处理野生型天 竺 葵(NaH13CO3/WT)叶 片4 h,以 未 经 过H13CHO处理的野生型天竺葵叶片为对照(CK)。在整个处理期,于25 ℃的组培室中,24h光照下摇床振荡(100r·min-1)培养,处理结束后,分别用预冷无菌蒸馏水冲洗叶片4~5次,去除叶片表面残留的H13CHO 和NaH13CO3,无菌吸水纸吸干叶片表面残留水分,液氮速冻,置于-80 ℃冰箱备用。
13C-NMR 分析如下:取-80 ℃冰箱中冻存的叶片,在液氮中研磨,加3mL 100mmol·L-1磷酸钾缓冲液(KPB,pH 7.4)抽提可溶性代谢产物,经沸水浴加热处理3 min使酶失活,4 ℃下12 000g离心20min。上清液经真空冷冻干燥后,用0.5mL的KPB缓冲液溶解,4℃下12 000g离心3min,取上清装入核磁管,并加入适量甲酰胺做内参和5%2H2O(V/V)。13C-NMR 分 析 在 布 鲁 克 核 磁 共 振 仪(DRX 500-MHz)上进行,使用相关参数如下:宽带质子去耦,5-ms(90°)脉冲,谱宽37 594 Hz,采样时间0.5s,延滞时间1.2s,样品温度保持在25℃,每个样品采集32 000个数据点,扫描1 200次,处理数据时线宽为4 Hz。H13CHO 标记样品中化学位移时参照甲酰胺碳原子共振峰(166.66ppm)。NMR谱中共振峰通过和已知化合物13C-NMR 谱进行比较鉴定。在计算不同样品中各代谢物的相对含量时目标共振峰以甲酰胺为内参进行积分。
1.4 测定项目和方法
1.4.1 天竺葵对HCHO 抗性分析 将野生型和转基因植株PSK5幼苗置于含有MS固体培养基的培养瓶内,25 ℃100μmol·m-2·s-1持续光照培养2周后,在其中加入一个去盖的500μL 的离心管,吸取30μL 37%的HCHO 溶液至该离心管中。由于HCHO 极易挥发,HCHO 气体很快充满密闭空间,使整个瓶中的HCHO 浓度达到48μg·L-1,继续培养15d后观察天竺葵的生长状态并采集图片。
1.4.2 丙二醛(MDA)、H2O2和蛋白羧基(PC)含量测定 将野生型和转基因植株PSK5幼苗置于含有MS固体培养基的密封盒(370 mL)内25 ℃100 μmol·m-2·s-1持续光照培养3~4周生根后,在其中加入一个去盖的500μL 离心管,吸取30μL 37% HCHO 溶液,使HCHO 浓度达到48μg·L-1,处理24h后收集叶片,液氮速冻,置于-80 ℃冰箱备用。参照Gurel等[15]的方法测定MDA 和PC含量。参照Gay等[16]的方法测定H2O2含量。
1.4.3 气体HCHO 胁迫下天竺葵HCHO 吸收效率和气孔传导率的测定 将温室条件下盆栽培养的生长良好、株龄和长势一致的的野生型和转基因植株放入一个三面由压缩板材(59×40×48cm)组成、一面有玻璃门的柜子里进行24h HCHO 胁迫处理,分别于8:00、13:00、18:00和次日8:00用便携式甲醛检测仪(PPM400 HTV,英国)测定柜子内的HCHO 浓度,以未放入植株的空柜为对照(CK1),同时用光合作用测量系统(CI-340,美国)测定叶片的气孔传导率,以相同光照和温湿度条件的柜外野生型植株为对照(CK2)。
1.5 数据的统计分析
所有生理生化指标分析均进行3 次重复。用Microsoft Excel 2003软件进行数据处理和作图,用DPS 7.05软件进行方差分析和多重比较(Duncan法);用F检验差异的显著性。
2 结果与分析
2.1 转基因天竺葵的鉴定
为了检测具有Km 抗性的天竺葵植株基因组中是否含有目的基因,以野生型和筛选出的转基因株系(PSK1、PSK4和PSK5)基因组为模板进行PCR分析,结 果 表 明,转 基 因 株 系(PSK1、PSK4 和PSK5)可以扩增出与阳性对照(DAS/DAK cDNA编码区)相同的目的条带(约0.5kb),而野生型则没有扩增出任何条带(图2,A、B),说明DAS 和DAK 基因均已插入到转基因株系的基因组中。
为检测目的基因在转基因株系中的表达水平,Western blot分析结果表明,3株PCR 阳性植株和阳性对照(PCK)中都能检测到非常强的77.4kD 的DAS和66.7kD 的DAK 信号条带,而野生型中没有检测到相应的信号条带(图2,C、D)。这3个转基因株系中PSK5中目的基因的表达水平最高,PSK4次之,最弱的是PSK1。以上结果说明DAS/DAK基因在这3个转基因株系中能正常表达,因此可以将这3个转基因株系进行继代用于后续实验。
2.2 转基因天竺葵的H13CHO 代谢产物分析
为了考察过表达DAS 和DAK 基因所形成的HCHO 同化途径是否在转基因天竺葵中引导HCHO代谢流进入卡尔文循环,以及其发挥作用时是否改变天竺葵原有HCHO 代谢途径,13C-NMR分 析 比 较 了 H13CHO/WT、H13CHO/PSK5 及NaH13CO3/WT 处理叶片的代谢谱,并以未经任何处理的野生型天竺葵抽提物作为对照(CK)检测叶片的背景13C-NMR信号水平,通过积分的方法计算代谢产物的相对含量。由于过量表达DAS/DAK基因所形成的HCHO 同化途径与卡尔文循环偶联,H13CHO/PSK5和NaH13CO3/WT 处理叶片的代谢谱应该相似。实验结果表明(图3),H13CHO/PSK5与NaH13CO3/WT 代谢产物相对含量的变化趋势相似。此外,对[U-13C]Gluc(葡萄糖)和[U-13C]Fruc(果糖)相对含量分析结果显示(图3,A),与CK 相比,H13CHO/WT 处 理 叶 片 中[U-13C]Gluc和[U-13C]Fruc相对含量都下降了,以[U-13C]Gluc下 降最为明显(P<0.05),下降为CK的57%,可见野生型天竺葵叶片通过消耗内源性Gluc和Fruc来响应HCHO 胁迫。而H13CHO/PSK5处理叶片中[U-13C]Gluc和[U-13C]Fruc的相对含量分别增加为H13CHO/WT 处理的1.86和12.19倍,说明过表 达DAS 和DAK 基 因 成 功 将H13CHO 的13C 代谢流引入卡尔文循环,使得糖类物质的生成量为H13CHO/WT 处理的2.85倍。
进一步对H13CHO 代谢重要产物分析结果显示,与CK 相比,H13CHO/WT 处理叶片中[U-13C]Cit(柠檬酸)相对含量与CK 没有显著性差异(P>0.05,图3,B)。但是H13CHO/PSK5 处理叶片中[U-13C]Cit的 相 对 含 量 比H13CHO/WT 处 理 和CK 呈显著性地降低(P<0.05,图3,B)。[1-13C]Gly(甘氨酸)的变化趋势与[U-13C]Cit相似,说明过表达DAS/DAK 基因削弱了转基因天竺葵通过H13CHO 代谢合成[U-13C]Cit和[1-13C]Gly的 途径。相反,在H13CHO/PSK5 处理叶片中产生了[2-13C]Gly,[2-13C]Mal(苹果酸)、[3-13C]Ser(丝氨酸)、[2-13C]Glu(谷氨酸)、[3-13C]Asp(天冬氨酸)以及[3-13C]PA(丙氨酸)等有机酸(图3,C),而在H13CHO/WT 处理叶片和CK 中大多没有检测到这些有机酸,说明转基因天竺葵中通过H13CHO 代谢产生这些有机酸的途径得到增强。
2.3 气体HCHO 胁迫下转基因天竺葵的抗性和抗氧化能力分析
环境中HCHO 污染主要以气体形式存在。为了考察过表达DAS/DAK 基因对天竺葵气体HCHO 抗性的影响,用48μg·L-1气体HCHO 处理野生型和转基因植株PSK5的无菌苗15d,结果表明转基因植株的生长状态比野生型的好,叶片白化现象较轻(图4),这表明过表达DAS/DAK 增强了转基因植株对气体HCHO 的抗性。
H2O2、MDA和PC是细胞氧化损伤的产物,在植物受到环境胁迫时其含量会明显增加。可作为氧化胁迫的指标,反映植物抗氧化能力的强弱。对野生型和转基因植株PSK5叶片中H2O2含量的分析结果显示,在48μg·L-1气体HCHO 胁迫下,野生型和转基因植株叶片中H2O2含量明显升高(图5),说明气体HCHO 对天竺葵叶片产生氧化胁迫,但是转基因植株叶片中H2O2含量升高的幅度小于野生型,说明过表达DAS/DAK基因可以缓解气体HCHO胁迫下天竺葵叶片受到的氧化胁迫。48μg·L-1气体HCHO胁迫还引起野生型和转基因天竺葵叶片中MDA 和PC(图5)含量的显著升高,说明气体HCHO 胁迫引起天竺葵叶片中膜脂和蛋白质的过氧化,但是MDA 和PC 的含量在转基因植株叶片中上升的幅度比野生型小,说明过表达DAS/DAK 基因减轻了气体HCHO 胁迫下转基因植株叶片中膜脂和蛋白质的过氧化作用。
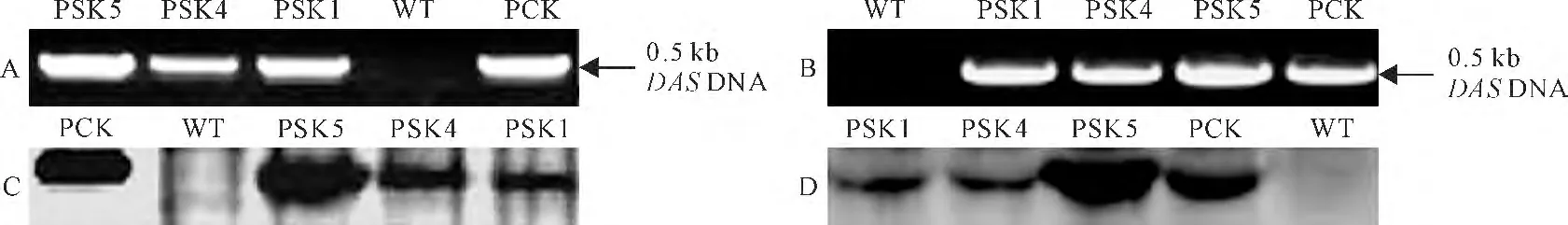
图2 DAS 和DAK 基因在转基因株系中整合与表达的分析A、B表示基因组PCR 检测DAS(A)和DAK(B)基因在转基因株系中的整合情况;C、D表示Western blot分析DAS(C)和DAK(D)基因在转基因株系中的表达情况;WT.野生型;PSK1、PSK4、PSK5.不同转基因株系;PCK.阳性对照Fig.2 Analysis of the integration and expression of DASand DAK genes in transgenic lines Genomic PCR analysis to detect the integration of DAS(A)and DAK (B)genes in transgenic lines;Western blot analysis to detect the expression of DAS(C)and DAK (D)genes in transgenic lines;WT.Wild type;PSK1,PSK4,PSK5.Different transgenic lines;PCK.Positive control

图3 13 C-NMR分析野生型和转基因植株H13 CHO 和NaH13 CO3 代谢产物CK.野生型;H13CHO/WT.2mmol·L-1液体H13CHO 处理野生型;NaH13CO3/WT.5mmol·L-1液体NaH13CO3 处理野生型;H13CHO/PSK5.2mmol·L-1液体H13CHO 处理转基因植株PSK5;不同字母表示在0.05水平有显著性差异;下同Fig.3 13 C-NMR analysis of H13 CHO and NaH13 CO3 metabolites in wild type and transgenic plant CK.Wild type;H13CHO/WT.Wild type treated with 2mmol·L-1 liquid H13CHO;NaH13CO3/WT.Wild type treated with 5mmol·L-1 liquid NaH13CO3;H13CHO/PSK5.Transgenic plant PSK5treated with 2mmol·L-1 liquid H13CHO;Different letters indicate significant difference at the 0.05level.The same as below

图4 气体HCHO 胁迫下野生型和转基因植株的生长状态WT.野生型;PSK5.转基因植株Fig.4 The growth statue of wild type and transgenic plant under gaseous HCHO stress WT.Wild type;PSK5.Transgenic plant

图5 气体HCHO 胁迫下野生型和转基因植株叶片H2O2、MDA 和PC含量变化0h/WT.野生型;0h/PSK5.转基因植株;24h/WT.48μg·L-1气体HCHO 处理24h的野生型;24h/PSK5.48μg·L-1气体HCHO 处理24h的转基因植株PSK5Fig.5 Changes of the H2O2,MDA and PC contents in the leaves of wild type and transgenic plant under gaseous HCHO stress 0h/WT.Wild type;0h/PSK5.Transgenic plant;24h/WT.Wild type treated with 48μg·L-1 gaseous HCHO for 24h;24h/PSK5;Transgenic plant treated with 48μg·L-1 gaseous HCHO for 24h
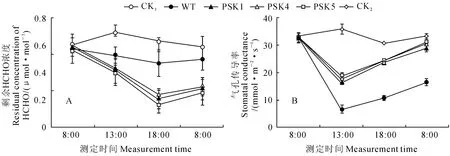
图6 野生型和转基因株系HCHO 吸收能力(A)和气孔传导率(B)分析A.野生型和转基因株系吸收柜内气体HCHO 能力分析;B.柜外处理野生型以及柜内处理野生型和转基因株系气孔传导率分析;CK1.空柜;CK2.柜外处理野生型,WT.野生型;PSK1、PSK4、PSK5.不同转基因株系Fig.6 Analysis of the HCHO-uptake capacity(A)and stomatal conductances of wild type and transgenic lines(B)A.Analysis of the HCHO-uptake capacity of wild type and transgenic lines in cabine;B.Analysis of the stomatal conductance of wild type out-cabinet and wild type and transgenic lines in cabinet;CK1.Empty cabinet;CK2.Wild type placed out-cabinet;WT.Wild type;PSK1,PSK4,PSK5.Different transgenic lines
2.4 转基因天竺葵吸收环境污染气体HCHO 能力的分析
压缩板在家具家装中的使用非常广泛,压缩板中使用的树脂脲醛,是室内排放HCHO 的最大来源。用压缩板材做成的柜子内有一定浓度的HCHO 污染。为了考察过表达DAS/DAK 基因天竺葵吸收家具中释放的气体HCHO 的能力,对野生型和转基因植株吸收家具中释放的气体HCHO的能力进行了检测。结果发现,柜内的HCHO 浓度从8:00至18:00处理期间,空柜内HCHO 浓度(CK1)先随温度上升而升高,到晚上温度下降时回落至接近早上的水平(图6,A)。放入天竺葵后柜内HCHO 浓度在各个测定时间点都下降了。当放入转 基 因 植 株PSK1、PSK4 和PSK5 时,柜 子 内HCHO 浓度在18:00 分别下降到野生型的63%、69%和58%(图6,A),可见转基因植株比野生型具有更强的吸收柜内HCHO 的能力。
叶片对气体HCHO 的吸收主要通过气孔进行,用光合测量系统测定了野生型和转基因植株叶片的气孔传导率,结果表明(图6,B),8:00 时柜内野生型和3个转基因株系叶片的气孔传导率与柜外野生型(CK2)差别不大(P>0.05),13:00、18:00和次日8:00测得的转基因株系PSK1、PSK4和PSK5叶片气孔传导率均明显高于野生型,而以13:00时差别最明显,转基因株系PSK1、PSK4 和PSK5 叶片的气孔传导率分别是野生型的2.5、2.7 和2.8倍,说明气体HCHO 胁迫下,过表达DAS/DAK 基因使转基因植株叶片的气孔传导率得以恢复。
3 讨 论
Song等[10]和Xiao等[12]的研究发现,在植物体中引入与卡尔文循环相偶联的代谢途径,能够促进植物通过该途径代谢HCHO,生成大量的糖类物质。本研究也发现,在2mmol·L-1液体H13CHO处理下,转基因天竺葵糖类质的生成量大约是野生型的2.85倍,说明过表达DAS/DAK 基因所形成的HCHO 同化途径成功将HCHO 代谢流引入卡尔文循环。但是,目前没有研究报道与卡尔文循环相偶联的代谢途径的引入是否改变植物原有的HCHO 代谢途径。本研究通过分析了其他重要HCHO 代谢产物在转基因天竺葵叶片中含量的变化发现,转基因天竺葵叶片中的[U-13C]Cit和[1-13C]Gly生成量显著低于野生型,并且产生了[2-13C]Gly、[2-13C]Mal、[3-13C]Ser、[2-13C]Glu、[3-13C]Asp以及[3-13C]PA 等有机酸。研究表明,进入植物体的HCHO 首先在HCHO 脱氢酶(FALDH)催化HCHO 下氧化为HCOOH,该反应是可逆的,且不能直接以游离HCHO 为底物,HCHO 需要和谷胱甘肽(GSH)结合为加合物S-羟甲基谷胱甘肽(HM-GSH)才能被FALDH 催化,虽然FALDH 对HM-GSH 的Km 值很小,但HM-GSH 的浓度由细胞内GSH 控制[17]。而DAS催化HCHO 和5-磷酸木酮糖的反应是不可逆的,DAS 可以游离HCHO为底物,HCHO 的Km 值约为1.4 mmol·L-1,反应不需要任何辅助因子参与就可以启动[18]。由于DAS和FALDH 催化反应的生化特性不同,使得二者在同时竞争结合进入细胞中的HCHO 时,DAS催化的反应更有优势,使得过表达DAS/DAK 基因所形成的HCHO 同化途径发挥作用,增加了H13CHO 的13C代谢流进入卡尔文循环的量,从而降低H13CHO 进入其它代谢途径的量。据此推测[U-13C]Cit和[1-13C]Gly可能是由FALDH 催化的下游代谢途径所产生,而[2-13C]Gly、[2-13C]Mal、[3-13C]Ser、[2-13C]Glu、[3-13C]Asp以及[3-13C]PA是卡尔文循环的下游途径产生的,至于这两条途径的下游途径有待进一步的研究。
Song等[10]研究表明,在天竺葵叶绿体中过量表达rmpAB 编码的HPS/PHI融合蛋白基因,可以增强转基因天竺葵对HCHO 的抗性和吸收效率,Xiao等[12]在烟草叶绿体中过量表达DAS 和DAK基因也得到了类似的结果,且HCHO 吸收效率是Song等[10]的1.6倍。本研究发现,在48μg·L-1气体HCHO 胁迫下,转基因植株的生长状态优于野生型,H2O2、MDA 和PC 含量均低于野生型,同时吸收家具释放的气体HCHO 的能力也高于野生型,气孔传导率得以恢复,说明过表达DAS/DAK基因提高了转基因天竺葵对HCHO 的抗性和吸收能力,这与前人的研究结果一致。本研究的结果再次证实了在植物叶绿体中过量表达来自于甲基型营养酵母中的DAS/DAK 基因,构建一条光合HCHO 同化途径提高植物吸收和代谢HCHO 能力的策略是可行的,这为今后开发转基因观赏植物治理气体HCHO 污染的技术奠定了理论基础。
[1] YURIMOTO H,KATO N,SAKAI Y.Genomic organization and biochemistry of the ribulose monophosphate pathway and its application in biotechnology[J].Applied Microbiology and Biotechnology,2009,84(3):407-416.
[2] WOLVERTON B C,DONALD R C,WATKINS E A.Foliage plants for removing indoor air pollution from energy-efficient homes[J].Economic Botany,1984,38(2):224-228.
[3] GIOSSMAN D.Pollution indoors[J].Technology Review Cambridge,1989,92(4):2-13.
[4] GIESE M,BAUER-DORANTH U,LANGEBARTELS C,et al.Detoxification of formaldehyde by the spider plant(Chlorophytum comosum L.)and by soybean(Glycine max L.)cell-suspension cultures[J].Plant Physiology,1994,104(4):1 301-1 309.
[5] AYDOGANA A,MONTOYA L D.Formaldehyde removal by common indoor plant species and various growing media[J].Atmospheric Environment,2011,45(16):2 675-2 682.
[6] ACHKOR H,DIAZ M,FERNANDEZ M R,et al.Enhanced formaldehyde detoxification by overexpression of glutathione-dependent formaldehyde dehydrogenase fromArabidopsis[J].Plant Physiology,2003,132(4):2 248-2 255.
[7] TADA Y,KIDU Y.Glutathione-dependent formaldehyde dehydrogenase from golden pothos(Epipremnum aureum)and the production of formaldehyde detoxifying plants[J].Plant Biotechnology,2011,28(4):373-378.
[8] NIAN H J,MENG Q C,ZHANG W,et al.Overexpression of the formaldehyde dehydrogenase gene fromBrevibacillus brevis to enhance formaldehyde tolerance and detoxification of tobacco[J].Applied Biochemistry and Biotechnology,2013,169:170-180.
[9] CHEN L M,YURIMOTO H,LI K Z,et al.Assimilation of formaldehyde in transgenic plants due to introduction of the bacterial ribulose monophosphate pathway genes[J].Bioscience Biotechnology and Biochemistry,2010,74(2):629-635.
[10] SONG Z B,ORITA I,YIN F H,et al.Overexpression of an HPS/PHI fusion enzyme from Mycobacterium gastri MB19in chloroplasts of geranium enhances its ability to assimilate and phytoremediate HCHO[J].Biotechnology Letters,2010,32(10):1 541-1 548.
[11] YURIMOTO H,KATO N,SAKAI Y.Assimilation,dissimilation,and detoxification of formaldehyde,a central metabolic intermediate of methylotrophic metabolism[J].Chemical Record,2005,5:367-375.
[12] XIAO S Q,SUN Z,WANG S S,et al.Overexpression of dihydroxyacetate synthase and dihydroxyacetone kinase in chloroplasts install a novel photosynthetic HCHO-assimilation pathway in transgenic tobacco using modified Gateway entry vector[J].Acta Physiologiae Plantarum,2012,34(5):1 975-1 985.
[13] KRISHNARAJ S,BI Y M,SAXENA P K.Somatic embryogenesisand Agrobacterium-mediated transformation system for scented geraniums(Pelargoniumsp.‘Frensham’)[J].Planta,1997,201(4):434-440.
[14] MURRAY M G,THOMPSON W F.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Research,1980,8(19):4 321-4 325.
[15] GUREL A,COSKUN O,ARMUTCU F,et al.Vitamin E against oxidative damage caused by formaldehyde in frontal cortex and hippocampus:Biochemical and histological studies[J].Journal of Chemical Neuroanatomy,2005,29(3):173-178.
[16] GAY C A,GEBICKI J M.Measurement of protein and lipid hydroperoxides in biological systems by the ferric-xylenol orange method[J].Analytical Biochemistry,2003,315(1):29-35.
[17] HASLAM R,RUST S,PALLETT K,et al.Cloning and characterisation of S-formylglutathione hydrolase from Arabidopsis thaliana:a pathway for formaldehyde detoxi cation[J].Plant Physiology and Biochemistry,2002,40:281-288.
[18] WAITES M J,QUAYLE J R.Dihydroxyacetone synthase:a special transketolase for formaldehyde fixation from the methylotrophic yeast Candida boidinii CBS 5777[J].Journal of General Microbiology,1983,129(4):935-944.

