渗透性冷冻保护剂对山羊精子的冷冻保护效果
席利萌,罗 军,杨地坤,王 维,孙 爽,史怀平,马雪瑶
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
渗透性冷冻保护剂对山羊精子的冷冻保护效果
席利萌,罗 军,杨地坤,王 维,孙 爽,史怀平,马雪瑶
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
【目的】 探索渗透性冷冻保护剂甘油、乙二醇、二甲基亚砜(DMSO)、二甲基乙酰胺(DMA)对山羊精子的冷冻保护效果。【方法】 采用假阴道法采集繁殖性能正常、健康、年龄2~4岁的6只西农萨能奶山羊种公羊精液,以Tris-卵黄为基础稀释液,分别添加体积分数为6%的甘油、3%和6%的乙二醇、3%和6%的DMSO、3%和6%的DMA,测定冷冻-解冻后精子活率、顶体完整性、质膜完整率、线粒体完整性、谷胱甘肽还原酶活性和丙二醛(MDA)浓度,对比不同冷冻保护剂对山羊精子的冷冻保护效果。【结果】 甘油(6%)和乙二醇(3%,6%)组解冻后精子活率均极显著(P<0.01)高于DMSO(3%,6%)和DMA(3%,6%)处理组;甘油(6%)、DMA(6%)和乙二醇(3%)组的线粒体完整性极显著(P<0.01)高于其他组;甘油(6%)和乙二醇(3%,6%)组的质膜完整率极显著(P<0.01)高于其他组;从顶体完整性、谷胱甘肽还原酶活性和MDA浓度等指标看,甘油(6%)和乙二醇(3%,6%)组极显著(P<0.01)优于其他组。【结论】 稀释液中添加乙二醇(3%,6%)和甘油(6%)都能明显提高山羊冷冻精子品质,其中3%乙二醇可以替代甘油作为山羊精液冷冻保护剂从而发挥更好的抗冷冻保护作用。
山羊;冷冻保护剂;精液;冷冻保存
精液冷冻保存技术有利于种质资源保存及遗传基因改良。冻精稀释液在一定程度上能够保护精子,但精子极易在低温或超低温环境下受到冷冻损伤[1-2],这种损伤不仅影响精子结构完整性和存活能力,也影响精子的受精能力[3]。为了提高精子的冷冻保存效果,在冷冻稀释液中添加冷冻保护剂显得很有必要。甘油(相对分子质量92.10)作为一种小分子渗透性冷冻保护剂,常用于山羊精液冷冻保存[4],但高浓度甘油对精子是有毒性的,不利于精子功能更好的发挥[5]。乙二醇(EG,相对分子质量 62.7)与甘油有着类似的结构[6],在冷冻胚胎中已经得到成功应用[7],也有报道指出乙二醇可明显提高绵羊冻精品质[8]。小分子物质二甲基乙酰胺(DMA,相对分子质量59.07),在家兔精液冷冻保存中发挥了较好的效果[9-10]。二甲基亚砜(DMSO)常用于细胞冷冻,也可用于精液冷冻保存[11-12]。DMA 和DMSO作为渗透性冷冻保护剂在山羊精液冷冻保存中鲜见报道。
本研究在冷冻稀释液中分别添加不同体积分数的甘油、乙二醇、DMSO、DMA等4种渗透性冷冻保护剂对山羊精液进行冷冻保存,以冷冻-解冻后精子的运动参数、质膜完整性以及相关抗氧化等指标为考察指标,探讨不同冷冻保护剂对山羊精子的冷冻-解冻效果。
1 材料与方法
1.1 材 料
1.1.1 试剂及仪器 主要试剂:果糖(F0127-100G)、甘油(G5516)、DMSO(D8418)、乙二醇(03750)、DMA(271012)、罗丹明123(R-8004)、碘化丙啶(P4170-10MG)、噻唑蓝(M2128-250MG)、硫代巴比妥酸(T5500-25G)和三氯乙酸(T6399-100G),均购自美国Sigma公司;HOST低渗膨胀试剂盒(GMS14017)、GPX测定试剂盒(GMS14015.1.1)、FITC-花生凝集素(PNA)试剂盒(GMS14014.1.1),购自Genmed公司。
主要仪器设备:冷冻精液封装仪,购自法国卡苏(IMV)公司;精液品质自动分析软件(CASA);倒置荧光显微镜,购自德国ZEISS公司;紫外分光光度计,为上海尤尼柯(UNIC)公司产品;多功能酶标仪,购自瑞士TECAN公司。
1.1.2 冷冻稀释液的配制 冷冻保存Ⅰ液:Tirs 375 mmol/L,柠檬酸124 mmol/L,葡萄糖41 mmol/L,0.275 g/L庆大霉素,严格无菌环境下添加终体积分数20%的卵黄。
冷冻保存Ⅱ液:在冷冻保存Ⅰ液基础上分别添加一定体积分数甘油(6%)、乙二醇(3%,6%)、DMSO(3%,6%)、DMA(3%,6%)的冷冻保护剂即为Ⅱ液。以上百分含量均为体积分数,下同。
1.1.3 其他溶液的配制 罗丹明123溶液(0.53 mmol/L):0.000 4 g 罗丹明123溶于2 mL DMSO中,0.45 μm 滤膜过滤后避光保存。硫代巴比妥酸溶液(6.7 g/L):准确称取0.67 g 硫代巴比妥酸用超纯水溶解,并定容于100 mL容量瓶中备用。
1.2 山羊冷冻精液的制备
1.2.1 精液样品的采集 试验用山羊精液样品采自西北农林科技大学萨能羊原种场,选取6只2~4周岁、健康、繁殖性能正常的西农萨能奶山羊种公羊,假阴道法采集精液,原精液做好标签后,400×倒置显微镜下镜检合格后备用。
1.2.2 精液的第1次稀释 将采集的精液迅速用等温冷冻保存Ⅰ液按1∶1体积比稀释后,置于30 ℃水浴保温瓶带回实验室,将精液样品置5 ℃冰箱中降温2 h,使精液样品从30 ℃降到5 ℃,降温过程中每隔1 h轻轻晃动样品1次。
1.2.3 精液的第2次稀释与平衡 取第1次稀释降温精液样品,于5 ℃冰箱中按1 ∶1体积比添加等温冷冻保存Ⅱ液稀释,之后于5 ℃冰箱中平衡1 h,精液样品镜检合格后均分为7份。
1.2.4 精液的冷冻 将1.2.3中精液样品用冷冻精液封装仪于5 ℃冰箱内灌装于细管(0.25 mL),并用封口粉封口。将分装好的细管先置于液氮面上方5 cm处4 min,使温度从5 ℃迅速降到-60 ℃,之后置于液氮表面3 cm处,使温度从-60 ℃降到-120 ℃,最后投于液氮中,温度由-120 ℃降到-196 ℃,装袋编号后贮存于液氮罐中。
1.3 精子品质的评定
取冻精细管投入37 ℃水浴中搅晃15 s解冻,测定以下指标。
1.3.1 运动参数评定 将带有加热板的显微镜预热到37 ℃,取10 μL精液样品于精子品质分析仪专用计数载玻片上,迅速盖上盖玻片,1 min后选取至少3个不同的视野,先通过自动分析软件(CASA)自动分析精子活率(CM);再选取至少5个视野计数,通过肉眼观测,统计精子表观活率(Subjective motility,SM)。
1.3.2 顶体完整性检测 参考文献[13]的方法,采用Genmed公司提供的HOST低渗膨胀试剂盒进行检测。每个样品计数200个精子细胞。在倒置荧光显微镜530 nm荧光激发下可观察到以下4种类型的精子:(1)整个顶体均匀分布着明亮绿色荧光,为完整顶体;(2)顶体赤道面均匀分布着明亮绿色荧光,而20%顶体帽端无荧光显示,为顶体部分破坏精子;(3)只有顶体赤道面呈现绿色荧光,为顶体前帽缺失精子;(4)精子头部无荧光,为顶体缺失精子。
1.3.3 精子质膜完整率检测 采用Genmed公司提供的HOST低渗膨胀试剂盒检测,净冻精细管在37 ℃水浴条件下搅晃15 s解冻,随后用等温的HOST低渗溶液调整精子密度至1×106mL-1,37 ℃避光孵育30 min后,取10 μL精液样品于载玻片上,在400×倒置显微镜下观察,统计精子弯尾率,每个样品计数时至少检测200个精子细胞。
1.3.4 线粒体完整性检测 于37 ℃下用冷冻保存Ⅰ液稀释精液样品,使精子密度为1×107mL-1,取50 μL稀释后的精液样品,分别加入1 μL碘化丙啶和1 μL罗丹明123,避光孵育1 min后置于37 ℃水浴锅孵育30 min,取10 μL精子于载玻片上,在400×倒置显微镜下观察,死精子在488 nm紫外光激发下头部核区显红色,活精子和有线粒体活性的精子头部不发光,但线粒体部分呈绿色,每次至少检测200个精子。
1.3.5 脂质氧化程度检测 取精液样品1 mL (精子密度为1×108mL-1)与等体积冰冷的三氯乙酸(200 g/L)均匀混合,离心(2 000g10 min),取上清液1 mL与硫代巴比妥酸溶液等体积混合,水浴(100 ℃ 10 min),冷却后用分光光度计在波长534 nm处检测丙二醛(MDA)浓度,确定脂质氧化水平。
1.3.6 谷胱甘肽还原酶活性测定 采用Genmed公司提供的GPX测定试剂盒,参考Wang等[14]的方法进行。
1.4 数据统计分析方法
采用SPSS 19.0软件中的Duncan’s法进行方差分析多重比较,结果采用“平均值±标准差(Mean±SEM)”表示。
2 结果与分析
2.1 山羊精子冷冻-解冻后形态观察及染色结果
山羊精子冷冻-解冻后形态观察及染色结果见图1和图2。

图1 HOST低渗溶液中山羊精子质膜完整性观察(400×) A.质膜完整精子;B.质膜损伤精子 Fig.1 Sperm in hypisotonic solution (400×)A.Sperm with intact plasma membrane;B.Sperm with damaged plasma membrane
精子质膜完整程度检测结果显示,正常精子在HOST低渗溶液中尾部弯曲,而质膜受损精子在HOST低渗溶液中尾部不弯曲(图1)。采用FITC-PNA试剂盒对精子顶体进行检测,结果显示,顶体完整精子顶体分布着均匀明亮绿色荧光,顶体受损精子顶体荧光分布不均匀或无荧光(图2)。
2.2 不同体积分数渗透性冷冻保护剂对山羊精子的冷冻保护效果
表1表明,甘油(6%)和乙二醇(3%,6%)组冷冻-解冻后的精子表观活率和活率均极显著高于其他组(P<0.01), DMSO(3%,6%)组解冻后精子表观活率和活率极显著高于DMA(3%,6%)组(P<0.01)。
表1还表明,在精子线粒体完整性检测中,乙二醇(3%)、甘油(6%)及DMA(6%)组间差异不显著(P>0.05),但均极显著高于其他组(P<0.01);DMA(3%)组极显著高于DMSO(3%,6%)组(P<0.01),显著高于乙二醇(6%)组(P<0.05)。
由表1还可知,从精子顶体完整性看,乙二醇(3%)组极显著高于其他组(P<0.01);甘油(6%)和乙二醇(6%)组均极显著高于DMSO(3%,6%)和DMA(3%,6%)组(P<0.01),而DMSO(6%)组和DMA(3%)组显著高于DMSO(3%)和DMA(6%)组(P<0.05)。
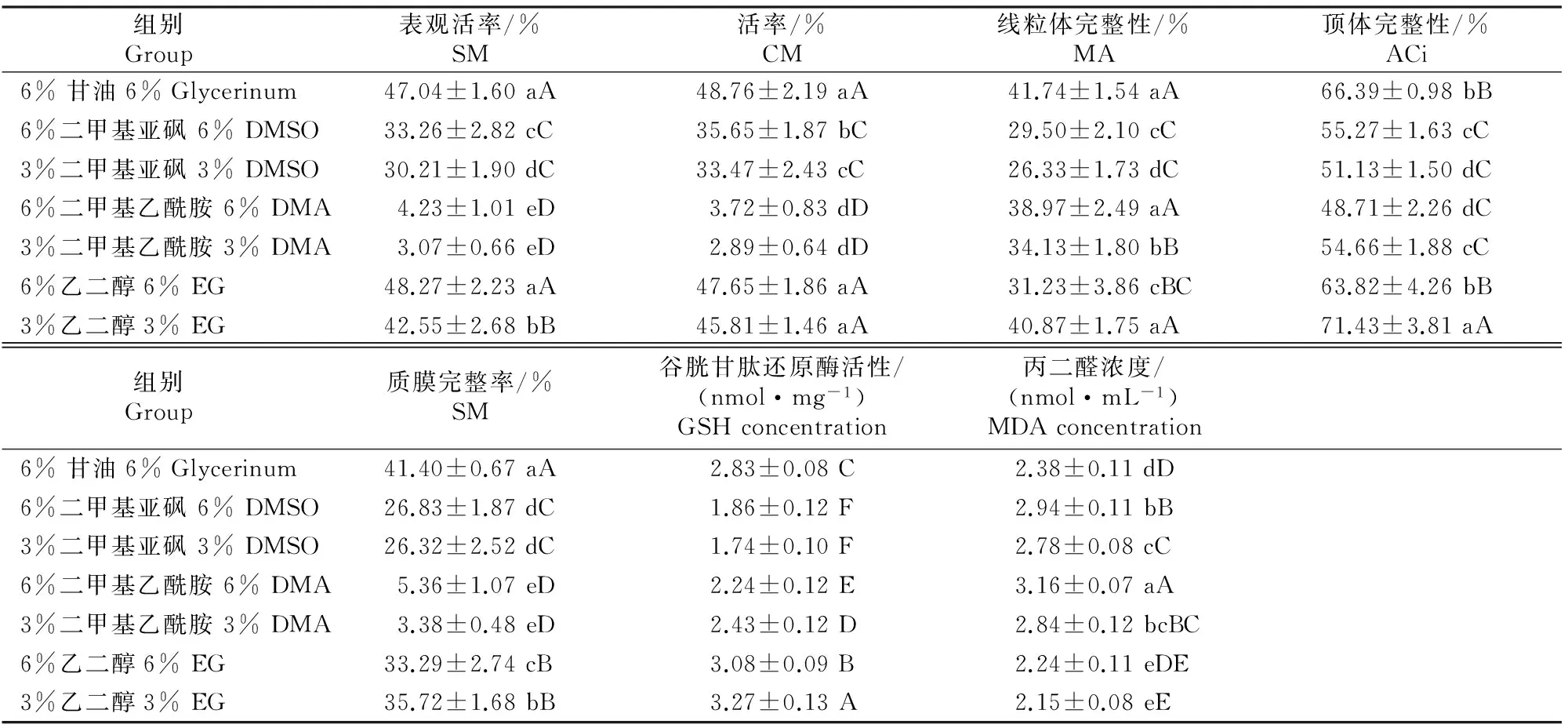
表1 冷冻保存Ⅱ液中添加不同体积分数渗透性冷冻保护剂对山羊精子的冷冻保护效果(n=6)Table 1 Effects of different concentrations of penetrating cryoprotectants on freezing of goat semen (n=6)
注:同列数据后标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01)。
Note:Different lowercase letters in each column indicate significant difference (P<0.05) while different uppercase letters indicate extremely significant difference (P<0.01).
从质膜完整率(表1)看,甘油(6%)组极显著高于其他组(P<0.01);乙二醇(3%)组显著高于乙二醇(6%)组(P<0.05),且两组极显著高于DMSO(3%,6%)和DMA(3%,6%)组(P<0.01);DMSO(3%,6%)组极显著高于DMA(3%,6%)组(P<0.05)。
谷胱甘肽还原酶活性代表精子细胞抗氧化能力,其值越高代表抗氧化能力越强。表1表明,从谷胱甘肽还原酶活性看,各组间大多差异达极显著水平(P<0.01),其中乙二醇(3%)组谷胱甘肽还原酶活性最高,表明该处理组精子抗氧化能力最强。
MDA浓度代表精子质膜氧化程度,其值越低表明精子氧化程度越低。由表1可见,从MDA浓度看,乙二醇(3%)组极显著低于其他各组(P<0.01);乙二醇(6%)组显著低于甘油(6%)组(P>0.05),二者均极显著低于DMSO(3%,6%)组和DMA(3%,6%)组(P<0.01);其中DMA(6%)组的MDA浓度最高,表明该组精子质膜受氧化损伤程度最高。
以上结果表明,在冷冻保存Ⅱ液中添加甘油和乙二醇,能有效保护山羊精子免受低温冷冻损伤,其中乙二醇(3%)组解冻后精子顶体完整性、谷胱甘肽还原酶活性、MDA浓度等指标极显著优于其他组(P<0.01)。说明乙二醇(3%)替代甘油作为山羊精液冷冻保护剂的效果好。DMSO(3%,6%)和DMA(3%,6%)组的各项指标均较低,表明DMSO(3%,6%)和DMA(3%,6%)不适宜用作奶山羊冷冻精液冷冻保护剂。
3 讨 论
本研究中,乙二醇能够提高冻后精子活率、顶体完整性和抗氧化能力,这与刘玉峰等[8]的研究报道一致,而武浩等[15]研究绵羊冻精发现,甘油具有较好的冷冻保护效果,这可能是试验所用动物品种以及稀释液配方不同所致。乙二醇保护冷冻精子的机制仍不清楚,但主要原因可能包括以下两个方面:一方面与甘油的作用机理相同,乙二醇容易渗透进入精子细胞,降低胞内盐溶质浓度从而保护细胞免受冷冻损伤,也可能是因为乙二醇在精子细胞内外形成了玻璃态结晶,有利于精子保存[16],本研究中乙二醇添加组解冻后精子活率、顶体完整性和质膜完整性等指标与甘油处理组相当或优于甘油组也说明了这一点;另一方面,Silva等[13]研究指出,乙二醇能提高冻精抗氧化应激能力,乙二醇进入精子细胞,能够有效保护精液具有抗氧化能力的酶和非酶分子,如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、谷胱甘肽还原酶、维生素C和维生素E、牛磺酸和亚牛磺酸等,这些物质能够减少或消除山羊精液冷冻过程中产生的对精子不利的活性氧自由基(ROS)[17],从而保护精子免受氧化应激损伤,本试验中乙二醇添加组解冻后精子谷胱甘肽还原酶活性较高,而MDA浓度较低等结果支持了这一观点。
本研究中,DMSO(3%,6%)和DMA(3%,6%)组解冻后精子受到了不可逆的损伤,导致精子活率、顶体完整性、质膜完整率等指标均显著下降,这与Li等[18]的报道一致。DMSO和DMA在山羊精子冷冻过程无法像甘油和乙二醇一样起到较好的保护作用,容易使精子遭受低温损伤,精子结构完整性受到破坏,导致精子活率下降[19]。而Kundu等[20]研究指出,DMSO作为渗透性冷冻保护剂,能防止细胞内冰晶的形成从而降低细胞损伤;此外,有研究发现,DMSO和DMA在禽类[21]和山羊[22]冻精中使用效果较好。本研究中,DMSO对山羊精子的保护效果相对优于DMA,但仍然不能有效改善冻后精子品质。这是因为,一方面,冷冻保护剂会受到稀释液以及冷冻程序的影响[14];另一方面,不同物种的精子细胞膜结构组成及质膜流动性不同,山羊精子细胞膜富含不饱和脂肪酸[23],这增加了细胞膜渗透性,而DMA分子量最小,从而更容易进入精子细胞,而高浓度的DMA对精子有毒性[24],易造成细胞渗透压改变导致精子脱水而死亡[25-26],这些都是对精子细胞维持正常生理功能的不利因素。
甘油广泛用于山羊精子冷冻保护,添加量一般为4%~7%,高浓度甘油对精子是有毒性的[20]。在常温下,甘油会损伤精子顶体和颈部,造成尾部弯曲,破坏某些酶类,从而影响受精率[21]。本研究结果表明,3%乙二醇组的精子顶体完整性、抗氧化能力极显著优于6% 甘油组,精子活率、线粒体完整性无显著差异,但后者质膜完整率却优于前者,这可能是由于精子特殊的生理结构、质膜组成不同,造成甘油和乙二醇与精子质膜的作用方式不同。研究证明,当乙二醇体积分数超过3.9%时会对精子产生毒副作用[14],而本试验中3% 乙二醇组精子的各项指标总体上均优于6%乙二醇组,这一方面可能与高浓度乙二醇对精子产生毒副作用有关,另一方面也可能是高浓度的乙二醇会造成精子细胞渗透压改变从而损伤细胞。
基于冷冻-解冻后精子的各项指标,本研究结果表明甘油(6%)、乙二醇(3%,6%)均对山羊精子具有冷冻保护作用,其中3% 乙二醇能极大提高解冻后精子顶体完整性和抗氧化能力,能更好地发挥对山羊精子的抗冷冻保护作用,因此乙二醇在动物精子乃至生物细胞的保护上具有重大研究价值。但有关乙二醇抗冷冻保护的具体分子机制尚不清楚,有待进一步研究。
4 结 论
乙二醇对山羊精子具有较好的冷冻保护效果,能明显提高山羊冻精解冻后顶体完整性及谷胱甘肽还原酶活性,降低MDA浓度,冷冻保存Ⅱ液中乙二醇适宜添加量为3%。
[1] Stornelli M C,Tittarelli C M,Savignone C A,et al.Efecto de los procesos de criopreservación sobre la fertilidad seminal [J].Analect Vet,2005,25:28-35.
[2] Salamon S,Maxwell W M C.Storage of ram semen [J].Anim Reprod Sci,2000,62:77-111.
[3] Watson P F.The cause of reduced fertility with cryopreserved semen animal [J].Anim Reprod Sci,2000,61:481-492.
[4] Morris G J,Acton E,Murray B.Freezing injury:The special case of the sperm cell [J].Cryobiology,2011,64:71-80.
[5] 王安奎,袁希平,张继才,等.波尔山羊冷冻精液稀释液配方的筛选研究 [J].草食家畜,2009(4):43-46.
Wang A K,Yuan X P,Zhang J C,et al.Effect of different diluent on Boer goat frozen semen [J].Grass-Feeding Livestock,2009(4):43-46.(in Chinese)
[6] Arifiantini R I,Purwantara B,Yusuf T L,et al.Effect of different cryoprotective agents on skim milk and dimitropoulus extender for stallion semen cryopreservation [J].Indonesian Trop Anim Agric,2010,35:68-74.
[7] 桑润滋.动物繁殖生物技术 [M].北京:中国农业出版社,2002:255-256.
Sang R Z.Animal reproduction biotechnology [M].Beijing:China Agriculture Press,2002:255-256.(in Chinese)
[8] 刘玉峰,李 武,兰 翠.乙二醇对绵羊冻精效果的研究 [J].中国草食动物,2002,22(6):9-11.
Liu Y F,Li W,Lan C.Effect of ethylene glycol on sheep frozen-thawed semen [J].China Herbivores,2002,22(6):9-11.(in Chinese)
[9] Kashiwazaki N,Okuda Y,Seita Y,et al.Comparison of glycerol,lactamide,acetamida and dimethylsulfoxide as cryoprotectants of Japanese white rabbit spermatozoa [J].Reprod Dev,2006,52:511-516.
[10] Okuda Y,Seita Y,Hisamatsu S,et al.Fertility of spermatozoacryopreserved with 2% acetamide or glycerol through artificial insemination in the Japanese white rabbit [J].Exp Anim,2007,1:29-34.
[11] 邓溯顺,燕海峰,易康乐,等.家禽精液冷冻保存技术研究进展 [J].家禽科学,2012(5):45-48.
Deng S S,Yan H F,Yi K L,et al.A review on poultry semen cryopreservation [J].Poultry Science,2012(5):45-48.(in Chinese)
[12] Valdivia M E,Canorio N,Carrillo E,et al.Effects of cryoprotectants on alpaca spermatozoa during cooling process [C]//Proceedings of the 38th Annual Meeting of the Society for the Study of Reproduction,Biology of Reproduction,special issue.[s.l]:[s.n.],2005:228.
[13] Silva E C B,Cajueiro J F P,Silva S V,et al.Invitroevaluation of ram sperm frozen with glycerol,ethylene glycol or acetamide [J].Animal Production science,2012,132:215-225.
[14] Wang X Z,Liu S S,Sun Y,et al.Beta-cypermethrin impairs reproductive function in male mice by inducing oxidative stress [J].Theriogenology,2009,72(5):599-611.
[15] 武 浩,王立强,华 松,等.无角陶赛特羊冻精制作技术 [J].中国畜牧杂志,2002,38(6):29-31.
Wu H,Wang L Q,Hua S,et al.Frozen semen production technology of Tao Dorset sheep. [J].Chinese Journal of Animal Science,2002,38(6):29-31.(in Chinese)
[16] Soylu M K,Nur Z,Ustuner B,et al.Effects of various cryoprotective agents and extender osmolality on post-thawed ram semen [J].Bull Vet Inst Pulawy,2007,51:241-246.
[17] Bilodeau J F,Chatterjee S,Sirard M A,et al.Levels of antioxidant defenses are decreased in bovine spermatozoa after a cycle of freezing and thawing [J].Mol Reprod Dev,2000,55:282-288.
[18] Li Y H,Cai K J,Kovacs A,et al.Effects of various extenders and permeating cryoprotectants on cryopreservation of cynomolgus monkey (Macacafascicularis) spermatozoa [J].Androl,2005,26:387-395.
[19] Silva P F N,Gadella B M.Detection of damage in mammalian sperm cells [J].Theriogenology,2006,65:958-978.
[20] Kundu C N,Chakrabarty J,Dutta P,et al.Effect of dextrans on cryopreservation of goatcauda epididymal spermatozoa using a chemically defined medium [J].Reproduction,2002,123:907-913.
[21] 黄素红,张兆旺,麻常胜,等.四种冷冻保护剂对鸡精液冷冻效果的比较 [J].甘肃农业大学学报,2007,3(6):41-43.
Huang S H,Zhang Z W,Ma C S,et al.Comparison of the frozen effectiveness of four cryoprotector on chicken semen [J].Journal of Gansu Agricultural University,2007,3(6):41-43.(in Chinese)
[22] Kundu C N,Das K,Majumder G C.Effect of amino acids on goat cauda epididymal sperm cryopreservation using a chemically defined model system [J].Cryobiology,2001,42:21-27.
[23] Sanocka D,Kurpisz M.Reactive oxygen species and sperm cells [J].Reprod Biol Endocrinol,2004,2:12-18.
[24] 李 昂,仲妍妍,章德育.家禽精液冷冻保存技术的研究进展 [J].家禽科学,2005,27(5):49-51.
Li A,Zhong Y Y,Zhang D Y.A review on Poultry semen cryopreservation [J].Poultry Science,2005,27(5):49-51.(in Chinese)
[25] Purdy P H.A review on goat spern cryopreservation [J].Sm-all Rumin Res,2006,63:215-225.
[26] Luzardo B,Castro M C,Ganboa F A,et al.Osmolarity of coconut water (Cocosnucifera) based diluents and their effect over viability of frozen boar semen [J].Anim Vet Sci,2010,5:187-191.
Effects of penetrating cryoprotectants supplementation on semen quality and oxidative stress variables in frozen-thawed dairy goat semen
XI Li-meng,LUO Jun,YANG Di-kun,WANG Wei,SUN Shuang,SHI Huai-ping,MA Xue-yao
(CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study explored the effects of penetrating cryoprotectants including glycerol,ethylene glycerol,dimethyl sulfoxide (DMSO) and dimethyl acetamide (DMA) supplementations on freezing goat spermatozoa.【Method】 Semen samples were collected from 6 healthy,2-4 years old Xinong Saanen dairy goats by artificial vagina method.Semen samples were diluted in Tris-egg yolk with glycerol (6%),ethylene glycerol (3%,6%),DMSO (3%,6%) and DMA (3%,6%) before being frozen at -196 ℃.Then,the effects on semen quality and oxidative stress variables in frozen-thawed dairy goat semen were evaluated through assessing motility,acrosome integrity,plasma membrane integrity,mitochondrial activity,and concentrations of GSH and MDA.【Result】 After thawing,sperm motilities with glycerol (6%) and ethylene glycerol (3%,6%) were greater (P<0.01) than those with DMSO (3%,6%) and DMA (3%,6%).Mitochondrial activities with glycerol (6%) and ethylene glycerol (3%) and DMA(6%) were greater (P<0.01) than others.Plasma membrane integrities with glycerol (6%) and ethylene glycerol (3%,6%) were greater (P<0.01) than others.Acrosome integrity,GSH concentration and MDA concentration with ethylene glycerol (3%) were greater (P<0.01) than others.【Conclusion】 Both glycerol (6%) and ethylene glycerol (3%,6%) could protect goat sperm against freezing.As cryoprotectant supplementation,ethylene glycerol 3% can provide greater protection for goat semen than glycerin.
goat;cryoprotectant;samen;cryopreservation
2014-02-20
国家公益性行业(农业)科研专项(201103038);陕西省重大科技创新项目(2009ZKC07-01-1)
席利萌(1989-),男,陕西商洛人,在读硕士,主要从事动物遗传育种与繁殖研究。 E-mail:xlm0223@163.com
罗 军(1965-),男,陕西宝鸡人,教授,博士生导师,主要从事动物遗传育种研究。
时间:2015-06-30 13:47
10.13207/j.cnki.jnwafu.2015.08.024
S827.3+4
A
1671-9387(2015)08-0027-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150630.1347.024.html

