外源NO供体硝普钠和镍对玉米生长及抗氧化酶活性的影响
张忠庆,李韶山,刘金华,杨靖民
(1 吉林农业大学 资源与环境学院,吉林 长春130118;2 吉林市金穗肥业有限公司,吉林 吉林132022)
外源NO供体硝普钠和镍对玉米生长及抗氧化酶活性的影响
张忠庆1,李韶山2,刘金华1,杨靖民1
(1 吉林农业大学 资源与环境学院,吉林 长春130118;2 吉林市金穗肥业有限公司,吉林 吉林132022)
【目的】 研究外源NO供体硝普钠(SNP)和镍(Ni)共同作用下玉米幼苗生长及抗氧化酶活性的变化,为镍污染防治提供参考。【方法】 以“吉农669”为供试玉米品种,以NO供体SNP和镍处理玉米幼苗,共设6个处理(1.Ni 0 mmol/L+SNP 0 mmol/L,对照;2.Ni 0 mmol/L+SNP 0.05 mmol/L;3.Ni 0 mmol/L+SNP 0.1 mmol/L;4.Ni 1.0 mmol/L+SNP 0 mmol/L;5.Ni 1.0 mmol/L+SNP 0.05 mmol/L;6.Ni 1.0 mmol/L+SNP 0.1 mmol/L),分析各处理下玉米幼苗生长生理指标和抗氧化酶活性的变化。【结果】 SNP能够明显缓解由于镍所造成的玉米鲜质量、干质量下降及根系生长受阻的情况;1.0 mmol/L镍(处理4)使玉米植株体内镍含量升高的同时还抑制了铁从玉米根系向地上部分的转移,导致植株地上部铁含量下降,而SNP能够缓解这种抑制作用,使植物体内镍含量降低,铁含量升高。另外,SNP可缓解镍造成的玉米叶片SPAD值下降以及过氧化氢和丙二醛含量升高,增加玉米叶片的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽过氧化物酶(GPX)等抗氧化酶活性,且高浓度(1.0 mmol/L)SNP效果较好。【结论】 外源NO供体SNP能减轻镍对玉米幼苗生长所产生的伤害。
镍胁迫;玉米;外源一氧化氮;硝普钠;生理特性
一氧化氮(Nitricoxide,NO)是近年来备受关注的重要气体信号分子,其在植物信号传导以及植物抗逆过程中发挥着重要作用。目前,有关NO减轻逆境对植物伤害的研究较多,如硝普钠(亚硝基铁氰化钠,Sodium nitroprusside,SNP)能显著促进盐胁迫下玉米幼苗株高、主根长和侧根数的增加,同时还能降低POD活性[1]。张艳艳等[2]和陈银萍等[3]发现,0.1~200 μmol/L硝普钠都可提高盐胁迫下玉米幼苗的干物质质量积累速率,同时外源NO可以缓解低温胁迫对玉米种子萌发及幼苗生长的抑制作用,还可缓解低温胁迫引起的膜脂过氧化,保护细胞膜免受损伤或减少损伤,提高植物抗低温胁迫的能力。郑春芳等[4]发现,用外源NO供体SNP浸种能够缓解盐胁迫下小麦幼苗的碳氮代谢,提高抗氧化酶活性。有研究表明,NO能够有效缓解镍引起的氧化胁迫对小麦和油菜叶片的伤害[5-6]。但是关于NO缓解玉米镍毒害的研究尚鲜见报道。
玉米是我国大面积种植的粮食作物,同时也是重要的饲料和工业原料,其产量和品质都与国民经济及人民生活水平息息相关。随着工业的迅速发展、磷肥的大量施用、镍矿的开采、电子材料的制造等,进入土壤的镍呈逐年上升之势,并且已成为土壤主要的重金属污染物之一[7]。因此研究外源NO对镍胁迫下玉米毒害的缓解效应,对镍污染的防治及提高作物产量具有重要的现实意义。本研究以SNP为NO外源供体,分析在SNP和镍作用下玉米幼苗生长及抗氧化酶活性的变化,以期为镍污染的治理提供参考。
1 材料与方法
1.1 试验材料
玉米品种为“吉农669”(吉林农业大学提供);NO供体SNP(购自国药集团,分析纯)现用现配,若配制成浓度为0.15 mmol/L的SNP,其NO产生速率为0.20 μmol/L[8]。
1.2 试验处理
选择均一饱满的玉米种子,用体积分数10.0% H2O2消毒10 min,蒸馏水反复冲洗后浸种24 h,放入培养箱中进行催芽,将芽长均匀一致的种子转移至水培箱中继续培养。水培箱大小为20 cm×30 cm×15 cm,箱内固定2 mm孔径塑料网膜,将发芽的玉米种子均匀撒播于网表面,以Hoagland营养液为基础培养液,每天补充营养液使其保持刚好没过种子一半的水平。试验共设6个处理,分别为:1(对照).Ni 0 mmol/L+SNP 0 mmol/L;2.Ni 0 mmol/L+SNP 0.05 mmol/L;3.Ni 0 mmol/L+SNP 0.1 mmol/L;4.Ni 1.0 mmol/L+SNP 0 mmol/L;5.Ni 1.0 mmol/L+SNP 0.05 mmol/L;6.Ni 1.0 mmol/L+SNP 0.1 mmol/L,每个水培箱保留长势一致的玉米幼苗30株,在玉米2叶1心后开始处理,每处理重复6次,每天更换处理液。前5 d,每天分别于6个处理的3个重复中取5株玉米幼苗,保存于-20 ℃冰箱,用于测定丙二醛(MDA)和过氧化氢(H2O2)含量以及抗氧化酶活性;处理10 d时,分别于每处理的另外3个重复中取10株幼苗,用于常规理化指标的测定;在处理后1~6 d内,每天12:00左右用SPAD502测定仪测定玉米幼苗叶片SPAD值,以其表征叶绿素含量。
1.3 测定项目及方法
玉米鲜质量和干质量均采用称质量方法测定,用WinFORLIA根系分析系统测定总根长、总根表面积、总根投影面积和总根体积。玉米根系及地上部的镍和铁含量采用浓硫酸-过氧化氢消煮(其中对根系的前处理先使用0.01 mol/L稀盐酸冲洗,再用蒸馏水反复冲洗),之后用原子吸收分光光度计(TAS-986,北京普析通用仪器有限公司)法[9]测定。粗酶液提取参见王海华等[10]的方法,超氧化物歧化酶(SOD)活性测定参照王爱国等[11]的方法,抗坏血酸过氧化物酶(APX)活性测定参照Braber[12]的方法,过氧化氢酶(CAT)活性测定参照Dhindsa等[13]的方法,谷胱甘肽过氧化物酶(GPX)活性测定参照Durner等[14]的方法,MDA含量测定采用硫代巴比妥酸法[15],H2O2含量测定参照Jana等[16]的方法。
1.4 数据处理
所有数据均取供测3个重复的平均值,数据分析及差异显著性检验均采用SPSS 12.0软件完成。
2 结果与分析
2.1 SNP和镍对玉米生长的影响
2.1.1 生物质量 图1显示,与处理1相比,处理2和处理3玉米幼苗鲜质量显著增加,增幅分别为14.6%,30.5%;处理2和处理3玉米幼苗干质量稍有增加,与处理1差异未达到显著水平,说明本试验中0.05~0.1 mmol/L SNP均能显著增加玉米幼苗鲜质量,对玉米幼苗干质量影响不大。与处理1相比,单独施镍的处理4玉米幼苗鲜质量和干质量均显著降低,分别降低了近20.8%和25.5%;与处理4相比,处理5和处理6玉米幼苗的鲜质量显著增加,增幅分别为16.7%,25.5%,处理6玉米幼苗干质量显著增加,增加幅度为21.6%;处理5与处理6玉米幼苗鲜质量和干质量之间差异不显著,且二者与处理1差异也不显著。说明0.05~0.1 mmol/L SNP均能缓解镍造成的玉米鲜质量和干质量的下降,且高浓度的SNP效果更好。
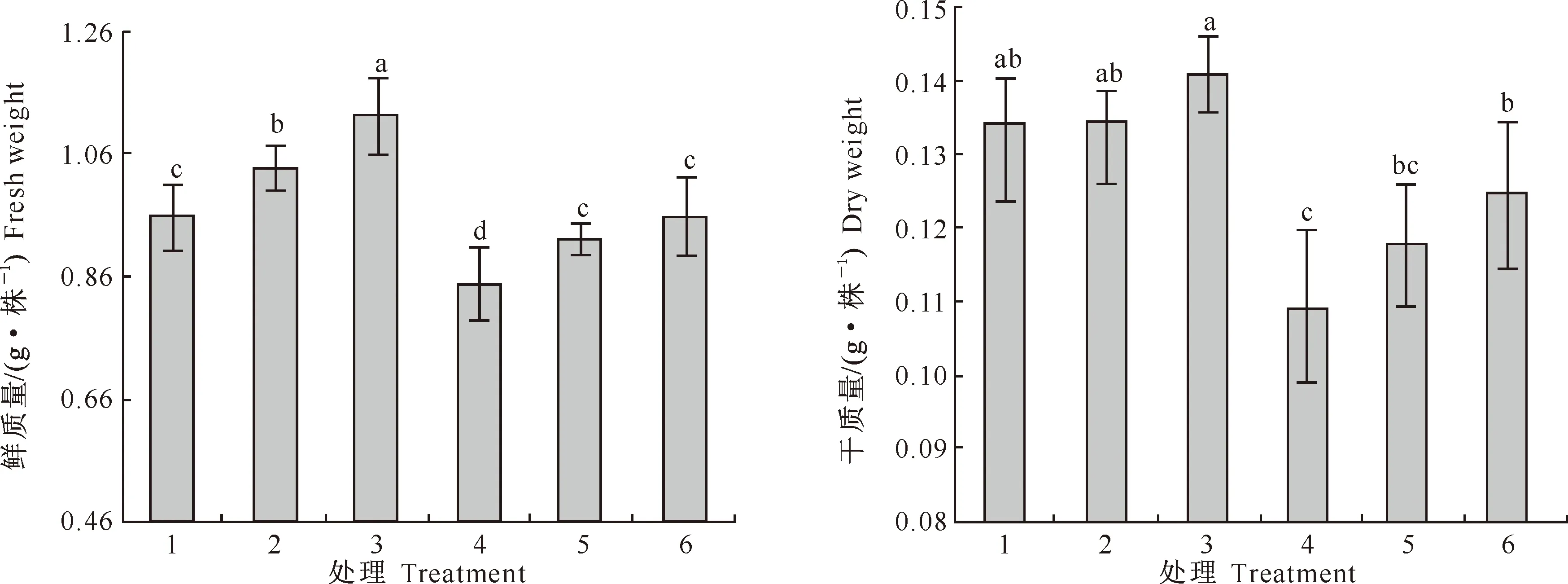
图1 SNP和镍对玉米幼苗干质量及鲜质量的影响
1.Ni 0 mmol/L+SNP 0 mmol/L(对照);2.Ni 0 mmol/L+SNP 0.05 mmol/L;3.Ni 0 mmol/L+SNP 0.1 mmol/L;4.Ni 1.0 mmol/L+SNP 0 mmol/L;5.Ni 1.0 mmol/L+SNP 0.05 mmol/L;6.Ni 1.0 mmol/L+SNP 0.1 mmol/L;
图柱上标不同小写字母表示处理间差异显著(P<0.05)。下图同
Fig.1 Effects of SNP and nickel on dry and fresh weights of corn seedlings
1.Ni 0 mmol/L+SNP 0 mmol/L(control);2.Ni 0 mmol/L+SNP 0.05 mmol/L;3.Ni 0 mmol/L+SNP 0.1 mmol/L;4.Ni 1.0 mmol/L+SNP 0 mmol/L;5.Ni 1.0 mmol/L+SNP 0.05 mmol/L;6.Ni 1.0 mmol/L+SNP 0.1 mmol/L;Lowercase letters mean significant difference (P<0.05)between treatments.The same below
2.1.2 根系生长 SNP和镍对玉米幼苗根系生长的影响见图2和图3。
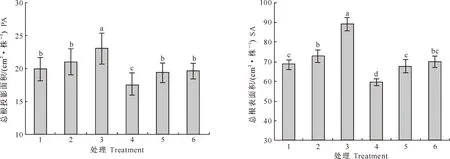
图2 SNP和镍对玉米幼苗总根投影面积和总根表面积的影响
Fig.2 Effects of SNP and nickel on root PA and SA of corn seedlings
从图2和图3可以看出,未施镍时,高浓度(0.1 mmol/L)SNP能显著增加玉米总根长、总根表面积(SA)、总根投影面积(PA)和总根体积(VOL),较对照增加的幅度分别为17.4%,51.5%,31.0%和58.2%,低浓度(0.05 mmol/L)SNP对根生长的促进作用小于高浓度SNP处理。单独施镍(处理4)能够显著降低玉米幼苗的总根长、总根表面积、总根投影面积,同时也降低了总根体积,但未达到显著水平;而镍与SNP配施的处理5和处理6能够缓解镍对玉米幼苗根系生长的抑制作用。说明SNP能够缓解镍对玉米根系生长的抑制作用,且高浓度SNP的效果更好。
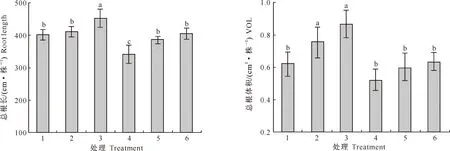
图3 SNP和镍对玉米幼苗总根长和总根体积的影响
Fig.3 Effects of SNP and nickel on root length and VOL of corn seedlings
2.2 SNP和镍对玉米体内镍、铁含量的影响
表1显示,单独施SNP处理(处理2和处理3)对玉米地上部和根部的镍含量影响不大。与处理1相比,单独施镍处理(处理4)玉米幼苗地上部和根部镍含量显著增加,且玉米根部镍含量增加幅度大于地上部。与处理4相比,处理5、处理6能够明显降低镍在玉米体内的积累,但是二者均未能使玉米体内镍含量恢复至对照(处理1)水平。单独施高浓度(0.1 mmol/L)SNP能显著增加玉米地上部和根部的铁含量。单独施镍处理对玉米根部铁含量影响不大,却能显著降低地上部的铁含量。而处理5和处理6均能使玉米幼苗地上部和根系内的铁含量恢复正常。说明镍能够抑制铁从根系向玉米地上部转移,而SNP能够缓解这种抑制作用,且高浓度SNP的效果更好。
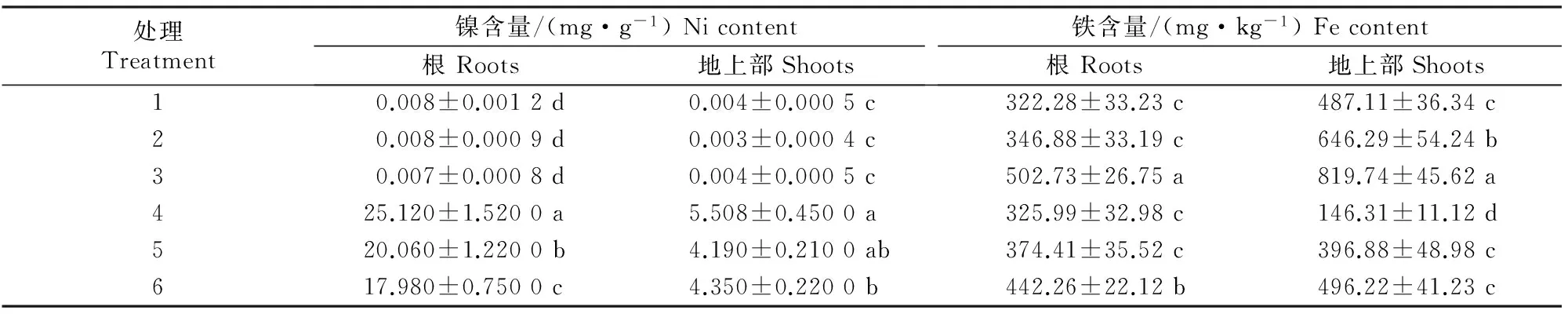
表1 SNP和镍对玉米幼苗体内镍及铁含量的影响Table 1 Effects of SNP and nickel on internal nickel and iron contents of corn seedlings
注:同列数据后标不同小写字母表示差异显著(P<0.05);处理间自由度为5,误差自由度为11,F0.05=5.32。
Note:Different lowercase letters mean significant difference(P<0.05).Degrees of freedom is 5,error degrees is 11,andF0.05=5.32.
2.3 SNP和镍对玉米叶片叶绿素含量的影响
SNP和镍对玉米叶片叶绿素含量的影响见图4。由图4可见,在整个监测期间,对照(处理1)玉米幼苗SPAD值变化不大;单施镍处理(处理4)玉米幼苗的SPAD值呈逐渐降低的趋势,而处理5和处理6 SPAD值总体呈增加趋势。与对照相比,单施SNP处理(处理2、处理3)能够增加SPAD值,平均增加幅度为2.3%,且高浓度(1.0 mmol/L)SNP增加幅度更大;单施镍处理(处理4)能够降低SPAD值,监测期间平均降低了11.5%;处理5和处理6能够缓解镍造成的玉米叶片SPAD值下降,监测后期SPAD值基本恢复正常。
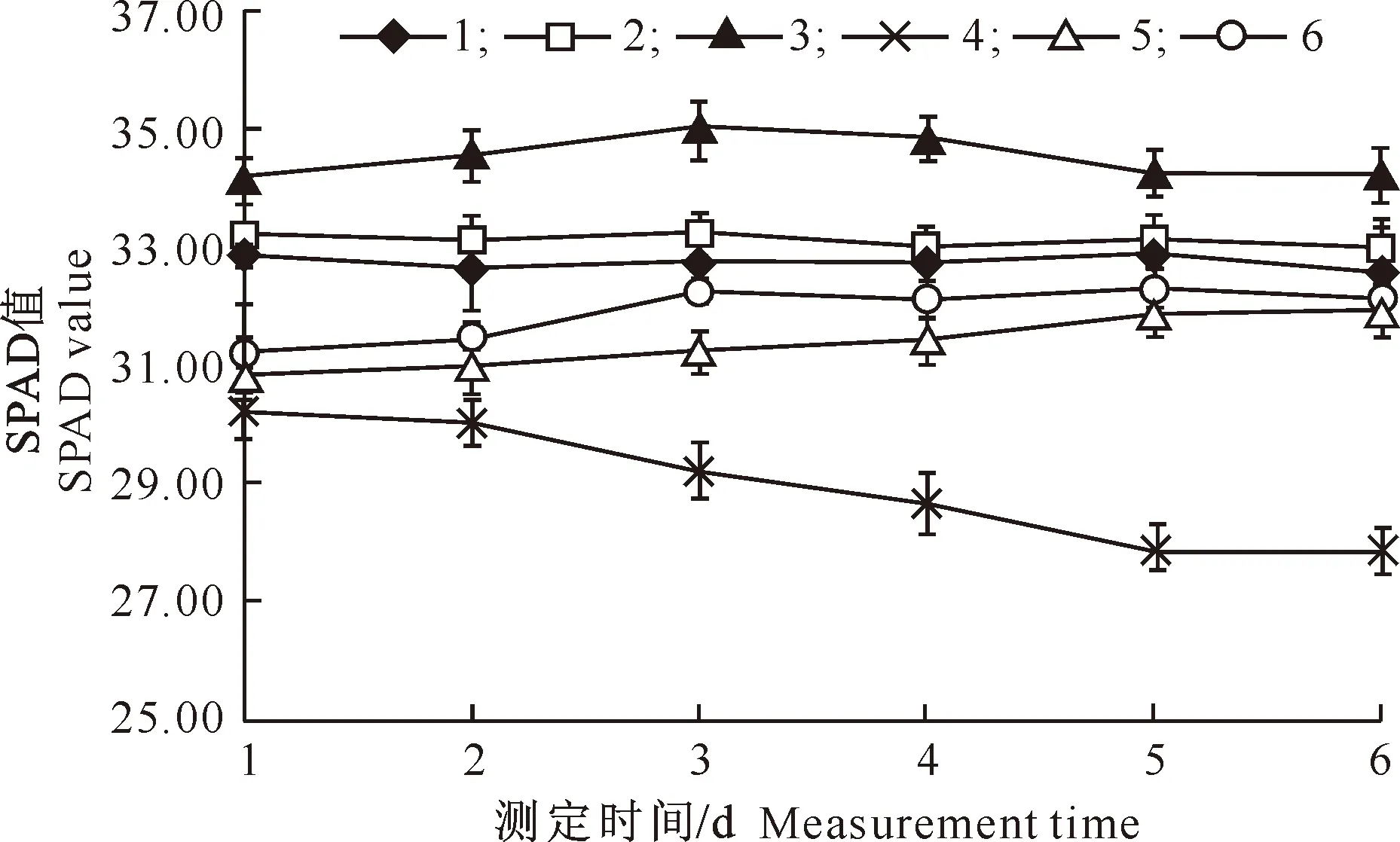
图4 SNP和镍对玉米叶片叶绿素含量的影响
Fig.4 Effects of SNP and nickel on chlorophyll content in corn leaves
2.4 SNP和镍对玉米叶片丙二醛、H2O2含量的影响
对玉米叶片连续5 d进行H2O2和丙二醛含量测定,结果(图5)显示,与对照相比,单施镍处理(处理4)玉米叶片H2O2和丙二醛含量增加,而单施SNP处理(处理2和处理3)能够降低玉米叶片的H2O2及丙二醛含量,且高浓度(0.1 mmol/L)SNP效果优于低浓度(0.05 mmol/L)SNP,可知SNP能够缓解玉米叶片由于镍胁迫造成的H2O2和丙二醛含量的升高。
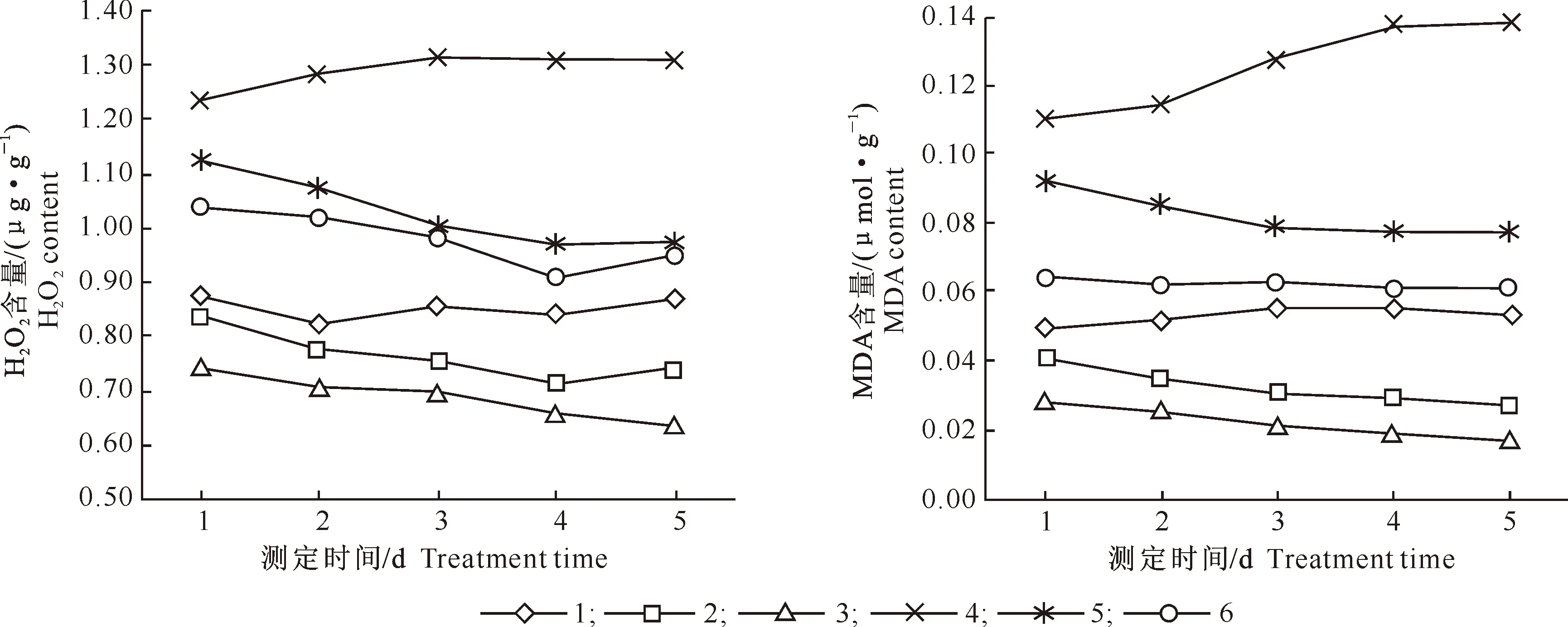
图5 SNP和镍对玉米幼苗叶片H2O2及丙二醛含量的影响
Fig.5 Effects of SNP and nickel on H2O2and MDA content in corn leaves
2.5 SNP和镍对玉米叶片抗氧化酶活性的影响
SNP和镍处理对玉米叶片抗氧化酶活性的影响见图6。
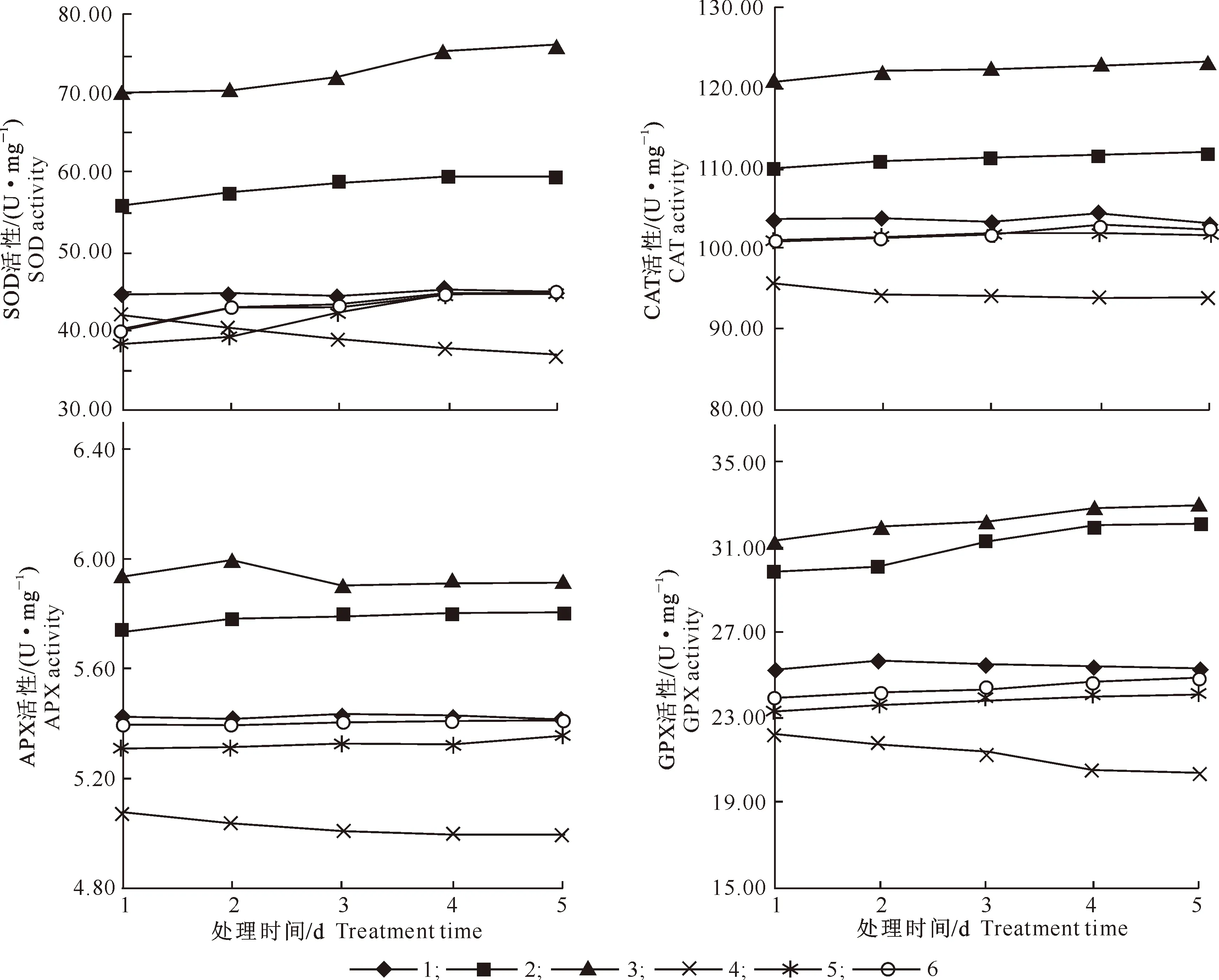
图6 SNP和镍对玉米叶片抗氧化酶活性的影响Fig.6 Effects of SNP and nickel on antioxidant enzymes activities in corn leaves
从图6可以看出,与对照相比,单施SNP处理能够增加玉米叶片的SOD、CAT、APX和GPX活性,高浓度(0.1 mmol/L)SNP增幅更明显。单施镍对玉米叶片SOD、CAT、APX和GPX活性有明显的抑制作用,测定期间平均降幅分别为12.8%,7.4%,8.9%和16.4%;SNP与镍共施的处理5和处理6 的4种抗氧化酶活性与对照差异较小,说明SNP能够缓解由于镍造成的玉米幼苗叶片抗氧化酶活性的降低。
3 讨 论
有研究者认为,过量的镍会降低玉米幼苗的干质量和鲜质量[9,17],其原因可能是镍改变了玉米植株体内的代谢过程,如叶片的光合作用和同化物的运输[18-21]。而本研究发现,高浓度镍通过影响玉米幼苗总根长、总根表面积、总根投影面积和总根体积,进而抑制了玉米幼苗的生长。玉米叶片SPAD值与叶绿素含量间有很好的相关性[22],故其能表征叶片叶绿素含量。不少学者认为,镍能减少植物叶片叶绿素含量[18-19,21],其原因是由于铁的供应不足影响了叶绿素的合成。而本研究发现,镍胁迫下玉米根系中的铁含量明显高于地上部,且地上部铁含量明显低于对照处理。因此,可以认为玉米SPAD值的下降是由于铁供应不足造成的。NO可以缓解由于铁含量降低对叶绿素生成所产生的毒害作用,根部铁含量增加的原因是由于镍从根部向叶片的运输量减少所致。同时由于抗氧化酶活性中心是由铁组成的,铁的缺乏必然会造成抗氧化酶活性的降低,因此施用NO供体SNP后,同样会提高抗氧化酶活性。因此,可以看出NO是通过影响玉米幼苗体内的抗氧化酶、活性氧和铁含量等生理指标进而缓解镍毒害的。但这种生理变化在分子水平上的表现,如对抗氧化酶非编码基因mRNA转录水平如何变化还需进一步研究。
4 结 论
1)单施镍处理玉米幼苗总根长、总根表面积、总根投影面积和总根体积均不同程度降低,影响了玉米幼苗的生长,外源NO供体SNP能够缓解镍对玉米幼苗根系生长的抑制作用。
2)外源NO供体SNP能够缓解镍对玉米生长和叶绿素含量造成的影响,并且可减少镍从植株根部向叶片的运输及玉米幼苗体内H2O2和MDA积累。
3)外源NO供体SNP提高了玉米幼苗叶片中抗氧化酶的活性,能够缓解镍对玉米幼苗的伤害。
[1] 唐 静,车永梅,侯丽霞,等.NO缓解玉米幼苗盐胁迫伤害的生理机制 [J].西北植物学报,2009,29(10):2007-2012.
Tang J,Che Y M,Hou L X,et al.Physiological mechanism for nitric oxide relieving growth inhibition of maize seedling under salt stress [J].Acta Bot Boreal Occident Sin,2009,29(10):2007-2012.(in Chinese)
[2] 张艳艳,刘 俊,刘友良.一氧化氮缓解盐分胁迫对玉米生长的抑制作用 [J].植物生理与分子生物学学报,2004,30(4):455-459.
Zhang Y Y,Liu J,Liu Y L.Nitric oxide alleviates growth inhibition of maize seedlings under NaCl stress [J].Journal of Plant Physiology and Molecular Biology,2004,30(4):455-459.(in Chinese)
[3] 陈银萍,王晓梅,杨宗娟,等.NO对低温胁迫下玉米种子萌发及幼苗生理特性的影响 [J].农业环境科学学报,2012,31(2):270-277.
Chen Y P,Wang X M,Yang Z J,et al.Effects of nitric oxide on seed germination and physiological reaction of maize seedlings under low tem perature stress [J].Journal of Agro-Environment Science,2012,31(2):270-277.(in Chinese)
[4] 郑春芳,姜 东,戴廷波,等.外源一氧化氮供体硝普钠浸种对盐胁迫下小麦幼苗碳氮代谢及抗氧化系统的影响 [J].生态学报,2010,30(5):1174-1183.
Zheng C F,Jiang D,Dai T B,et al.Effects nitroprusside,a nitric oxide donor,on carbon and nitrogen metabolism and the activity of the antioxidation system in wheat seedings under salt stress [J].Acta Ecologica Sinica,2010,30(5):1174-1183.(in Chinese)
[5] 王松华,周正义,何庆元,等.一氧化氮对小麦叶片镍毒害的缓解作用 [J].云南植物研究,2007,1(7):115-121.
Wang S H,Zhou Z Y,He Q Y,et al.Nitric oxide alleviates the nickel toxicity in wheat seedlings [J].Acta Botanica Yunnanica,2007,1(7):115-121.(in Chinese)
[6] Nader K,Ramazan A K N,Hamid F,et al.Effects of exogenous salicylic acid and nitric oxide on lipid peroxidation and antioxidant enzyme activities in leaves ofBrassicanapusL.under nickel stress [J].Scientia Horticulturae,2010,126:402-407.
[7] 刘国栋.植物营养元素:Ni [J].植物营养与肥料学报,2001,7(1):103-108.
Liu G D.Nickel:A nutrition element for higher plant growth [J].Plant Nutrition and Fertilizer Science,2001,7(1):103-108.(in Chinese)
[8] 孙 群,胡景江.植物生理学研究技术 [M].陕西杨凌:西北农林科技大学出版社,2006.
Sun Q,Hu J J.Plant physiology research and technology [M].Yangling,Shaanxi:Northwest A&F University Press,2006.(in Chinese)
[9] 鲍士旦.土壤农化分析 [M].北京:中国农业出版社,2000:49-50.
Bao S D.Soil and agricultural chemistry analysis [M].Beijing:Agriculture Press of China,2000:49-50.(in Chinese)
[10] 王海华,康 健,曾富华,等.高浓度镍对水稻幼苗生长及酶活性的影响 [J].作物学报,2001,27(6): 953-957.
Wang H H,Kang J,Zeng F H,et al.Effect of nickel at high concentrations on growth and activities of enzymes of rice seedlings [J].Acta Agronomica Sinica,2001,27(6):953-957.(in Chinese)
[11] 王爱国,罗广华,邵从本,等.大豆种子超氧物歧化酶的研究 [J].植物生理学报,1983,9(1):77-84.
Wang A G,Luo G H,Shao C B,et al.A study on the superojde dismutase of soybean seeds [J].Acta Phytophysiologia sinica, 1983,9(1):77-84.(in Chinese)
[12] Braber J M.Catalase and peroxidase in primary bean leaves during development and senescence [J].Zeitschriftfür Pflanzenphysiologie,1980,97(2):135-144.
[13] Dhindsa R S,Plumb-Dhindsa P,Thorpe T A.Leaf senescence correlated with increased levels of membrane permeability and lipid peroxidation and decreased levels of dismutase and cata-lase [J].J Exp Bot,1981,32:91-101.
[14] Durner J,Klessing D F.Inhibition of ascorbate peroxidase by salicylic acid and 2,6-dichloroisonicotinic,two inducers of plant defense response [J].Proc Natl Acad Sci USA,1995,92:11312-11316.
[15] 吴雪霞,陈建林,查丁石.低温胁迫对茄子幼苗叶片叶绿素荧光特性和能量耗散的影响 [J].植物营养与肥料学报,2009,15(1):164-169.
Wu X X,Chen J L,Zha D S.Effects of low temperature stress on chlorophyll fluorescenc characteristics and excitation energydssipation in eggplant seedling leaves [J].Plant Nutrition and Fertilizer Science,2009,15(1):164-169.(in Chinese)
[16] Jana S,Choudhurim.Glycolate metabolism of three sub-merged aquatic angiosperms during aging [J].Aquat Bot,1981,12:345-354.
[17] 康立娟,谢忠雷.镍对玉米和水稻污染效应及累积规律的研究 [J].农业环境科学学报,2008(6):2315-2318.
Kang L J,Xie Z L.Pollution effects and accumulation rules of nickel in corn and rice [J].Journal of Agro-Environment Science,2008(6):2315-2318.(in Chinese)
[18] Pandey N,Sharma C P.Effect of heavy metals Co2+,Ni2+and Cd2+on growth and metabolism of cabbage [J].Plant Science,2002,163(4):753-758.
[19] Gajewska E,Sklodowska M,Slaba M,et al.Effect of nickel on antioxidative enzyme activities,proline and chlorophyll contents in wheat shoots [J].Biol Plant,2006,50 653-659.
[20] Gajewska E,Sklodowska M.Effect of nickel on ROS content and antioxidative enzyme activities in wheat leaves [J].BioMetals,2007,20:27-36.
[21] Seregin I V,Kozhevnikova A D.Physiological role of nickel and its toxic effects on higher plants [J].Plant Physiol,2006,53:257-277.
[22] 李志宏,张云贵,刘宏斌,等.叶绿素仪在夏玉米氮营养诊断中的应用 [J].植物营养与肥料学报,2005,11(6):58-62.
Li Z H,Zhang Y G,Liu H B,et al.Application of chlorophyll meter on N nutritional diagnosis for summer corn [J].Plant Nutrition and Fertilizer Science,2005,11(6):58-62.(in Chinese)
Effect of exogenous NO donor SNP and nickel on growth and antioxidant enzymes activities of corn
ZHANG Zhong-qing1,LI Shao-shan2,LIU Jin-hua1,YANG Jing-min1
(1CollegeofResourcesandEnvironment,JilinAgriculturalUniversity,Changchun,Jilin130118,China;2JilinJinSuiFertilizerLimitedCompany,Jilin,Jilin132022,China)
【Objective】 The growth of maize seedlings and activities of antioxidant enzymes were studied under the interaction of exogenous NO donor SNP and nickel to provide reference for preventing and controlling nickel pollution.【Method】 Jinong 669 maize seedlings were treated by NO (SNP) and Ni.The 6 treatments were:1.Ni 0 mmol/L+SNP 0 mmol/L (control),2.Ni 0 mmol/L+SNP 0.05 mmol/L,3.Ni 0 mmol/L+SNP 0.1 mmol/L,4.Ni 1.0 mmol/L+SNP 0 mmol/L,5.Ni 1.0 mmol/L+SNP 0.05 mmol/L,and 6.Ni 1.0 mmol/L+SNP 0.1 mmol/L.The changes of growth and physiological indexes and activities of antioxidant enzymes were analyzed.【Result】 SNP significantly relieved the decrease of fresh and dry weights and inhibition of root growth caused by nickel.Nickel with concentration of 1.0 mmol/L (treatment 4) not only increased nickel content in the seedlings,but also inhibited the transfer of iron from corn roots to aboveground parts,which caused the decrease of iron concentration in plant.SNP could relieve this inhibition by decreasing nickel concentration while increasing ion concentration.In addition,SNP alleviated the decrease of SPAD values and the increase of H2O2and MDA content in corn leaves,and increased the activities of SOD,CAT,APX and GPX.High concentration SNP (1.0 mmol/L) was better.【Conclusion】 Exogenous NO donor SNP alleviated the damage caused by nickel in corn seedlings.
nickel stress;maize;exogenous NO;SNP;physiological characteristic
2014-01-20
国土资源部项目(12120105-11208)
张忠庆(1985-),男,山东菏泽人,硕士,主要从事作物镍毒害缓解效应研究。E-mail:zhangzq1126@qq.com
杨靖民(1970-),男,吉林榆树人,教授,主要从事作物重金属污染研究。E-mail:yangjingmin2001@163.com
时间:2015-06-30 13:47
10.13207/j.cnki.jnwafu.2015.08.030
S513.01
A
1671-9387(2015)08-0079-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150630.1347.030.html

