美托洛尔及其手性对映体的合成工艺研究最新进展
狄潘潘,徐自奥,李家明,丁斌,李晓祥(.安徽中医药大学药学院,安徽合肥3003;.安徽省新星药物开发有限责任公司,安徽合肥30088)
美托洛尔及其手性对映体的合成工艺研究最新进展
狄潘潘1,徐自奥2,李家明1,丁斌1,李晓祥2
(1.安徽中医药大学药学院,安徽合肥230031;2.安徽省新星药物开发有限责任公司,安徽合肥230088)
摘要:美托洛尔属第二代β受体阻滞剂,是目前治疗高血压的常用五大类药物之一,为临床一线用药。药理研究表明,S-美托洛尔较其对映体R-美托洛尔而言,具有更高的选择性和较低的毒副作用。针对目前美托洛尔外消旋体以及其手性对映体的合成工艺做一综述。
关键词:美托洛尔;手性对映体;合成工艺
心脑血管疾病严重威胁人类健康,居各种死因首位。而导致心脑血管疾病的一个主要原因就是高血压。高血压是最常见的慢性病,也是心脑血管病最主要的危险因素。治疗高血压可以最大限度地降低心血管发病和死亡的总危险。
目前常用的治疗高血压的药物有五大类,分别是β受体阻滞剂(Beta Blockers)、钙通道阻滞剂(Calcium Channel Blockers)、血管紧张素转换酶抑制剂(Angiotensin Converting Enzyme Inhibitors)、血管紧张素受体阻滞剂(Angiotensin Receptor Blockers)和利尿剂(Diuretics),其中β受体阻滞剂为目前临床上所使用的主要心血管药物。β受体可分为3种类型:β1受体、β2受体和β3受体,与高血压关系最密切的为β1受体。
美托洛尔(图1)为选择性β1受体阻滞剂的代表药物,也是全球首个选择性β1-肾上腺素能受体阻滞剂,属于2A类,即无部分激动活性的β1-受体阻断药(心脏选择性β-受体阻断药)。它对β1受体有选择性阻断作用,无PAA(部分激动活性),无膜稳定作用,是近年来世界高血压治疗的首选药物,也是我国的基本药物之一。

图1 美托洛尔化学结构式
本文综述了美托洛尔外消旋体以及其手性对映体的合成工艺研究进展,并对美托洛尔的两种光学对映体的药理活性的研究做了简述。
1 美托洛尔光学对映体的药理活性
美托洛尔又名甲氧乙心安、倍他乐克、美多心安等。化学名为(RS)1-异丙氨基- 3- [对-(2-甲氧乙基)苯氧基]- 2-丙醇。美托洛尔的分子中含有一个手性碳原子,具有两种光学对映异构体。近年来手性药物的研究较为热门,而S-美托洛尔具有选择性高,药效强,副作用少,用量少等优点,具有较高的临床应用价值与广阔的市场前景。
药理学研究表明,(S)-美托洛尔对β受体的阻断作用为(R)-美托洛尔的33倍,两种对映体具有不同的代谢速率[1],并且(R)-美托洛尔会产生一些副作用[2]。进一步研究表明,(S)-美托洛尔与β1受体的亲和力是(R)-美托洛尔的500倍,(R)-美托洛尔对β2受体的亲和活性是(S)-美托洛尔的十倍。(S)-美托洛尔具有心脏选择性,即使高剂量也不会对β2受体产生阻滞作用,且与其他药物几乎无药物相互作用;而(R)-美托洛尔没有心脏选择性,且高剂量会产生β2受体阻断作用。相对于(S)-美托洛尔,(R)-美托洛尔的药物作用会提高40%~50%[3]。
美托洛尔在临床上主要的药用形式为美托洛尔的盐酸盐、琥珀酸盐、富马酸盐或者酒石酸盐。目前临床广泛应用的为美托洛尔的外消旋体,全世界只有印度上市了(S)-琥珀酸美托洛尔缓释片及其原料药[4]。
2 美托洛尔及其手性对映体的合成工艺
1969年,美托洛尔于瑞典研发成功,最初的合成工艺路线如下(Scheme 1):
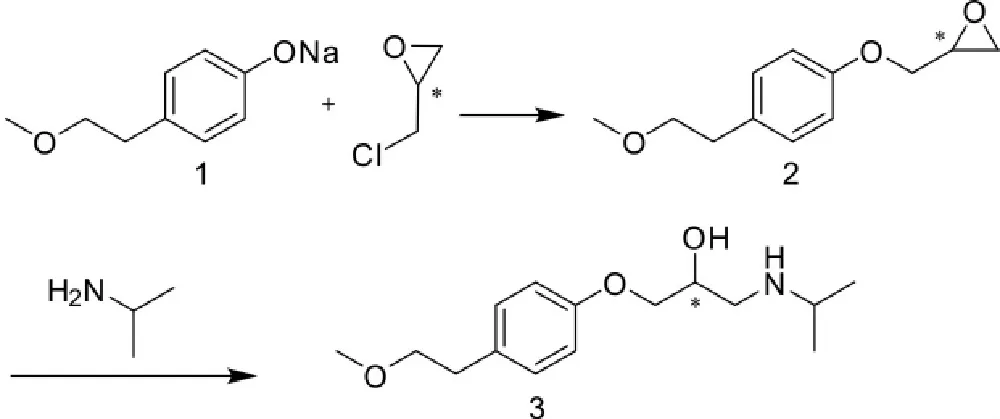
Scheme 1
上述合成路线是以4-(2-甲氧基乙基)苯酚钠(化合物1)为起始原料,先与环氧氯丙烷反应,生成3- [4-(2-甲氧基乙基)苯氧基]- 1,2-环氧丙烷(化合物2),最后再和异丙胺发生胺化反应生成美托洛尔(化合物3)。
此后,众多文献报道了针对此美托洛尔合成路线的工艺优化方法,如田建文等人[5]在反应中加入聚乙二醇400作为相转移催化剂,使得收率达到84.5%。
除上述简易的美托洛尔合成路线外,众多研究者相继研发了许多其他合成路线。
2007年,Muthukrishnan[6]等人以4-(2-羟基乙基)苯酚(化合物1)为起始原料,与手性环氧氯丙烷反应,生成化合物2;化合物2经(R,R)- Salen- CoⅢ催化剂催化水解动力学不对称拆分得到(S)- 3,接着在叔丁醇钾存在的条件下,(S)- 3与碘甲烷反应,生成化合物(R)- 4;最后再与异丙胺反应,得到(S)-美托洛尔(Scheme 2)。由于进行了(S)- 3的立体选择性水解,致使其损失50%左右,最终收率较低。
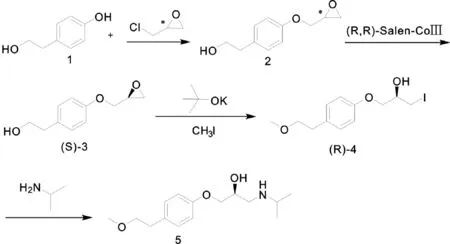
Scheme 2
2008年,纪德华[7]等同样以4-(2-羟基乙基)苯酚(化合物1)为起始原料,选择性与(R)-环氧氯丙烷反应,生成化合物(S)-2。然后化合物2与碘甲烷和叔丁醇钠反应生成化合物(R)-3,最后再与异丙胺反应生成(S)-美托洛尔。最后将得到的(S)-美托洛尔与酒石酸成盐,得到(S)-酒石酸美托洛尔,收率79.2%。较上述合成工艺路线收率提高,成本降低(Scheme 3)。

Scheme 3
2010年,宋光伟[8]等人以4-羟基苯甲醛(化合物1)为起始原料,与苄氯反应,生成化合物2;化合物2与2-氯乙酸乙酯在碱性条件下反应生成化合物3,接着与亚硫酸氢钠反应生成化合物4。化合物4用硼氢化钾还原生成化合物5,再在氢化钠的催化下,与硫酸二甲酯反应,醚化生成化合物6;化合物6在钯的催化下,用氢气还原,脱掉苄基,生成化合物7;最后化合物7与环氧氯丙烷和异丙胺反应,得到最终产物美托洛尔(Scheme 4)。
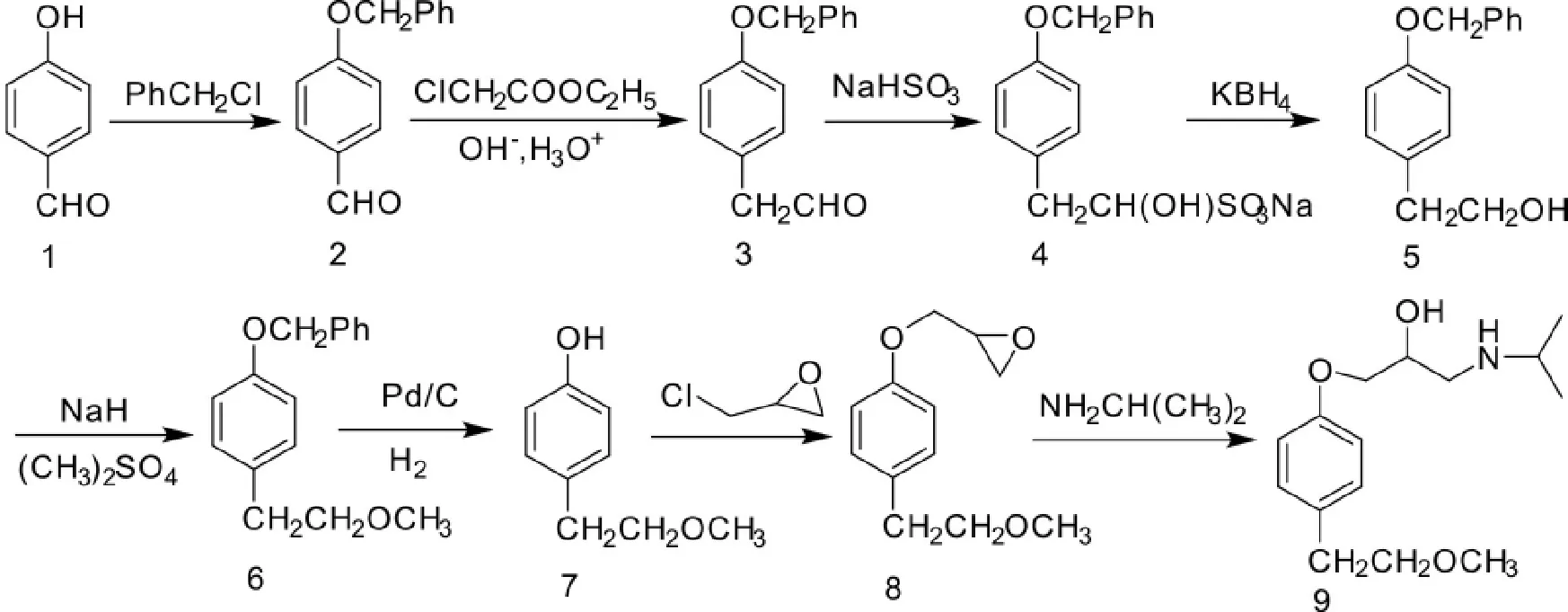
Scheme 4
上述美托洛尔合成工艺极为繁琐,步骤较长,收率低,且用到危险催化剂钯碳以及剧毒试剂硫酸二甲酯,因而不适合规模化、工业化生产。
总结以往美托洛尔合成工艺,其目的都是为了得到关键中间体对甲氧基乙基苯酚。近年来,由于有对甲氧基乙基苯酚原料上市,所以目前美托洛尔的合成,都以对甲氧基乙基苯酚为起始原料,集中研究其合成工艺的优化。
2011年,Pujala[9]等人以对甲氧基乙基苯酚为起始原料,与环氧氯丙烷反应,再在阻燃剂四氟硼酸锌水合物的作用下,惰性反应环境中,与异丙胺在20℃条件下进行氨化反应,得到美托洛尔,最终收率近64%(Scheme 5)。
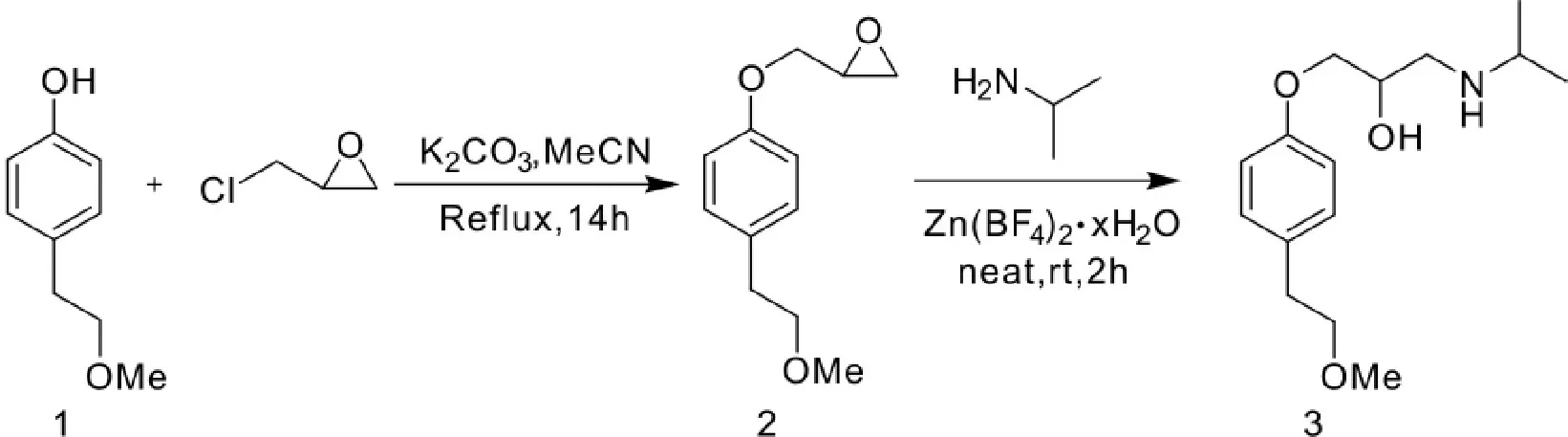
Scheme 5
卢定强[4]等人以对甲氧基乙基苯酚(化合物1)为起始原料,和(R)-环氧氯丙烷反应,生成化合物(S)- 2;接着化合物(S)- 2与异丙胺反应,生成化合物(S)-美托洛尔(化合物3);最后,(S)-美托洛尔与琥珀酸成盐,得到(S)-琥珀酸美托洛尔(化合物4)。在反应过程中,利用装填除水剂的外循环出水系统进行循环除水,提高了化合物2的收率,最终收率大于75%(Scheme 6)。
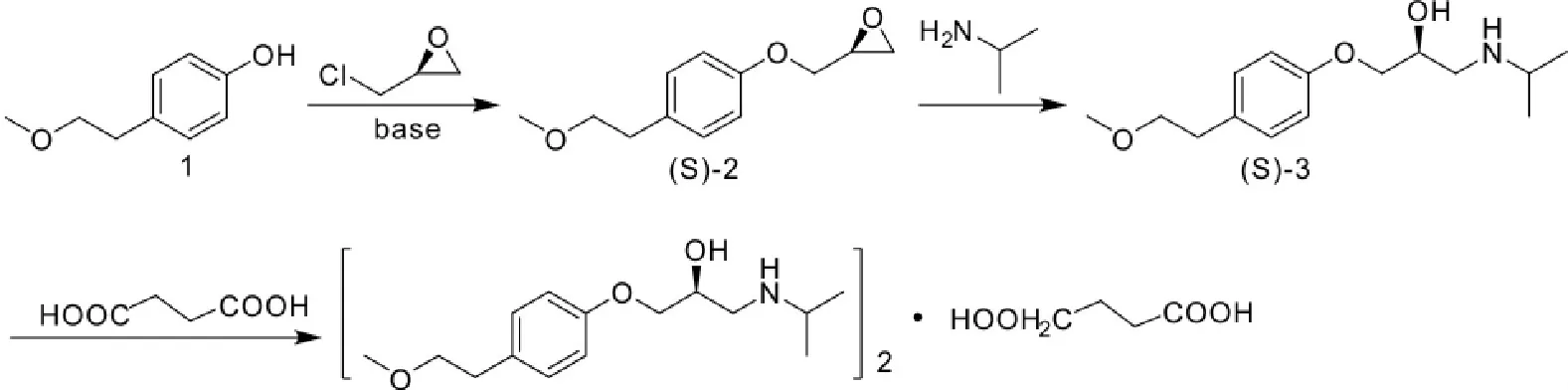
Scheme 6
2012年,Cheng Sikun[10]等人也以对甲氧基乙基苯酚为原料,进行S-美托洛尔的合成,但是,其过程比较复杂,路线长,用高聚物支载配体QN- AQN- OPEG- OMe,与原乙酸三甲酯反应,用对甲苯磺酸吡啶盐(PPTS)作为脱水剂,处理复杂,成本高,收率也较低(Scheme 7)。

Scheme 7
此外,Regla[11]、Sonawane[12]等也对美托洛尔合成工艺进行了探索,但同样存在操作不便,成本高,不适合规模化生产等问题。
3 总结与展望
美托洛尔的合成路线多达20条,大部分路线较为复杂,不易操作,成本较高,收率低,有些甚至用到剧毒性化学试剂。目前以市售对甲氧基乙基苯酚为起始原料,与环氧氯丙烷和异丙胺反应,合成美托洛尔或选择性合成单一手性对映体,是目前步骤最为简单的合成路线,具有工业化生产前景,但其具体反应条件有待于进一步摸索优化。
参考文献
[1] Dasbiswas S,Shinde S,Dasbiswas D. S- metoprolol: the 2008 clinical review [J]. Journal of the Indian Medical Association,2008,106(4):259- 262.
[2]纪德华,姚军,贾永辉,等. S-美托洛尔的不对称合成[J].现代化工,2008,28(11):58- 59.
[3] Arup D,Debasri D. Chirally Pure S- Metoprolol- Place in Therapy [J]. Indian Heart Journal,2010,62:143- 145.
[4]卢定强,赵娴,吴永平,等.一种制备(S)-琥珀酸美托洛尔的方法[P].中国专利:102295569,2011- 12- 28.
[5]田建文,张小林,彭雪萍,等.强碱性条件下的相转移催化合成美多心安[J].南昌大学学报(理科版),2005,29(6): 529- 532.
[6] Muthukrishnan M,Garud DR,Joshi R R,et al. Concise synthesis of β- blockers(S)- metoprolol and(S)- betaxolol using hydrolytic kinetic resolution[J]. Tetrahedron,2007,63:1872- 1876.
[7]纪德华,姚军,贾永辉,等. S-美托洛尔的不对称合成[J].现代化工,2008,28(11):58- 59.
[8]宋光伟,姚国新,陈刚,等.美托洛尔的合成新工艺研究[J].中国药物化学杂志,2010,20(1):44- 60.
[9] Pujala B,Rana S,Chakraborti A K. Zinc tetrafluoroborate hydrate as a mild catalyst for epoxide ring opening with amines: Scope and limitations of metal tetrafluoroborates and applications in the synthesis of antihypertensive drugs(RS)/(R)/(S)- metoprolols[J]. Journal of Organic Chemistry,2011,76(21):8768- 8780.
[10]Cheng S K,Liu X Y,Wang P A,et al. Asymmetric synthesis of (S)- metoprolol via sharpless asymmetric dihydroxylation induced by a recoverable polymer ligand QN- AQNOPEG- OMe [J]. Letters in Organic Chemistry,2012,9(7):516- 519.
[11]Regla I,Luviano J A,Demare P,et al. Chemoenzymatic synthesis ofthe potential antihypertensive agent(2R,2′S)-βhydroxyhomometoprolol[J]. Tetrahedron Asym- metry,2008,19 (21):2439- 2442.
[12]Sonawane S P,Patil G D,Gurjar M K. Concise synthesis of two β- adrenergic blocking agents in high stereoselectivity using the readily available chiral building block(2S,2′S,2″S)- tris-(2,3- epoxypropyl)- isocyanurate [J]. Organic Process Research and Development, 2011, 15(6):1365- 1370.□
doi:10.3969/j.issn.1008- 553X.2015.01.002
中图分类号:R544.1
文献标识码:A
文章编号:1008- 553X(2015)01- 0012- 05
收稿日期:2014- 07- 03
基金项目:安徽中医药大学千人计划培养资助
作者简介:狄潘潘(1989-),男,在读硕士研究生,研究方向:药物设计及其合成工艺研究,18326617918, fydpp08@sina.com;通讯联系人:李家明(1964-),博士,教授,研究方向:药物分子结构修饰与改造,lijiaming2004@sina.com。
Recent Progress of the Metoprolol and Chiral Enantiomers Synthesis
DI Pan-pan1, XU Zi-ao2, LI Jia-ming1, DING Bin1, LI Xiao-xiang2
(1.Anhui Universityof Chinese Medicine,Hefei 230031,China;2.Anhui NewStar Pharmaceutial Development Co.,Ltd.,Hefei 230088,China)
Abstract:Metoprolol, the second generation of beta blockers,is one of the five commonly used drugs for the treatment of hypertension currently, as well the first- line drug for the treatment of hypertension disease in clinical. The corresponding pharmacological studies have shown that, S- Metoprolol is more selectivity and lower side effects. This article summarize the synthesis technologyofmetoprolol racemate and its chiral enantiomers.
Key words:Metoprolol; chiral enantiomers; synthesis technology

