野牛草克隆分株酶促活性氧清除系统对差异光周期的响应
李 伟,钱永强,韩 蕾,刘俊祥,孙振元,*
(1中国林业科学研究院林业研究所,国家林业局林木培育重点实验室,北京100091;2青岛农业大学园林与林学院,山东青岛266109)
野牛草克隆分株酶促活性氧清除系统对差异光周期的响应
李 伟1,2,钱永强1,韩 蕾1,刘俊祥1,孙振元1,*
(1中国林业科学研究院林业研究所,国家林业局林木培育重点实验室,北京100091;2青岛农业大学园林与林学院,山东青岛266109)
以盆栽野牛草克隆分株为材料,将克隆分株分别标记为O(姊株)和Y(妹株),设置连接组和断开组两种处理,其中,连接组中O分株和Y分株通过节间子相连,断开组则剪断分株节间子;两组处理的O分株光周期均设置为光照12h/黑暗12h,Y分株光周期均设置为黑暗12h/12h光照(恰好与O分株相反),经过7d的差异光周期处理后进行72h全光照稳定培养,并于全光照条件下在48h内连续测定各分株叶片超氧化物歧化酶(SOD),过氧化物酶(POD),过氧化氢酶(CAT),抗坏血酸过氧化物酶(APX)的活性以及丙二醛(MDA)的含量,探讨野牛草叶片酶促活性氧清除系统对差异光周期的响应特征。结果表明,差异光周期处理1周后,全光照条件下,断开状态的野牛草克隆分株O和Y间叶片中SOD、POD、CAT、APX活性以及MDA含量在24h内基本呈现相反的变化趋势,而野牛草相连克隆分株O和Y间叶片中以上指标在24h内呈现趋于一致的变化规律。研究发现,野牛草酶促活性氧清除系统活性在一天内呈现节律性表达模式,且差异光周期处理下的野牛草相连克隆分株的活性氧清除系统的活性的节律性变化趋于同步。
野牛草;克隆分株;差异光周期;活性氧清除系统;同步化
地球每天围绕地轴的自转形成了环境的规律性变化。如光照、温度、湿度等都具有明显的日变化规律,而生物体对地球物理学的周期性变化,在行为和生理机能上产生有节律的反应,被称为生物钟,作为一种内源机制,生物钟在各类生物体内发挥重要功能[12]。在恒定的外界条件下,植物内源生物钟以近24h的周期振荡,使植物根据外界环境的周期性变化来协调自身的新陈代谢和生理过程,进而增强植物的适应性和生存能力[3-6]。
在植物中,生物钟调控了很多生理生态反应,并且与每天的日变化相互匹配,如碳固定、气孔开闭、蒸腾作用等,同时还参与了逆境胁迫响应、活性氧(reactive oxygen species,ROS)代谢和基因表达等过程[7-9]。而细胞基础代谢的周期性振荡与氧化还原反应的动态平衡密切相关,在细菌以及动植物的生物节律中发挥重要作用。在微生物中,ROS可以直接促进粗糙脉孢菌的生物钟功能,而在植物中,ROS与生物钟基因之间存在反馈调节机制,拟南芥1/3以上的ROS相关转录本受到生物钟的调控[1011],因而各类ROS呈现出每天的节律性振荡;相应地,约70%的拟南芥生物钟基因也受到各种逆境胁迫的调节[12]。GI(Gigantea)是拟南芥核心生物钟基因之一,在黑暗条件下,拟南芥gi突变体能够耐受超氧化物供体——百草枯胁迫,而后者是一个超氧化物供体[13]。在拟南芥的其他生物钟基因突变体,包括cca1(circadian clock associated1)、lhy(late elongated hypocotyl)、prr9(pseudo response regulator)、prr7和prr5也表现出对超氧化物敏感,同时,这些突变体中过氧化氢水平提高,而过氧化氢清除系统的活性降低[11]。也有研究发现抗坏血酸过氧化物酶基因1(APX1),以及FER3/4(Ferritins)基因在拟南芥tic(time for coffee)突变体中表达上调,这有助于对氧化还原反应的调控[14],拟南芥日长依赖型的过氧化氢酶突变体中观察到的生物钟和氧化还原反应之间的平衡关系也有力地证明了这点[15]。由此可见,活性氧代谢调控网络与生物钟系统之间互相协调,增强了植物对环境的适应能力。
光周期是影响植物生长发育的重要环境因子之一,在植物不同生境(生态区)间引种、异地移植、远缘嫁接等过程中频繁出现的低成活率或生长异常等问题,其重要原因之一也是植物内源生物钟与外界环境因子(如光周期)难以协调一致,而导致植物生长代谢紊乱,甚至死亡。野牛草[Buchloe dactyloides(Nutt.)Engelm.]是典型的匍匐茎型克隆植物,先前的研究发现,异质性水分胁迫下,野牛草相连克隆分株通过节间子实现水分[16]、光合同化物的运输与共享[17]。当野牛草相连克隆分株分别处于不同的光周期下,能否感知外界的差异光周期信号,实现内部生物学过程与外界光周期的协调一致?本试验拟以野牛草克隆分株为材料,研究差异光周期条件下野牛草的脂质过氧化作用及酶促活性氧清除系统的变化规律,以期进一步为植物生物节律调控机理提供依据。
1 材料和方法
1.1 植物材料
试验于中国林业科学研究院科研温室及林业研究所的光照培养箱中进行。野牛草幼苗来自于一粒种子萌发后产生的无性繁殖群体,保证了所用试验材料基因型完全相同。从中选取长势基本一致的相连克隆分株,移栽于装有基质(草炭土中加入适量鸡粪)的营养钵内(直径为7cm,高度为8cm),相连克隆分株分别种植于两个钵内,中间由节间子相连,在光照培养箱中培养。培养条件为:光照/黑暗为12h/12h,白天/夜晚的温度为25℃/20℃,培养箱室内光照强度约为1 100lx。每隔2d浇水50 mL/钵,保证其正常生长。预培养4周后,当相连克隆分株生长和生理状态一致时,进行差异光周期处理。
1.2 光周期处理
培养4周后的野牛草相连克隆分株进行差异光周期处理,野牛草相连克隆分株标记为O(姊株)和Y(妹株),实验设置为连接组和断开组(图1)。连接组(处理组)野牛草O分株和Y分株
通过节间子相连,O分株光周期设置为光照/黑暗=12h/12h,Y分株光周期设置为黑暗/光照=12h/12h(恰好与O分株相反);断开组(对照组)O和Y分株光周期设置相同连接组,但O和Y分株间节间子被剪断,光照培养箱的温度、湿度和光照强度同1.1。连接组和断开组样本经过7d的光周期处理后进行3d全光照条件(24h光照)稳定培养,随后在全光照条件下,于48h内每隔4h取叶片样品1次,液氮速冻后保存于-80℃备用。
1.3 酶促活性氧清除系统活性测定
1.3.1 粗酶液制备 按王爱国等[18]的方法加以改进,取植物材料0.5g(新鲜叶片)于预冷过的研钵中,加入少量石英砂在冰浴条件下研磨成粉,将粉末转移至10mL离心管,加入5mL提取液摇匀,4℃下,12 000×g离心20min,取上清液定容至5 mL后保存于4℃,即为粗酶液。用于超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性测定以及丙二醛(malondialdehyde,MDA)含量测定。提取液为50mmol·L-1(pH 7.8)的磷酸缓冲(PBS)溶液,内含1%(W/V)的聚乙烯吡咯烷酮(PVP)。
1.3.2 MDA含量测定 MDA含量测定参照Buege等[19]的方法略加改动。反应体系:取1mL粗酶液加入2mL 0.6%的硫代巴比妥酸(TBA),沸水浴15min(自试管内出现小泡开始计时),到时间后立即将试管放入冰水浴中,待试管冷却后,12 000g离心10min,取上清测定体积,以0.6%的TBA为对照测定600、532和450nm处的吸光度值A600、A532、A450,最后计算MDA含量。MDA含量(μmol/g)=(6.452×(A532-A600)-0.559×A450)×VT/(VS×FW),式中,VT为酶提取液总体积(mL);VS为测定时酶液用量(mL);FW为样品鲜重(g)。
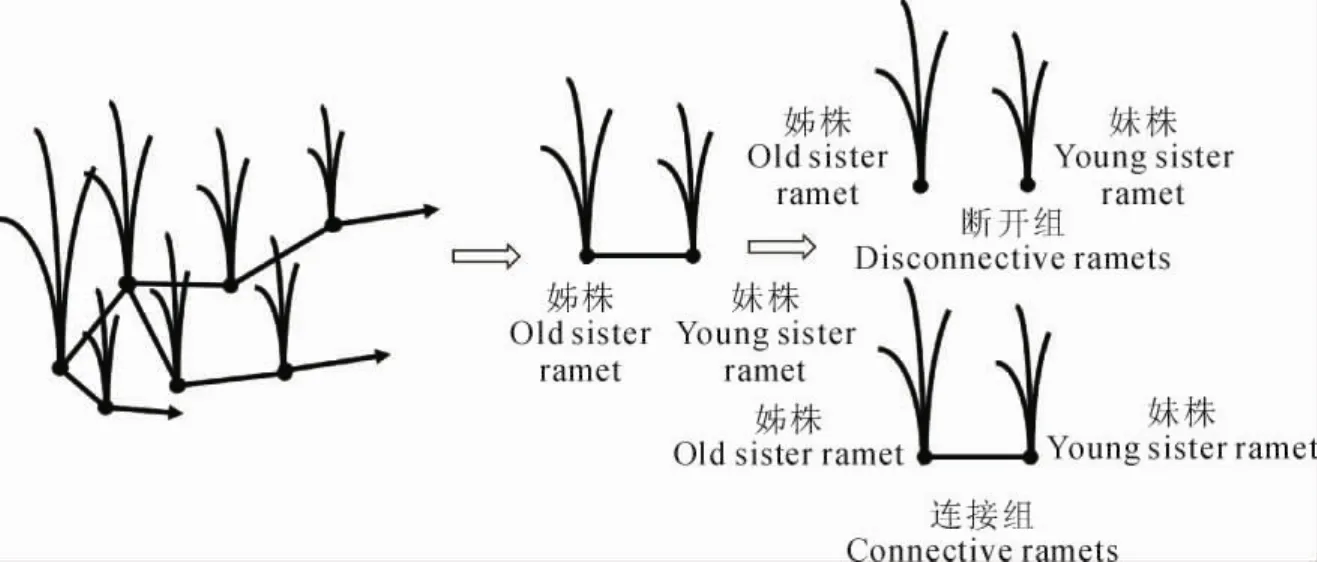
图1 野牛草差异光周期处理示意图Fig.1 Schematic diagram of buffalo grass under different photoperiod treatments
1.3.3 SOD活性测定 SOD活性测定参照Giannopolitis等[20]的方法稍加改进。反应混合液配制(以60个样为准):分别取130mmol/L甲硫氨酸(Met)溶液162mL,100μmol/L EDTA-Na2溶液0.6mL,PBS(pH 7.8)5.4mL,750μmol/L氯化硝基四氮唑蓝(NBT)溶液6mL,20μmol/L核黄素溶液6mL(用前配制,避光保存),混合后摇匀;分别取上述3mL反应混合液和30μL粗酶液于离心管中,将离心管置于4 000lx光照下反应20min;同时做两支对照管,其中1支管取3mL反应混合液加入30μL PBS(pH 7.8)不加酶液,照光后测定作为最大光还原管,另1支只加缓冲液置于暗中测定时用于调零;以不照光的对照管(只有缓冲液并置于暗处)调零后,遮光下测A560(当最大光还原管的A560约为0.9~1.1时测定)。酶活性计算:SOD活性单位以抑制NBT光化还原50%所需酶量(测的样品值要在最大管的一半左右才合适,否则要调整酶量)为1个酶活单位(U)。SOD总活性(U·g-1· min-1)=[(ACK-AS)×VT]/(1/2ACK×FW×VS)。式中,ACK为照光对照管的吸光度;AS为样品管的吸光度;VT为酶提取液总体积(mL,加入PBS的体积);VS为测定时的粗酶液用量(mL,30μL);FW为样品鲜重(g)。
1.3.4 POD活性测定 POD活性测定参照Kraus等[21]的方法略有改动。反应混合液配制(以60个样为准):取200mL PBS(0.2mol/L,pH 6.0),加入0.076mL愈创木酚(2-甲氧基酚)原液加热搅拌溶解,冷却后加入0.112mL 30%的H2O2,混匀后置冰箱中备用。取3mL反应液并加入30μL粗酶液,以PBS(pH 6.0)为对照调零,而后测定A470值(测定60s)。(边加样边测定,测定前等待5s,动作要快,如果慢的话,要保证每个样品从加好样到开始记时的时间相差不大)。酶活性计算:以A470值变化(升高)0.01为1个酶活性单位(U)。POD活性(U· g-1·min-1)=(ΔA470×Vt)/(FW×Vs×0.01× t)。式中,ΔA470为反应时间内吸光度的变化;FW为样品鲜重(g);t为反应时间(min);Vt为酶提取液总体积(mL);Vs为测定时粗酶液用量(mL)。
1.3.5 CAT活性测定 CAT活性测定参照Kraus等[21]的方法略有改动。反应液配制:取200mL PBS(0.15mol/L,pH 7.0),加0.309 2mL 30%的H2O2(原液)摇匀。取3mL反应液加0.1mL(可视情况调整)粗酶液,以PBS为对照调零,测定吸光度A240(紫外)值(测定60s)。酶活性计算:以A240值减少0.01为1个酶活性单位(U)。CAT活性(U· g-1·min-1)=(ΔA240×VT)/(FW×VS×0.01× t)。式中,ΔA240为反应时间内吸光度的变化;FW为样品鲜重(g);t为反应时间(min);VT为酶提取液总体积(mL);VS为测定时粗酶液用量(mL)。
1.3.6 APX活性测定 APX活性测定参照Dal-ton等[22]的方法略有改动。取3mL反应液(含0.05mol/L PBS(pH 7.0),0.1mmol/L EDTA,0.5mmol/L ASA)加入80μL粗酶液。1号比色皿中不加抗坏血酸(ASA)和H2O2作为参照,2号比色皿中不加H2O2作为控制参照,3号比色皿中加入0.1mmol/L H2O2启动反应,每10s连续记录室温下290nm吸光值的变化ΔA290。以室温下氧化1 μmol ASA的酶量作为一个酶活性单位(U)。计算APX活性(μmol·g-1·min-1)=(ΔA290×VT× VR×1 000)/(FW×2.8×VS×t)。式中,ΔA290为反应时间内吸光度值的变化;VT为酶提取液总体积(mL);VR为反应液体积(mL);1 000为将mmol/L转换成μmol/L的系数;FW为样品鲜重(g);2.8为消光系数(mmol·L-1·cm-1);VS为测定时粗酶液用量(mL);t为反应时间(min)。
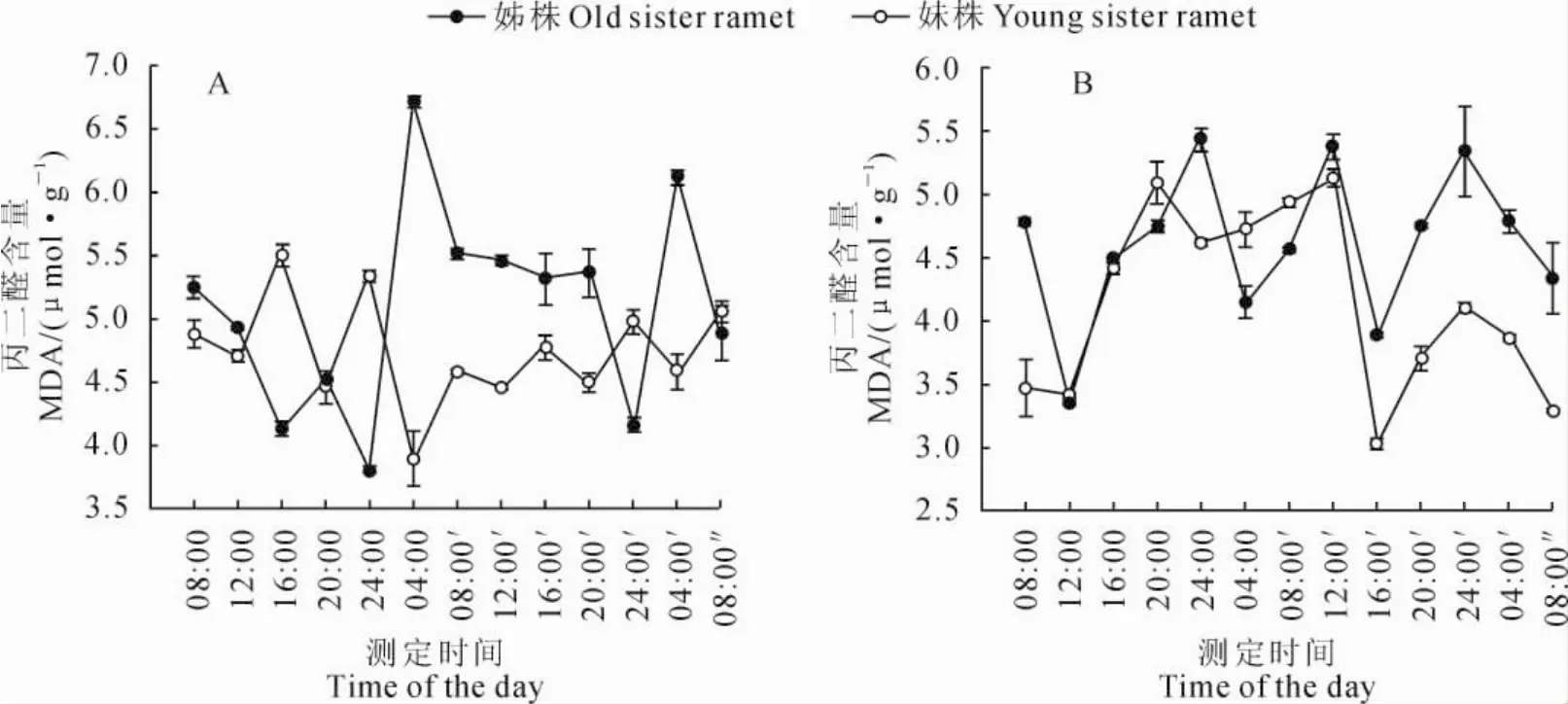
图2 差异光周期处理后断开组(A)和连接组(B)野牛草克隆分株MDA含量的日变化图中数据为差异光周期处理7d后进行全光照稳定培养72h,并于全光照下连续48h测定的指标;下同Fig.2 Diurnal changes on MDA content in disconnective ramets(A)and connective ramets(B)of buffalo grass under different photoperiod treatments The data of MDA content which was continuous measured 48hillumination after cultivation of 7ddifferent photoperiod treatments and 72hstable illumination conditions.The same as below.
2 结果与分析
2.1 差异光周期处理对野牛草克隆分株MDA含量的影响
在断开组(图2,A)中,野牛草经过1周的正置光周期(光照/黑暗=12h/12h)处理后,O分株中MDA含量在24h内呈现近余弦的波形,并在测定第1天4:00和测定第2天4:00时达到波峰,分别为6.715和6.117μmol/g;而经过1周的倒置光周期(黑暗/光照=12h/12h)处理后,Y分株中MDA含量整体的变化趋势与O分株相反,24h内基本上呈现近正弦的波形,并在测定第1天4:00和测定第2天4:00时达到波谷,分别为3.893和4.577 μmol/g。在连接组中(图2,B),相连克隆分株分别经过相反的光周期处理后(即O分株处于正置光周期,Y分株处于反置光周期),O分株MDA含量变化呈现近余弦的波形,并在测定第1天24:00、测定第2天12:00和24:00时达到波峰,分别为5.431、5.377和5.341μmol/g,而Y分株MDA含量在24 h内的整体变化与O分株趋于基本一致,并在测定第1天24:00、测定第2天12:00和24:00时达到波峰,分别为5.090、5.129和4.105μmol/g。这说明野牛草克隆分株内的MDA含量在日变化周期内呈现节律性变化,断开分株间由于光周期完全相反,其MDA含量变化也基本处于相反的变化规律,而相连克隆分株通过节间子相连,分株之间存在着物质的交流和信号的传递,在完全相反的光周期处理条件下,由于克隆植物的生理整合特性,使得MDA含量的节律性变化趋于一致。
2.2 差异光周期处理对野牛草克隆分株SOD活性的影响
在断开组(图3,A)中,经过1周的正置光周期处理后,O分株中SOD活性在24h内的变化基本符合近正弦的波形,并在测定第1天24:00、测定第3天8:00时达到波峰,分别为355.253和277.995 U·g-1·min-1,而经过1周的倒置光周期处理后,Y分株中SOD活性在48h内的整体变化趋势与O分株基本相反,符合近余弦的波形,并在测定第1天24:00、测定第3天8:00时达到波谷,分别为225.991和246.811U·g-1·min-1;而在连接组中(图3,B),相连克隆分株分别经过相反的光周期处理后,O分株中SOD活性在24h内的变化基本属于近正弦的波形,并在测定第1天20:00、测定第2天20:00时达到波峰,分别为393.378和348.973 U·g-1·min-1,Y分株SOD活性在24h内的整体变化趋于与O分株基本一致,并在测定第1天20:00、测定第2天8:00和20:00时达到波峰,分别为394.119、317.917和305.196U·g-1·min-1。这说明野牛草克隆分株内的SOD活性在日变化周期内呈现一定的节律性变化,且相连克隆分株之间存在着物质的共享和信号的传递,使得处于相反光周期处理条件下的两分株在差异光信号因子作用下,克隆分株的酶促活性氧清除系统中的SOD活性的节律性变化也趋于一致。
2.3 差异光周期处理对野牛草克隆分株POD活性的影响

图3 差异光周期处理断开组(A)和连接组(B)野牛草克隆分株SOD活性的日变化Fig.3 Diurnal changes on SOD activity in disconnective ramets(A)and connective ramets(B)of buffalo grass under different photoperiod treatments
在断开组中(图4,A),经过1周的正置光周期处理后,O分株中POD活性在24h内的变化呈现“M形”的波形,并在测定第1天16:00和24:00、测定第2天20:00和04:00时达到波峰,分别为6 239.219、7 347.397、5 971.764和6 294.940U· g-1·min-1;同时,而经过1周的倒置光周期处理后,Y分株中POD活性在24h内的整体变化趋势也是呈现“M形”的波形,但变化轨迹与O分株基本相反,即当O分株中POD活性位于波峰时,Y分株中POD的活性基本降为最低值,并分别在测定第1天16:00、测定第2天4:00和20:00,以及测定第3天4:00时达到波谷,分别为3 216.643、4 575.685、2 516.720和1 510.163U·g-1·min-1。而在连接组中(图4,B),相连克隆分株分别经过相反的光周期处理后,O分株POD的活性在24h内的变化呈现“倒V”的波形,并在测定第1天4:00、测定第2天16:00时达到波峰,分别为6 524.908和6 617.583U·g-1·min-1,Y分株POD活性在24 h内的整体变化趋于与O分株基本一致,并在测定第1天4:00、测定第2天16:00时达到波峰,分别为5 558.562和6 102.131U·g-1·min-1。这说明野牛草克隆分株在差异光信号因子作用下,植株内部酶促活性氧清除系统中的POD活性呈现节律性变化,且相连分株间的节律性变化规律趋于一致,推测是由于克隆分株间的生理整合作用。
2.4 差异光周期处理对野牛草克隆分株CAT活性的影响

图4 差异光周期处理断开组(A)和连接组(B)野牛草克隆分株POD活性的日变化Fig.4 Diurnal changes on POD activity in disconnective ramets(A)and connective ramets(B)of buffalo grass under different photoperiod treatments

图5 差异光周期处理后野牛断开组(A)和连接组(B)草克隆分株CAT活性的日变化Fig.5 Diurnal changes on CAT activity in disconnective ramets(A)and connective ramets(B)of buffalo grass under different photoperiod treatments
在断开组中(图5,A),经过1周的正置光周期处理后,野牛草O分株中CAT活性在24h内的变化变化呈现近余弦曲线的波形,并在测定第1天8:00、测定第2天4:00和12:00,以及第3天4:00时达到波峰,分别为94.392、103.823、90.041和74.074U·g-1·min-1;而经过1周的倒置光周期处理后,Y分株中CAT活性在24h内的变化趋势呈现近正弦曲线的波形,变化轨迹与O分株完全相反,并在测定第1天8:00、测定第2天4:00和12:00,以及第3天8:00时达到波谷,分别为31.208、49.730、14.276和36.752U·g-1· min-1。在连接组中(图5,B),相连克隆分株分别经过相反的光周期处理后,O分株CAT活性在24h内的变化呈现“M形”的波形,并在测定第1天20:00、测定第2天4:00和16:00,以及测定第3天4:00时达到波峰,分别为150.067、122.410、90.880和106.088U·g-1·min-1,Y分株CAT活性在24 h内的整体变化趋势与O分株基本一致,并在测定第1天20:00、测定第2天4:00和16:00,以及测定第3天4:00时达到波峰,分别为133.729、135.732、71.509和94.242U·g-1·min-1。说明断开分株间彼此独立,在相反的光周期处理下,酶促活性氧清除系统中的CAT活性的变化也基本处于相反的状态,并在两个日变化周期内呈现一定的节律性,而相连分株间由于存在着物质和能量的传递与共享,在差异光信号因子作用下,克隆分株的酶促活性氧清除系统中CAT活性的节律性变化也趋于一致。
2.5 差异光周期处理对野牛草克隆分株APX活性的影响
在断开组中(图6,A),经过1周的正置光周期处理后,野牛草O分株中APX活性在24h内的变化呈现近余弦曲线的波形,并在测定第1天24:00和测定第2天12:00时达到波峰,分别为1 142.645和1 168.216μmol·g-1·min-1,而经过1周的倒置光周期(黑暗/光照=12h/12h)处理后,Y分株中APX活性在24h内的整体变化趋势则是呈现近正弦曲线的波形,变化规律与O分株完全相反,并在测定第1天24:00、测定第2天12:00和24:00时达到波谷,分别为478.762、305.919和560.734 μmol·g-1·min-1;在连接组中(图6,B),相连克隆分株分别经过相反的光周期处理后,O分株APX活性在24h内的变化呈现“W”形的波形,并在测定第1天12:00、20:00和测定第2天8:00时达到波峰,分别为2 112.895、2 306.622和1 388.289μmol· g-1·min-1,而同期Y分株APX活性在24h内的整体变化趋势与O分株基本一致,并分别在测定第1天20:00,测定第2天4:00和16:00时达到波峰,分别为1 492.513、1 454.275和1 015.177μmol· g-1·min-1。这说明断开分株在相反的光周期处理下,APX活性的变化也基本处于相反的状态,并在两个日变化周期内呈现一定的节律性,而相连分株间由于生理整合作用,在差异光信号因子作用下,克隆分株的酶促活性氧清除系统中的APX活性也趋于一致。
以上结果说明,野牛草分株在断开和连接两种处理条件下,植株酶促活性氧清除系统的活性在一天内呈现节律性变化,且差异光周期处理下的野牛草相连克隆分株的活性氧清除系统的活性的节律性变化趋于同步。
3 讨 论

图6 差异光周期处理断开组(A)和连接组(B)野牛草克隆分株APX活性的日变化Fig.6 Diurnal changes on APX activity in disconnective ramets(A)and connective ramets(B)of buffalo grass under different photoperiod treatments
植物体内许多反应都能够产生活性氧:如质外体(特别是叶绿体和线粒体)中的电子传递链,过氧化物酶体及质膜上的氧化酶和过氧化物酶等[23-25]。活性氧(ROS)的增加以及与氧化还原组分之间的互作可以完成信号的传递[26-28],诱导体内其它信号的级联反应,启动植物体内复杂的活性氧清除系统网络进行调控[24]。本研究通过对野牛草设置差异光周期处理,分析了断开和连接两种状态下的相连克隆分株生理代谢的变化,发现分株MDA的含量及酶促活性氧清除系统(SOD、POD、CAT、APX)的活性在一天内呈现周期振荡的节律变化,并具有一定消长规律。其一,野牛草克隆分株SOD、POD、CAT和APX的活性增强时,MDA的含量呈现下降趋势,总体上此消彼长,呈负相关。前人研究证实,MDA含量的高低在一定程度上能反映脂膜过氧化水平和膜结构的受害程度及植物的自我修复能力,而当植物受到逆境胁迫时,植物体内活性氧的清除能力有所下降,本研究结果与之一致。其二,野牛草克隆分株在断开的状态下,当O分株和Y分株处于相反的光周期条件(即O分株处于正置光周期,而Y分株处于反置光周期)时,叶片中SOD、POD、CAT和APX的活性和MDA的含量的变化轨迹在两者之间基本上是相反的。因为Y分株在预培养的基础上,将光周期完全倒置,在这种逆境条件下,植物体内的活性氧既对细胞造成毒害作用,同时还作为防御化学信号分子,诱导体内其它信号的级联反应,启动植物体内抗氧化系统[24],植物体内的SOD、CAT、POD等活性氧清除系统活性增加,协调清除活性氧自由基,减轻植物受到的伤害[29-30],进而提高植物的适应力。其三,野牛草克隆分株在连接的状态下,当O分株和Y分株处于相反的光周期条件下时,两者叶片中SOD、POD、CAT和APX的活性和MDA的含量的变化趋于一致,并倾向于O分株的变化轨迹,这点再次证明了克隆植物可以通过分株之间节间子的连接,发生生理上的整合作用[31],不仅能实现物质或资源(如光合产物、水分和养分等)在克隆分株之间的运输与分享[32],同时发生分株间的信号转导,使其在恶劣环境中具备较强的适应能力和生存竞争能力[33]。其四,野牛草叶片中SOD、POD、CAT和APX的活性与MDA的含量的变化规律并不依赖于光照条件,如在相连分株断开条件下,O分株叶片中MDA含量在4:00、SOD活性在24:00、POD活性在24:00和4:00′、CAT活性在4:00和04:00′、APX活性在24:00都处于最大值;而野牛草相连分株在连接状态下,O分株叶片中MDA含量在24:00和24:00′、POD活性在4:00、CAT活性在4:00和4:00′、APX活性在4:00,以及Y分株中SOD活性在4:00′时都处于最大值。植物酶促活性氧清除系统在光保护中虽然功能各异,但发挥作用时互相配合,使得光合器官活性氧代谢能够保持一定的动态平衡,从而避免活性氧伤害[34]。O株在与外部自然昼夜节律环境相近或同步,表现出更强的生长适应性。Y株虽经完全相反的节律同步化处理,但与外部自然环境客观上存在失同步,为提高其适应性,两相连分株基于生理整合机制实现生长及生理代谢的同步化,且倾向于O株。
总之,野牛草酶促活性氧清除系统活性在一天内并非维持在一个恒定的水平,而是呈现节律性变化规律;同时,野牛草活性氧清除系统不仅减缓了活性氧产生速率及其对细胞膜的氧化伤害,而且在差异光周期下相连克隆分株间的活性氧清除系统活性趋于同步,有效地分摊了胁迫风险,提高野牛草在逆境下的适应能力。
[1] BELL-PEDERSEN D,CASSONE VM,EARNEST DJ,et al.Circadian rhythms from multiple oscillators:lessons from diverse organisms[J].Nature Reviews Genetics,2005,6(7):544-556.
[2] WIJNEN H,YOUNG M W.Interplay of circadian clocks and metabolic rhythms[J].Annu.Rev.Genet.,2006,40:409-448.
[3] OUYANG Y,ANDERSSON CR,KONDO T,et al.Resonating circadian clocks enhance fitness in cyanobacteria[J].Proceedings of the National Academy of Sciences,1998,95(15):8 660-8 664.
[4] GREEN R M,TINGAY S,WANG Z Y,et al.Circadian rhythms confer a higher level of fitness to Arabidopsis plants[J].Plant Physiol.,2002,129(2):576-584.
[5] DODD A N,SALATHIA N,HALL A,et al.Plant circadian clocks increase photosynthesis,growth,survival,and competitive advantage[J].Science,2005,309(5 734):630-633.
[6] ZOLTOWSKI B D,SCHWERDTFEGER C,WIDOM J,et al.Conformational switching in the fungal light sensor Vivid[J].Science,2007,316(5 827):1 054-1 057.
[7] MCCLUNG C R.Comes a time[J].Curr.Opin.Plant Biol.,2008,11(5):514-520.
[8] WENDEN B,KOZMA-BOGNAR L,EDWARDS K D,et al.Light inputs shape the Arabidopsis circadian system[J].Plant J.,2011,66(3):480-491.
[9] YAKIR E,HILMAN D,HARIR Y,et al.Regulation of output from the plant circadian clock[J].FEBS J,2007,274(2):335-345.
[10] COVINGTON M F,MALOOF J N,STRAUME M,et al.Global transcriptome analysis reveals circadian regulation of key pathways in plant growth and development[J].Genome Biol.,2008,9(8):R130.
[11] LAI A G,DOHERTY C J,MUELLER-ROEBER B,et al.CIRCADIAN CLOCK-ASSOCIATED 1regulates ROS homeostasis and oxidative stress responses[J].Proceedings of the National Academy of Sciences,2012,109(42):17 129-17 134.
[12] KREPS J A,WU Y,CHANG H S,et al.Transcriptome changes for Arabidopsis in response to salt,osmotic,and cold stress[J].Plant Physiol,2002,130(4):2 129-2 141.
[13] KUREPA J,SMALLE J,VA M,et al.Oxidative stress tolerance and longevity in Arabidopsis:the late-flowering mutant gigantea is tolerant to paraquat[J].The Plant Journal,1998,14(6):759-764.
[14] DUC C,CELLIER F,LOBREAUX S,et al.Regulation of iron homeostasis in Arabidopsis thaliana by the clock regulator time for coffee[J].Journal of Biological Chemistry,2009,284(52):36 271-36 281.
[15] QUEVAL G,ISSAKIDIS-BOURGUET E,HOEBERICHTS FA,et al.Conditional oxidative stress responses in the Arabidopsis photorespiratory mutant cat2demonstrate that redox state is a key modulator of daylength-dependent gene expression,and define photoperiod as a crucial factor in the regulation of H2O2-induced cell death[J].Plant Journal,2007,52(4):640-657.
[16] QIAN Y,LI D,HAN L,et al.Inter-ramet physiological integration detected in buffalo grass(Buchloe dactyloides(Nutt.)Engelm.)under water stress[J].Weed &Turfgrass Science,2009,23(2):331-343.
[17] QIAN Y,LI D,HAN L,et al.Inter-ramet photosynthate translocation in buffalo grass under differential water deficit stress[J].Journal of the American Society for Horticultural Science,2010,135(4):310-316.
[18] WANG A G(王爱国),LUO G H(罗广华).Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants[J].Plant Physiology Communications(植物生理学通讯),1990,26(6):55-57.
[19] BUEGE J A.Microsomal lipid peroxidation[J].Methods Enzymol.,1978,52:302-310
[20] GIANNOPOLITIS CN,RIES SK.Superoxide dismutases I.Occurrence in higher plants[J].Plant Physiol.,1977,59(2):309-314.
[21] KRAUS T E,FLETCHER R A.Paclobutrazol protects wheat seedlings from heat and paraquat injury.Is detoxification of active oxygen involved?[J].Plant and Cell Physiology,1994,35(1):45-52.
[22] DALTON D A,HANUS F J,RUSSELL S A,et al.Purification,properties,and distribution of ascorbate peroxidase in legume root nodules[J].Plant Physiol.,1987,83(4):789-794.
[23] BINDSHEDLER L V,DEWDNEY J,BLEE K A,et al.Peroxidase-dependent apoplastic oxidative burst in Arabidopsis required for pathogen resistance[J].The Plant Journal,2006,47(6):851-863.
[24] MITTLER R,VANDERAUWERA S,GOLLERY M,et al.Reactive oxygen gene network of plants[J].Trends.Plant Sci.,2004,9(10):490-498.
[25] SAGI M,FLUHR R.Production of reactive oxygen species by plant NADPH oxidases[J].Plant Physiol.,2006,141(2):336-340.
[26] APEL K,HIRT H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annu.Rev.Plant Biol.,2004,55:373-399.
[27] FOYER CH,LOPEZ-DELGADO H,et al.Hydrogen peroxide and glutathione-associated mechanisms of acclimatory stress tolerance and signalling[J].Physiologia Plantarum,1997,100(2):241-254.
[28] LAMB C,DIXON R A.The oxidative burst in plant disease resistance[J].Annu.Rev.Plant Biol.,1997,48(1):251-275.
[29] YORDANOVA R Y,CHRISTOV K N,POPOVA L P.Antioxidative enzymes in barley plants subjected to soil flooding[J].Environmental and Experimental Botany,2004,51(2):93-101.
[30] YAN B,DAI Q,LIU X,et al.Flooding-induced membrane damage,lipid oxidation and activated oxygen generation in corn leaves[J].Plant and Soil,1996,179(2):261-268.
[31] MARSHALL C,SAGAR G.The distribution of assimilates in Lolium multiflorumLam.following differential defoliation[J].Annals of Botany,1968,32(4):715-719.
[32] MARSHALL C.Source-sink relations of interconnected ramets[J].Clonal Growth in Plants:Regulation and Function,1990:23-41.
[33] CHEN SH(陈 尚),LI Z ZH(李自珍),WANG G(王 刚).Advances in research of growth form of the clonal plant[J].Chinese Journal of Ecology(生态学杂志),1997,16(4):59-63.
[34] MARUTA T,TANOUCHI A,TAMOI M,et al.Arabidopsis chloroplastic ascorbate peroxidase isoenzymes play a dual role in photoprotection and gene regulation under photooxidative stress[J].Plant and Cell Physiology,2010,51(2):190-200.
(编辑:裴阿卫)
The Response of Enzymatic Active Oxygen Scavenging System in Leaves of Buchloe dactyloides to Differences Photoperiod
LI Wei1,2,QIAN Yongqiang1,HAN Lei1,LIU Junxiang1,SUN Zhenyuan1,*
(1Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration,Research Institute of Forestry,CAF,Beijing 100091;2College of Landscape Architecture and Forestry,Qingdao Agricultural University,Qingdao,Shandong 266109,China)
We used Buchloe dactyloides.ramets as materials to research physiological metabolic response of B.dactyloides.leaves active oxygen scavenging system to differences photoperiod response.Clonal ramets were labeled as O(old sister ramet)and Y(young sister ramet),then we set connective group and disconnected group.O ramet and Y ramet were connected through the internode in connective group,whereas the internodes were cut off in disconnected group;the light cycle of O ramet was set for light 12h/dark 12hin both two groups,instead,light cycle of Y ramet was set for 12hdarkness/12hlight(just opposite to O ramet).And the activities of superoxide dismutase(SOD),peroxidase(POD),catalase(CAT),ascorbate peroxidase(APX),and malondialdehyde(MDA)content of ramet leaves were continuous measured 48hillumination after cultivation of 7ddifferences photoperiod treatment and 72hstable illumination condi-tions.The results showed that after one weeks of different photoperiod treatments,under continuous light conditions,SOD,POD,CAT,APX activities and MDA content in disconnected ramets of B.dactyloides.leaves basically showed the opposite variation trend within 24h.However,SOD,POD,CAT,APX activities and MDA content in connected ramets of B.dactyloides.leaves presented convergence of variation trend within 24h.It indicated that reactive oxygen species scavenging system of B.dactyloides.showed rhythmic expression patterns,and B.dactyloides.connected ramets reactive oxygen species scavenging system tends to be synchronized under different photoperiod treatments.
Buchloe dactyloides(Nutt.)Engelm.ramets;photoperiod;reactive oxygen species scavenging system;synchronization
Q945.78
A
1000-4025(2015)07-1428-09
10.7606/j.issn.1000-4025.2015.07.1428
2014-04-28;修改稿收到日期:2015-05-28
国家自然科学基金(31100505);中国林业科学研究院基金(CAFYBB2012043);中央级公益性科研院所基本科研业务费专项(RIF2014-03)
李伟(1985-),博士,主要研究方向为植物分子育种。E-mail:lwcsu_caf@163.com
*通信作者:孙振元,博士,研究员,主要研究方向为园林植物生理生态。E-mail:sunzy@263.net

