采前壳寡糖处理对杏果实黑斑病的抗性诱导
赵亚婷,刘豆豆,朱 璇,侯媛媛
(新疆农业大学食品科学与药学学院,乌鲁木齐830052)
采前壳寡糖处理对杏果实黑斑病的抗性诱导
赵亚婷,刘豆豆,朱 璇*,侯媛媛
(新疆农业大学食品科学与药学学院,乌鲁木齐830052)
以新疆赛买提杏为试验材料,分别在果实坐果期、膨大期、转色期及采收前48h,采用分子量为5 000、浓度为0.05%的壳寡糖(GOS)溶液对杏果实进行喷施处理,以喷施清水为对照(CK);采收后的杏果实在机械损伤接种链格孢菌后置于4℃、相对湿度90%~95%的条件下贮藏,定期统计接种链格孢菌杏果实的病斑直径和发病率,测定抗病相关酶苯丙氨酸解氨酶(PAL)、β-1,3-葡聚糖酶(GLU)和几丁质酶(CHT)的活性及木质素、富含羟脯氨酸糖蛋白(HRGP)的含量,探讨采前壳寡糖处理对杏果实黑斑病的抗性诱导及其生理机制。结果显示,贮藏结束时,采前壳寡糖处理的果实发病率与病斑直径分别比对照显著降低了16.37%和17.57%。随着贮藏期间的延长,壳寡糖处理杏果实PAL、GLU、CHT的活性和木质素、HRGP的含量均表现出先上升后下降的变化趋势,且始终显著高于同期对照,并分别在接种后第21、28、21、28和14天达到峰值,峰值比同期对照分别显著提高12.17%、78.22%、31.41%、34.81%和77.44%。研究表明,采前壳寡糖处理能通过诱导提高杏果实病程相关蛋白及细胞壁HRGP和木质素的含量来增强杏果实对黑斑病的抗性。
壳寡糖(GOS);杏;病程相关蛋白;黑斑病;细胞壁物质
新疆杏品种多样,果实肉质柔软、多汁,品质极佳,深受广大消费者的喜爱。但杏采收时正处于6、7月份的高温季节,后熟过程迅速,加之果实皮薄对机械损伤敏感,易受病原微生物的侵染,造成贮运过程中严重的腐烂损失。其中链格孢(Alternaria alternata)引起的黑斑病是杏果实采后的主要病害[1]。目前对杏果实采后病害的防治主要采用化学杀菌剂,但随着人们对食品安全和环保的重视,化学杀菌剂的应用日益受到限制,因此需要寻求新的安全高效的防腐方法,以逐步取代和减少化学杀菌剂的使用。近年来,采用生物和非生物诱导因子处理采后果蔬产品,以提高其抗病免疫能力,实现对果蔬采后病害的控制已经成为果蔬采后病害防治研究的热点[2]。
壳寡糖(chitosan oligosaccharide,COS)是由壳聚糖降解而获得的2~10个氨基葡萄糖通过β-1,4-糖苷键连接而成的水溶性低聚糖[3]。壳寡糖作为一种功能性低聚糖外源激发子,具有诱导植物抗逆防御反应的生物功能,包括抑制真菌生长,增强多种防御酶系活性、植保素合成与积累、木质化作用等活性。国内外学者对壳寡糖控制果蔬采后贮藏病害的相关研究发现,适当浓度的壳寡糖浸泡处理可以有效诱导采后柑橘[4]、番茄[5]等果实产生抗病性,从而减轻采后病害的发生。
然而,已有的报道大多集中于采后处理与果实抗病的关系方面,有关采前壳寡糖处理提高杏果实采后抗病性的研究还很少。因此,本试验分析了采前壳寡糖处理对杏果实苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)、β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)和几丁质酶(chitinase,CHT)活性变化的影响,并探讨了壳寡糖对细胞壁物质富含羟脯氨酸糖蛋白(hydroproline-rich glycoprotein,HRGP)和木质素的诱导作用,以期为壳寡糖在杏果实抗病防腐上的开发与利用提供参考。
1 材料和方法
1.1 原料和菌种
实验材料为赛买提杏,产自新疆库车县乌恰镇杏果园。链格孢菌由新疆农业大学采后生理研究室提供。
1.2 试验处理方法
1.2.1 壳寡糖处理 采前处理于库车县乌恰镇进行。选择光照、通风、生长势一致的杏树,采用单株随机组合设计。共2个处理,每个处理5棵树,各重复3次,做好标记。均采用0.05%COS溶液(在预实验的基础上,筛选出采前COS对杏果实病害控制最佳的作用浓度为0.05%)分别在杏果实的坐果期、膨大期、转色期及采收前48h进行喷施,以喷施清水为对照(CK)。每个处理喷施20kg,以树叶和果实全部喷湿为度。选择硬度在1.6~1.8kg/cm2之间,可溶性固形物含量在12%~13%之间的杏果实采摘,果实采收后12h内运回新疆农业大学果蔬采后生理研究室,剔除伤、病果,选择大小、果色均匀、成熟度相近的杏果实置于4℃、相对湿度为90%~95%的冷库中贮藏。贮藏期间,每隔7d取1次样测定发病率、病斑直径(每处理用果20个,重复3次)及相关酶活性、细胞壁物质指标(每处理用果10个,重复3次)。
1.2.2 孢子悬浮液的配制 参照Bi等[6]方法并修改。取生长7d的链格孢菌培养皿,用胶头滴管加入10mL含有0.05%Tween-20的无菌水,用接种环轻轻刮下PDA平板上的链格孢菌孢子,然后倒入50mL三角瓶中,将孢子悬浮液在微型旋涡混合器上振荡15s,以混合均匀,之后再用双层纱布过滤。过滤后的孢子悬浮液用血球计数板记数并调节,使滤液中链格孢菌的浓度达到每亳升1×106个细胞。
1.2.3 损伤接种链格孢菌 取采前COS处理和对照的杏果实,先用70%酒精擦洗杏果实表面以进行消毒,再用经过灭菌的铁钉在杏果实中部刺孔1个(直径3mm、深度3mm),向刺孔内注入15μL的孢子悬浮液,随后用胶带在注射孔的上方贴封,防止其它微生物的进入和保持局部湿度,以利于病原菌的生长。接种完成后,将果实有孔的一面向上放置,整齐地置于塑料筐内,放置于4℃、相对湿度为90%~95%的冷库中贮藏。
1.3 测定指标及方法
1.3.1 果实接种发病率及病斑直径 利用十字交叉法测量病斑直径,当注射孔菌斑直径大于3mm时可判断为接种发病果实。果实接种发病率计算公式如下:

1.3.2 抗病相关酶活性 (1)苯丙氨酸解氨酶(PAL)活性:参照曹建康等[7]方法,以单位时间每克新鲜果实组织中吸光度值增加0.01时为1个PAL活性单位(U),U=0.01△OD290·h-1·g-1。(2)几丁质酶活性(CHT):参照曹建康等[7]方法测,以单位时间内每克鲜重样品中酶分解几丁质产生1× 10-9mol N-乙酰葡萄糖胺为一个几丁质酶活性单位(U),U=1×10-9mol·s-1·g-1。(3)β-1,3葡聚糖酶(GLU)活性:参照曹建康等[7]方法测定,一个β-1,3-葡聚糖酶活性单位(U)是以每秒钟每克新鲜组织里酶分解产生1×10-9mol葡萄糖来表示,U=1×10-9mol·s-1·g-1。
1.3.3 羟脯氨酸糖蛋白(HRGP)和木质素含量
羟脯氨酸糖蛋白(HRGP)参照李建华等[8]方法测定。HRGP含量以μg/mg表示。木质素含量用碘量法进行测定,参照骆桂芬[9]的方法,略有改动。木质素的含量计算公式如下:

式中,K为Na2S2SO4的浓度;DW为样品干重;a为滴定对照液所用Na2S2SO4体积(mL);b为滴定样品液所用Na2S2NO4体积(mL)。
1.4 数据处理
试验数据采用IBM SPSS Statistics 20分析软件进行分析,并利用最小显著极差(LSD)进行平均数显著性检验。
2 结果与分析
2.1 采前COS处理对损伤接种链格孢杏果实发病率及病斑直径的影响
采前COS处理对采收后损伤接种链格孢杏果发病率的影响见图1,A。其中,整个贮藏期间,COS处理和CK组杏果实接种发病率均呈现不断上升的趋势,但COS处理组杏果实接种发病率始终显著低于CK组;在接种的第14天,CK组杏果实已开始发病,而COS处理组未见发病;在接种的第28天,对照组发病率为64.72%,而COS处理组则为31.16%,不及对照组的1/2;贮藏结束时,COS处理的果实发病率仅为CK的83.63%,较对照降低了16.37%(P<0.05)。同样,由图1,B可知,杏果实经损伤接种后,病斑直径随着贮藏时间的延长迅速增大,但COS处理有效控制了果实病斑直径的扩展,COS处理组果实病斑直径始终显著小于CK组;接种后第28天和35天时病斑直径分别比对照显著低21.23%和17.57%(P<0.05)。说明采前壳寡糖处理可以显著降低杏果实接种发病率和抑制病斑直径的增大,减轻病害的发生。
2.2 采前COS处理对接种杏果实抗病相关酶活性的影响
几丁质酶(CHT)和β-1,3葡聚糖酶活性(GLU)是两类重要的病程相关蛋白,能直接水解绝大多数真菌细胞壁的主要成分,在寄主抵御病原菌侵染过程中起着重要作用。由图2,A可知,COS处理组杏果实CHT活性始终高于对照,并呈现先升高后下降的趋势。在贮藏的第21天,两组的CHT均达到峰值,COS处理组果实的CHT活性为13.18U,比对照组高31.41%(P<0.05);贮藏结束时,COS处理CHT活性仍显著高于对照。同时,整个贮藏过程中COS处理组杏果实GLU活性呈波动上升趋势,而对照组变化则不明显(图2,B)。采收时,COS处理组比对照组高44.12%(P<0.01);在贮藏的第28天,COS处理GLU活性为129 828U,比对照的72 363U高78.22%(P<0.05)。
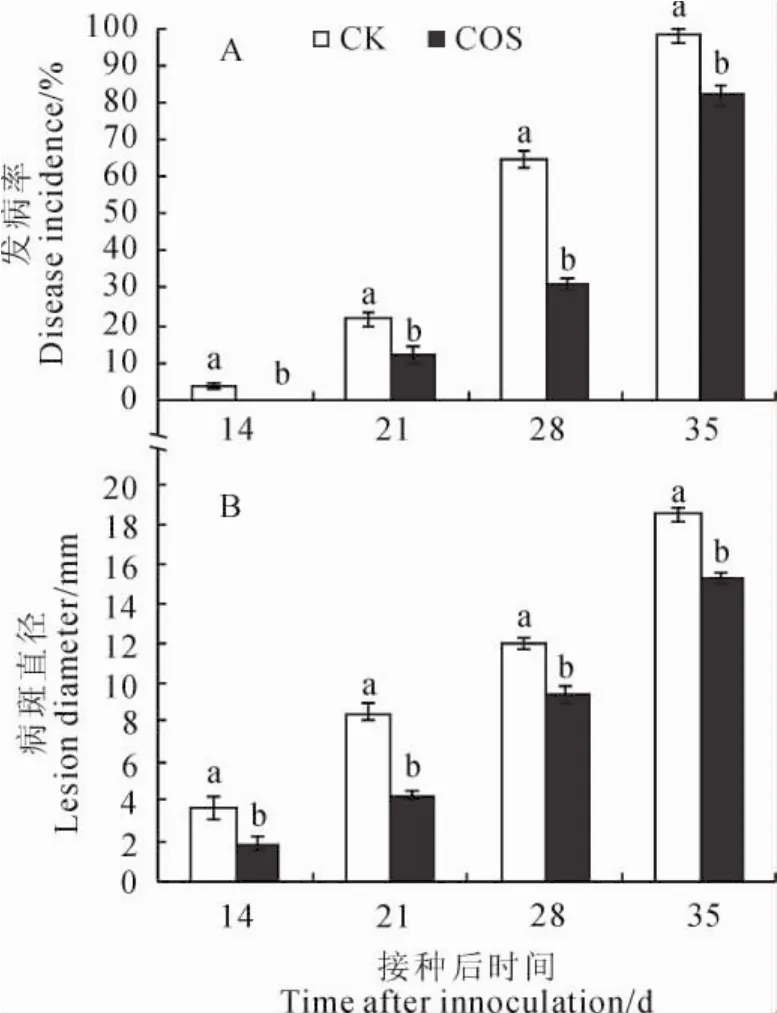
图1 采前COS处理对损伤接种链格孢杏果实发病率和病斑直径的影响CK.对照(蒸馏水);COS.0.05%壳寡糖处理;同期不同字母表示处理间在0.05水平上存在显著性差异;下同Fig.1 Effects of pre-harvest COS treatment on the inoculation incidence and lesion diameter in apricot fruits inoculated with A.alternata.CK.Control(water);COS.Treated with chitosan 0.05%;Different letters indicate the significant difference among treatments during the same time at 0.05level;The same as below.
另外,PAL是苯丙烷代谢途径的关键酶,其活性的高低与植物抗病性的强弱密切相关,被认为是植物最主要的防御酶之一。如图2,C所示,杏果实在贮藏期间CK组和COS处理组PAL活性均呈先上升后下降的趋势,并均在第21天达到峰值,只是CK组上升不明显,幅度较小。采收时,COS处理组PAL活性为138.70U,比对照组高10.25%;贮藏第21天,COS处理组PAL活性达到最大值(153.91U),比对照组高12.17%(P<0.05),随后缓慢下降;贮藏第35天,寡糖处理组PAL活性为146.10U,比对照(130.65U)高11.87%(P<0.05)。以上结果说明,采前COS处理对接种杏果实的CHT和CLU活性有诱导提升作用,同时显著提高了杏果实PAL活性。
2.3 采前COS处理对接种杏果实HGRP含量和木质素含量的影响
在采收时和整个贮藏期间COS处理组和对照组杏果实的HRGP含量变化趋势一致,均呈先上升后下降趋势,但COS处理组始终比对照组高(图3,A)。采收时,COS处理组和CK组杏果实HRGP含量分别为0.57和0.43μg/mg,比对照组高32.56%(P<0.05);贮藏第14天,COS处理组HRGP含量达到高峰,比对照高出77.44%(P<0.05);在贮藏第35天时,COS处理组与对照组的HRGP含量差异最明显,COS处理组杏果实羟脯氨酸糖蛋白含量高出对照果实的10.33倍(P<0.05)。同时,由图3,B可知,COS处理组果实的木质素含量在采收和整个贮藏期间均高于对照组,贮藏的第28天,COS处理组木质素含量达到最大值46.63%,比对照组高34.81%(P<0.05);贮藏第35天,处理组与对照组木质素含量分别为41.34%和33.80%,COS处理组比CK组高22.30%(P<0.05)。上述结果说明,采前COS处理可以显著提高贮藏期间杏果实细胞壁HRGP含量,促进杏果实中木质素的积累。

图2 采前COS处理对杏果实CHT、GLU和PAL活性的影响Fig.2 Effects of pre-harvest COS treatment on the CHT,GLU and PAL activities in apricot fruits

图3 采前COS处理对杏果实HGRP含量和木质素含量的影响Fig.3 Effects of pre-harvest COS treatment on HGRP and lignin contents of apricot fruits
3 讨 论
壳寡糖作为一种激发子,可有效地诱导植物抗病性,增强植物对病害的防御能力。本试验结果表明采前壳寡糖处理可以有效降低接种链格孢杏果实黑斑病发病率及抑制果实的病斑扩展,诱导杏果实对采后病害的抗性增强,这与前人在采后用壳寡糖处理桃[10]、柑橘[11]等果实提高了果实抗病能力增强的结果相似。
病程相关蛋白(pathogenesis-related proteins,PRs)是植物受到病原菌侵染后产生或积累的一类可以直接攻击病原菌的蛋白,受病原体或其他外界因子的胁迫而诱导表达,并在植物抗病以及适应其他环境胁迫中具有重要作用[12]。GLU和CHT是果蔬中广泛存在的病程相关蛋白的典型代表,可以降解真菌细胞壁,使原生质膜破裂而直接杀死病原菌,达到保护寄主的目的,可作为诱导处理后植物SAR建立的标志[13]。Yan等[14]在冬枣的研究中发现,壳寡糖处理诱导了果实抗病相关的防御酶如PAL、CLU和CHT的活性升高,提高了采后果实的抗病能力。Meng等[15]研究表明壳寡糖处理梨果实后,有效抑制了A.alternata的菌丝生长,提高了果实体内CHT和GLU的活性,证明了病程相关蛋白参与了果实抗病的过程。本研究中,采前COS处理明显促进了贮藏期杏果实GLU和CHT活性的提高,从而诱导杏果实抗病性的增强。从而表明诱导病程相关蛋白的积累是壳寡糖诱导果实产生抗病性的重要机制之一。
植物在受到病原菌及其激发子诱导时会产生一系列防卫反应,如植保素的合成、细胞壁木质化以及HRGP在细胞壁中的积累等[16]。苯丙烷代谢是参与合成酚类、植保素和木质素等抗菌物质的主要途径,PAL是苯丙烷代谢途径中的关键酶和限速酶。因此,植物PAL活性提高,有利于植物抗病性增强。解婷婷等[17]研究壳寡糖对黄瓜的诱导抗病性,发现壳寡糖能诱导黄瓜对黑星病产生抗性,并且抗性机制与黄瓜体内PAL、POD、PPO、SOD等多种防御酶的活性提高有密切关系。本试验结果表明,采前COS处理提高了杏果实采后贮藏期PAL的活性,有利于木质素、酚类等抗菌物质的合成,增强采后果实的抗病性。木质素作为植物细胞壁的基本组成成分之一,不仅对病原微生物的侵害起屏障作用,而且木质素低分子量酚类前体以及多聚作用时产生的游离基可以钝化病原真菌的细胞。HRGP是植物细胞壁的主要结构蛋白,与木质素的形成密切相关。HRGP和木质素可以加强细胞壁,增强组织木质化程度,构成致密的结构屏障,阻止病原真菌的侵染穿透,并被多种激发子诱导。程智慧等[18]研究发现BTH处理和霜霉菌接种可诱导黄瓜叶片细胞壁木质素和HRGP含量的增加,HRGP的积累和细胞壁的木质化与黄瓜对霜霉病的抗性反应有关;陈年来等[19]认为SA诱导处理可以诱导植株系统积累HRGP和木质素,降低果实的病情指数。上述结果与本研究中采前COS处理能促进杏果实木质素含量和HRGP含量的增加均表明,外源激发子提高果实抗病性增强与诱导木质素含量和HRGP含量的积累密切相关。
综上所述,采前壳寡糖处理能够显著降低杏果实接种发病率和病斑直径,诱导杏果实的PAL、GLU和CHT的活性提高,促进杏果实木质素和HRGP的含量增加,从而减轻采后贮藏期病害的发生。
[1] KOBILER L,AKERMAN M,HUBERMAN L,et al.Integration of pre-and postharvest treatments for the control of black spot caused by Alternaria alternates in store dpersimmon fruit[J].Postharvest Biology and Technology,2011,59(2):166-171.
[2] NUNES C A.Biological control of postharvest diseases of fruit[J].European Journal of Plant Pathology,2012,133(1):181-196.
[3] ZHANG H Y,LI R P,LIU W.Effects of chitin and its derivative chitosan on postharvest decay of fruits:a review[J].International Journal of Molecular Sciences,2011,12(2):917.
[4] WANG L(王 丽),ZHAO P(赵 盼),MENG X H(孟祥红).Antifungal activity of chitosan(oligochitosan)on Geotrichum candidumand Alternaria citri of citrus and postharvest disease control[J].Science and Technology of Food Industry(食品工业科技),2011,32(12):424-428(in Chinese).
[5] KIIRIKA L M,STAHL F,WYDRA K.Phenotypic and molecular characterization of resistance induction by single and combined applica-tion of chitosan and silicon in tomato against Ralstonia solanacearum[J].Physiological and Molecular Plant Pathology,2013,81:1-12.
[6] BI Y,TIAN S P,ZHAO J,et al.Harpin induces local and systemic resistance against Trichothecium roseumin harvested Hami melons[J].Postharvest Biology Technology,2005,38(2):183-187.
[7] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:轻工业出版社,2007.
[8] LI J H(李建华),LI X B(李雄彪).Preparation and hydroxyproline analysis of plant cell wall[J].Plant Physiology Communications(植物生理学通讯),1993,29(5):363-365(in Chinese).
[9] LUO G F(骆桂芬),CUI J T(崔俊涛),ZHANG L(张 莉),et al.Relationship between sugar,lignin content and resistance to downy mildew of cucumber[J].Acta Phytopathologica Sinica(植物病理学报),1997,27(1):65-69(in Chinese).
[10] GU R X(古荣鑫),ZHU L Q(朱丽琴),LIU N(刘 娜),et al.Effects of chitosan oligosaccharide and anthocyanin of purple sweet potato on controlling of Monilinia fructicola disease in harvested‘Feicheng’peach fruit and their mechanisms[J].Journal of Fruit Science(果树学报),2013,30(5):835-840(in Chinese).
[11] DENG L L,ZENG K F,ZHAOU Y H,et al.Effects of postharvest oligochitosan treatment on anthracnose disease in citrus(Citrus sinensis L.Osbeck)fruit[J].European Food Research and Technology,2015,240(4):795-804.
[12] FERREIRA R B,MONTEIRO S,FREITAS R,et al.The role of plant defence proteins in fungal pathogenesis[J].Molecular Plant Pathology,2007,8:677-700.
[13] STICHER L,MAUCH M B,METRAUX J P.Systemic acquired resistance[J].Ann.Rev.Phytopathol.,1997,35(1):235-270.
[14] YAN J Q,LI J,ZHAO H W,et al.Effects of oligochitosan on postharvest Alternaria Rot,storage quality,and defense responses in Chinese Jujube(Zizyphus jujube Mill.cv.Dongzao)fruit[J].Journal of Food Protection,2011,74(5):783-788.
[15] MENG X H,YANG L Y,K J F.Effects of chitosan and oligochitosan on growth of two fungal pathogens and physiological properties in pear fruit[J].Carbohydrate Polymers,2010,81(1):70-75.
[16] HADRAMI A E,ADAM L R,HADRAMI I E,et al.Chitosan in plant protection[J].Mar.Drugs,2010,84(4):968-987
[17] XIE T T(解婷婷),LV S X(吕淑霞),MA D(马 镝),et al.Primary study on the resistance to Cladosporium cueumerinumof cucumber induced by chito-oligosaccharide[J].Natural Product Research and Development(天然产物研究与开发),2011,23(3):508-511,555(in Chinese).
[18] CHENG ZH H(程智慧),LI Y H(李玉红),MENG H W(孟焕文),et al.The relationship between BTH-induced resistance to downy mildew in cucumber seedlings and content of HRGP and lignin in cell wall[J].Scientia Agricultura Sinica(中国农业科学),2006,39(5):935-940(in Chinese).
[19] CHEN N L(陈年来),HU M(胡 敏),QIAO CH P(乔昌萍),et al.Effects of BTH,SA,and SiO2treatment on disease resistance and leaf HRGP and lignin contents of melon seedlings[J].Scientia Agricultura Sinica(中国农业科学),2010,43(3):535-541(in Chinese).
(编辑:裴阿卫)
Resistance Induction of Preharvest Chitosan Oligosaccharide Treatment to Black Spot in Apricots Fruits
ZHAO Yating,LIU Doudou,ZHU Xuan*,HOU Yuanyuan
(College of Food Science and Pharmacy,Xinjiang Agricultural University,Urumqi 830052,China)
Xinjiang apricot fruits(Saimaiti)were sprayed with 0.05%chitosan oligosaccharide(COS)with molecular weight 5000Da in four periods:fruit setting period,fruit enlarging period,color turning stage and 48hbefore1picking.The post-harvest apricot fruits after being innoculated were stored at 4℃,90%-95%RH.The lesion diameter and inoculation incidence of apricot fruits inoculated with Alternaria alternata.The activities of defense related enzymes including phenylalanine ammonia-lyase(PAL),β-1,3-glucanase(GLU)and chitinase(CHT)and the contents of lignin,hydroproline-rich glycoprotein(HRGP)were measured regularly.Effects of preharvest chitosan oligosaccharide-induced resistance to black spot in fruits and contents of HRGP and lignin in cell wall was studied.The results showed that disease incidence and lesion diameter were lower in chitosan oligosaccharide-treated fruits compared with their respective controls at the end of storage.The activities of PAL,CHT,GLU and the contents of lignin and hydroproline-rich glycoprotein in chitosan oligosaccharide-treated fruits were showed the change trend:rise after the fall,and was significantly higher than their respective controls in the same period.The activities of PAL,CHT,GLU and the contents of lignin and hydroproline-rich glycoprotein in chitosan oligosaccharide-treated fruits reached the peak at 21thday,28thday,21thday,28thday,14thday.Moreover,all of peak were 12.17%,78.22%,31.41%,34.81%and 77.44%higher than their respective controls.The above results indicated that pre-harvest chitosan oligosaccharide can induce the disease resistance of apricot fruit treated by improving the disease related protein,HRGP and the content of the cell wall.
chitosan oligosaccharide;apricots;pathogenesis-related proteins;black spot;cell wall substances
Q945.78
A
10.7606/j.issn.1000-4025.2015.07.1409
1000-4025(2015)07-1409-06
2015-01-03;修改稿收到日期:2015-06-11
国家自然科学基金(31460414);公益性行业(农业)科研专项(201303075)
赵亚婷(1989-),女,硕士研究生,主要从事果蔬贮藏与保鲜研究。E-mail:491770895@qq.com
*通信作者:朱 璇,教授,主要从事果蔬贮藏与保鲜研究。E-mail:zx9927@126.com

