外源茉莉酸甲酯诱导竹根姜对青枯菌的抗性
周大祥,熊 书
(1重庆三峡学院生命科学与工程学院,重庆万州404100;2重庆大学生命科学学院,重庆市基因功能与调控重点实验室,重庆400300;3重庆三峡医药高等专科学校基础医学部,重庆万州404120)
外源茉莉酸甲酯诱导竹根姜对青枯菌的抗性
周大祥1,2,熊 书3
(1重庆三峡学院生命科学与工程学院,重庆万州404100;2重庆大学生命科学学院,重庆市基因功能与调控重点实验室,重庆400300;3重庆三峡医药高等专科学校基础医学部,重庆万州404120)
以竹根姜幼苗为材料,采用室内水培试验和茎基部注射接种姜青枯菌方法,探讨外源茉莉酸甲酯(MeJA)诱导竹根姜产生姜瘟病抗病性的生理生化机制。结果显示:外源MeJA处理可以显著降低竹根姜的病情指数,提高对姜瘟病的抗性,而对青枯菌的致病力没有直接的抑制作用。MeJA处理可促进竹根姜内源H2O2在前期迅速积累,同时诱导增强姜块内苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、过氧化氢酶(CAT)等防御酶以及病程相关蛋白几丁质酶和β-1,3-葡聚糖酶的活性,促进姜块内木质素含量上升。研究表明,MeJA能通过调控竹根姜细胞内下游信号分子H2O2的水平来提高防御相关酶的活性和病程相关蛋白的表达,促进木质素的合成,提高了竹根姜的抗病性。
竹根姜;茉莉酸甲酯;过氧化氢;病程相关蛋白;木质素
竹根姜(Zingiber officinale Roscoe)为中国特有地方姜种,姜瘟病是其生产上的一种毁灭性病害,长期以来使用的各种化学杀菌剂对其防治效果不明显,很难从根本上根除姜瘟病的发生。化学防治还会带来生姜农药残留、环境污染和病原菌产生的抗药性问题,诱导抗病性为解决姜瘟病流行提供了新的途径。
茉莉酸(jasmonic acid,JA)及其甲酯(methyl jasmonate,MeJA)作为外源信号分子,已被证明能够广泛诱导植物的抗病反应[1-2]。大量的研究结果表明,外源施用JA或MeJA可诱导植物防御基因表达及过敏性反应,进而提高植物抗病性[3-4]。进一步的研究显示,H2O2作为植物细胞内一种主要的信号分子,在木质素合成过程中发挥着重要的作用[5]。对烟草悬浮细胞的研究证实,胞内H2O2急剧上升可有效提高苯丙氨酸解氨酶(PAL)的活性,从而促进木质素和病程相关蛋白的合成[6]。前期的预实验研究发现,MeJA处理可以显著降低姜瘟病的发生。但有关MeJA处理对竹根姜内源信号分子水平与木质素和病程相关蛋白合成的关系还不清楚。本研究以竹根姜为材料,对外源MeJA诱导的竹根姜抗姜瘟病、内源信号分子H2O2水平与木质素和病程相关蛋白活性的关系进行了探讨,以期揭示MeJA诱导竹根姜产生抗病性的机制,为姜瘟病的防治提供理论依据。
1 材料与方法
1.1 材料及其培养
姜青枯菌(Ralstonia solanacearum)于2012年6月自重庆市荣昌县盘龙镇三合村罹病竹根姜分离,经鉴定为4号生理小种,生化型为Ⅳ型,并经TTC(2,3,5-氯化三苯基四氮唑)培养基(蛋白胨10 g,酸水解酪蛋白1g,葡萄糖5g,琼脂18g,加水至1 000mL,pH7.0,灭菌放凉加入过滤灭菌浓度为1%TTC 5mL)及接种竹根姜鉴定为强致病力菌株。致病性姜青枯菌在NA液体培养基上摇菌扩大培养后,配成3×108·mL-1菌悬液,备用。
供试竹根姜为四川地方品种,竹根姜无菌苗栽种于珍珠岩∶泥炭土按3∶7的体积比混合而成的基质中,温室控制28℃~30℃、16h/d光照(2 000~3 000lx),相对湿度为60%~80%,当竹根姜生长至5~7叶时,在其茎基部注射接种。
1.2 MeJA对竹根姜抗姜瘟病的诱导作用
1.2.1 MeJA对姜青枯菌致病性的影响 将0.2 μm细菌微孔滤膜过滤的MeJA加入TTC培养基中,MeJA的终浓度分别为0.001、0.01、0.1、0.5和1mmol·L-1,对照为TTC培养基中加入与MeJA等量的灭菌蒸馏水。致病性姜青枯菌28℃培养48 h,计算弱化指数(N),弱化指数大于0.80为无致病力菌株,0.60~0.80时为致病力不确定菌株,小于0.60为强致病力菌株[7]。

式中,D1为菌落中央的红斑半径,D2为菌落半径
MeJA处理的菌落摇菌后取菌液0.5mL接种竹根姜,15d后按姜瘟病5级分级标准记载病级,统计病情指数(DI)[8]。
1.2.2 MeJA诱导竹根姜对姜瘟病的抗性 将MeJA配制成0、0.001、0.01、0.1、0.5和1mmol· L-1的水溶液,过滤灭菌,喷雾处理竹根姜,直至全部叶片湿润为止,保湿24h。2d后再用致病性姜青枯菌液接种,15d后按姜瘟病5级分级标准记载病级,计算病情指数和诱抗效果[8]。
1.3 MeJA诱导姜瘟病抗性机制研究
1.3.1 处理和取样 实验设置4个处理:1)单独接种姜青枯菌;2)单独用MeJA溶液处理;3)MeJA溶液处理后接种姜青枯菌;4)茎基部注射无菌水对照。根据诱导实验得到的MeJA最佳浓度(0.1mmol· L-1)喷雾竹根姜叶片,保湿24h后,再接种姜青枯菌,分别于接种后0、2、4、6、9、12和15d取样姜块,-80℃保存备用。每个处理重复3次。
1.3.2 H2O2含量测定 H2O2含量测定按照Jiang[9]的方法进行,其单位以nmol·g-1表示。1.3.3 防御酶和病程相关蛋白活性测定 参照Moerschbacher[10]的方法提取粗酶液,略有改进。苯丙氨酸解氨酶(PAL)活性测定参照Xue[11]的方法,过氧化物酶(POD)活性测定参照Zhang[12]的方法,多酚氧化酶(PPO)活性测定参Li[13]的方法,过氧化氢酶(CAT)活性测定参照Dhindsa[14]的方法。
几丁质酶液的提取及活性测定参照Boller[15]方法,胶体几丁质参照Berger[16]的方法制备。几丁质酶活性测定以胶体几丁质为底物,测定反应后产生的N-乙酰氨基葡糖胺的量。一个酶活单位定义为每分钟生成1μmol N-乙酰氨基葡萄糖所需的酶量。β-1,3-葡聚糖酶活性测定参考Mauch[17]的方法。
1.3.4 木质素含量测定 木质素的提取和含量测定按照Musel[18]的方法,以每克鲜重在280nm处的吸收值(A280)表示木质素的相对含量。
1.4 数据分析
应用SPSS19.0统计软件对实验数据进行t检验,P<0.05表示具有显著性差异。
2 结果与分析
2.1 MeJA对姜青枯菌致病性和竹根姜对姜瘟病抗性的影响
在含0.001~1mmol·L-1MeJA的TTC培养基上,姜青枯菌培养48h后,弱化指数为0.30~0.34,与对照基本相同;接种后15d竹根姜的病情指数为80.73~84.23(表1),且处理与对照无显著性差异(P>0.05)。结果说明在实验浓度范围内,MeJA对姜青枯菌的致病力没有直接的抑制作用。同时,用不同供试浓度的MeJA处理竹根姜幼苗,都能够显著降低竹根姜姜瘟病病情指数(P<0.05),并提高对姜瘟病的抗性(表1)。其中,MeJA浓度为0.1mmol·L-1时竹根姜的病情指数最低,诱抗效果最好,分别达到21.68%和73.44%。以上结果说明,外源MeJA提高了竹根姜对姜瘟病的抗性。2.2 MeJA处理对竹根姜块H2O2含量的影响
如图1所示,随着MeJA处理时间的延长,对照组竹根姜块H2O2含量一直稳定在比较低的水平,而各种处理的竹根姜块H2O2含量表现出先升高后降低的变化趋势,并均在处理2d后就达到峰值;在整个处理过程中,各类处理的竹根姜块H2O2含量始终高于同期对照,并且单独MeJA处理和MeJA处理后再接种青枯菌的竹根姜块H2O2含量始终保持在较高水平,而单独接种青枯菌处理的H2O2含量稍低,在接种12d后接近对照水平(P>0.05)。在同期各处理之间以及处理与对照之间的差异大多达到显著水平(P<0.05)。以上结果说MeJA处理促进了竹根姜内源H2O2在前期迅速积累,提高了竹根姜的抗病性。
2.3 MeJA对竹根姜防御酶和病程相关蛋白活性的影响
用0.1mmol·L-1的MeJA和青枯菌处理竹根姜,姜块PAL、POD、PPO和CAT活性在15d内的变化如图2所示。清水对照姜块的4种酶活性比较稳定,各种处理姜块PAL、POD、PPO和CAT活性较对照均有不同程度的增加,并以MeJA喷雾后再接种青枯菌的处理活性最高,单独MeJA处理的活性也保持在较高水平,且均显著高于对照(P<0.05)。首先,MeJA处理后再接种青枯菌,竹根姜姜块的PAL活性较未处理均有所增加;单独MeJA处理和MeJA处理后接种青枯菌的竹根姜的PAL活性在早期上升较快,于第9天达到峰值,其酶活性分别是对照、单独MeJA和单独青枯菌处理的2.47倍、1.25倍和2.04倍。
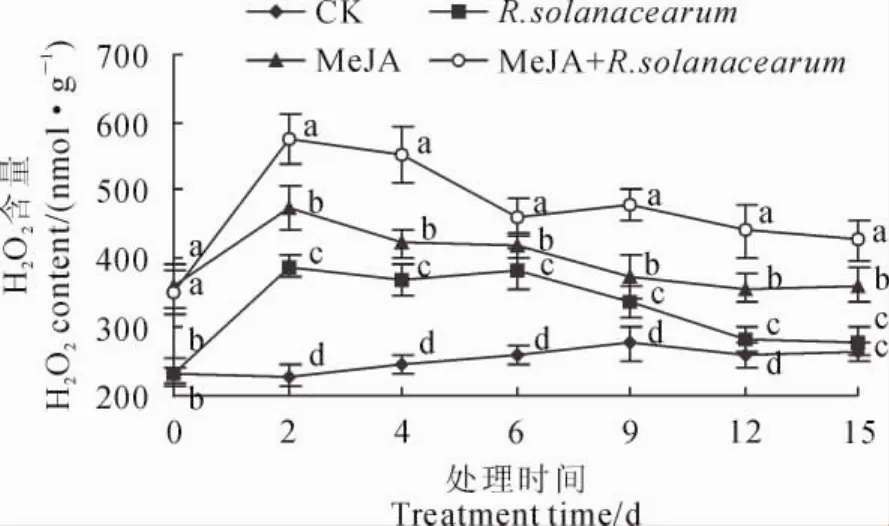
图1 MeJA处理对竹根姜H2O2含量的影响Fig.1 Effect of MeJA on H2O2content in‘Zhugenjiang’ginger
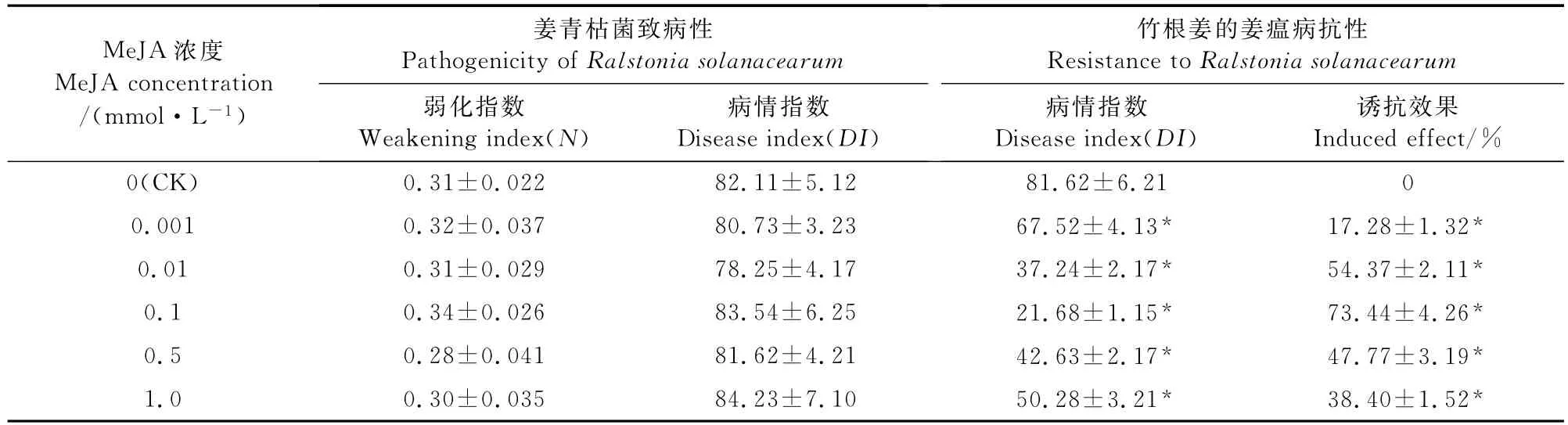
表1 MeJA对姜青枯菌致病性和竹根姜的姜瘟病抗性的影响Table 1 Effect of MeJA on pathogenicity and resistance of‘Zhugenjiang’ginger to Ralstonia solanacearum
其次,用MeJA处理后再接种青枯菌和单独用MeJA处理的竹根姜,其POD活性同样是在前期迅速升高;各处理POD活性随处理时间逐渐上升,均在处理第9天时最大,此后缓慢下降。另外,各处理PPO和CAT活性随处理时间缓慢上升,在第12天时达到最大值,随后有所降低;各处理的PPO和CAT活性始终高于同期对照,并基本表现为MeJA处理后再接种青枯菌处理最高,单独MeJA处理次之,单独青枯菌处理最低,表明MeJA诱导竹根姜产生对青枯病的抗性与PPO和CAT活性有密切关系。以上结果说明MeJA处理短时间内提高了胞内H2O2含量,进而激活相关防御酶基因的表达,增强防御酶活性,促进了木质素的合成。
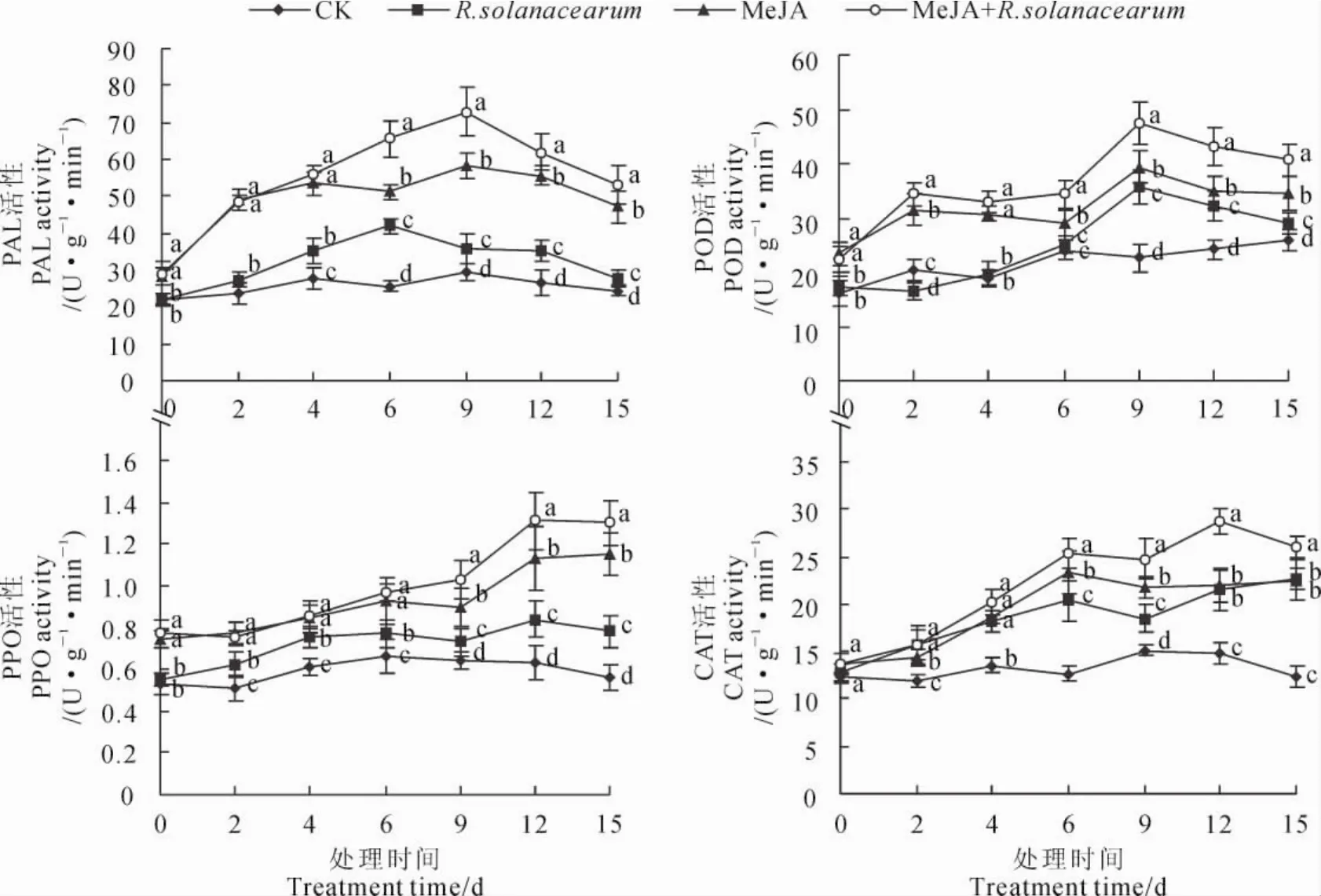
图2 MeJA处理对竹根姜PAL、POD、PPO和CAT活性的影响Fig.2 Effect of MeJA on activities of PAL,POD,PPO and CAT in‘Zhugenjiang’ginger

图3 MeJA处理对竹根姜几丁质酶和β-1,3-葡聚糖酶活性的影响Fig.3 Effect of MeJA on activities of chitinase andβ-1,3-glucanase in‘Zhugenjiang’ginger
同时,如图3所示,单独MeJA处理和MeJA处理后再接种青枯菌处理的竹根姜病程相关蛋白(几丁质酶和β-1,3-葡聚糖酶)活性较对照和接种青枯菌处理显著升高(P<0.05)。其中,几丁质酶活性在前期上升迅速,随后一直保持较高水平,且同期的各处理之间达到显著差异水平;MeJA处理后再接种青枯菌处理姜块的β-1,3-葡聚糖酶活性在中期快速上升,于第6天达到峰值,之后缓慢降低;单独MeJA处理的β-1,3-葡聚糖酶活性分别在第4天和第9天出现了两个高峰;而单独接种青枯菌的竹根姜的β-1,3-葡聚糖酶活性缓慢上升,接种12d后显著高于对照(P<0.05)。以上结果说明MeJA处理提高了竹根姜几丁质酶和β-1,3-葡聚糖酶的活性,抑制病原菌的生长。
2.4 MeJA处理后竹根姜木质素含量的动态变化
竹根姜木质素含量随处理时间的变化如图4所示。其中,除了第0天单独接种青枯菌外,各处理姜块木质素含量均始终显著高于同期对照(P<0.05);MeJA处理竹根姜的木质素的积累非常明显,均在第12天达到顶峰,随后略微降低;而单独接种青枯菌的竹根姜的木质素含量缓慢上升,于第6天达到最大值。在整个处理过程中,两个MeJA处理竹根姜的木质素含量明显高于其余处理,MeJA处理后再接种青枯菌处理又显著高于单独MeJA处理,且随处理时间延长这种趋势越明显。这说明MeJA处理通过提高竹根姜木质素的合成,强化细胞壁,提高对姜瘟病的抗性。

图4 MeJA处理对竹根姜木质素含量的影响Fig.4 Effect of MeJA on lignin content in‘Zhugenjiang’ginger
3 讨论与结论
MeJA作为一种诱导因子,参与植物对病原菌的信号传递和应答反应,在植物抗病反应中有着极其重要的作用[19]。Ahn等[20]发现用0.1mmol· L-1的MeJA可以有效提高水稻对稻瘟病菌的抗性,但有关MeJA诱导竹根姜对姜青枯菌的抗病反应尚未有研究报道。本研究结果表明,0.001~1 mmol·L-1的MeJA处理姜青枯菌对其致病力没有直接的抑制作用;施用0.1mmol·L-1的MeJA能够降低竹根姜的病情指数,提高竹根姜对姜瘟病的抗性。
研究表明,植物体内含有抗病防卫基因,这些基因翻译特定的防卫蛋白,当植物体内的MeJA含量迅速积累达到正常水平的数十倍时,即诱导植物的抗病性反应,包括激活病程相关蛋白、促进木质素、植保素和酚类积累。进一步的研究发现,MeJA或JA需要多级信号分子传导才能充分诱导植物的抗病性反应[21]。目前已证实,H2O2是植物体内主要的信号传递分子之一。作为活性氧自由基的H2O2,可在植物受到病原菌侵染或激发子诱导时大量产生(活性氧迸发),从而在转录和翻译水平上激活植物体内各种防卫基因的表达,进而传递诱导下游防御反应如木质素(细胞壁的强化)的合成和病程相关蛋白的积累,提高植物的抗病性[22]。
PAL、POD、PPO和CAT是参与植物抗病反应的重要防御酶类,其中PAL和POD在木质素的合成与积累中起重要作用,与植物抗病性密切相关,而PPO能将酚类氧化成对病原菌有毒的醌类物质,CAT与植物体内活性氧的清除有关[23-24]。病程相关蛋白的积累是植物获得系统抗性的重要原因[25],其中几丁质酶和β-1,3-葡聚糖酶是2种重要的病程相关蛋白。几丁质酶和β-1,3-葡聚糖酶通过特异性的水解病原菌细胞壁中的几丁质和葡聚糖并破坏细胞壁结构,从而抑制病原菌的生长。在本实验中,经外源MeJA处理的竹根姜,姜块中H2O2含量在前期达到峰值,伴随着H2O2的迸发,4种防御酶(PAL、POD、PPO和CAT)和2种病程相关蛋白(几丁质酶和β-1,3-葡聚糖酶)的活性均显著上升,进而促进木质素的合成。结果说明,MeJA通过调控竹根姜细胞内下游信号分子H2O2的水平,将抗病信号传递并放大到整个植株,进而提高防御相关酶,包括木质素合成相关酶(PAL和POD)的活性和病程相关蛋白的表达,促进木质素的合成,提高了竹根姜的抗病性。但MeJA与其它信号分子(如H2S、NO等)之间的关系仍需后续研究。
参考文献:
[1] TURNER J G,ELLIS C,DEVOTO A.The jasmonate signal pathway[J].The Plant Cell,2002,14:153-164.
[2] LIECHTI R,FARMER E E.The jasmonate pathway[J].Science,2002,296(5 573):1 649-1 650.
[3] SHI Y X(石延霞),YU Y(于 洋),FU J F(傅俊范),et al.Relationship between LOX activity and JA accumulations in cucumber leaves induced by pathogen[J].Acta Phytophylacica Sinica(植物保护学报),2008,35(6):486-490(in Chinese).
[4] FENG Y J(冯远娇),WANG J W(王建武),SU Y J(苏贻娟),et al.The role of jasmonic acid in the systemic induced defense response of aboveground and underground in corn(Zea mays)[J].Scientia Agricultura Sinica(中国农业科学),2009,42(8):2726-2735(in Chinese).
[5] NEILL S J,DESIKAN R,CLARKE A,et al.Hydrogen peroxide and nitric oxide as signalling molecules in plants[J].Journal of Experimental Botany,2002,53(372):1 237-1 247.
[6] LIU F,WEI F F,WANG L,et al.Riboflavin activates defense responses in tobacco and induces resistance against Phytophthora parasitica and Ralstonia solanacearum[J].Physiological and Molecular Plant Pathology,2010,74:330-335.
[7] LIU B(刘 波),LIN Y ZH(林营志),ZHU Y Q(朱育菁),et al.Attenuation Characteristics of Bacterial-wilt-disease Biocontrol Strain Anti-8098A(Bacillus cereus)to Ralstonia solanacearum[J].Journal of Agricultural Biotechnology(农业生物技术学报),2004,12(3):322-329(in Chinese).
[8] HE L Y,SEQUEIRA L,KELMAN A.Characteristics of strains of Pseudomonas solanaeearumfrom China[J].Plant Disease,1983,67:1357-1361.
[9] JIANG M Y,ZHANG J H.Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and
up-regulates the activities of antioxidant enzymes in maize leaves[J].Journal of Experimental Botany,2002,53(379):2 401-2 410.
[10] MOERSCHBACHER B,HECK B,KOGEL K H,et al.An elicitor of the hypersensitive lignification response in wheat leaves isolated from the rust fungus Puccinia graminis f.sp.Tritici.Induction of enzymes correlated with biosynthesis of lignin[J].Zeitschrift fur Naturforsch,1986,41:839-844.
[11] 薛应龙.植物生理学实验[M].北京:高等教育出版社,1990:21-23.
[12] 张志良.植物生理学实验指导[M].北京:高等教育出版社,2005:52-54.
[13] XU J H(徐建华),LI R Q(利容千),WANG J B(王建波).Some changes of enzyme activities from susceptible and resistant cucumber cultivars after inoculation with cucumber wilt Fusarium[J].Acta Phytopathologica Sinica(植物病理学报),1995,25(3):239-242(in Chinese).
[14] DHINDSA R S,PLUMB-DHINDSA P,THORPE T A.Leaf senescence:correlated with increased levels of membrane permeability and lipid peroxidation,and decreased levels of superoxide dismutase and catalase[J].Journal of Experimental Botany,1981,32(1):93-101.[15] BOLLER T,GEHRI A,MAUEH F,et al.Chitinase in bean leaves:induction by ethylene,purification,properties,and possible function
[J].Planta,1983,157(1):22-31.
[16] BERGER L R,REYNOLDS D M.The chitinase system of a strain of Streptomyces griseus[J].Biochimica et Biophysica Acta,1958,29(3):522-534.
[17] MAUCH F,HADWIGER L A,BOLLER T.Ethylene:symptom,not signal for the induction of chitinase andβ-1,3-glucanase in pea pods by pathogens and elicitors[J].Plant Physiology,1984,76:607-611.
[18] MUSEL G,SCHINDLER T,BERGFELD R.Structure and distribution of lignin in primary and secondary cell walls of maize coleoptile analyzed by chemical and immunological probes[J].Planta,1997,201:146-159.
[19] DURRANT W E,DONG X.System atic acquired resistance[J].Annu.Rev.Phytopathol.,2004,42:185-209.
[20] AHN I P,KIM S,KANG S,et al.Rice defense mechanisms against Cochliobolus miyabeanus and Magnaporthe grisea are distinct[J].Phytopathology,2005,95(11):1 248-1 255.
[21] VAN DER ENT S,VAN WEES S C M,PIETERSE C M J.Jasmonate signaling in plant interactions with resistance-inducing beneficial microbes[J].Phytochemistry,2009,70:1 581-1 588.
[22] TORRES M A.ROS in biotic interactions[J].Physiologia Plantarum,2010,138:414-429.
[23] LI ZH L(李兆亮),YUAN Y B(原永兵),LIU CH L(刘成连),et al.Regulation of antioxidant enzymes by salicylic acid in cucumber[J].Acta Botanica Sinica(植物学报),1998,40(4):356-361(in Chinese).
[24] SONG F M(宋凤鸣),ZHENG ZH(郑 重),GE X CH(葛秀春).Role of active oxygen and membrane lipid peroxidation in plant-Pathogen interactions[J].Plant Physiology Communications(植物生理学通讯),1996,32(5):377-385(in Chinese).
[25] SMITH J L,MORAES C M D,MESCHER M C.Jasmonate and salicylate mediated plant defense responses to insect herbivores,pathogens and parasitic plants[J].Pest Manag.Sci.,2009,65:497-503.
(编辑:裴阿卫)
Resistance of‘Zhugenjiang’Ginger to Ralstonia solanacearum Induced by Exogenous Methyl Jasmonate
ZHOU Daxiang1,2,XIONG Shu3
(1College of Life Science and Engineering,Chongqing Three Gorges University,Wanzhou,Chonqqing 404100,China;2College of Life Science,Chongqing University,Chongqing Key Lab of Genetic Function and Regulation,Chongqing 400030,China;3Department of Basic Medicine,Chongqing Three Gorges Medical College,Wanzhou,Chongqing 404120,China)
With‘Zhugenjiang’ginger(Zingiber officinale Roscoe)as the object of study,we analyzed the physiological and biochemical mechanism of MeJA induced to the disease resistance.The research discovered that the treatment of exogenous Methyl jasmonate(MeJA)could significantly reduce disease indices of‘Zhugenjiang’ginger,and increase resistance against Bacterial Wilt of Ginger.no directly inhibitory effect was detected on pathogenicity of Ralstonia solanacearum in vitro.MeJA-treated‘Zhugenjiang’ginger could speedly promote endogenous H2O2content during the early stage,and simultaneously induce the increases of activities of phenylalanine ammonialyase(PAL),peroxidase(POD),polyphenol oxidase(PPO),catalase(CAT),chitinase andβ-1,3-glucanase associated with increase of lignin content.The results exhibited that MeJA regulated the downstream signaling molecule H2O2level to enhance activities of enzymes related to defense and expressions of pathogenesis-related proteins(PR proteins)in ginger cells,resulting in promoting lignin accumulation and furthermore improving disease resistance in ginger.
‘Zhugenjiang’ginger(Zingiber officinale Roscoe);methyl jasmonate;hydrogen peroxide;pathogenesis-related proteins;lignin
Q945.78
A
10.7606/j.issn.1000-4025.2015.07.1415
1000-4025(2015)07-1415-06
2014-12-25;修改稿收到日期:2015-06-05
重庆市自然科学基金(cstc2012jjA80012);重庆市教委科学技术研究项目(KJ131112);重庆三峡学院院级重点项目
周大祥(1979-),男,副教授,主要从事植物生理及病理研究。E-mail:dqzhou79@163.com

