紫杉醇对大鼠尿道成纤维细胞增殖和胶原生成的影响
翟晓强,张 刚,付德来,李和程,李建平,种 铁
(1.西安交通大学第二附属医院泌尿外科,陕西西安 710004;2.四川省达州市中心医院泌尿外科,四川达州 635000)
·基础研究·
紫杉醇对大鼠尿道成纤维细胞增殖和胶原生成的影响
翟晓强1,张 刚2,付德来1,李和程1,李建平1,种 铁1
(1.西安交通大学第二附属医院泌尿外科,陕西西安 710004;2.四川省达州市中心医院泌尿外科,四川达州 635000)
目的 探讨紫杉醇对大鼠尿道成纤维细胞增殖和胶原生成的影响。方法 组织块接种法培养大鼠尿道成纤维细胞。以不同浓度紫杉醇(0、5、10、20、40、80 mg/L)处理尿道成纤维细胞,MTT法检测成纤维细胞增殖能力,羟脯氨酸法检测培养液中成纤维细胞Ⅰ型和Ⅲ型胶原生成,RT-PCR检测成纤维细胞中TGF-β1、Ⅰ型胶原、Ⅲ型胶原、TIMP-1等mRNA表达水平。结果 与对照组相比,实验组不同浓度紫杉醇均对成纤维细胞的增殖有抑制作用。各组间细胞抑制率差异有统计学意义 (P<0.05)。紫杉醇浓度越高,抑制作用越强。实验组培养液中胶原浓度、每十万细胞胶原浓度比对照组显著降低,差异具有统计学意义(P<0.05)。实验组尿道成纤维细胞TGF-β1、Ⅰ型胶原、Ⅲ型胶原和TIMP-1的mRNA表达量均低于对照组 (P<0.05)。结论 紫杉醇可抑制大鼠尿道成纤维细胞增殖、胶原生成以及细胞中TGF-β1、Ⅰ型胶原、Ⅲ型胶原和TIMP-1的mRNA表达,紫杉醇在预防、治疗尿道狭窄形成中的作用值得进一步研究。
紫杉醇;尿道狭窄;成纤维细胞;瘢痕
尿道狭窄是泌尿外科的常见疾病,瘢痕狭窄是常见的并发症,如何预防和处理是研究的热点。尿道局部瘢痕的形成除了和术中瘢痕切除不彻底、尿道黏膜吻合不确切、术后局部感染等因素有关,同时也和损伤部位成纤维细胞的大量增殖、分泌胶原等细胞外基质有关。紫杉醇是从红豆杉中提取的一种抗肿瘤药物,在肿瘤治疗领域应用广泛。近年来发现,紫杉醇能抑制人皮肤瘢痕和血管外膜中成纤维细胞的增殖[1-2]。本课题研究紫杉醇对体外培养大鼠尿道成纤维细胞增殖及生物学功能的影响, 寻找预防和治疗尿道狭窄的新方法。
1 材料与方法
1.1 大鼠尿道成纤维细胞培养与鉴定 取雄性大鼠尿道黏膜下组织,剪成1 mm×1 mm×1 mm组织块,培养于含10%胎牛血清的DMEM培养液中(37℃、5%CO2、饱和湿度),常规换液,传代。波形蛋白单克隆抗体染色对培养的细胞进行鉴定。
1.2 紫杉醇对成纤维细胞增殖的影响 取对数生长期细胞,消化后将细胞浓度调整为1.0×104/mL。设置不同浓度紫杉醇的给药组(实验组)、对照组和空白组,每组设6个复孔。实验组和对照组各加100 μL细胞悬液接种于96孔板,细胞贴壁后弃原液,实验组加100 μL含不同浓度紫杉醇(5、10、20、40、80 mg/L)的培养液,对照组常规换液,空白组仅加100 μL的培养液。48 h后各孔加20 μL MTT溶液,孵育4 h后弃培养液,加150 μL二甲基亚砜,微孔振荡器振荡10 min。以空白孔调零,酶标仪测定A值(492 nm),计算各组细胞抑制率。
细胞抑制率=(对照组A492nm-药物组A492nm)/(对照组A492nm)×100%
1.3 紫杉醇对成纤维细胞胶原生成的影响 依照上述分组和培养方法,按羟脯氨酸测试盒说明书分别对实验组和对照组培养液中羟脯氨酸进行测定。根据测得的吸光度和细胞计数,计算培养液中胶原浓度和每十万细胞胶原浓度。
羟脯氨酸含量(μg/mL)=(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准管浓度(5 μg/mL)
胶原浓度(μg/mL)=羟脯氨酸含量(μg/mL)×7.46
每十万细胞胶原浓度(μg/ mL)=105×胶原浓度(μg/mL)/每孔细胞数
1.4 逆转录聚合酶链反应(RT-PCR)检测紫杉醇对尿道成纤维细胞相关mRNA表达的影响 取对照组和实验组成纤维细胞,提取总RNA,逆转录成cDNA进行PCR扩增。扩增产物琼脂糖凝胶电泳, 溴化乙锭染色,凝胶成像分析系统进行扫描和定量分析,记录各电泳条带的积分吸光度。以TGF-β1、Ⅰ型胶原(Col1)、Ⅲ型胶原(Col3)及TIMP-1扩增带灰度与内参照物β-actin灰度之比表示相应mRNA 表达水平。PCR引物由南京金斯瑞生物科技有限公司设计并合成。
2 结 果
2.1 大鼠尿道成纤维细胞培养与鉴定 大鼠尿道组织块接种3 d后可见散在细胞生长出来,第4天细胞呈放射状分布,第7天细胞相互融合成片,排列规律呈旋涡状。经波形蛋白单克隆抗体染色,培养的细胞胞质被染成黄褐色,说明培养的细胞为成纤维细胞(图1)。
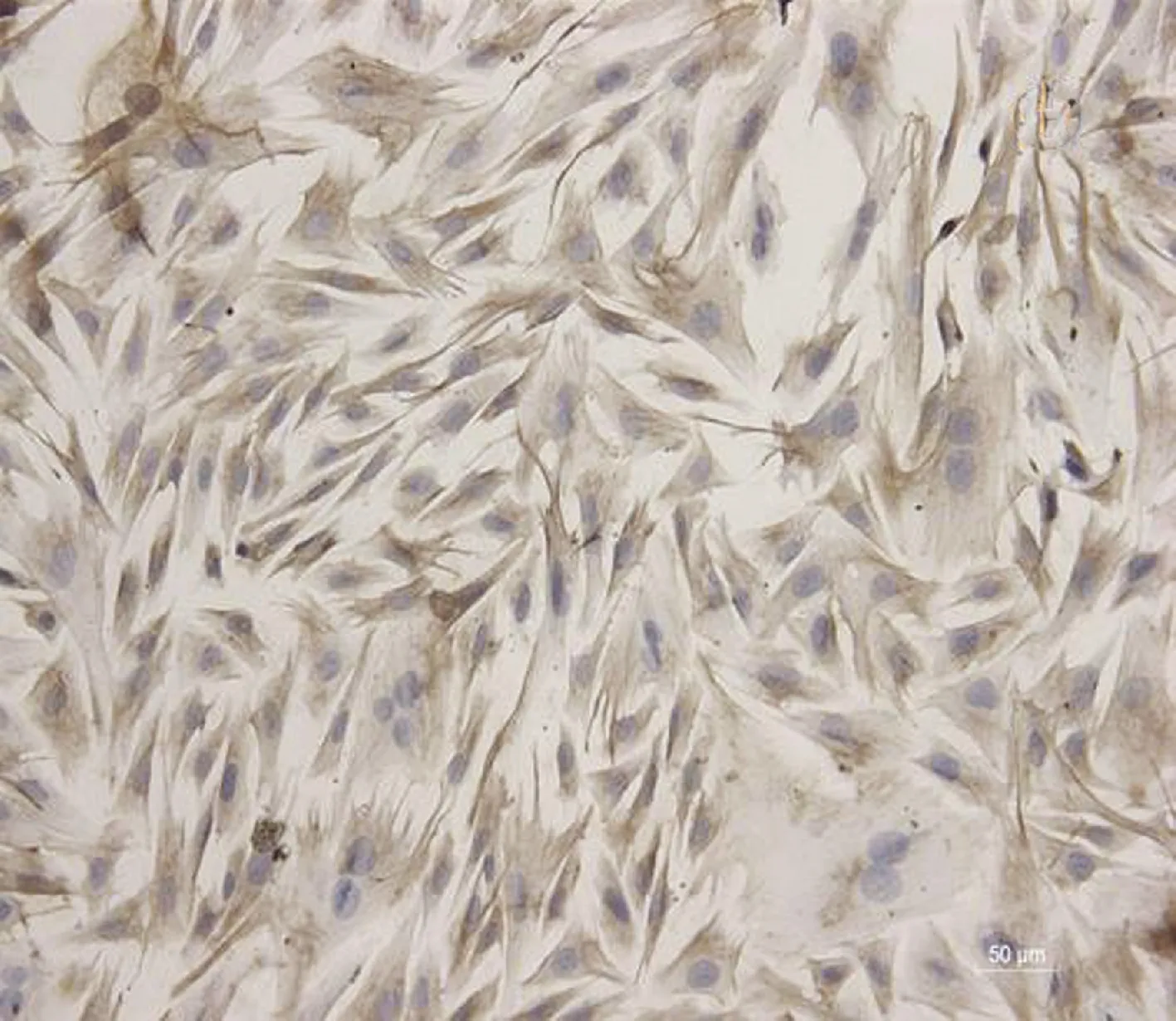
图1 组织块接种法培养的大鼠尿道成纤维细胞(×400)
2.2 紫杉醇对成纤维细胞增殖的影响 与对照组相比较,实验组不同浓度紫杉醇对大鼠尿道成纤维细胞增殖均具有抑制作用(P<0.05)。紫杉醇浓度越高,抑制作用越强。不同实验组间比较,各组间细胞抑制率差异具有统计学意义(P<0.05)。不同浓度紫杉醇对成纤维细胞增殖的抑制率见图2。
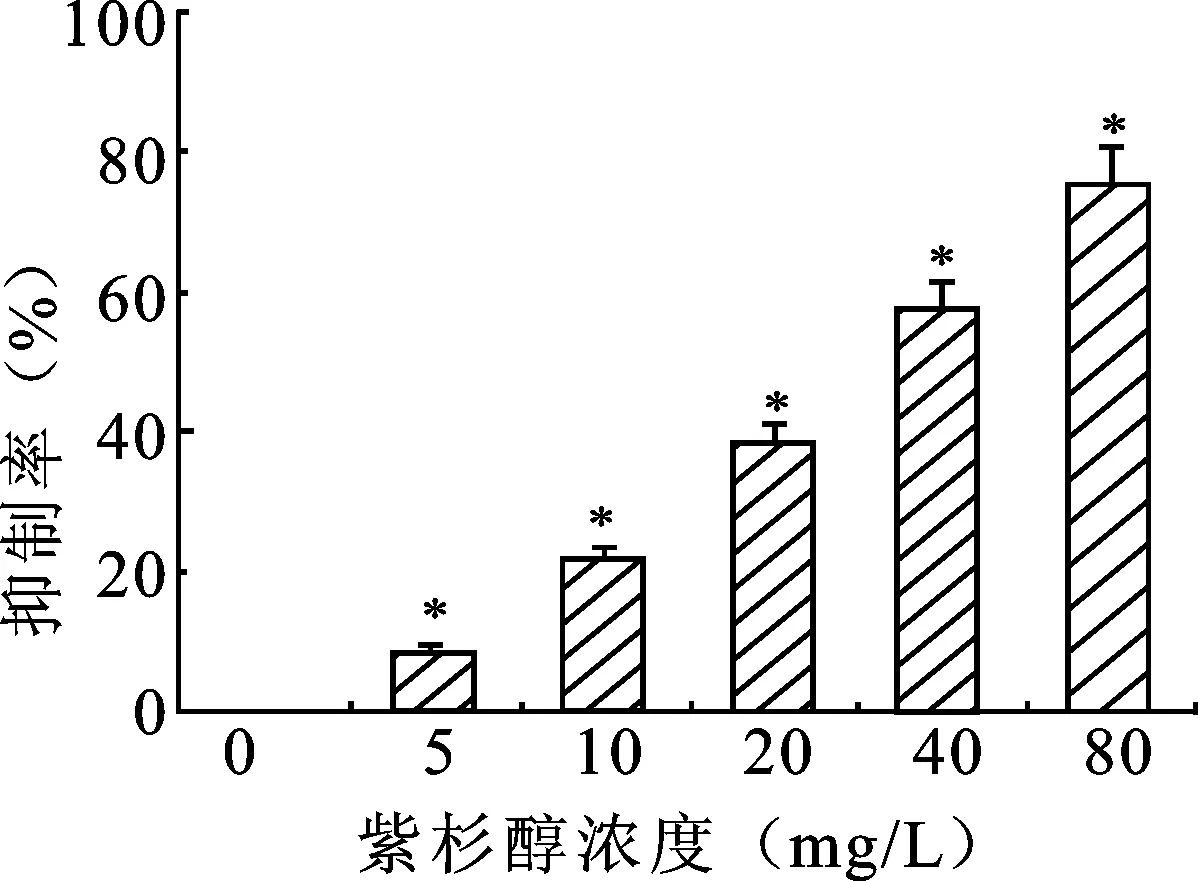
图2 紫杉醇干预后各组成纤维细胞的细胞抑制率
2.3 紫杉醇对成纤维细胞胶原生成的影响 与对照组比较,各实验组培养液中胶原浓度均明显降低,差异具有统计学意义(P<0.05)。实验组中的紫杉醇浓度越高,培养液中胶原浓度越低(图3A)。与对照组比较,各实验组培养液中每十万细胞胶原浓度也低于对照组,差异具有统计学意义(P<0.05)。实验组中的紫杉醇浓度越高,培养液中每十万细胞的胶原浓度越低(图3B)。
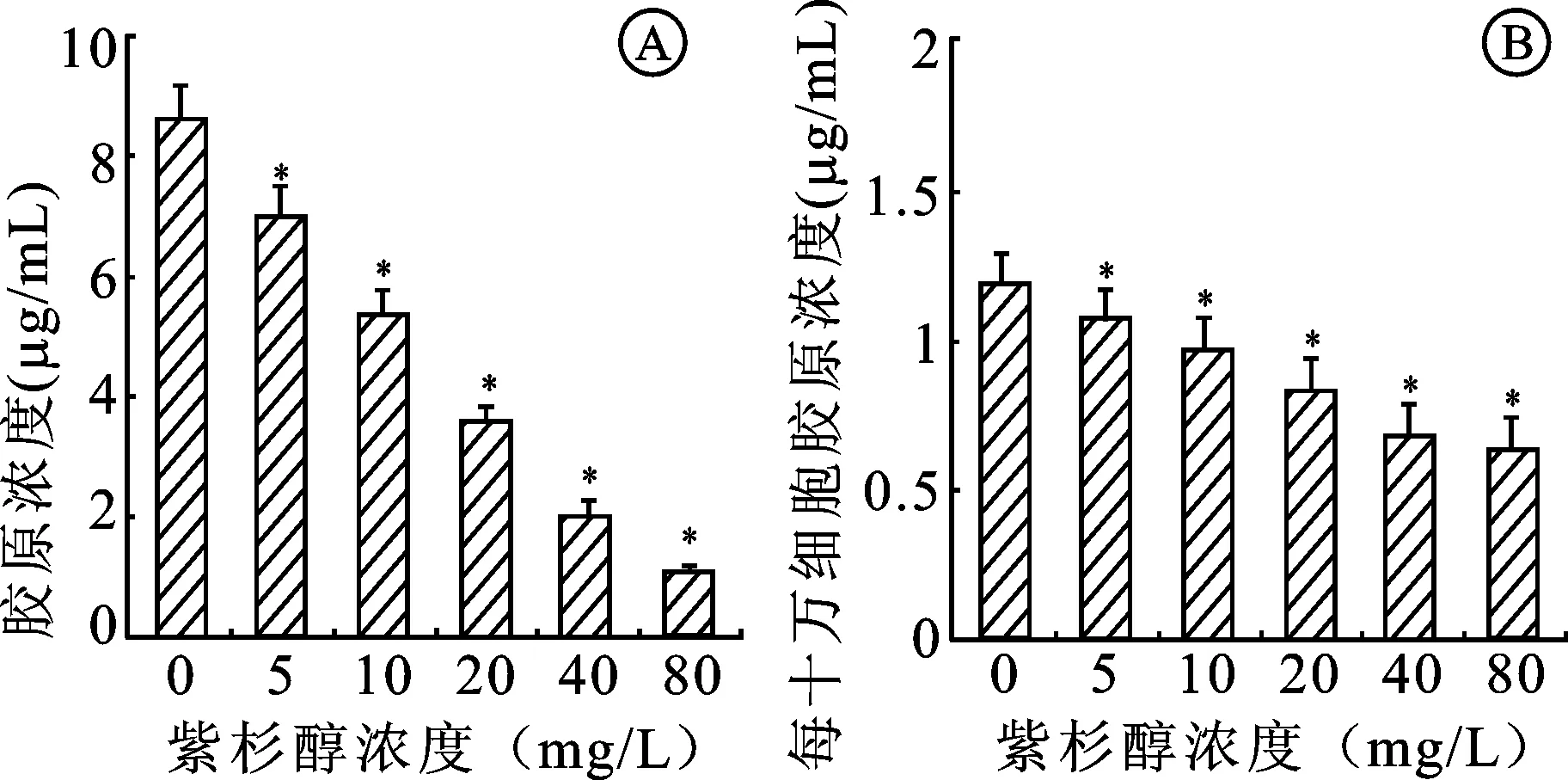
图3 紫杉醇干预后各组培养液中胶原浓度
A:胶原浓度; B:每十万细胞胶原浓度。与对照组比较,*P<0.05。
2.4 紫杉醇对成纤维细胞相关mRNA表达的影响 TGF-β1、Col1、Col3、TIMP-1和β-actin的PCR电泳条带如图4所示。凝胶成像分析系统对电泳条带进行吸光度分析(表1)。与对照组比较,各实验组TGF-β1、Col1、Col3和TIMP-1的相对积分吸光度明显降低(P<0.05)。紫杉醇浓度越高,相对蛋白或多肽链的相对积分吸光度越低。
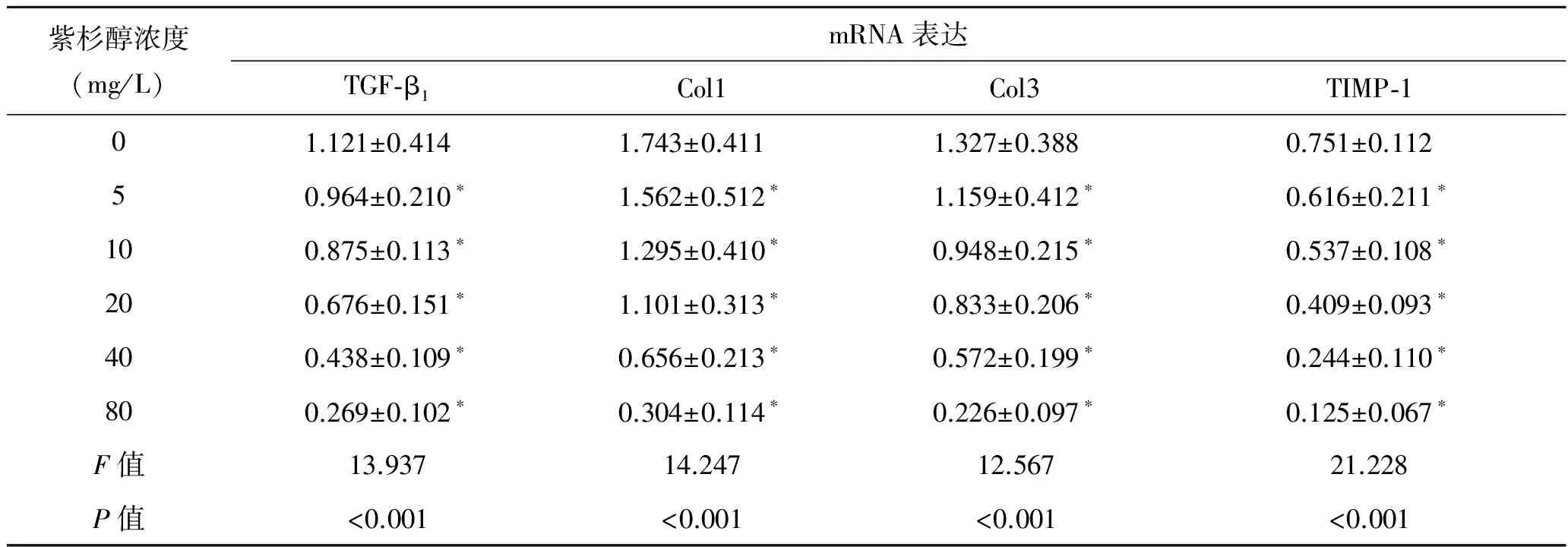
表1 紫杉醇干预后成纤维细胞相关mRNA表达情况
与对照组比较,*P<0.05。
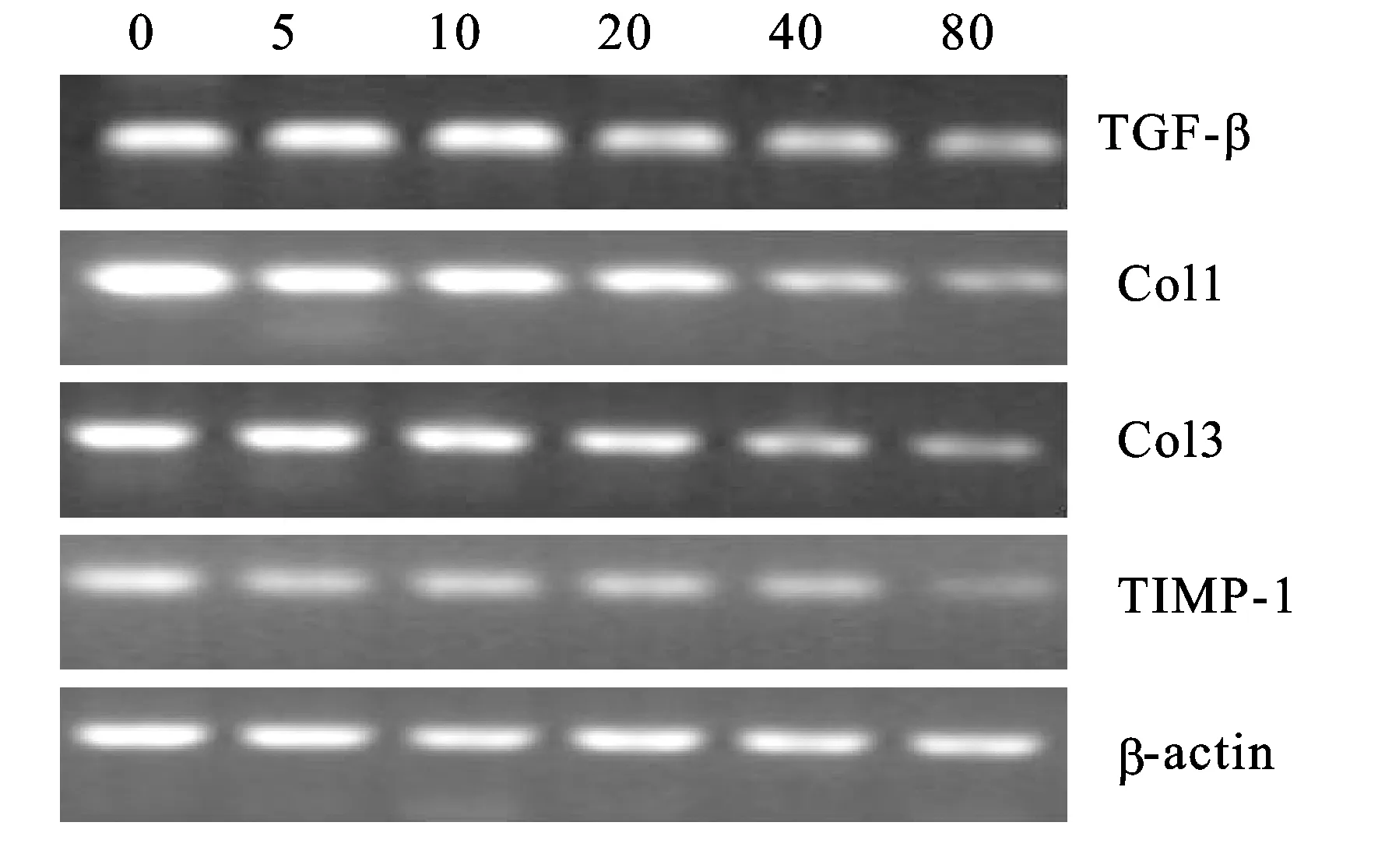
图4 紫杉醇干预后成纤维细胞相关mRNA电泳条带
图中0、5、10、20、40、80分别代表紫杉醇浓度(mg/L)。
3 讨 论
尿道狭窄治疗的难点在于预防复发。除了手术技术改良外,其他辅助治疗(包括药物治疗)是预防尿道狭窄复发的新思路。近年来发现多烯紫杉醇、雷帕霉素等药物能显著抑制兔尿道瘢痕的生成[3-4]。
成纤维细胞是人体结缔组织中最常见的细胞,主要通过快速增殖、分泌大量胶原和细胞外基质等参与机体创伤的修复,是尿道损伤后修复,特别是瘢痕生成过程中起关键作用的细胞[5]。紫杉醇作为经典抗肿瘤药物在临床上已广泛应用,近年来文献发现它具有抗瘢痕作用[6],理论上存在预防和治疗尿道狭窄的可行性。我们实验中紫杉醇浓度的选择主要参考了国内外相关研究结果[2,7],将实验组中紫杉醇浓度分为:5、10、20、40、80 mg/L。
通过MTT法检测细胞抑制率,我们发现紫杉醇对成纤维细胞的增殖具有显著抑制作用。紫杉醇浓度越高,抑制作用越强。机制可能是紫杉醇通过调节细胞微管稳定性,干扰靶细胞有丝分裂[8]。紫杉醇可以通过抑制成纤维细胞增殖,减少成纤维细胞数量,减少胶原和细胞外基质的合成和分泌,这在后续检测细胞培养液中胶原浓度的实验中得以证实。我们发现,各实验组培养液中的胶原浓度均显著低于对照组。而且在各实验组中,紫杉醇浓度越高,培养液中的胶原浓度越低。通过调整培养液中细胞浓度,排除细胞数量对胶原生成的影响后,我们发现实验组中每十万细胞的胶原浓度也显著低于对照组。而且随着实验组中紫杉醇浓度的增加,每十万细胞的胶原浓度越低。这说明除了抑制成纤维细胞增殖外,紫杉醇还存在其他影响胶原生成的因素,需要我们后续进一步研究其作用机制。
TGF-β1是瘢痕形成过程中起关键作用的细胞因子,能通过自分泌或旁分泌形式作用于成纤维细胞,促进其增殖、分泌胶原和细胞外基质[9]。我们通过RT-PCR法检测成纤维细胞内TGF-β1表达,发现紫杉醇能显著抑制成纤维细胞自身表达TGF-β1,且抑制作用有浓度依赖性,浓度越高抑制作用越强。所以,紫杉醇还可抑制成纤维细胞自身分泌TGF-β1,减轻对自身细胞增殖的刺激作用。
另外,细胞外基质的过度沉积也参与组织的修复和瘢痕生成。细胞外基质的过度沉积一方面与胶原合成、分泌增加有关,另一方面与胶原的降解减少有关[10]。基质金属蛋白酶(matrix metalloproteinase,MMP)是胶原降解的关键酶,它的活性受金属蛋白酶组织抑制因子(metallopeptidase inhibitors,TIMPS)的调节。TIMP-1是TIMPS中最主要的一种,能与MMP-1按1∶1形成复合物,抑制其活性,达到抑制胶原降解的作用[11]。本研究发现,紫杉醇能抑制大鼠尿道成纤维细胞中TIMP-1的表达,减轻对胶原酶的抑制作用,有利于细胞外基质的降解,避免胶原等细胞外基质的过度沉积。
总之,本实验初步证实紫杉醇在体外既能抑制大鼠尿道成纤维细胞增殖,又能抑制成纤维细胞的相关功能,包括胶原的产生和细胞内相关mRNA的表达。展望未来紫杉醇可能在抑制尿道瘢痕生成、治疗尿道狭窄方面有潜在的应用价值。当尿道外伤或尿道狭窄术后,在常规治疗的基础上局部使用一定浓度的紫杉醇,抑制局部瘢痕生成,预防尿道狭窄的发生。
[1] 吴志远,罗少军,汤少明.紫杉醇对人皮肤瘢痕成纤维细胞增殖及胶原基因表达的影响[J].广东医学院学报,2003,25(5):432-434.
[2] 沈凯,张怀勤,袁国裕,等.紫杉醇对血管外膜成纤维细胞增殖和迁移的影响[J].中国临床药理学杂志,2012,28(1):40-42.
[3] CHONG T, FU DL, LI HC, et al. Rapamycin inhibits formation of urethral stricture in rabbits[J]. J Pharmacol Exp Ther, 2011,338(1):47-52.
[4] FU DL, CHONG T, LI HC, et al. Docetaxel inhibits urethral stricture formation, an initial study in rabbit model[J]. PLoS One, 2014,9(11):e0112097.
[5] 高英茂.组织学与胚胎学[M].第2版.北京:人民卫生出版社, 2010:33-34.
[6] 任彦新,王华,卫玉彩等.紫杉醇在青光眼滤过手术中的作用[J].眼科新进展, 2010, 30(5):458-460.
[7] 王荔,孙红,杨翎,等.紫杉醇对TGF-β1促人Tenon’s囊成纤维细胞增殖的影响[J]. 南京医科大学学报, 2011,31(6):794-797.
[8] SCHIFF PB, FANT J, HORWITZ SB. Promotion of microtubule assembly in vitro by taxol[J]. Nature, 1979, 277(5698):665-667.
[9] L-J ZHOU, ICHIRO O, F. KANEKO. Role of transforming growth factor-β1 in fibroblasts derived from normal and hypertrophic scarred skin[J]. Archiv Dermatol Res, 1997,289(11):646-652.
[10] RPBERT VISSE, HIDEAKI NAGASE. Matrix metalloproteinases and tissue inhibitors of metalloproteinases[J]. Circulation Research, 2003,92:827-839.
[11] MOESGAARD SG, AUPPERLE H, RAJAMKI MM, et al. Matrix metalloproteinases (MMPs), tissue inhibitors of metalloproteinases (TIMPs) and transforming growth factor-β (TGF-β) in advanced canine myxomatous mitral valve disease[J]. Res Vet Sci, 2014,97(3):560-567.
(编辑 何宏灵)
Effects of paclitaxel on the proliferation and collagen production of urethral fibroblasts in male rats
ZHAI Xiao-Qiang1, ZHANG Gang2, FU De-Lai1, LI He-Cheng1, LI Jian-Ping1, CHONG Tie1
(1. Department of Urology, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004;
2. Department of Urology, Dazhou Central Hospital, Dazhou 635000, China)
Objective To investigate the effects of paclitaxel on the proliferation and collagen production of urethral fibroblasts in male rats. Methods Urethral fibroblasts were cultivated with tissue inoculation, which were then treated with different concentrations of paclitaxel (0 mg/L, 5 mg/L, 10 mg/L, 20 mg/L, 40 mg/L, 80 mg/L). Cell proliferation was evaluated with MTT assay. The production of collagen I and III were assessed with hydroxyproline assay. The mRNA expressions of TGF- β1, collagen Ⅰ,Ⅲ, and TIMP-1 in the fibroblasts were evaluated with RT-PCR. Results Compared with control group, cell proliferation was significantly inhibited by paclitaxel in the treatment groups. The inhibition rate was dose-dependently different between each group (P<0.05). In the treatment groups, collagen concentration and collagen expression per 105cells were lower than that in control, and the difference was statistically significant (P<0.05). Meanwhile, the mRNA expressions of TGF-β1, collagen I, collagen III and TIMP-1 were significantly lower compared with control (P<0.05). Conclusions Paclitaxel could significantly inhibit the proliferation and collagen production of rat urethra fibroblasts in vitro. Moreover, paclitaxel could reduce mRNA expressions of TGF-β1, collagen I, collagen III and TIMP-1. Further studies are deserved to investigate the effect of paclitaxel on the prevention and treatment of urethral stricture.
paclitaxel; urethral stricture; fibroblasts; scar
2015-03-25
2015-04-08
种铁,教授.E-mail: chongtie@126.com
翟晓强(1982-),男(汉族),硕士,住院医师.研究方向:男科疾病、泌尿系肿瘤.E-mail: zxq-200169@163.com
R34
A
10.3969/j.issn.1009-8291.2015.08.016

