脑血流低灌注对大鼠突触后致密物结构及PSD-95蛋白表达的影响
欧阳俊摇 王蕾 张秋霞 王雅丽 张建 龙建飞 赵晖
脑血流低灌注对大鼠突触后致密物结构及PSD-95蛋白表达的影响
欧阳俊摇 王蕾 张秋霞 王雅丽 张建 龙建飞 赵晖
目的 研究脑血流低灌注对大鼠学习记忆、脑组织突触后致密物(postsynaptic density,PSD)超微结构及PSD-95蛋白表达的影响。方法 利用双侧颈总动脉永久性结扎制备SD大鼠脑血流低灌注模型。将SD大鼠随机分为假手术组和脑血流低灌注模型组。采用Morris水迷宫检测大鼠学习记忆情况。采用透射电镜结合Image Pro Plus图像分析系统定量分析大鼠海马突触数量、PSD长度和厚度。采用免疫组化观察大鼠脑组织PSD-95的表达。结果 脑血流低灌注大鼠空间参考记忆及工作记忆能力减退,在第2至4天游泳训练时间段,搜寻隐藏平台路径较假手术组明显增加(P<0.05);撤离平台后,在原平台象限游泳时间及路径较假手术组降低,准确穿越原平台所在位置次数减少(P<0.05);当平台移动到第Ⅱ、Ⅳ象限时,搜索移动平台路径较假手术组明显延长(P<0.05)。与假手术组比较,脑血流低灌注大鼠海马突触数量明显减少,PSD长度变短,厚度变薄(P<0.05);海马CA1区、丘脑前内侧核、颞叶皮层PSD-95积分吸光度降低(P<0.05)。结论 脑血流低灌注所致学习记忆功能减退与海马突触后致密物结构损伤、PSD-95蛋白表达下降有关。
脑血流低灌注;学习记忆;突触后致密物;PSD-95
长期脑灌注不足是血管性痴呆形成的重要病理机制,发病早期主要表现为认知功能障碍,最终可导致持久或进展性的认知与神经功能障碍[1]。突触是神经信息传递的关键结构,附着于突触后膜、由多个蛋白复合体组成的突触后致密物(postsynapticdensity,PSD) 作为突触水平信号整合的中心环节,可改变神经信号传递的下游效应,调节突触可触性变化[2]。PSD-95是PSD上含量最丰富的支架蛋白,在介导和整合突触信号传递过程起到了重要作用[3]。PSD容易受突触前神经冲动传入及内外环境的影响而发生形态变化,具有很强的可塑性,双侧颈总动脉永久性结扎大鼠是公认的研究脑血流低灌注的动物模型。本实验通过观察脑血流低灌注模型大鼠PSD超微结构及PSD-95蛋白表达变化,旨在从突触可塑性角度探讨脑血流低灌注对学习记忆功能的损害机制。
1 材料和方法
1.1 材料SPF级雄性Sprague-Dawley大鼠25只〔北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012-0001〕,体质量180~220g。动物饲养在首都医科大学实验动物中心SPF级实验室,动物实验设施许可证号:SYXK(JING)2010-0020。采用随机数字法将大鼠随机分为假手术组(n=10),脑血流低灌注模型组(以下简称模型组,n=15)。
1.2 主要试剂及仪器 包括PSD-95(博奥森,bs-0179R)、浓缩型DAB试剂盒(北京中杉金桥公司)、羊血清工作液(北京中杉金桥公司)、透射电镜(HITACHI)、Centrifuge5810R高速冷冻离心机(Eppendorf)、ASP300 全自动脱水机(Leica)、Eclipse生物显微镜(Nikon)、NIS-ElementsBasicResearch图像采集分析系统(Nikon)。
1.3 方法
1.3.1 脑血流低灌注模型制作:参考文献[1]制备双侧颈总动脉永久性结扎(2VO)大鼠模型。颈部皮肤去毛消毒,正中切口,钝性分离,暴露双侧颈总动脉,切勿损伤迷走神经,丝线结扎两侧颈总动脉, 逐层缝合伤口。假手术组大鼠仅分离双侧颈总动脉,不结扎。
1.3.2 学习记忆功能检测:双侧颈总动脉永久性结扎术后40d利用Morris水迷宫检测大鼠学习记忆能力。造模期间,模型组死亡5只大鼠。学习记忆功能检测包括空间参考记忆能力测试及工作记忆能力的测试。平台放在水池西南象限(第Ⅲ象限)正中距池壁22cm处,水迷宫周围标志物固定,以供大鼠定位平台。(1)空间参考记忆能力测试:1)隐藏平台获得实验:大鼠入池位置分别为平台所对及相邻象限,记录大鼠在90s内成功进驻平台(找到平台并滞留5s)游泳路径,如在90s内大鼠不能成功进驻平台,将大鼠引上平台停留5s,引导其学习与记忆。每只大鼠每天训练4次,计算大鼠每天寻找平台游泳路径平均值。2)空间搜索实验:隐藏平台获得实验结束后第5天撤除平台,在平台相邻象限将大鼠面向池壁放入水中,在30s内观察并计算大鼠在原平台象限(第Ⅲ象限)游泳时间与总游泳时间比值(tP/tT)、原平台象限(第Ⅲ象限)游泳路径与总游泳路径比值(dP/dT)。(2)工作记忆能力的测试:将平台分别移动到第Ⅰ、Ⅱ、Ⅳ象限,记录90s内大鼠搜索平台的游泳距离。学习记忆功能检测结束后,每组随机取6只大鼠,脑组织取材,分别进行透射电镜观察和免疫组化染色,其余动物脑组织取材后,置液氮备存。
1.3.3 透射电镜观察:各组动物完成学习记忆功能检测后,每组随机取2只大鼠,将大鼠麻醉后以4%(质量浓度)多聚甲醛-2.5%(质量浓度)戊二醛-0.1mol/LPB缓冲液灌注固定,断头取海马CA1区组织1mm×3mm×5mm,放入2.5%(质量浓度)戊二醛后固定。常规方法进行组织修块、超薄切片,醋酸双氧铀和枸橼酸铅双重染色,透射电镜(×4万倍)观察组织超微结构。每张切片均按从左上向右下的顺序进行全视野观察,并对突触进行拍照。采用ImageProPlus图像分析系统,对突触数量进行计数,对PSD长度、厚度进行定量统计。
1.3.4 免疫组化染色检测PSD-95表达:各组动物完成学习记忆功能检测后,每组随机取4只大鼠,将大鼠麻醉后以4%(质量浓度)多聚甲醛灌注固定,常规方法制备脑组织切片,进行PSD-95免疫组化染色。柠檬酸盐缓冲液(pH6.0)高热修复20min暴露抗原;兔抗PSD-95(抗体稀释浓度1∶100),4℃孵育40h;每片滴加二抗50μL,37℃孵育2h,DAB显色1min。阴性对照用磷酸盐缓冲液取代一抗,其余步骤同前。在Olympus光学显微镜下观察切片,LEICA数字显微照相机采集图像,400倍光镜下采集海马CA1、颞叶皮层5个视野及丘脑前内侧核4个视野,利用NIS-ElementsBasicResearch图像采集分析分析每个视野下PSD-95阳性表达的积分吸光度。

2 结果
2.1 脑血流低灌注对大鼠学习记忆的影响
2.1.1 脑血流低灌注对大鼠空间参考记忆的影响:隐藏平台获得实验结果显示,假手术组和模型组大鼠第1天寻找隐藏平台时间和路径未见统计学差异;在第2~4天游泳训练时间段,模型组大鼠搜寻隐藏平台路径较假手术组明显增加(P<0.05,表1)。
空间探索实验结果显示,与假手术组比较,模型组大鼠在原平台象限游泳时间、游泳路径减少,tP/tT、dP/dT降低,准确穿越原平台所在位置次数也明显减少(P<0.05,表2)。

表 1 各组大鼠搜寻隐藏平台游泳路径(Morris水迷宫)比较
注:与假手术组比较,*P<0.05
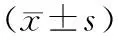

组别n空间探索能力tP/tT(%) dP/dT(%) 穿环次数搜寻移动平台游泳路径(cm)Ⅰ象限Ⅱ象限Ⅳ象限假手术组100.42±0.110.36±0.092.50±0.71908.49±710.681338.02±715.32968.95±615.43模型组100.27±0.06*0.25±0.07*1.50±0.97*1280.99±926.562107.64±638.69*1723.49±606.80*
注:与假手术组比较,*P<0.05
2.1.2 脑血流低灌注对大鼠工作记忆的影响 空间搜索实验后,将水迷宫平台分别置于第Ⅰ、Ⅱ、Ⅳ象限,检测结果显示,当平台移动到第Ⅱ、Ⅳ象限时,模型组大鼠搜索平台路径较假手术组明显延长(P<0.05,表2)。
2.2 慢性脑血流低灌注对大鼠PSD结构的影响 假手术组大鼠海马突触结构完整清晰,突触前膜有少量囊泡聚集,突触间隙明显,PSD较长且厚度大,线粒体丰富,可见清晰的线粒体嵴。模型组大鼠海马突触数量明显减少,突触结构模糊不完整,PSD长度较假手术组变短,厚度较假手术组变薄(P<0.05,图1,表3)。
2.3 脑血流低灌注对大鼠突触后PSD-95蛋白表达的影响 免疫组化染色显示PSD-95阳性细胞胞质呈淡棕黄色至深棕黄色。模型组大鼠海马CA1区、丘脑前内侧核、颞叶皮层PSD-95蛋白表达较假手术组明显减少(P<0.05,表4、图2)。

注:PSD:突触后致密物;A:假手术组;B:模型组
图1 透射电镜观察脑血流低灌注大鼠海马突触超微结构(箭头所示为PSD)

表 3 各组大鼠海马突触超微结构的变化比较
注:与假手术组比较,*P<0.05

表 4 免疫组化法检测各组大鼠不同脑组织PSD-95表达积分吸光度变化±s)
注:与假手术组比较,*P<0.05

图2 各组大鼠脑组织PSD-95表达(箭头所示为PSD-95,免疫组化,DAB显色)
3 讨论
近几年的研究表明,颈部血管逐渐狭窄引起长期慢性脑供血不足是血管性认知障碍形成的重要因素之一[1]。采用双侧颈总动脉永久性结扎复制大鼠脑血流低灌注模型是目前公认的研究脑血流低灌注的动物模型,该模型能较好地模拟人类由于血管粥样硬化导致头颈动脉逐渐狭窄所致的慢性大脑供血不足[1]。研究结果显示,结扎双侧颈总动脉早期可造成急性脑缺血,动物可以通过基底动脉和基底动脉环血流调节以及逐渐形成的侧支循环来改善和代偿供血,使脑血流量趋于稳定,持久双侧颈总动脉结扎形成慢性大脑供血不足,结扎0~21 d大脑顶叶皮层血流量减少至47%,结扎7 d后脑白质血流量减少18%~28%[4]。其病理学改变主要表现为海马神经元损伤、突触丢失,最终导致神经功能下降、学习记忆障碍[5]。
本实验利用Morris水迷宫测试大鼠学习记忆功能,在空间参考记忆检测过程中,大鼠在多次的训练中学会寻找固定位置的平台,形成稳定的空间位置认知,从信息的加工和提取方式来看,这种空间参考记忆进入意识系统,其储存的机制主要涉及边缘系统(如海马)以及大脑皮质有关脑区,常伴有Hebb突触修饰[6-7],属于陈述性记忆(declarative memory)。而工作记忆为动物和人类提供了对外部世界作出反应的快速机制,其建立不需要内侧颞叶和海马的参与,读出过程不需要意识的参与[8]。该研究结果显示,在检测过程中,脑血流低灌注大鼠空间参考记忆能力降低,搜索固定位置平台的游泳路径明显延长,并在空间探索实验中存在定位记忆障碍,穿越平台位置的次数减少,同时慢性脑血流低灌注大鼠出现工作记忆能力下降,移动平台位置后,搜寻移动平台的游泳路径明显比假手术组延长。
突触是神经元之间进行信息交流的关键部位,突触的可塑性和长时程增强(Long-term potentiation,LTP)与学习记忆的细胞分子机制有关。脑灌注减少可影响糖和氧的正常传递,导致脑细胞生物合成及突触通路的能量代谢衰竭[9-10],通过透射电镜该文作者观察到脑血流低灌注大鼠海马突触数量减少,PSD厚度变薄,长度明显缩短,表明脑血流低灌注状态导致学习记忆功能减退与海马PSD结构损伤、PSD-95蛋白表达下降有关。相关研究表明PSD厚度及活性区长度变化可影响突触可塑性,是LTP形成的重要结构基础。钙离子/钙调素依赖性蛋白激酶Ⅱ(calcium/calmodulin-depended protein kinase Ⅱ,CaMKⅡ)在PSD部位通过磷酸化N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)参与LTP 的诱导与维持,LTP形成后,突触PSD厚度、面积增大[11]。自然衰老小鼠学习记忆功能力与脑内皮层、海马PSD厚度减少有平行关系,东莨菪碱或高钙在损伤小鼠学忆记忆的同时也引起海马突触PSD厚度减小一致[12]。
PSD中所含的各种蛋白质和酶的构象和数量的变化都会导致PSD形态变化[13],PSD-95是PSD最重要的支架蛋白,作为膜相关鸟苷酸激酶(membrane-associated granulate kinase,MAGUK)蛋白超家族中的成员[14],可直接调控NMDA受体在突触后膜的簇集和谷氨酸通路的活性[15],对维持PSD的构架和信号转导起重要作用。本实验采用免疫组化方法对脑组织PSD蛋白进行检测,结果显示脑血流低灌注大鼠海马CA1区、丘脑前内侧核、颞叶皮层PSD-95蛋白表达均较假手术组明显减少。结合学习记忆功能检测结果,表明脑血流低灌注可减少突触数量、损伤突触结构,并通过降低PSD-95蛋白表达影响突触可塑性,最终导致学习记忆功能损害。
近年来突触功能与神经系统疾病的关系日益受到关注,PSD在调节突触可塑性方面起着关键的作用。通过对PSD关键蛋白、基因表达进行干预,改善突触功能,增强突触传递将成为疾病的治疗提供新的思路和方法。
[1]田金洲. 血管性痴呆[M].北京:人民卫生出版社,2003.598-607.
[2]Chen X, Winters C, Azzam R, et al. Organization of the core structure of the postsynaptic density[J]. Proc Natl Acad Sci USA,2008,105(11):4453-4458.
[3]Shih PC, Yang YR, Wang RY. Effects of exercise intensity on spatial memory performance and hippocampal synaptic plasticity in transient brain ischemic rats[J]. PLoS One,2013,8(10):e78163.
[4]Briones TL, Suh E, Jozsa L, et al. Behaviorally induced synaptogenesis and dendritic growth in the hippocampal region following transient global cerebral ischemia are accompanied by improvement in spatial learning[J]. Exp Neurol,2006,198(2):530-538.
[5]Xu X, Ye L, Ruan Q. Environmental enrichment induces synaptic structural modification after transient focal cerebral ischemia in rats[J]. Exp Biol Med (Maywood),2009,234(3):296-305.
[6]Ueno M, Tomimoto H, Akiguchi I, et al. Blood-brain barrier disruption in white matter lesions in a rat model of chronic cerebral hypoperfusion[J]. J Cereb Blood Flow Metab,2002,22(1):97-104.
[7]胡镜清,温泽淮,赖世隆. Morris水迷宫检测的记忆属性与方法学初探[J]. 广州中医药大学学报,2000,17(2):117-119.
[8]Tsai YW, Yang YR, Sun SH, et al. Post ischemia intermittent hypoxia induces hippocampal neurogenesis and synaptic alterations and alleviates long-term memory impairment[J]. J Cereb Blood Flow Metab,2013,33(5):764-773.
[9]Okabe S. Molecular anatomy of the postsynaptic density[J]. Mol Cell Neurosci, 2007, 34(4): 503-518.
[10]Takagi N, Logan R, Teves L, et al. Altered interaction between PSD-95 and the NMDA receptor following transient global ischemia[J]. J Neurochem,2000,74(1):169-178.
[11]Gardoni F, Schrama L H, Kamal A, et al. Hippocampal synaptic plasticity involves competition between Ca2+/calmodulin-dependent protein kinase II and postsynaptic density 95 for binding to the NR2A subunit of the NMDA receptor[J]. J Neurosci,2001,21(5):1501-1509.
[12]Petersen JD, Chen X, Vinade L, et al. Distribution of postsynaptic density (PSD)-95 and Ca2+/calmodulin-dependent protein kinase Ⅱ at the PSD[J]. J Neurosci,2003,23(35):11270-11278.
[13]Wu Q, Dibona VL, Bernard LP, et al. The polarity protein partitioning-defective 1 (PAR-1) regulates dendritic spine morphogenesis through phosphorylating postsynaptic density protein 95 (PSD-95)[J]. J Biol Chem,2012,287(36):30781-30788.
[14]Chen WF, Hsu JH, Lin CS, et al. Granulocyte-colony stimulating factor alleviates perinatal hypoxia-induced decreases in hippocampal synaptic efficacy and neurogenesis in the neonatal rat brain[J]. Pediatr Res,2011,70(6):589-595.
[15]Zhou L, Li F, Xu HB, et al. Treatment of cerebral ischemia by disrupting ischemia-induced interaction of nNOS with PSD-95[J]. Nat Med,2010,16(12):1439-1443.
(本文编辑:时秋宽)
The influence of cerebral hypo-perfusion on postsynaptic density structure and postsynaptic density -95 protein expression in rats
OUYANGJunyao,WANGLei,ZHANGQiuxia,WANGYali,ZHANGJian,LONGJianfei,ZHAOHui*.
*School of Traditional Chinese Medicine, Capital Medical University, Beijing Key Lab of TCM Collateral Disease Theory Research, Beijing 100069, China
ZHAOHui,Email:zhaohui8957@sina.com
ObjectiveToobservetheinfluenceofcerebralhypo-perfusiononthelearningandmemoryabilityofrats,andtheultrastructureofpostsynapticdensity(PSD)andPSD-95proteinexpressionchanges.MethodsSDratswererandomlydividedintosham-operatedgroupandcerebralhypo-perfusiongroup.Thecerebralhypo-perfusionmodelwasproducedbypermanentbilateralcommoncarotidarteryligation.Learning-memoryfunctionexaminationwasassessedbyMorriswater-maze.Thenumberofsynapses,lengthandthicknessofPSDwereanalyzedbymeansoftransmissionelectronmicroscopycombinedwithImageProPlusimageanalysissystem.PSD-95expressioninbrainofrats’tissueswasobservedbyimmunohistochemicalstaining.ResultsTheswimdistanceforsearchingthehiddenplatformwasobviouslylongerincerebralhypo-perfusiongroup(P<0.05)incomparisonwithsham-operatedgroupinthefirst2-4daysofswimmingtrainingperiod.Afterthewithdrawaloftheplatform,thetimeandswimdistanceofcerebralhypo-perfusiongroupwerelessthanthesham-operatedgroupinthetargetquadrant.Thefrequencyofgoingthroughtheplatformcorrectlyalsodecreasedincerebralhypo-perfusiongroup(P<0.05).Whentheplatformwasmovedtothesecondandthirdquadrant,thedistanceforsearchingthemovingplatformwasobviouslylongerincerebralhypo-perfusiongroupcomparedwithsham-operatedgroup(P<0.05).Thenumberofhippocampalsynapsesalsoreducedsignificantlyincerebralhypo-perfusiongroup.TheactivitylengthandthicknessofPSDwereobviouslydecreasedincerebralhypo-perfusiongroup(P<0.05).TheintegratedopticaldensityofPSD-95inhippocampalCA1region,anteromedialthalamicnucleusandtemporalcortexweresignificantlydecreasedincerebralhypo-perfusiongroup.ConclusionsCerebralhypo-perfusioncanleadtolearning-memorydysfunction;itisrelatedtothedamageofpostsynapticdensestructureandthedecreaseofPSD-95expression.
cerebralhypo-perfusion;learningandmemory;postsynapticdensity;postsynapticdensityprotein-95
10.3969/j.issn.1006-2963.2015.01.006
国家自然科学基金资助项目(No.30973782;No.81373526);北京市自然科学基金资助项目(No.7122018);北京市属高等学校高层次人才引进与培养计划-长城学者项目资助(CIT&TCD20140329);北京市属高等学校人才强教深化计划“中青年骨干人材培养计划”项目(No.PXM2011014226)
100069 首都医科大学中医药学院,中医络病研究北京市重点实验室
赵晖,Email:zhaohui8957@sina.com
R743.3
A
1006-2963 (2015)01-0020-06
2014-06-29)

