绿脓杆菌耐药性与外膜通透性联系及对新药筛选的影响
刘晓荣 翟俊伟
绿脓杆菌耐药性与外膜通透性联系及对新药筛选的影响
刘晓荣 翟俊伟
目的:针对绿脓杆菌进行研究,主要通过对其外膜通透性的实验了解其对不同抗生素的耐药性,从而为药物选用提供帮助。方法选取不同种类药物并制备好不同酸碱值以及浓度的溶液,培养菌体细胞并分离外膜、制备外膜蛋白、微孔蛋白处理、电泳处理与磷脂预处理、重建蛋白脂质体。结果确定了绿脓杆菌外膜微孔蛋白的分离以及纯化方面的严格步骤,证实了一些孔道形成蛋白。同时测定了几种抗生素对于绿脓杆菌外膜的通透作用。结论绿脓杆菌对多种抗生素的固有耐药性是多重外排转运体和有效通透屏障相结合的结果,因此在新药物的筛选方面,应研制克服这一耐药机制的新化合物。
绿脓杆菌;外膜通透性;药物作用
绿脓杆菌感染是当前临床上难以控制的疾病之一。临床上出现的数量不断增多的耐药菌株迫使我们在重新设计药物时应考虑其更广泛的耐药机制,也就是生物膜屏障与主动转运阻止药物到达其作用靶位。绿脓杆菌对多种结构不同的抗生素耐药,可以认为绿脓杆菌的耐药性与外膜通透性有关。外膜对抗生素的通透性大小直接影响到抗生素对细菌的作用,因此建立克服这一耐药机制的药物筛选模型、用于筛选新的抗绿脓杆菌化合物具有极高研究价值。
1 材料与方法
1.1 材料本次研究中的绿脓杆菌菌株为购买所得,可保障菌株的标准性。培养基方面,采用的是LB培养基,其中包含了蒸馏水、氯化镁、浓度为0.5%的氯化钠、0.5%的酵母浸膏粉以及1%的胰蛋白胨。将上述材料充分混合后制备成培养基。
1.1.1 药品准备:药品准备方面,由于研究是针对绿脓杆菌的耐药性,因此研究使用的药品种类较多,如下:上海丽珠东风制定的蛋白质分子量标准、北京天象人生物公司生产的脱氧核糖酸酶以及同公司生产的十二烷基肌氨酸钠、Sigma公司生产的水苏四糖、β-辛基葡萄糖苷、双十六烷磷酸盐以及磷脂洗胆碱、Bio-Rad公司生产的Bio-Beads SM-2、本院保存的抗生素样品妥布拉霉素以及庆大霉素、中国药品生物制品检定所提供的哌拉西林、头孢克罗、头孢氨苄、美国施贵宝公司生产的氨曲南、英国格兰素公司生产的头孢他啶、大连辉瑞公司生产的头孢哌酮以及美国默沙东公司生产的亚胺培南。
1.1.2 配制溶液准备[1-3]:溶液中蔗糖含量为20%,每升含有2 mol蔗糖,每升含有0.1 mol缓冲液(缓冲液的酸碱值为7.8),浓度为1%的Na-EDTA溶液(酸碱值为7.8),每升含有10 mmol磷酸钠缓冲液(酸碱值为7.0),每升含有10 mmol的磷酸钠缓冲液(酸碱值为7.2,其中还含有1%的十二烷基肌氨酸钠),浓度为10%的SDS溶液、每升1.0 mol的Tris缓冲液(酸碱值为6.8),每升1.5 mol的Tris缓冲液(酸碱值为8.8)。
制备SDS凝胶加样缓冲液:选取10%甘油、0.1%溴酚蓝、2%SDS、5%β硫基乙醇以及每升0.05 mol的Tris缓冲液(酸碱值为6.8)。制备Tris-HCl缓冲液:包含每升5 mmol的EDTA以及每升34 mmol的β-辛基葡萄糖苷,制备成酸碱值为8.0、每升10 mmol的缓冲液。制备贮备液:取1%N亚甲双丙烯酰胺以及29%的丙烯酰胺,制备成浓度为30%的丙烯酰胺贮备液。
制备三种研究用缓冲液:A缓冲液——取每升1 mmol EDTA以及每升2.5 mmol的β-C12E8制备成酸碱值为8.0、每升含10 mmol的Tris-HCl缓冲液。B缓冲液——取每升1 mmol EDTA以及每升34 mmol的辛基葡萄糖苷制备成酸碱值为8.0、每升含10 mmol 的Tris-HCl缓冲液。C缓冲液——取每升1 mmol的氯化镁(MgCl2)以及每升34 mmol的β-C12E8制备成酸碱值为8.0、每升含10 mmol的Tris-HCl缓冲液。
制备MOPS缓冲液:酸碱值为7.2,每升1 mmol;制备NAD缓冲液,酸碱值6.0,每升1 mmol;制备HCl缓冲液,酸碱值7.5,其中含有5%的DexrtanT-40,每升5 mmol。
1.1.3仪器准备:由于本次研究是对绿脓杆菌进行耐药性以及成分等方面的研究,因此涉及到的仪器较多,包含有检测设备、离心设备、干燥设备、色谱设备等,具体应用设备种类如下:日本日立公司生产的紫外分光光度计、高速离心机以及超速离心机;美国PerkinEnlier公司生产的二极管阵列检测器以及高压液相色谱仪;美国Cole Parmer公司生产的超声粉碎仪;背景科普仪器厂生产的电泳仪;背景医疗设备厂提供的小型三用水箱、Wesco公司生产的渗透压计(本次研究选择的是5100B型号);Edwards公司生产的冷冻干燥机。研究中的系统使用的是微机实时处理系统,由Apple公司提供。
1.2 方法
1.2.1 培养菌体细胞并分离外膜:①菌体细胞的培养:将已经贮备好的绿脓杆菌标准菌株接种到培养基(LB培养基,25 ml)中,将其静置放在37℃环境中,隔夜之后采用已经预热处理的LB培养基稀释,稀释到250 ml之后再次放置在37℃环境中进行通气培养,时间4 h即可,期间每分钟200 r,这样能够保障得到菌液生长状态较好[4]。②分离外膜:在室温下对期细胞进行时间为8 min,转速为每分钟8 000 r的离心处理之后,在浓度为20%的蔗糖(此处剂量选为18 ml)中加入大约1.5 g湿菌体,使之悬浮于溶液中。让溶液处于冰浴状态,将浓度为0.5%的溶菌酶(剂量10 ml)、浓度为1%的NA-EDTA(酸碱值为7.8、剂量为0.8 ml)以及浓度为每升0.1 mol的Tris-HCl缓冲液(酸碱值为7.8、剂量为10 ml)缓慢的加入到溶液中[5]。
将上述操作中得到的混合物放置10 min,之后加热使其温度达到30℃,之后保温处理1 h,期间在30 min时应按照每毫升3 μg的剂量加入脱氧核糖酸酶。到时间后按照每分钟12 000 r的速度离心处理约15 min,当清液出现之后再按照每分钟30 000 r的速度离心处理1 h。将粗制的外膜回收,并将外膜放入蒸馏水中使之悬浮,放置于4℃环境中透析[6]。
1.2.2 制备外膜蛋白:将粗制外膜在磷酸钠缓冲液中悬浮(缓冲液酸碱值7.0、浓度为每升10 mmol,共取5 ml),将0.5 ml浓度为2%的十二烷基肌氨酸钠溶液缓慢倒入,将混合液放置在常温下20 min是其融合。之后将其放在10℃环境中离心60 min,将产生的沉淀物重新加入到磷酸钠缓冲液中(酸碱值为7.2、其中含有1%的十二烷基肌氨酸钠,共200 μl)使之悬浮,同样在室温下放置20 min,之后在10℃环境中离心处理60 min。之后将产生的沉淀物(沉淀物中包含了外膜蛋白)在蒸馏水中悬浮,在4℃环境下透析处理之后放在零下70℃中保存备用[7,8]。
1.2.3 微孔蛋白处理:对于微孔蛋白的处理,主要自傲与分离以及纯化两方面。首先取大约10高蛋白,将其外膜取下,加入到Tris-HCl缓冲液(酸碱值为8.0、剂量为5 ml、浓度为每升10 mmol)中,缓冲液中需含有每升5 mmol的EDTA以及每升34 mmol的β-辛基葡萄糖苷。将其充分混合之后放在超声粉碎仪中,超声处理2 min之后,采用离心处理,在20℃环境中处理0.5 h,将混合液中得到的上清液利用DEAE离子将高压液相色谱柱交换。得到的色谱柱首先通过A缓冲液来平衡,使用浓度在每升0~0.5 mol的氯化钠溶液中实施梯度洗脱,流速保持在每分钟1 ml。检测吸收度,采用紫外检测器,对280 nm处展开检测,将A、B、C 3组的高峰值记录下来。放置在4℃环境中一晚之后,分析其蛋白,采用PAGE(聚丙烯酰胺凝胶电泳法)分析[9]。
将B组分超滤进行浓缩,完成后通过B缓冲液使之平衡,将得到的DEAE例子交换高压液相色谱柱,使用浓度在每升0~0.5 mol的氯化钠溶液中实施梯度洗脱,吸收度的检测同样设定在280 nm处,将峰组分收集记录;放置在4℃环境中一晚之后,分析其蛋白。将实验得到的微孔蛋白干燥、冷冻处理,放置在零下70℃环境中保存备用。分离纯化流程图如下。见图1。
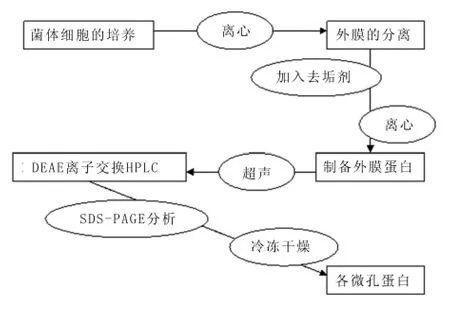
图1 微孔蛋白分离纯化流程图
1.2.4 电泳处理与磷脂预处理:在实施电泳处理之前,应将样品放置在Tris-HCl缓冲液(酸碱值为6.8、浓度为每升0.05 mol)中,缓冲液中还应包含有0.01%溴酚蓝、2%SDS、5%β-硫基乙醇以及10%甘油。将其处于100℃环境中加入3 min,将积层胶以及分离胶中分别含有5%与10%的丙烯酰胺(比例调配方面,丙烯酰胺与双丙烯酰胺的摩尔比控制在29∶1)。凝胶上将电压控制在每厘米8 V。观察研究对象状态,当染料前端已经进入到分离胶内部之后,应适当提升电压,从之前的8 V提升至15 V,保持电泳处理,直到溴酚蓝处于分离胶下部。达到之后,使用硝酸银溶液(0.1%)实施染色,同时将标准蛋白质电泳。在分子量标准方面,蛋白质分子量标准需要采用97.4 kD磷酸化酶、31 kD碳酸酐酶、43 kD肌动蛋白、66.2 kD牛血清白蛋白、14.4 kD鸡蛋清溶菌酶以及20.1 kD胰蛋白酶抑制剂[10]。
对磷脂的预处理方面,首先应选取2.5 g磷脂胆碱,将其研磨直到成为细粉末状态,将其加入到50 ml丙酮之中(其中含有每升2 mmol的硫基乙醇)。将其静置在室温下,抽提3 h,将丙酮抽提物丢弃,残余物使用蒸馏水有效清洗,之后使用污水硫酸钠将残余物干燥处理,保存在零下70℃环境中备用。
1.2.5 重建蛋白脂质体:将经过预处理之后的磷脂酰胆碱取2.4 μmol,并取双十六烷磷酸盐0.2 μmol,将两者同时加入到CHCl3中溶解。使用N2将试管底部干燥处理,完成后将其放入到真空干燥器中,时间定为2 h。取经过适量纯化之后的微孔蛋白以及脂类薄膜放入每升34 mmol的β-辛基葡萄糖苷100 μl中溶解,溶解后放在超声仪中处理2 min。观察悬浮液状态,当期处于透明状时,可加入到Bio-Beads SM-2(150 mg)中,在室温状态下轻轻摇动约1 h,之后放在蒸馏水中,在4℃环境中透析24 h。将已经重建的蛋白脂质体放置在45℃水浴里面,使用N2将其干燥处理,时间为2 min;之后将试管放入真空干燥器中,时间至少为2 h。
2 结果
2.1 不同碳源生长情况研究统计实验下不同碳源的生长情况,本次研究中主要研究了葡萄糖、果糖、蔗糖、肌醇、醋酸钠、乳糖、柠檬酸钠以及可溶性淀粉,具体生长情况。根据上表结果,可结合放线菌的鉴定分类标准以及链霉菌鉴定方法,鉴定菌株的流程,为外膜通透性研究提供帮助。见表1。
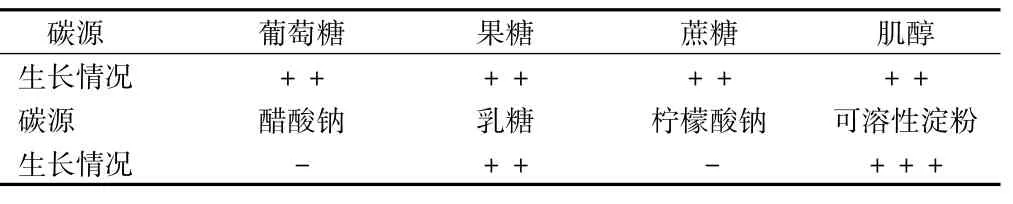
表1 碳源生长情况表
2.2 耐药机制研究将不同菌株提取的β-内酰胺酶对其他的β-内酰胺抗生素水解率展开研究,了解绿脓杆菌对于不同药物(磺苄青霉素、氨苄青霉素、亚胺培南、氨曲南、头孢哌酮、头孢他啶等)的水解率状态,具体研究结果。见表2。
3 讨论
在革兰氏阴性菌中使用抗生素,首先应建立一条通道,此通道由外膜蛋白形成,这样药物才能够进入到周浆的间隙之中。本次研究采用分离纯化实验,将绿脓杆菌实施了外膜微孔蛋白处理,之后利用重建蛋白脂质体,研究了抗生素对于微孔蛋白通透性的影响,也就是研究了其耐药性。研究结果证明,采用的几种试剂均具有通透功能。在对绿脓杆菌进行外膜的分离制备时,传统大多使用的是等密度梯度离心处理,这类型操作比较花费时间。本次研究使用的则是十二烷基肌氨酸钠,在试验时间上大大减少,同时所得结果与相关研究者的研究成果不谋而合,因此这种研究方式具有较高推广价值。研究发现,在使用DEAE来进行离子交换时,流动相使用盐水体系,能够让蛋白在分离之后仍具有较高的微生物活性。在将β-辛基葡萄糖苷作为去垢剂加入之后,蛋白的溶解度可提升,让柱承受的负载不会过于偏低,同时也可达到分离选择性改善的效果[11]。
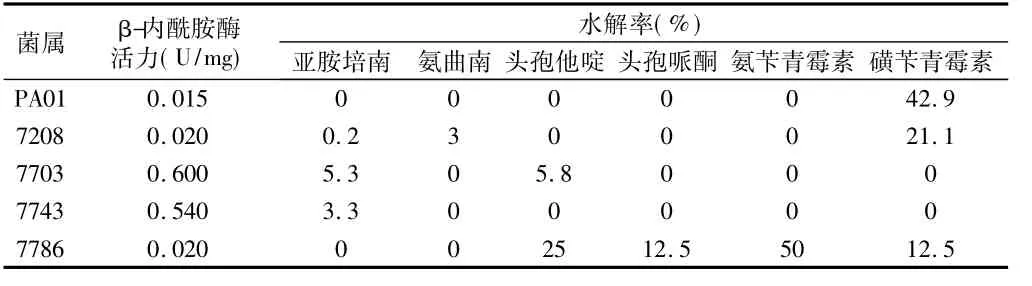
表2 绿脓杆菌对不同药物水解率对比
通过研究,发现虽然氨曲南以及碳青霉素等单环β-内酰胺类型的抗生素对于耐药菌株产生的抑菌作用,但进一步研究不难发现,研究中可能会受到β-内酰胺抗生素的影响、干扰,可能让研究出现假阳性状态,影响研究准确性。本次试验中得到了两株符合要求的菌株,但要想了解其作用机制是否能够有效应用于外膜之上还需要进一步实验分析。
碳青霉烯类(包括亚胺培能等在内)抗生素都是经过扩散途径来对绿脓杆菌外膜进行通过的,抗生素扩散过程中,微孔蛋白的作用仅会表现于亚胺培能或其它碳青霉烯类抗生素,此时表现相对更为明显。绿脓杆菌在外膜通透性方面若较轻,则其会更易选择微孔蛋白孔道的狭窄部位。抗生素(如β-内酞胺类、喳诺酮类、氯霉素类、四环素类)。一旦在细胞中产生了积累,并且积累到某一程度(临界值)时,便会通过质子梯度依赖性从系统泵中主动排出。换言之,绿脓杆菌对多种抗生素的固有耐药性是多重外排转运体和有效通透屏障相结合的结果,因此在新药物的筛选方面,应研制克服这一耐药机制的新化合物[12,13]。
总之,本次研究确定了绿脓杆菌外膜微孔蛋白的分离以及纯化方面的严格步骤,证实了一些孔道形成蛋白。同时测定了几种抗生素对于绿脓杆菌外膜的通透作用,也就研究了绿脓杆菌的耐药性,通透效果越强,证明其耐药性越弱,那么此类型抗生素的使用效果也就越佳。研究建立了通过外膜得出的抗绿脓杆菌筛选方式,通过外膜通透性了解药物作用效果,为新药的筛选提供了有效帮助。
1 邓治平,杨莹,吴小玲,等.80例支气管扩张伴绿脓杆菌感染疗效分析.临床肺科杂志,2014,2:308-310.
2 刘红彬,顾小龙.绿脓杆菌ATCC9027外毒素PE40基因克隆与系统发育分析.中国老年学杂志,2013,19:4769-4771.
3 冯越,张国利,赵福广,等.绿脓杆菌外毒素A受体结合亚基-结核分枝杆菌热休克蛋白65融合蛋白的表达及纯化.中国生物制品学杂志,2013,10:1395-1399.
4 刘建芳,薛改,李云霞,等.创伤涂膜剂对烫伤大鼠感染绿脓杆菌的治疗作用.解放军药学学报,2013,6:506-508.
5 王贵礼.高温转群引发种兔绿脓杆菌性肺炎的诊治.特种经济动植物,2013,12:15-16.
6 徐鹏.石油烃代谢菌分泌绿脓菌素对其降解过程的影响作用研究.西安建筑科技大学,2013.
7 邢进.北京地区实验动物中绿脓杆菌耐药分析及PFGE和MLVA分型方法比较.中国人民解放军军事医学科学院,2012.
8 卫泽峰.抗绿脓杆菌的活性物质筛选及其有效成分分析.重庆理工大学,2012.
9 付莹,李文化,黄薇.25例绿脓杆菌感染原因分析.华北煤炭医学院学报,2011,6:802.
10 张海沙.绿脓杆菌的分布及耐药分析.中国社区医师(医学专业),2012,2:284.
11 周萍,张恩仁,周立,等.绿脓杆菌Pseudomonas aeruginosa BTE-1直接电催化特征.电化学,2012,1:73-78.
12 邢进,岳秉飞,贺争鸣.绿脓杆菌分子分型方法研究进展.中国比较医学杂志,2012,8:62-67.
13 王幸兴.绿脓杆菌外毒素A基因的密码子优化、脱毒改造及其特性研究.河北农业大学,2011.
R 978.1
A
1002-7386(2015)03-0443-04
2014-06-11)
10.3969/j.issn.1002-7386.2015.03.049
063300河北省唐山市丰南区医院检验科

