TCDD暴露对子宫内膜异位症模型小鼠在位内膜组织PR亚型和DNMT-1表达的影响
朱芳 崔照领 黄向华
TCDD暴露对子宫内膜异位症模型小鼠在位内膜组织PR亚型和DNMT-1表达的影响
朱芳 崔照领 黄向华
目的:探讨TCDD暴露小鼠子宫内膜异位症模型在位内膜DNA甲基转移酶-1(DNMT-1)、PR-A、PR-B的表达,以及PR-A、PR-B基因启动子区CpG岛甲基化程度。方法60只C57BL/6雌性小鼠以2∶1与30只C3H雄性小鼠随机合笼交配,根据母鼠妊娠第8天和雌性子鼠出生后21 d所暴露TCDD的剂量(μg/kg)分为5组,0/0组、0/3组、3/0组、3/3组及3/10组。每组均为12只雌性子鼠。以上组别除0/0组外,均于出生后49 d再次暴露TCDD (3 μg/kg),出生后第70天给予TCDD(3 μg/kg)并实施自体子宫内膜移植术构建小鼠子宫内膜异位症模型,并且于术后3、6、9周各暴露1次TCDD(3 μg/kg),术后12周取阴道脱落细胞将处于动情前期雌性子鼠脱臼处死。取其在位内膜制成蜡块,免疫组化SP法检测在位内膜DNMT-1、PR-A、PR-B的表达,以及甲基化特异PCR(MSP)检测PR-A、PR-B基因启动子区CpG岛甲基化程度。结果(1)DNMT-1在3/3组中的表达显著高于0/0组(P<0.01),在3/10组中的表达显著高于3/3组(P<0.01);PR-B在0/0组中的表达显著高于3/3组(P<0.01),在3/3组中的表达显著高于3/10组(P<0.01);4组PR-A的表达经比较差异均无统计学意义(P>0.05)。(2)PR-B基因启动子区CpG岛甲基化程度3/3组中的表达高于0/0组(P<0.05),在3/10组中的表达高于3/3组(P<0.05);4组PR-A基因启动子区CpG岛甲基化程度经比较差异无统计学意义(P>0.05)。结论自胚胎期至成年期持续暴露TCDD有可能通过上调在位子宫内膜DNMT-1的表达,从而使PR-B基因启动子区CpG岛甲基化程度增强,致使PR-B表达减弱,促进了内异症的发生与发展。
子宫内膜异位症;TCDD;DNA甲基转移酶-1;PR-A;PR-B
子宫内膜异位症(endometriosis,EMS)是指子宫内膜间质细胞及腺体生长于子宫腔面以外的其他部位,其为一种雌激素依赖性良性疾病,但因其具有“转移、侵袭”等恶性行为,被称为“benign cancer”。其可导致女性痛经、不孕等,且近年来发病率逐年上升,但到目前为止其发病机制尚未完全阐明。随着目前对环境内分泌干扰物(endocrine disturbing chemicals,EDCS)研究的逐步深入,二恶英类对人类健康的影响机制也在逐步深入。已有众多研究表明二恶英促进EMS的发生与发展[1,2]。我们先期通过二恶英类代表物TCDD暴露小鼠后自体子宫内膜移植术构建内异症模型发现TCDD的确可以促进腹膜及卵巢异位病灶的形成,研究同时发现了在位内膜PR表达的下降,这种现象尤其表现在自胚胎期开始至成年期持续暴露TCDD的情况下。从而提示TCDD对子宫内膜生物学性能的改变是一个从胚胎期至成年期的持续过程[3]。EMS发病机制中“在位内膜决定论”得到了越来越多的研究证明,其认为在位内膜的特性是诱导EMS发病的关键因素[4]。目前研究发现EMS患者在位内膜孕酮受体B (PR-B)的缺失[5,6],PR-B的缺失使17β羟胆固醇脱氢酶2型(17β-Hydroxysteroid Dehydrogenase-2,17β-HSD-2)表达下降,导致病灶局部芳香化酶P450产生的雌激素活性不能被减弱,从而促进EMS的发生[7]。这也成为EMS患者“孕酮抵抗”的一种解释。而由DNA甲基转移酶(DNA methyltransferases,DNMTs)介导的PRB基因启动子区CpG岛超甲基化与其表达缺失有关[8],已有研究表明TCDD具有表观遗传学的甲基化调节作用,且TCDD构建的EMS模型中孕酮受体及其亚型分布发生了相似的改变。本研究通过建立小鼠EMS模型,观察不同发育阶段的小鼠暴露TCDD后,其在位内膜DNMT-1、PR-A、PR-B的表达及PR-A、PRB基因启动子区CpG岛甲基化程度的情况,从表观遗传学的角度探讨TCDD对EMS发病的影响及其机制。
1 材料与方法
1.1 实验动物无特殊病原体(specific pathogen free,SPF)级C57BL/6成熟小鼠60只,雌性,体重18~22 g;SPF级C3H成熟小鼠30只,雄性,体重20~24 g;均购自北京维通利华实验动物技术有限公司。
1.2 主要试剂TCDD为标准品,纯度>99%,购自美国Cambridge Isotope Labe公司。DNMT-1一抗为兔抗DNMT-1单克隆抗体,购自北京博奥森生物科技有限公司,PR-A为hPRa7鼠单克隆抗体,PR-B为hPRa6鼠单克隆抗体,均购于美国Neomarker公司。二抗(山羊抗兔/小鼠IgG抗体-HRP多聚体)购自北京博奥森生物科技有限公司。甲基化特异PCR(Methylation specific PCR,MSP)引物由上海生工生物工程股份有限公司合成,PCR反应体系及DNA Marker购于TaKaRa宝生物工程(大连)有限公司。
1.3 方法
1.3.1 实验分组:60只C57BL/6雌性小鼠以2∶1与30只C3H雄性小鼠随机合笼交配,以见阴道栓为受孕当日,于受孕第8天将60只已孕母鼠随机分为原对照组20只暴露TCDD(0 μg/kg),和原暴露组40只暴露TCDD(3 μg/kg),于生后21 d根据TCDD的暴露剂量[生前/生后(μg/kg)]原对照组所产子鼠随机分为2个处理组:0/0、0/3组,原暴露组所产子鼠分为3个处理组分别为:3/0、3/3、3/10,每组12只。于出生后49 d除0/0组外每个处理组再次给予TCDD (3 μg/kg),于出生后第70天给予TCDD(3 μg/kg)并实施自体子宫内膜移植术构建小鼠EMS模型,并且于术后3、6、9周各暴露1次TCDD(3 μg/kg),术后12周取阴道脱落细胞将处于动情前期雌性子鼠脱臼处死。
1.3.2 动物模型的建立:自体子宫内膜移植术。建模成功的标准:肉眼观:移植的子宫内膜存活,移植物的体积增大,有血管形成,见内含清亮液体的小囊泡;镜下观:病理检查见囊内有子宫内膜腺体和间质细胞,其间可见大量炎性细胞浸润。
1.3.3 取材与检测:建模后12周,取小鼠阴道脱落细胞涂片见大量有核上皮细胞,少量角化上皮及少量粘液为动情前期,而后脱臼处死动物,取其子宫角中性甲醛固定,石蜡包埋。
1.3.4 免疫组化SP法检测小鼠在位子宫内膜DNMT-1、PR-A和PR-B的表达:脱蜡、水化组织切片,微波炉间断加热抗原修复25~30个循环(切片放入盛柠檬酸缓冲液容器中加热3 min,至刚沸腾,停10 s,加热1 min,如此循环),3%过氧化氢甲醇溶液孵育30 min,消除内源性过氧化物酶,磷酸盐缓冲液(PBS)清洗5 min×3次。正常山羊血清封闭15~20 min,甩干,勿洗。加一抗(DNMT-1∶1∶100;hPra 6∶1∶50;hPra 7∶1∶50)37℃水浴箱孵育4 h,PBS溶液清洗5 min×3次,加二抗,室温15 min,PBS溶液清洗5 min×3次,HRP标记的链霉亲和素,室温10 min,PBS溶液清洗5 min ×3次,显微镜下加DAB溶液显色约10 min。苏木素复染1 min,水洗,乙醇脱干,封片。光镜下观察结果每张切片随机连续选取不重叠的5个高倍视野(400 ×),棕黄色为阳性表达区域。利用HMIAS-2000高清晰度彩色医学图文分析系统计算单位面积阳性染色区域平均光密度(optical density,OD)进行比较以反映蛋白的相对含量。
1.3.5 MSP分析PR-A、PR-B基因启动子区CpG岛甲基化程度:①石蜡组织中DNA的提取:切除多余的石蜡,暴露组织,将组织切碎(小于0.5 mm),移入Ep管中,加入1 ml TES(10 mmol Tris-Hcl,1 mmol EDTA,0.5%SDS)溶液,充分振荡,70℃水浴30 min,振荡,4℃12 000 r/min离心15 min,弃上清。重复3次。加入500 μl TET(100 mmol Tris-Hcl,1 mmol EDTA 1% TritonX-100)溶液和30 μl蛋白酶K,37℃水浴过夜。加入500 μl Tris-饱和酚,充分振荡,4℃12 000 r/min离心10 min。取上层水相,加入等体积的Tris-饱和酚:氯仿:异戊醇(25∶24∶1),充分振荡,4℃12 000 r/min离心10 min。取上层水相,加入1/10体积的3 mol/L醋酸钠(NaAc),摇匀,37℃30 min。加入2.5倍体积的预冷无水乙醇,摇匀,-20℃过夜。4℃12 000 r/min离心15 min,弃上清,用70%乙醇洗2次,室温干燥后,加入20 μl三羟甲基氨基甲烷/乙二胺四乙酸二钠盐(TE)缓冲液溶解DNA,-20℃保存。②DNA纯度的测定:取5 μl DNA样品,加双蒸水至1 ml混匀后,用紫外分光光度计分别在260 nm和280 nm处读取A值,A260/A280=1.8~2.0间方可使用。③DNA亚硫酸氢钠(NaHSO3)修饰:取提取的DNA 20 μl加去离子水(dd·H2O)24.5 μl,加入3 mol/L NaOH 5.5 μl,37℃,15 min。加入3 mol/L NaHSO3(pH值5.0)280 μl+新鲜配置的10 mmol/L 1,4-苯二酚(C6H6O2)15 μl,55℃温浴18 h(过夜)。透析方法:500 mmol/L NaAC,4℃,4 h;0.5 mmol/L C6H6O24℃,4 h;0.5 mmol/L NaAc,4℃过夜; dd·H2O 4℃,4 h,3次,最后1次4℃过夜。透析完毕,用NaAc和乙醇沉淀DNA,最后加入20 μl TE缓冲液溶解DNA,-20℃保存。④PCR扩增引物[9]:由上海生工生物有限公司合成,具体序列及各自退火温度见表1。⑤MSP反应条件及反应体系:PCR扩增条件: 94℃变性3 min;(94℃40 s,各自退火温度50 s,72℃60 s);35个循环;72℃延伸12 min。反应体系为25 μl,含10×PCR反应缓冲液2.5 μl;25 mmol/L MgCl2,1.5 μl;10 mmol/L dNTP 0.5 μl;10 μmol/L引物各1 μl;模板2 μl;5 U/μl Taq DNA聚合酶0.5 μl;上样染料,稳定剂,优化剂等;余下用灭菌去离子水补足。震荡混匀后短暂离心,加少许矿物油于PCR仪扩增。
1.4 统计学分析应用SPSS 19.0统计软件,计量资料以±s表示,采用方差分析,计数资料采用Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 TCDD暴露小鼠在位子宫内膜中DNMT-1、PR-A 及PR-B的表达5组雌性子鼠在位内膜中DNMT-1的表达:SP法显示,DNMT-1主要在子宫内膜腺体胞核中表达。0/0组、0/3组及3/0组DNMT-1的表达组间两两比较差异无统计学意义(P>0.05),但其在3/3组中的表达显著高于0/0组(P<0.01),在3/10组中的表达显著高于3/3组(P<0.01)。见表2,图1。

表1 小鼠PR-A、PR-B基因启动子区甲基化与非甲基化引物
表2 5组小鼠在位子宫内膜中DNMT-1、PR-A、PR-B的表达n=12,±s

表2 5组小鼠在位子宫内膜中DNMT-1、PR-A、PR-B的表达n=12,±s
注:与0/0组比较,*P<0.01;与3/3组比较,#P<0.01
组别DNMT-1 PR-A PR-B 0/0组0.2143±0.0065 0.5383±0.0032 0.5251±0.0070 0/3组0.2102±0.0093 0.5401±0.0018 0.5294±0.0056 3/0组0.2104±0.0066 0.5390±0.0054 0.5288±0.0069 3/3组0.5207±0.0089*0.5402±0.0322 0.2362±0.0068*3/10组0.5749±0.0061*#0.5389±0.0014 0.1112±0.0077*#
2.2 5 组雌性子鼠在位内膜中PR-B的表达SP法显示,PR-B主要在子宫内膜腺体胞核中表达。0/0组、0/3组及3/0组PR-B的表达组间两两比较差异均无统计学意义(P>0.05),但其在0/0组中的表达显著高于3/3组(P<0.01),在3/3组中的表达显著高于3/10组(P<0.01)。见表2,图2。
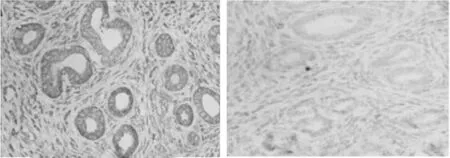
图2 0/0组小鼠动情前期在位子宫内膜中PR-B表达位于子宫内膜腺体和间质细胞胞核中,呈棕黄色(SP×400)
2.3 5 组雌性子鼠在位内膜中PR-A的表达SP法显示,PR-A主要在子宫内膜间质胞核中表达。5组PR-A的表达经比较差异均无统计学意义(P>0.05)。而同一组别中PR-A的表达要强于PR-B。见表2,图3。
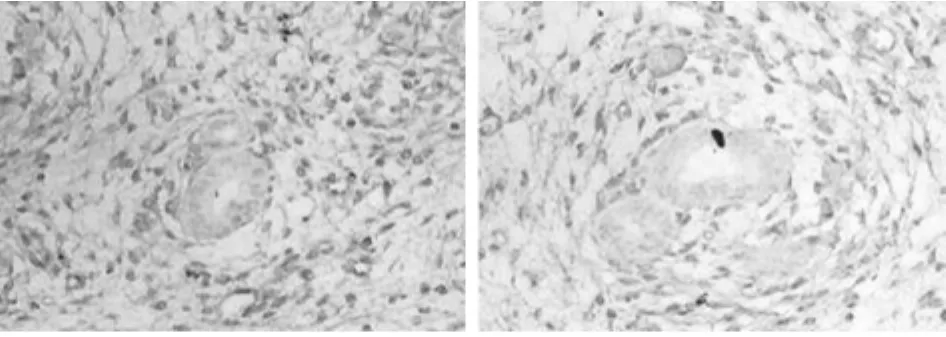
图3 0/0组与3/10组小鼠动情前期在位子宫内膜中PR-A主要表达于子宫内膜间质细胞胞核中,呈棕黄色(SP×400)
2.4 5 组雌性子鼠在位内膜中PR-A、PR-B基因启动子区CpG岛甲基化程度PR-B基因启动子区CpG岛甲基化程度0/0组与0/3组比较差异无统计学意义(P>0.05);0/0组与3/0组比较差异无统计学意义(P>0.05);而0/0组与3/3组比较差异有统计学意义,且3/3组高于0/0组(P<0.05);3/3组与3/10组比较差异有统计学意义(P<0.05),且3/10组高于3/3(P<0.05)。而各组中PR-A基因启动子区CpG岛甲基化程度差异均无统计学意义(P>0.05)。而同一组别中除0/0组外PR-B基因启动子区CpG岛甲基化程度要强于PR-A基因启动子区CpG岛甲基化程度。见表3,图4、5。
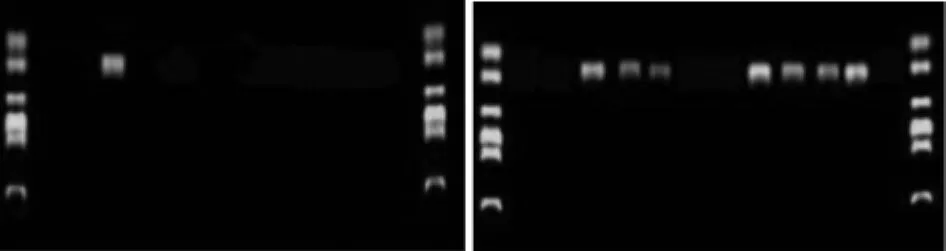
图4 0/0组12只小鼠动情前期在位子宫内膜标本中PR-B基因启动子区CpG发生甲基化改变的为1只,而3/3组为7只。DNA marker自上向下依次为100、200、500、750、1 000、2 000 bp。目标DNA长度为207 bp
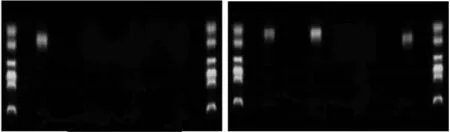
图5 0/0组12只小鼠动情前期在位子宫内膜中PR-A基因启动子区CpG岛甲基化改变为1只,3/3组为3只。DNA marker同上。目标DNA长度为125 bp

表3 5组小鼠在位子宫内膜中PR-A、PR-B基因启动子区CpG岛甲基化程度只
3 讨论
3.1 TCDD暴露内异症模型在位内膜PR及其亚型的表达已有众多研究者就TCDD的免疫及内分泌毒性对EMS发病机制的影响进行深入研究,但Bruner-Tran等[10]就TCDD所引起的子宫内膜“孕酮抵抗”导致EMS发生及发展机制的研究中发现,生长发育期暴露TCDD通过甲基化作用引起子宫内膜PR表达的缺失,且持续数代。另有研究进一步证明了TCDD对PR的下调作用中尤以对PR-B的下调明显[11]。我们先期的研究也指出3/3组与3/10组中PR蛋白表达显著低于其他各组,与间质来源的旁分泌因子TGF-β2通过某种信号传递影响了在位内膜MMP-3、MMP-7的表达,促进逆流的子宫内膜组织碎片黏附到腹膜、卵巢表面,并降解解细胞外基质(extracellar matrix,ECM),导致早期异位病灶的形成。本研究发现了在3/3组与3/ 10组中与其他各组相比PR-B的表达明显下降。提示自胎儿期至成年期TCDD的持续暴露改变了子宫内膜的生物学功能,PR-A/PR-B比例的失调有可能调节了MMPs的表达,促进了子宫内膜的侵袭与粘附,并且PR-B的下降使17β-HSD-2表达下降,导致病灶局部芳香化酶P450产生的雌激素活性不能被减弱,这些都可能参与了EMS的形成与发展。
3.2 TCDD的甲基化修饰作用表观遗传学(epigenetics)是研究生物表观遗传变异(epigenetic variation)现象的一门遗传学分支学科。它是指DNA序列不发生变化但基因表达却发生了由上代传于下代的可遗传的改变,并且具有可复性[12]。DNA的甲基化是表观遗传学的重要方面,一般是指甲基基团与基因启动子区中CpG岛即二核苷酸岛胞嘧啶环第5碳原子以共价键的形式结合,利用S-腺苷蛋氨酸(SAM)作为甲基供体,形成了5-甲基胞嘧啶。甲基化过程则由DNMTs催化,在哺乳动物中主要包含三种具有活性的DNA甲基转移酶DNMT1,DNMT3a和DNMT3b,DNMTs在小鼠胚胎早期发育中起着至关重要的作用,研究发现Dnmt1和Dnmt3敲除的小鼠胚胎(Dnmt1-/-和Dnmt3-/-)发育有缺陷,致死率高[13],DNA复制过程中产生一些半甲基化的CpG位点,Dnmt1可以特异性识别这些位点,并将这些半甲基化的CpG位点上的胞嘧啶甲基化,即在新合成的DNA链上复制一个已经存在的甲基化模式给新合成的DNA链。这个过程可以保证每个分裂产生的细胞都具有一定的DNA甲基化水平和甲基化状态,因此具有维持甲基化状态的功能[14]。目前发现在胚胎(胎儿)发育编程中,影响表观遗传修饰的主要因素有饮食和环境两大方面,环境因素中就包括TCDD,植入前的小鼠胚胎若暴露于TCDD,印记基因IGF2和H19甲基化改变将使胎儿生长发育受到抑制,从而表明了TCDD表观遗传学的甲基化调节作用[15]。有学者在对胚胎期暴露EDCS对青春期、生育期及老龄期卵巢功能的影响研究中也发现了基因组的广泛甲基化变化,而这些有可能与Rapid Estrogen Signaling,PI3K/Akt signaling pathway,PTEN Signaling,IGF-1 Signaling有关[16]。在EDCS的研究中发现,其对胚胎生殖系统的发育毒性可能与乳糖转铁蛋白(1actotransferrin)基因的持续表达有关,乳糖转铁蛋白持续表达能够参与调节基因元件去甲基化抑或甲基化状态[17]。该研究还指出EDCS的雌激素作用增强了雌激素与受体的结合,增加了靶细胞或组织中c-fos及c-jun基因的表达,而c-fos的过度表达可上调与DNA甲基化相关的胞嘧啶甲基转移酶的表达。随着环境基因组学的应用和发展,有关其作用机制方面的具体研究正逐步深入。本研究表明小鼠EMS模型中0/0、0/ 3、3/0组中由DNMT-1所介导的甲基化作用并没有明显改变成年小鼠子宫内膜的生物学特性,而自胚胎期开始至成年期持续暴露TCDD却增强了此作用,改变了子宫内膜的生物学功能,TCDD的这种甲基化调节作用有可能促进了EMS的形成与发展。
3.3 EMS模型中TCDD与DNMT-1、PR-A、PR-B表达及PR-A、PR-B基因启动子区CpG甲基化程度的关系
EMS患者在位内膜PR-B的缺失促进了该病的发生与发展,而EMS患者中也发现了PR-B基因启动子区的超甲基化改变[18]。PR-B基因启动子区的超甲基化与其表达缺失有关[8]。本研究结果表明,尽管DNMT-1在维持小鼠正常生理功能方面起着至关重要的作用,但自胚胎期至成年期持续的TCDD暴露增强了在位子宫内膜DNMT-1的作用,使PR-B基因启动子区CpG岛发生了超甲基化改变,从而使其表达下降,并且与生长发育早期所接受的剂量有一定的相关性。而对PR-A这种调节作用却不显著。TCDD有可能通过DNMT-1所介导的甲基化作用最终使PR-B表达发生了改变,从而导致局部子宫内膜的生物学功能以及其对激素的反应发生了改变,促进了EMS的发生与发展。而又由于PR-A、PR-B在组织的表达具有组织及阶段特异性[19],并且两种受体亚型间以及其与ER亚型间复杂的干扰机制是否影响了TCDD对PR-B的这种调节作用尚有待于进一步深化研究。
1 Eskenazi B,Ocarelli P,Warner M,et al.Serum dioxin concentrations and endometriosis:a cohort study in Seveso,Italy.Environ Health Perspect,2002,110:629-634.
2 崔照领,黄向华.二恶英与子宫内膜异位症发病关系研究进展.中国实用妇科与产科杂志,2010,26:886-888.
3 崔照领,黄向华,王振海.TCDD暴露对子宫内膜异位症模型小鼠在位内膜组织中TGF-β2、PR、MMP-3和MMP-7表达的影响.中华妇产科杂志,2011,46:946-948.
4 郎景和.子宫内膜异位症研究的新里程.中华妇产科杂志,2005,40: 3-4.
5 Attia GR,Zeitoun K,Edwards D,et al.Progesterone receptor isoform A But Not B is expressed in endometriosis.Clin Endocrinol Metab,2000,85:2897-2902.
6 吕艳文,张淑兰,王丹波.孕激素受体与子宫内膜异位症的关系.中国全科医学,2008,15:1342-1344.
7 Bulun SE,Cheng YH,Pavone ME,et al.17b-HydroxysteroidDehydrogenase-2 Deficiency and Progesterone Resistancein Endometriosis.Semin Reprod Med,2010,28:44-50.
8 Sasaki M,Dharia A,Oh BR,et al.Progesterone receptor B gene inactivation and CpG hypermethylation in human uterine endometrial cancer.Cancer Res,2001,61:97-102.
9 Wargon V,Fernandez SV,Goin M,et al.Hypermethylation of the progesterone receptor A in constitutive antiprogestin-resistant mouse mammary carcinomas.Breast Cancer Res Treat,2011,126:319-332.
10 Bruner-Tran KL,Ding TB,Osteen KG.Dioxin and Endometrial Progesterone Resistance.Semin Reprod Med,2010,28:59-68.
11 Igarashi TM,Bruner-Tran KL,Yeaman GR,et al.Reduced expression of progesterone receptor-B in the endometrium of women with endometriosis and in cocultures of endometrial cells exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin.Fertil Steril,2005,84:67-74.
12 Issa JP.Epigenetic variation and human disease.J Nutr,2002,132(8 Suppl):2388-2392.
13 Okano M,Bell DW,Haber DA,et al.DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development.Cell,1999,99:247-257.
14 杨晓丹,韩威,刘峰.DNA甲基化与脊椎动物胚胎发育.遗传,2012,34:1108-1113.
15 黄偲璇,徐丹,汪晖.胚胎(胎儿)发育编程中的表观遗传修饰现象.国际病理科学与临床杂志,2008,28:291-296.
16 Zama AM,Uzumcu M.Targeted genome-wide methylation and gene expression analyses reveal signaling pathways involved in ovarian dysfunction after developmental EDC exposure in rats.Biol Reprod,2013,88: 52.
17 McLachlan JA.Environmental signaling:what embryos and evolution teach us about endocrine disrupting chemicals.Endocr Rev,2001,22: 319-341.
18 Yan Wu,Strawn E,Basir Z,et al.Promoter hypermethylation of progesterone receptor isoform B(PR-B)in Endometriosis.Epigenetics,2006,1:106-111.
19 Mylonas I,Jeschke U,Shabani N,et al.Steroid receptors ERalpha,ER-beta,PR-A and PR-B are differentially expressed in normal and atrophic human endometrium.Histol Histopathol,2007,22:169-176.
Effect of TCDD exposure on the expression of PR isoforms and DNMT-1 of eutopic endometrium in m ice
ZHU Fang*,CUI Zhaoling,HUANG Xianghua,et al.*Department of Obstetrics and Gynecology,The First Hospital of Hebei,Handan 056500,China
Objectives To investigate the influence of TCDD on the expression of PR isoforms(PR-A and PR-B)and DNA methyltransferase-1(DNMT-1)of eutopic endometrium in mice,and to explore the methylation of CpG islands in the promoter region of PR-A and PR-B gene.M ethodsSixty mice divided into 0/0,0/3,3/0,3/3,3/10 groups,with 12 female mice in each group.The mice in each group
TCDD(3μg/kg)again on the 49th day after birth except for the 0/0 group.On the 70th day after birth autotransplantation of endometrium was performed to establish the endometriosis models,at the same time,the mice in each group were exposed to TCDD(3μg/kg)again except for 0/0 group.After the surgery the mice in exposure groups received TCDD(3μg/kg)respectively at 3,6,9 weeks.Finally,at 12 weeks after surgery the mice were executed,the the endomembrane in the position was entrapped with paraffin blocks,and the expression levels of DNMT-1,PR-A were detected by immunohistochemistry(SP),moreover,the methylation of CpG islands in promoter region of PR-A and PR-B gene was detected by methylation-specific PCR(MSP).ResultsThe expression levels of DNMT-1 in 3/3 group were significantly higher than those in 0/0 group(P<0.01),at the same time,which in 3/10 group were significantly higher than those in 3/3 group(P<0.01).However the expression levels of PR-B in 0/0 group were significantly higher than those in 3/3 group(P<0.01),which in 3/3 group were significantly higher than those in 3/10 group(P<0.01).But there were no significant differences in the expression levels of PR-A among different groups(P>0.05).(2)The methylation degree of CpGs islands of PR-B gene in 3/3 group was significantly higher than that in 0/0 group(P<0.05),which in 3/10 group was significant higher than that in 3/3 group(P<0.05).However there was no significant difference in methylation degree of PR-A among different groups(P>0.05).ConclusionTCDD may enhance methylation degree of CpG islands in promoter of PR-B gene by up-regulating the expression of DNMT-1 to reduce the expression of PR-B of eutopic endometrium in mice,as a result,which may promote the pathogenesis and development of endometriosis.
endometriosis;TCDD;DNA methyltransferase-1;PR-A;PR-B
R 711.71
A
1002-7386(2015)03-0334-05
2014-03-20)
10.3969/j.issn.1002-7386.2015.03.003
056500河北省邯郸市第一医院(朱芳);河北省石家庄市妇幼保健院(崔照领);河北医科大学第二医院(黄向华)
黄向华,河北医科大学第二医院; E-mail:huangxh2003@163.com

