木犀草素对脂多糖诱导下小鼠急性肺损伤的保护作用及其机制研究
戴丽端 莉梅 姚志清
木犀草素对脂多糖诱导下小鼠急性肺损伤的保护作用及其机制研究
戴丽端 莉梅 姚志清
目的:探讨木犀草素(luteolin)对脂多糖(1ipopolysaccharid,LPS)诱导的小鼠急性肺损伤的保护作用,以及可能的作用机制。方法96只小鼠随机分为正常组、模型组、木犀草素低剂量组、木犀草素中剂量组、木犀草素高剂量组及地塞米松组,每组8只。以小鼠气道穿刺滴入LPS制备小鼠ALI模型,呼吸机检测气道吸气阻力(Ri)、气道呼气阻力(Re)和动态肺顺应性(Cdyn)的变化,ELISA法测定肺泡灌洗液(BALF)中IL-1β、IL-6和TNF-α的浓度,制作HE病理切片以及Western blot法检测肺组织中NF-κB p65、IκB-α和PIκB-α的表达情况。结果木犀草素能明显抑制Ri、Re增长和Cdyn降低,抑制BALF中IL-1β、IL-6、TNF-α的释放(P<0.05),减轻了肺部病变,抑制了NF-κB p65和PIκB-α的活化。结论木犀草素对LPS诱导的小鼠急性肺损伤具有保护作用,其作用机制与抑制NF-κB信号传导通路表达有关。
木犀草素;急性肺损伤;脂多糖;肺功能
急性肺损伤(acute lung injury,ALI)是由多种原因引起的以肺泡毛细血管膜通透性增高为特征的肺损伤,是临床重症监护患者主要的死亡原因,病死率达到30%~50%[1-3]。ALI病因复杂,多种疾病可并发ALI,致病环节众多,其中过度失控的炎性反应和促炎、抗炎反应失衡是该疾病的主要发病机制,炎性细胞因子和趋化因子间的复杂网络调控在启动、放大和促进病理进程中起到重大作用[4],迄今仍无有效治疗ALI的方法和药物。木犀草属属于黄酮类化合物,因最初从木犀草科木犀草属草本植物木犀草的叶、茎、枝中分离出而得名,是一种天然色素组分,具有很高的生物活性,如抗炎、抗氧化、抗肿瘤、免疫调剂、抑菌等作
用[5]。木犀草素的抗炎作用与抑制炎性介质的释放与核因子κB(nuclear factor κB,NF-κB)介导的基因表达有关。本文旨在探讨木犀草素对ALI是否有干预和保护作用及其在体内的可能作用机制。
1 材料与方法
1.1 动物健康雄性ICR小鼠,体重18~22 g,上海西普尔-必凯实验动物有限公司提供,许可证号码: SCXK(沪)2008-0016。饲养于室温、充分给水和食物。
1.2 试剂及药物脂多糖(LPS)(大肠杆菌O111: B4,Sigma公司,076K4020);木犀草素(Sigma公司);地塞米松磷酸钠注射液(金陵药业股份有限公司,080201);戊巴比妥钠(国药集团化学试剂有限公司,WS 20060401);小鼠白介素-1β(IL-1β)ELISA试剂盒(A6071384)、IL-6 ELISA试剂盒(A6071377)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(A6071379)均购自R&D公司;Braford蛋白含量检测试剂盒、NF-κB p65 Antibody、IκB-α Antibody、IκB-α(Phospho-ser32)Antibody、内参一抗(β-Actin)、内参一抗(Lamin B)、辣根过氧化酶标记的二抗均购于南京凯基生物科技发展有限公司;其他试剂均为国产分析纯。
1.3 主要仪器动物肺功能分析系统(AniRes2005型,北京贝兰博科技有限公司);酶标仪(680型,美国BIO-RAD公司);低温离心机(SH03014型,美国科俊仪器公司);超低温冰箱(1500型,日本SANYO公司),Western电泳仪(164-5051型,美国Bio-Rad公司),分光光度计(UV-2540型,日本SHIMADZ公司)。
1.4 方法
1.4.1 实验分组和模型的制备:96只小鼠随机平均分为两批,每批随机平均分为6组,分别为正常组、模型组、木犀草素低剂量组、木犀草素中剂量组、木犀草素高剂量组及地塞米松组,每组8只。木犀草素低、中、高剂量组于造模前4 d分别灌胃给予25 mg/kg、50 mg/kg、100 mg/kg的木犀草素,正常组和模型组均灌胃给予相同体积的0.9%氯化钠溶液。小鼠腹腔注射1%的戊巴比妥钠(80 mg/kg)后暴露气管,除正常组外,其余组气管内缓慢注入5%的LPS溶液(5 mg/kg),造成小鼠急性肺损伤,正常组以相同方式注入相同体积的0.9%氯化钠溶液。
1.4.2 肺功能相关指标的检测造模6 h后,取一批小鼠腹腔注射1%的戊巴比妥钠(90 mg/kg)深度麻醉,气管插管,将小鼠置于体描箱中。设置呼吸机的频率为90次/min,潮气量为5 ml/kg,呼吸比为15∶10。通过对动物气道压力(Press)、肺容积变化(Volume)的测量,计算出呼吸流速(Flow)、平均吸气气道阻力(Ri)、呼气气道阻力(Re)、肺动态顺应性(Cdyn),经AniRes 2005软件进行分析,40 min后取出小鼠。
1.4.3 支气管肺泡灌洗液(BALF)中细胞因子的测定:取另一批小鼠,造模3 h后,结扎右肺,暴露气管并插管,向左肺注入4℃0.9%氯化钠溶液1 ml进行支气管肺泡灌洗,重复3次。收集肺泡灌洗液并混匀,于4℃、1 500 r/min离心15 min。收集上清液,分装后保存于-70℃超低温冰箱中,ELISA试剂盒检测检测IL-1β、IL-6和TNF-α的浓度。
1.4.4 肺组织病理检测:灌洗结束后,立刻取右肺上叶以10%甲醛溶液固定,HE染色,制作常规石蜡病理切片。观察肺泡壁有无增厚、充血、炎性细胞浸润,间质有无炎症、水肿,肺泡有无坏死、出血等情况。
1.4.5 Western blot测定肺组织中p65、IκB-α、p IκB-α的表达:将100 mg右肺组织置于0.5 ml冰预冷裂解缓冲液中,用十字匀浆器匀浆,充分裂解。4℃,13 000 g,离心10 min,保留上清液。Braford法测定上清液中总蛋白浓度后,进行SDS-PAGE电泳。转膜、封闭并加入相应的一抗(NF-κB p65抗体,1∶400;IκB-α抗体,1∶200;p IκB-α抗体,1∶200)4℃孵育过夜。PBST漂洗后,将膜与HRP结合的二抗(辣根过氧化酶标记抗体,1∶5 000)室温下摇荡孵育1 h。用PBST充分洗膜,然后将显影液加于PVDF膜上,室温放置1 min。暗室中迅速曝光、显影、洗像。
1.5 统计学分析应用SPSS 11.5统计软件,计量资料以±s表示,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 木犀草素对肺功能的影响造模6 h后,6组小鼠的Ri、Re随时间的延长呈增长趋势,其中模型组的增长百分比涨幅最大,正常组涨幅最小;6组小鼠的Cdyn随时间的延长呈下降趋势,其中模型组的下降百分比降幅最大,正常组降幅最小。木犀草素呈剂量依赖性的抑制Ri、Re的增长和Cdyn的下降。地塞米松也可明显抑制Ri、Re的增长和Cdyn的下降。见图1。
2.2 木犀草素对BALF中IL-1β、IL-6和TNF-α的影响与正常组相比,模型组的IL-1β、IL-6和TNF-α均明显增加(P<0.01)。和模型组相比,地塞米松和木犀草素较明显的降低了IL-1β、IL-6和TNF-α等细胞因子的含量(均P<0.01),其中,木犀草素200 mg/kg组作用效果更显著。见表1。
表1 木犀草素对LPS诱导的ALI小鼠BALF中IL-1β、IL-6和TNF-α的影响n=10,pg/ml,±s

表1 木犀草素对LPS诱导的ALI小鼠BALF中IL-1β、IL-6和TNF-α的影响n=10,pg/ml,±s
注:与正常组比较,*P<0.01;与模型组比较,#P<0.01
组别IL-1βIL-6 TNF-α正常组31±12 48±14 64±12模型组194±22*333±24*1 520±156*木犀草素50 mg/kg组123±12#221±31#842±39#木犀草素100 mg/kg组65±10#170±46#375±25#木犀草素200 mg/kg组43±12#83±7#108±8#地塞米松组55±10#72±13#106±13#
2.3 木犀草素对LPS诱导的小鼠ALI的保护作用在解剖过程中发现,模型组肺部水肿严重,肺表面粗糙有出血点,且气管内有泡沫状分泌物流出,正常组无这些症状。组织病理切片可见,被感染的肺出现重度炎症,大量的中性粒细胞、巨噬细胞、淋巴细胞等炎症细胞浸润肺部。肺组织结构发生改变,肺泡腔大面积消失,肺泡壁增厚。木犀草素200 mg/kg组和地塞米松组病变较模型组有所改善,肺泡腔逐渐清晰,肺组织间炎性细胞浸润明显减轻。见图2。
2.4 木犀草素对肺组织中p65、IκB-α、pIκB-α的表达的影响NFκB信号通路调控了众多炎性细胞因子基因的表达,NFκB p65和IκB-α、pIκB-α的Western blot结果显示如图3。造模3 h后,和正常组相比,模型组中P65的表达量显著提高;和模型组相比,木犀草素和地塞米松不同程度的降低了P65的表达。进一步研究发现,ALI模型组中启动炎性反应的p IκB-α表达量显著增加,IκB-α表达量显著降低,而木犀草素和地塞米松却抑制了pIκB-α的表达,促进了IκB-α的表达。见图3。

图1 木犀草素对ALI小鼠Ri、Re及Cdyn的影响
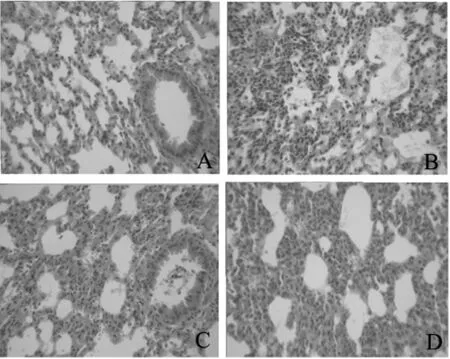
图2 木犀草素对小鼠ALI肺组织病理学的影响(HE×200)
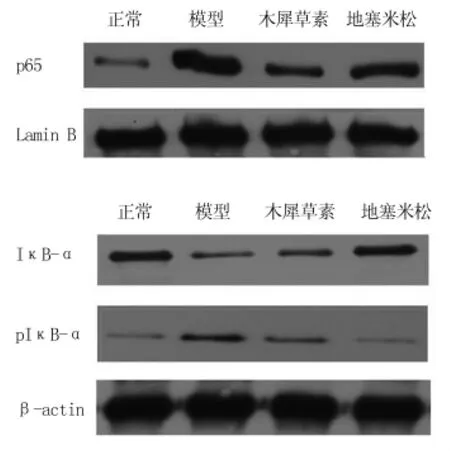
图3 木犀草素抑制了NFκB的活化和IκB-α的磷酸化
3 讨论
内毒素是革兰氏阴性细菌细胞壁外膜上的脂多糖(LPS)成分,可作为抗原激活机体的免疫应答,激活白细胞,诱使TNFα、IL-1β、IL-6等炎性因子的释放[6]。LPS直接作用于肺组织,破坏肺泡引起出血、肺水肿,使坏死组织、炎性细胞堆积,促使肺泡巨噬细胞和炎性反应链的激活,导致肺内炎性反应[7]。近年来,为研究吸入性急性肺损伤,动物模型大多数是用LPS气道穿剌滴入造模。来源于革兰阴性菌外壁的LPS滴注小鼠后,BALF中细胞因子含量显著升高,毛细血管通透性增加和肺功能的变化等表明ALI造模成功[8,9]。后两项指标的变化可间接表明肺表面活性物质的代谢发生改变。
王旭光等[10]采用ELISA检测木犀草素对PGE2生成的影响,结果发现木犀草素抑制LPS诱导的RAW264.7细胞(小鼠单核/巨噬细胞系)PGE2的生成,同时下调LPS诱导的RAW264.7细胞环氧合酶2 (COX-2)及mPGES-1mRNA和蛋白的表达,这可能是木犀草素抗炎的机制之一。范文辉等[11,12]通过建立哮喘气道重塑模型,分别使用地塞米松及木犀草素进行干预,观察支气管肺泡灌洗液中白细胞介素-5和γ干扰素水平的变化,得出结论木犀草素有显著的抗气道重塑作用。同时发现木犀草素抑制气道重塑的作用机制为抑制气道白细胞介质13受体α2(IL-13Rα2)的表达。张毅等[13]研究木犀草素对LPS诱导的RAW264.7细胞核因子κB(NF-κB)和COX-2表达及NF-κB DNA结合活性的影响,结果发现木犀草素能显著性抑制LPS诱导的RAW264.7细胞PGE2的生成,降低NF-κB的DNA结合活性,下调LPS诱导的RAW264.7细胞COX-2mRNA、NF-κB和COX-2蛋白的表达。这些研究结果提示,木犀草素可能对ALI具有保护作用。
本研究结果显示,木犀草素能明显抑制脂多糖诱导的急性肺损伤小鼠的Ri、Re增长和Cdyn降低,抑制BALF中IL-1β、IL-6、TNF-α的释放,减轻了肺部病变,抑制了NFκB p65和pIκB-α的活化。这表明木犀草素对LPS诱导的小鼠急性肺损伤具有保护作用。
TNF-α和IL-1β是ALI早期两个重要的前炎性因子[14]。在炎性反应初期,TNF-α除能动员血循环中的PMN向炎症部位聚集外,还能动员骨髓白细胞进入血液循环,同时激活内皮细胞。内皮细胞受TNF-α刺激时,释放E选素、L选择素、细胞间黏附分子1和血管黏附因子1等黏附因子,进一步诱导IL-1、IL-6、IL-8、CSF等细胞因子的分泌,共同参与炎性反应。当PMN被激活后,TNF-α又能增强PMN的吞噬能力,促进PMN脱颗粒和释放溶酶体,增强PMN呼吸爆发,产生大量脂质代谢产物,破坏毛细管内皮细胞的屏障功能,增加肺毛细血管的通透性,刺激内皮细胞释放大量组织因子,同时抑制纤溶活性,损害毛细血管的抗凝功能。这些促炎因子作为重要的信号因子,进一步启动、放大和延续全身或局部炎性反应,呈现级联反应,最终导致炎症失控。本研究表明木犀草素能明显的降低了TNF-α、IL-1β和IL-6等细胞因子的含量,其中200 mg/kg作用效果更显著。
目前研究证实,与炎症和免疫反应关系密切的许多细胞因子、黏附分子基因启动部位均含有核因子NF-κB位点。NF-κB对细胞因子网络具有广泛的调控作用,能够调控多种细胞因子的基因转录。NF-κB的主要形式为p50和p65组成的二聚体,p50是与DNA结合的部位,p65参与基因转录的超始调节,p65是NF-κB的主要活性形式,并可促进p50与DNA结合,当p65与细胞质内抑制蛋白IκB结合,可掩盖p50上核定位信号,仅有p65蛋白C末含有转录激活区域,能够直接启动基因的转录[15,16]。NF-κB一般存在于细胞质中,同IκB仅紧密结合,却不发挥作用。在IL-1、TNF、LPS等炎性介质作用下,细胞质内IκB激酶被激活,导致IκB被磷酸化,进而由蛋白酶降解,使IκB发生降解、磷酸化,多聚体上的IκB分子的2个丝氨酸磷酸化、泛素化而降解,NF-κB则从多聚体上释放,进入细胞核与DNA特定靶κB部位结合,调控特定基因转录[17]。本研究提示木犀草素保护急性肺损伤中降低了P65的表达同时抑制了pIκB-α的表达,同时促进了IκB-α的表达。本研究说明木犀草素对NFκB信号通路的调控在急性肺损伤的保护中起到了重要作用,是否和其他细胞信号通路有关目前尚不清楚,有待进一步研究。
1 Matthay M A,Uchida T,Fang X.Clinical acute lung injury and acute respiratory distress syndrome.Curr Treat Options Cardiovasc Med,2002,4: 139-149.
2 Vincent JL,Sakr Y,Ranieri VM.Epidemiology and outcome of acute respiratory failure in intensive care unit patients.Crit Care Med,2003,31: S296-S299.
3 Cepkova M,Matthay MA.Pharmacotherapy of acute lung in jury and the acute respiratory distress syndrome.J Intensive Care Med,2006,21:188.
4 Zambon M,Vincent JL.Mortality rates for patients with acute lung injury/ ARDS have decreased over time.Chest,2008,133:1120-1127.
5 Xagorari A,Papapetropoulos A,Mauromatis A,et al.Luteolin inhibits an endotoxin stimulated phosphorytlation cascade and-proin flammatory cytokine production in macrophage.J Pharm Exp Ther,2001,296:181-187.
6 Kalyanaraman M,Heidemann SM,Sarnaik AP.Macrophage inflammatory Protein-2 predicts acute lung injury in endotoxemia.J Invegtig Med,1998,46:275-278.
7 Martin TR.Direct lung injury by bacteria:clarifying the tools of the trade.Crit Care Med,2004,32:2360-2361.
8 朱瑞芳,周敏,何建林.姜黄素对大鼠油酸型急性肺损伤的保护作用.中国中药杂志,2008,33:2141-2145.
9 陆晶,张林丽,余书勤.氧化基参咸碱对油酸型免急性肺损伤的干预作用.中国新药杂志,2007,16:1090-1094.
10 王旭光,陈根殷,陈妙萍,等.木犀草素对LPS诱导的RAW264.7细胞COX-2及mPGES-1表达的影响.中药材,2007,30:1263-1266.
11 范文辉,黄茂.木犀草素对哮喘小鼠气道重塑的影响及机制探讨.安徽医药,2006,10:647-649.
12 王正东,黄茂,范文辉,等.木犀草素对哮喘气道重塑小鼠模型气道IL-13Rα2表达的影响.南京医科大学学报(自然科学版),2007,27: 491-494.
13 张毅,王旭光.木犀草素的体外抗炎机制研究.广州中医药大学学报,2007,24:231-234.
14 李洪霞,张进川,赵亚力,等.急性肺损伤大鼠TNF-α、IL-1β、IL-lra mRNA的表达及药物干预.解放军医学杂志,2005,30:306-309.
15 Baldwin AS.The NF-kappa B and I kappa B proteins:new discoveries and insights.Annu Rev Immunol,1996,14:649-683.
16 Dejardin E.The alternative NF-kappa B pathway from biochemistry to biology;pitfalls and promises for future drug development.Biochem Pharmacol,2006,72:1161-1169.
17 De Bosschet K,Vanden Berghe W,Haegeman G.The Interplay between the glucocorticoid receptor and nuclear factor-kappa B or activator protein-1:molecular mechanisms for gene repression.Endocr Rev,2003,24:488-522.
Study on protective effects and its imechanism of luteolin on acute lung injury induced by lipopolysaccharide in m ice
DAI Li,DUAN Limei,YAO Zhiqing.Dental Hospital of Medical School,Nanjing University,Nanjing 210008,China
ObjectiveTo investigate the effect of luteolin on acute lung injury(ALI)induced by lipopolysaccharide (LPS)in mice,and to explore possible action mechanism.M ethodsNinety-six mice were random ly divided into 6 groups: notmal control group,model group,luteolin low-dose group luteolin median-dose group luteolin high-dose group,dexamethasone control group,with 8 mice in each group.The animal models with ALI were established by injecting LPS into airway of mice,then the changes of lung airway inspiratory resistance(Ri),expiratory resistance(Re)and dynamic lung compliance(Cdyn) were detected by pulmonary function test apparatus.The levels of IL-1β,IL-6,TNF-α in bronchoalveolar lavage fluid(BALF) were determined by ELISA.The pathological sections were made,and the histopathological changes were observed under light microscope.The expression levels of NF-κB p65,IκB-α and PIκB-α in lung tissues were detected by Western blotting.ResultsLuteolin could obviously inhibit Ri,Re and reduce Cdyn,and could significantly decrease the concentrations of IL-1β,IL-6 and TNF-α in BALF(P<0.05),as a result,which could relieve lung injury,moreover,luteolin could inhibit the activation of NF-κB p65 and PIκB-α.ConclusionLuteolin has a protective effect on ALI induced by LPS in mice,and its action mechanism is correlated to inhibiting the expression of NF-κB signal transduction pathway.
luteolin;acute lung injury;lipopolysaccharide;pulmonary function
R 563
A
1002-7386(2015)03-0339-04
2014-09-15)
10.3969/j.issn.1002-7386.2015.03.004
210008南京市,南京大学医学院附属口腔医院

