MDEA+MEA天然气脱碳工艺影响因素
陈杰,张新军,褚洁,史泽林,唐建峰
(1中海石油气电集团技术研发中心,北京100027;2中国石油大学 (华东)储运与建筑工程学院,山东 青岛266580)
引 言
天然气脱碳是预处理工艺中的关键环节,常用的脱除天然气中CO2的方法主要有以下3种:化学吸收法、变压吸附法和膜分离法[1-4]。目前醇胺化学吸收法已成为常用的天然气脱碳方法,在天然气脱酸装置中得以广泛应用,并取得良好效果[5-8]。实际工厂中,在装置运行稳定的基础上,需要调节操作参数以保证较好的吸收效果,同时降低运行能耗。目前,国内外针对MDEA及其他单一或混合胺液的吸收再生性能进行了大量的研究[9-12],但多采用反应釜等小型实验装置,研究结果难以在实际生产中得到验证,结论适用性受限,因此采用中试实验装置验证已有的小实验结论显得十分有必要。
由于大型实验装置成本高、设计复杂、调整工况耗时长、对操作人员技术要求高等特点,导致目前国内外关于此方面的研究不多,相关的研究结论较少且多属于公司专有技术,因此本文基于胺法脱碳实验装置,对胺法脱碳工艺操作参数的优化做了详细研究,旨在为天然气脱碳工艺提供理论指导和基础数据。
本文实验研究采用胺液配方为2mol·L-1MDEA+1mol·L-1MEA[13]混合胺液,此配方是通过前期配方筛选小实验得到的综合性能较优的胺液配方。
1 实验方法
1.1 实验流程
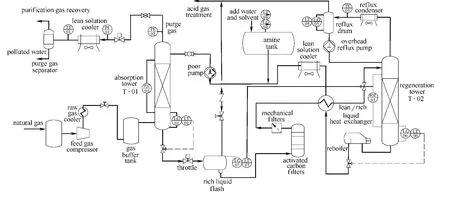
图1 胺法脱酸工艺流程图Fig.1 Flow chart of amine deacidification
本文实验流程如图1所示,采用撬装化模块设计。在典型脱碳工艺流程的基础上增加了原料气配气模块、原料气循环模块,实验过程中的流量、温度及压力数据通过传感器自动采集,并可通过自控阀门进行自动调节和远程控制。
其工艺流程为:配置好的原料气体在混合罐内进行充分混合,经压缩机加压进入吸收塔,在吸收塔中与贫胺液接触实现天然气脱碳,净化气经分离、降压后返回原料气混合罐。富胺液由吸收塔塔底排出,经过闪蒸、过滤、换热后,进入再生塔、再沸器进行富液再生。再生后的贫胺液经过换热、冷却,由胺液循环泵增压返回吸收塔顶部。与反应釜等小型实验装置相比,本文实验装置可模拟工厂实际生产,实现胺液吸收与再生循环过程的连续、稳定操作。
1.2 实验方法
(1)实验试剂
各实验试剂参数如表1所示。
(2)实验过程
a.原料气配置。将天然气和CO2同时注入原料气混合罐,自混合罐底部取原料气样,运用布鲁克GC450气相色谱仪定时检测气相成分,分别配制出CO2含量为6%、4%的原料气。
b.胺液配置。将MDEA和MEA胺液注入胺液储罐,根据实验要求配制出合适的混合胺液,本文实验采用2mol·L-1MDEA+1mol·L-1MEA混合胺液,配置胺液使用的溶剂是纯净水。
c.运行实验。采用单吸收塔流程,控制原料气流量50Nm3·h-1,按实验要求进行某一操作参数下的天然气脱碳工艺实验。
d.定时取样。待每组工况稳定后,分别于原料气混合罐底部、吸收塔顶部取原料气和净化气样,并于吸收塔底部、胺液循环泵出口取富液、贫液样,进行气液相成分检测。
e.调整实验工况。待上一组工况稳定、测样完毕后,改变实验工况,分别进行不同吸收温度、吸收压力、胺液循环流量及再生温度、再生压力下的天然气脱碳工艺实验。每组工况自调整至稳定需时约2h,且为保证实验数据稳定,每次实验启动到结束应不少于6h。
(3)实验结果检测
本实验装置得到的直接产物是原料气、净化气、富液及贫液,因此需通过特定的检测手段来得到本实验使用的醇胺溶液配方的脱碳效果。本文采用布鲁克GC450气相色谱仪来测定原料气及净化气中CO2含量,采用富、贫液酸解实验[14]来测定胺液中的CO2含量。酸解实验装置如图2、图3所示,其主要实验原理为强酸置换弱酸,使用强酸H2SO4将CO2从胺液中置换出来,通过测定放出的CO2气体体积计算溶液对CO2的吸收量。
1.3 分析指标
天然气脱酸性能的分析通常以CO2脱除率、残余酸气负荷、解吸率为分析指标,指标定义如下。
(1)CO2脱除率
指原料气中脱除的CO2量与原料气中初始CO2含量的比值,表示胺液的吸收性能。计算公式如式 (1)所示
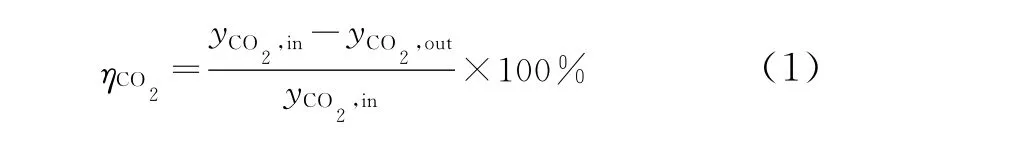
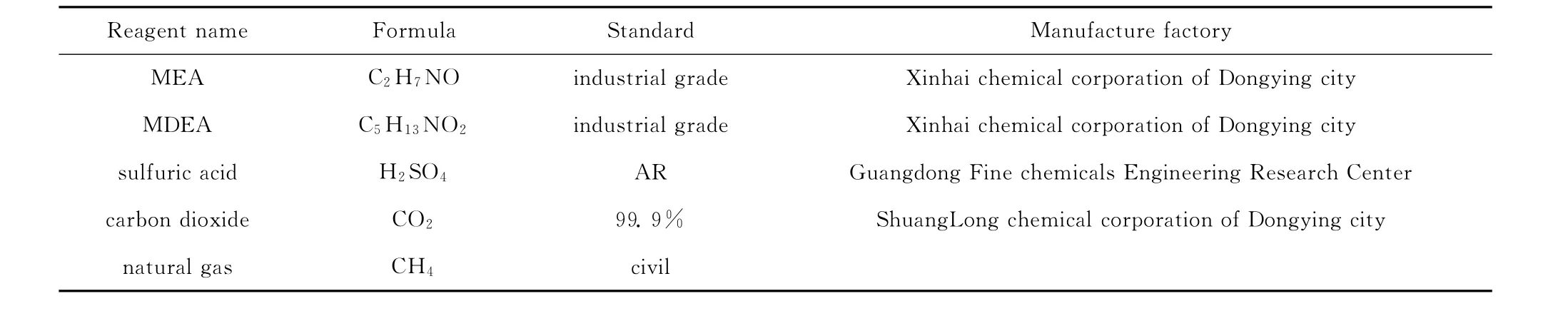
表1 实验试剂明细表Table 1 Parameters of reagents

表2 实验所用胺液物化参数表Table 2 Chemical parameters of amine solution
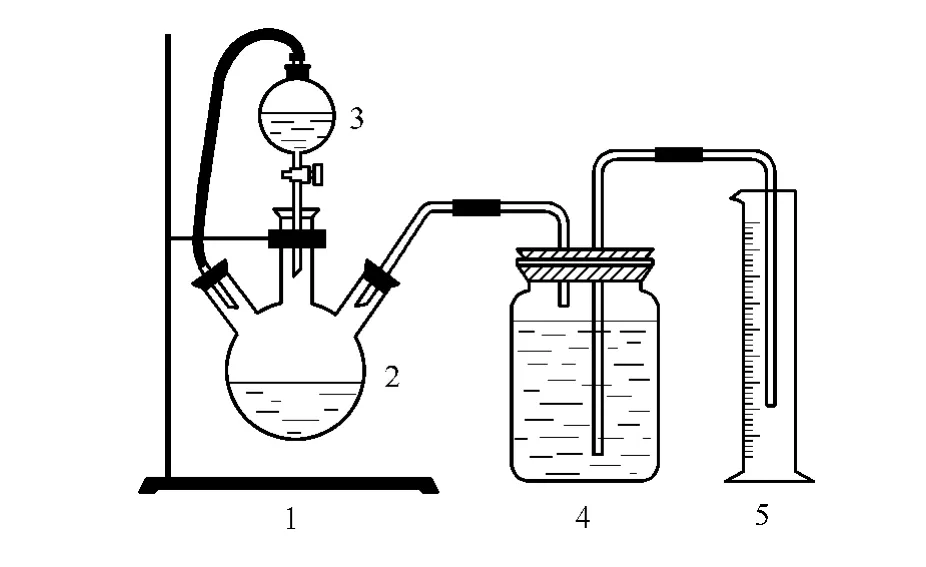
图2 富液CO2含量测定实验装置Fig.2 Experimental determination of CO2in rich liquid 1—formwork units;2—three-necked flask;3—funnel;4—jars;5—graduate
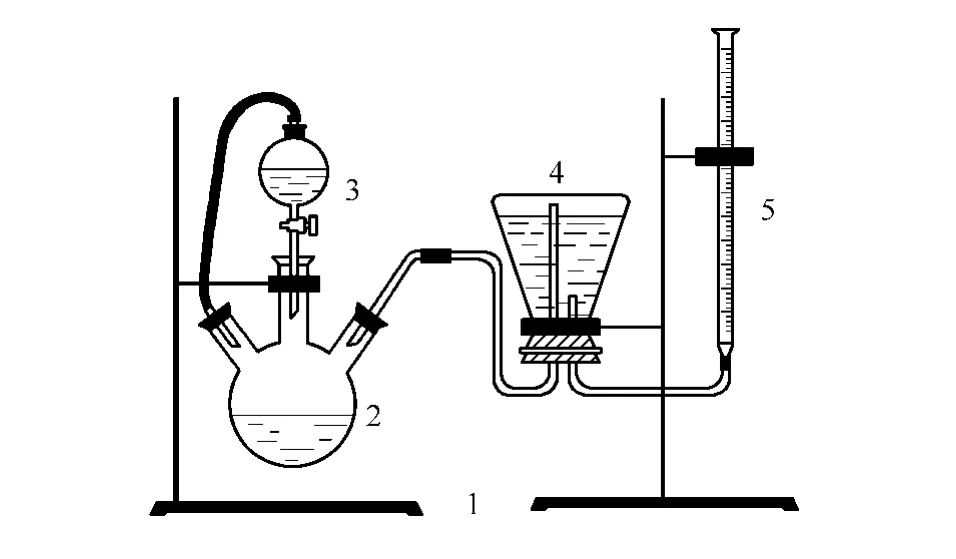
图3 贫液CO2含量测定实验装置Fig.3 Experimental determination of CO2in poor liquid 1—formwork units;2—three-necked flask;3—funnel;4—erlenmeyer flask;5—trachea
(2)残余酸气负荷
指经过再生后贫液中单位体积醇胺所含的酸气摩尔量,单位为mol·L-1,该指标表征胺液的再生效果。实验中通过贫液酸解实验将再生后的贫液用强酸进行酸解,得到的CO2含量即为再生后胺液中所含CO2量,进而计算出贫液中残余酸气负荷。
(3)解吸率
指胺液再生后解吸出的酸气量与富液中所含酸气总量的比值,该指标能够表示胺液的再生能力。实验中通过富/贫液酸解实验得到液样中酸气体积,进而计算出解吸率。
2 实验结果分析
2.1 影响吸收性能操作参数分析
(1)吸收温度
针对混合胺液 MDEA+MEA (2mol·L-1+1mol·L-1),在再生压力50kPa,再生温度110℃,胺液循环流量0.2m3·h-1,吸收压力3.0 MPa条件下,进行不同吸收温度下吸收效果的实验研究,实验结果如图4所示。

图4 不同吸收温度下的CO2脱除率Fig.4 CO2removal efficiency in different absorption temperature
由图4可以看出,两种酸气浓度下,CO2脱除率均随着实验吸收温度的增加而升高,即提高吸收温度有利于提高胺液的吸收性能。产生此现象的原因可用胺液与CO2的反应机理来解释,温度升高能够提高化学反应的速率,同时促使反应向吸收CO2的方向进行,进而提高CO2脱除率。CO2含量为6%时,温度较低时由于原料气中CO2浓度较高,反应速率较慢,温度高于50℃后,反应速率明显增快;CO2含量为4%时,脱除率随反应温度的升高而增大,反应速率基本保持稳定。因此,分析认为,吸收温度最优值受气液接触时间、酸气浓度、反应平衡、胺液的吸收容量、胺液性质等的影响,并不是越高越好。温度的升高会使得溶液对CO2的溶解度减小,导致溶液可吸收的CO2量减少[15]。当吸收温度处于60℃附近时易对脱酸装置造成腐蚀[16]。为防止腐蚀对设备造成损害,笔者根据本实验设备和操作参数建立了模型,模拟吸收效果随吸收温度的变化,结果证明,高于60℃时,净化气中酸气含量升高,净化效果变差。综合实验数据、模拟结果和理论分析可知,认为吸收温度在55℃时,MDEA+MEA混合胺液具有较好的吸收性能。
(2)吸收压力
针对 MDEA+MEA (2mol·L-1+1mol·L-1)混合胺液,在再生压力50kPa,再生温度110℃,胺液循环流量0.2m3·h-1,吸收温度55℃条件下,不同的吸收压力对CO2吸收效果的影响进行实验研究,实验结果如图5所示。
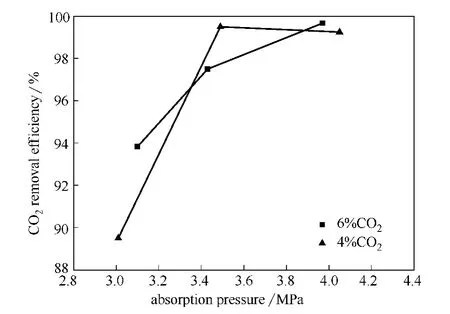
图5 不同吸收压力下的CO2脱除率Fig.5 CO2removal efficiency in different absorption pressure
从图5中可以看出,在两种酸气浓度下,CO2脱除率随吸收压力的增加而升高,即净化气CO2含量随吸收压力的增加而减少;原料气中CO2含量为4%时,当吸收压力提高到3.5MPa时,吸收反应已基本达到平衡,CO2脱除率达到最高,而后随压力的增大CO2脱除率几乎不变;原料气中CO2含量为6%时,CO2脱除率随压力的增大而升高,吸收压力低于3.5MPa时随吸收压力的升高CO2脱除率的升高速率较大,吸收压力高于3.5 MPa以后,随吸收压力的升高CO2脱除率的升高速率减缓。分析认为,吸收压力的增加会导致单位体积内CO2含量的提高,增加CO2与胺液的接触面积,且提高压力有利于化学反应平衡向吸收的方向移动,因此在初始阶段压力的升高可促进胺液对CO2的吸收;当压力进一步升高后,压力对吸收性能的增幅减弱。综合分析实验结果,认为3.5~4.0MPa左右的吸收压力下胺液具有较好的吸收性能。
(3)胺液循环流量
针对 MDEA+MEA (2mol·L-1+1mol·L-1)混合胺液,在再生压力50kPa,再生温度110℃,吸收压力3.0MPa,吸收温度55℃条件下,不同的胺液循环流量对CO2吸收效果的影响进行实验研究,实验结果如图6所示。
从图6中可以看出,在两种酸气浓度下,CO2脱除率随胺液循环流量的增加而升高,即净化气CO2含量随胺液循环流量的增加而减少;在酸气含量6%的原料气条件下,胺液流量对CO2脱除率的影响较大,在酸气含量4%条件下,胺液流量对CO2脱除率的影响较小。说明提高胺液流量有利于增强胺液的CO2吸收效果,且其影响大小与原料气中酸气浓度大小有关。分析产生这种现象的原因,认为胺液循环流量的升高会增加处理单位CO2的胺液量,提高单位体积内胺液与CO2的接触面积,因此可增强胺液的CO2吸收效果。对于酸气含量4%的原料气,较低的胺液流量便能够实现与CO2的充分接触,因此当胺液流量达到一定值后,提高胺液流量对吸收效果的影响不大;而对于酸气含量6%的原料气,胺液流量低时不足以实现与CO2的充分接触,因此提高胺液流量可明显增强其吸收效果。但过高的胺液循环流量会导致胺液的利用效率下降,装置再生能耗增加,相同再生条件下再生效果变差。因此综合分析认为,胺液的流量为0.25m3·h-1时胺液的吸收效果较好。
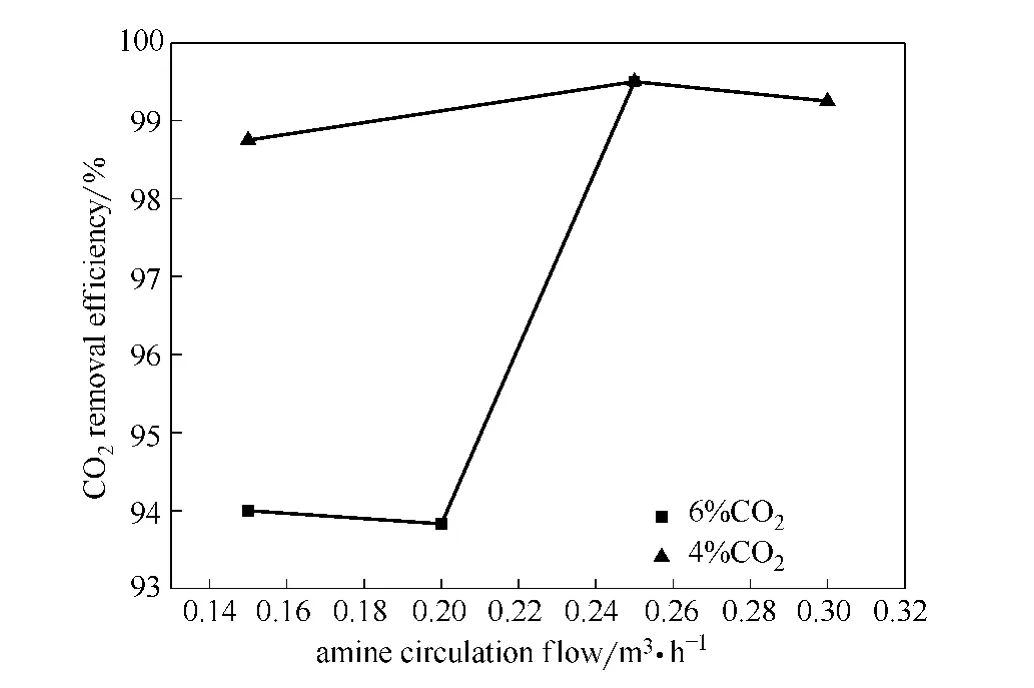
图6 不同胺液循环流量下的CO2脱除率Fig.6 CO2removal efficiency in different amine circulation flow
综合吸收温度、吸收压力及胺液循环流量对胺液吸收性能的影响分析认为,针对本文实验装置,在原料气处理量50Nm3·h-1时确定的最优吸收操作参数为:吸收温度55℃,吸收压力3.5~4 MPa,胺液循环流量0.25m3·h-1。
2.2 影响再生性能操作参数分析
(1)再生温度
对 MDEA+MEA (2mol·L-1+1mol·L-1)的胺液配方,在吸收压力3.0MPa、胺液循环流量0.20m3·h-1、吸收温度55℃,再生压力50kPa条件下,分析胺液在不同再生温度下的再生效果,考察再生温度变化对解吸率的影响,实验结果如图7所示。
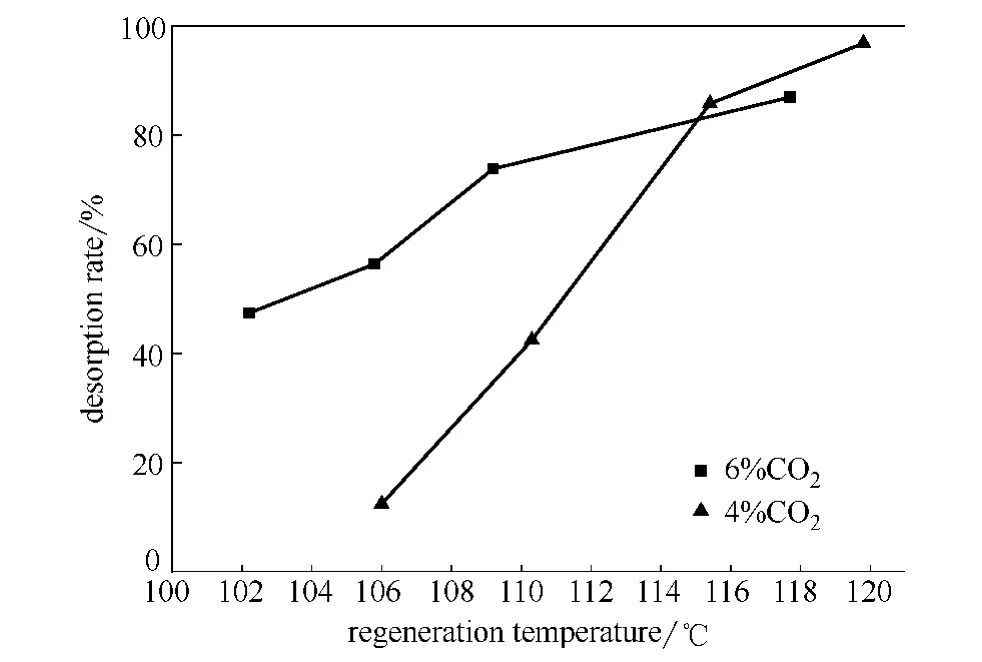
图7 不同再生温度下的解吸率Fig.7 Desorption rate in different regeneration temperature
从图7中可以看出,再生温度的变化对解吸率及酸气残余负荷的影响较大,相同原料气组成下,解吸率随着再生温度的增大而增大,即酸气残余负荷随再生温度的增加而减小;再生温度低于115℃时,原料气CO2含量6%时的解吸率明显大于原料气CO2含量4%时;再生温度大于115℃时,两种原料气组成的解吸率相近。分析产生这种现象的原因,认为再生温度低于115℃时,在原料气CO2浓度高的情况下,富液中的CO2含量较高,而再生后贫液的CO2含量相近,导致酸气浓度6%原料气的解吸率较高;再生温度高于115℃时,两种原料气富液的再生效果相差不大,再生后贫液CO2含量均较低,解吸率达到90%左右。因此,综合以上分析可得,提高再生温度有利于胺液的再生,但再生温度过高易导致胺液变质、再生能耗大幅度增加。根据实验分析结果,再生温度120℃时胺液的再生效果较好。
(2)再生压力
对 MDEA+MEA (2mol·L-1+1mol·L-1)的胺液配方,在吸收压力3.0MPa、胺液循环流量0.20m3·h-1、吸收温度55℃,再生温度110℃条件下,分析胺液在40~70kPa不同再生压力下的再生效果,考察再生压力变化对解吸率和残余酸气负荷的影响,实验分析结果如图8所示。
从图8中可以看出,两种酸气浓度下,解吸率随再生压力的增大而降低,再生效果均变差。由于压力升高,反应会向胺液中吸收CO2的方向进行,胺液中CO2含量会升高,则解析率降低。酸气浓度为4%原料气的解吸率变化曲线明显低于酸气浓度为6%的原料气。分析产生这种现象的原因,与酸气浓度为4%的条件相比,酸气浓度为6%的条件下,富液中的酸气含量较高,而再生后贫液的CO2含量相近,导致相同再生压力下6%原料气的解吸率高于4%原料气。因此可得,降低再生压力有利于促进胺液的再生,但实验中发现再生压力为45kPa及更小值时会导致再沸器中胺液的蒸汽量过大、再生能耗增高。综合分析实验结果,认为再生压力50kPa时胺液的再生效果较好。
综合再生温度及再生压力对胺液再生性能的影响分析认为,本文实验装置条件下确定的最优再生操作参数为:再生温度120℃,再生压力50kPa。两种原料气条件下的再生效果均明显高于其他实验工况。
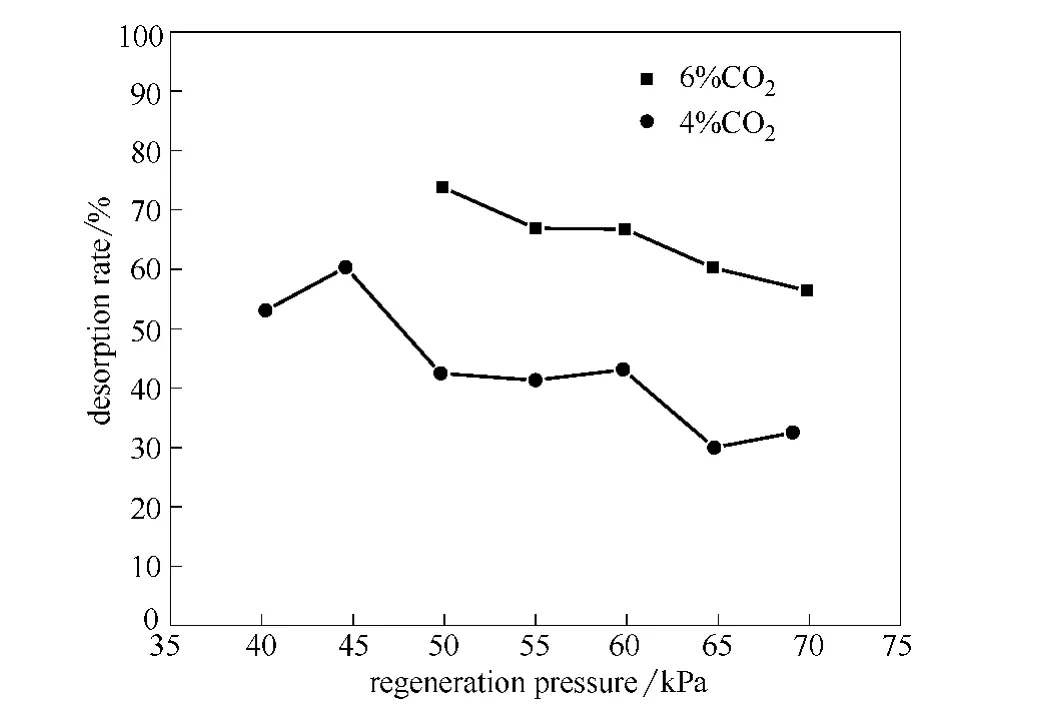
图8 不同再生压力下的解吸率Fig.8 Desorption rate in different regeneration pressure
3 结 论
本文基于本中试胺法脱碳实验装置,根据混合胺液 MDEA+MEA (2mol·L-1+1mol·L-1)脱碳工艺实验结果,对不同原料气CO2浓度(6%、4%),原料气流量50Nm3·h-1下,影响吸收效果和再生效果的参数进行了对比分析,得出以下结论:
(1)在本实验操作参数范围内吸收温度、吸收压力、胺液循环流量的增加均能够提升胺液的CO2吸收性能。但吸收温度超过60℃时会增强酸气腐蚀装置,吸收压力超过3.5MPa后对胺液的CO2吸收效果影响不明显,胺液循环流量超过0.25m3·h-1后会降低胺液的再生效果且导致装置运行能耗增加。因此,在实际天然气脱碳工艺中可通过在一定范围内提升吸收温度、吸收压力、胺液循环流量来改善胺液的CO2吸收效果。
(2)在本实验操作参数范围内升高再生温度、降低再生压力均可提升胺液的再生效果。但再生温度超过120℃后会导致胺液变质、能耗增加,再生压力低于45kPa后会导致再沸器中胺液蒸汽量过大、再生能耗过高。因此在实际天然气脱碳工艺中,可通过在一定范围内升高再生温度、降低再生压力来改善胺液的再生效果。
(3)MDEA+MEA (2mol·L-1+1mol·L-1)混合胺液在天然气胺法脱酸实验装置中的最佳的吸收操作参数为:吸收温度55℃,吸收压力3.5~4MPa,胺液循环流量0.25m3·h-1;最佳的再生操作参数为:再生温度120℃,再生压力50kPa。
[1] Liu Lu (刘露),Duan Zhenhong (段振红),He Gaohong(贺高红).Comparison and progress of CO2gas removal method [J].ChemicalIndustryandEngineeringProgress(化工进展),2009,28 (S1):290-292.
[2] Zhu Zhenyu (朱振玉),Liu Enju (刘恩举),Yang Jie (杨杰),Song Feng (宋峰).The principle and technology of carbon dioxide removal[J].GuangdongChemicalIndustry(广州化工),2011,39 (5):51-53.
[3] Jiang Ning (姜宁),Li Chunfu (李春福),Wang Yuanjiang(王 远 江),Guo Qingsheng (郭 庆 生).The review of technology on carbon dioxide remove from natural gas [J].ChemicalEngineering&Equipment(化学工程与装备),2011,(7):147-150.
[4] Shaw T P,Hughes P W.The optimization of technology on carbon dioxide removal [J].ForeignOilfieldEngineering(国外油田工程),2003,19 (1):32-34.
[5] Zhang Yongjun (张永军),Yuan Huimin (苑慧敏),Wan Shubao(万书宝),Li Yinghui(李影辉),Zhang Zhixiang(张志翔),Li Wenpeng (李文鹏).Technology of carbon dioxide remove from natural gas [J].Chemical Intermediates(化工中间体),2008,(9):002.
[6] Wang Shaogui(王绍贵).The Progress and development trend of carbon dioxide removal[J].LutianhuaKeJi(泸天化科技),2000,(2):100-104.
[7] Ma Le(马乐).Research of formula of active MDEA based carbon dioxide absorbent[D].Beijing:Beijing University of Chemical Technology,2011.
[8] Dranchuk P M,Abou-Kassem H.Calculation ofZfactors for natural gases using equations of state [J].Journalof CanadianPetroleumTechnology,1975,14 (03).
[9] Gu Guanglin (顾 光 临).Research of compound chemical absorbent for carbon dioxide [D].Beijing: Beijing University of Chemical Technology,2010.
[10] Xu Li(徐莉).A study on fundamental issues of carbon dioxide absorption using mixed TETA-MDEA aqueous solution [D].Tianjin:Hebei University of Technology,2009.
[11] Xiang Fei(项菲).Study on absorption of CO2in flues into aqueous solutions of DETA/TETA [D]. Hangzhou:Zhejiang University,2003.
[12] Tan Dazhi(谭大志).The basic research on absorption of CO2into aqueous solutions [D].Dalian:Dalian University of Technology,2005.
[13] Chen Jie(陈杰),Guo Qing (郭清),Hua Yihuai(花亦怀),Tang Jianfeng (唐建峰),Feng Jie (冯颉),Chu Jie (褚洁),etal.Study on absorption and desorption of MDEA+MEA/DEA mixed solution for natural gas decarburization [J].NaturalGasIndustry(天 然 气 工 业),2014,34 (05):137-143.
[14] Wang Kaiyue (王开岳).Natural Gas Purifying Process—The Decarburization Desulfurization,Dehydration,Sulfur Recovery and Tail Gas Treatment(天然气净化工艺——脱硫脱碳、脱水、硫磺回收及尾气处理)[M].Beijing:Petroleum Industry Press,2005.
[15] Chen Long (陈 龙 ).Impact of the addition of MEA to MDEA solution on MDEA's absorption of carbon dioxide[D].Beijing:School of Energy,Power and Mechanical Engineering,2013.
[16] Li Xianhua(李宪华),Zou Guang (邹广).The corrosion and protection of amine regeneration device [J].Henan ChemicalIndustry(河南化工),2011,28 (4):5-7.

