右美托咪定用于Ebstein畸形矫治术麻醉管理的临床观察
王丽晶,刘丽丹,孙莹杰,刁玉刚,张铁铮,金 强
沈阳军区总医院麻醉科,辽宁沈阳 110016
三尖瓣下移畸形(Ebstein畸形)是一种复杂的先天性心脏病,发病率约占先天性心脏病的1.1%[1]。由于5% ~10%的Ebstein畸形伴有室上性心动过速[2],且危重患者常并发右心功能不全。因此,维持术中血流动力学稳定、维护右心功能和减少心律失常的发生,成为此类患者麻醉管理的关键。右美托咪定(dexmedetomidine,Dex)是新型高选择性α2受体激动药,具有中枢性镇静、镇痛、抗交感、降低应激反应等作用[3]。选取沈阳军区总医院2012年1月至2013年5月择期行体外循环下Ebstein畸形心内直视矫治术患者20例,通过观察其对手术期间血流动力学、右心功能和室上性心动过速发生率的影响,探讨Dex用于Ebstein畸形矫治术患者麻醉的安全性和有效性。
1 资料与方法
1.1 临床资料 本组患者共20例。其中,男性9例,女性11例,年龄7~32岁,体重25~67 kg。按美国麻醉师协会(American Society of Anesthesiologists,ASA)分级[4]Ⅱ~Ⅲ级。按随机数字表法均分为右美托咪定组(D组)和对照组(C组),每组各10例。排除标准为重度肺动脉高压、严重高血压、明显心动过缓、糖尿病。两组患者年龄、体重、性别、手术时间、麻醉时间和体外循环时间等方面比较差异无统计学意义。所有入组患者围手术期无死亡报告。见表1。
表1 两组患者一般情况比较(±s)

表1 两组患者一般情况比较(±s)
组别 例数(例)男性/女性(例) 年龄(岁) 体重(kg) 手术时间(min) 麻醉时间(min) 心肺转流时间(min)D组 10 4/6 16.5±3.2 42.5±9.2 135.6±32.8 172.5±35.2 81.3±32.0 C组 10 5/5 15.2±2.9 45.6±10.3 128.2±29.3 181.8±41.6 78.9±30.5
1.2 麻醉方法及体外循环方法 成人麻醉前1 h口服地西泮10 mg,麻醉前30 min肌注吗啡10 mg、长托宁0.5 mg。小儿麻醉前30 min肌注阿托品0.1 mg/kg,哌替啶1 mg/kg。患者入室后建立静脉通路,连接Datex-Ohmeda多功能监护仪(美国GE公司),桡动脉穿刺置管连续测量动脉压,监测心电图和脉搏血氧饱和度。D组麻醉诱导前15 min内静脉泵注0.004%Dex负荷剂量0.5 μg/kg,麻醉诱导依次静注丙泊酚1~2 mg/kg、舒芬太尼1 μg/kg和哌库溴铵0.1 mg/kg。经口气管内插管后连接Ohmeda麻醉机(芬兰Ohmeda公司)行机械通气,并置入食管超声探头,调整呼吸机参数(潮气量8~10 ml/kg、呼吸频率10~15/min、吸入氧浓度60% ~80%、吸呼比1:2),维持呼气末二氧化碳分压35~45 mmHg。麻醉维持采用吸入2%七氟醚、静脉持续泵注 Dex 0.7 μg/(kg·h),并间断给予咪达唑仑、舒芬太尼和哌库溴铵。C组应用等容量生理盐水代替Dex。患者麻醉后行右颈内静脉穿刺置管,监测中心静脉压(central venous pressure,CVP)。主动脉阻断前静脉注射肝素3 mg/kg后,待活化凝血时间达400 s后常规建立体外循环,应用Jostra-20型人工心肺机(德国Maquet公司)及Medtronic型膜式氧合器(美国Medtronic公司)行非搏动性灌注,动脉端安装微栓过滤器。预充液成分包括复方乳酸钠林格液、琥珀酰明胶和20%人血白蛋白,并加入乌司他丁、肝素、甲泼尼龙、甘露醇等药物。根据红细胞比容测定结果酌情加入红细胞及血浆成分。主动脉根部灌注4℃晶体高钾停搏液完成心脏停跳。体外循环采用浅低温(鼻咽温度32~35℃),灌注流量为100~125 ml/(kg·min),维持灌注压力30~50 mmHg、CVP 0~4 cmH2O、二氧化碳分压35~45 mmHg、红细胞比容25% ~30%。体外循环结束后,经颈内静脉缓慢注射1:1.5剂量鱼精蛋白中和肝素,并进行改良超滤。
1.3 监测指标 记录入手术室(T0)、麻醉诱导前(T1)、气管插管前(T2)、气管插管后(T3)、切皮前(T4)、切皮后(T5)、锯胸骨前(T6)和锯胸骨后(T7)的平均动脉压(MAP)和心率(HR),计算应用负荷剂量Dex、气管插管、切皮和锯胸骨等重要刺激前后MAP和 HR 的变化幅度[(T1-T0)/T0、(T3-T2)/T2、(T5-T4)/T4、(T7-T6)/T6],作为术中血流动力学是否稳定的指标。经食管超声心动图测量阻断前(T8)和复跳后30 min(T9)右心室射血分数(RVEF)、右心室心肌作功指数(RVMPI)及右心室舒张早期最大运动速度(TAM-MDV)作为右心功能指标,并记录手术期间室上性心动过速发生次数。
1.4 统计学方法 采用SPSS 13.0统计软件进行分析,计数资料比较采用χ2检验,计量资料采用t检验,以均数±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 血流动力学指标和心律失常发生情况 两组患者T0时点和(T1-T0)/T0的MAP和HR差异无统计学意义,表明负荷剂量的Dex对循环无明显作用。D 组(T3-T2)/T2、(T5-T4)/T4、(T7-T6)/T6的MAP和HR均明显小于 C组(P<0.05),表明Dex可明显减轻气管插管、切皮和锯胸骨等重要手术刺激引发的血流动力学波动。D组患者均未出现室上性心动过速,C组患者共出现3次,差异有统计学意义(P<0.05),表明Dex可减少此类患者阵发性室上性心动过速的发生。见表2。
表2 两组患者血流动力学指标和室上性心动过速发生情况(±s)

表2 两组患者血流动力学指标和室上性心动过速发生情况(±s)
注:与C组比较,a P<0.05。
组别 例数(例)(T1-T0)/T0(%)(T3-T2)/T2(%)(T5-T4)/T4(%)(T7-T6)/T6(%)T0 MAP(mmHg) HR(/min)MAP HR MAP HR MAP HR MAP HR室上性心动过速(次)D组 10 71.5±12.6 82.9±21.6 1.1±0.1 1.9±0.2 6.2±1.9a6.8±2.1a 6.2±1.1a5.1±1.0a 4.1±1.2a3.2±0.9a 0a C组 10 68.2±13.9 85.2±25.1 1.2±0.1 1.5±0.1 15.8±2.9 18.8±4.2 21.2±5.8 22.5±6.1 15.2±2.8 18.1±3.9 3
2.2 右心功能指标 C组T9时点RVEF、RVMPI和TAM-MDV明显低于T8时点和D组T9时点,差异有统计学意义(P<0.05);D组T8和T9时点差异无统计学意义。见表3。
表3 两组患者经食管超声心动图测量右心功能指标(±s)
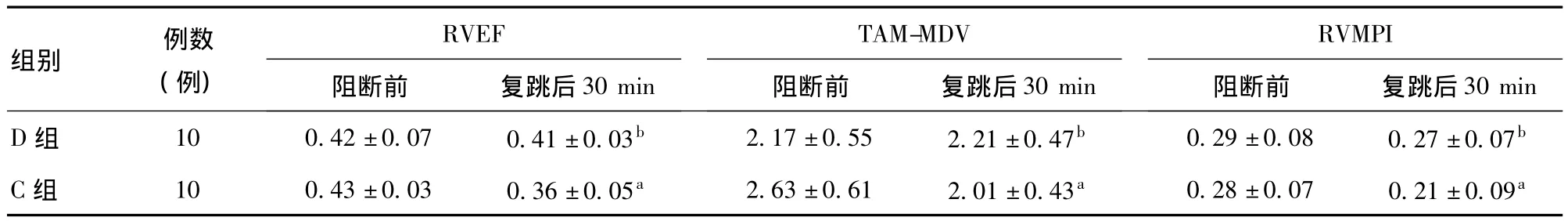
表3 两组患者经食管超声心动图测量右心功能指标(±s)
注:与阻断前比较,a P<0.05;与C组比较,b P<0.05。
组别 例数(例)30 min D组 10 0.42±0.07 0.41±0.03b 2.17±0.55 2.21±0.47b 0.29±0.08 0.27±0.07 RVEF阻断前 复跳后30 min TAM-MDV阻断前 复跳后30 min RVMPI阻断前 复跳后b C组 10 0.43±0.03 0.36±0.05a 2.63±0.61 2.01±0.43a 0.28±0.07 0.21±0.09a
3 讨论
Ebstein畸形由于瓣叶的改变和瓣环扩大而导致右心室壁成为右心房的一部分,即房化右心室。当心房收缩时,血液流入房化右心室而使其扩张,当心房舒张时,心室中的一部分血液返流至右心房,又因三尖瓣关闭不全导致返流严重,可造成右心房极度扩张和右心功能衰竭。增厚的心内膜常压迫右束支,致使很多患者并发完全性右束支传导阻滞。由于5%~10%患者存在异常房室传导束而合并预激综合征[2]。因此,此类患者围手术期极易出现阵发性室上性心动过速。基于上述病理生理特征,Ebstein根治术患者围手术期极易出现心血管意外,表现为:(1)对麻醉的耐力极度下降,麻醉略加深即可能发生心肌抑制和血管扩张而引发血压下降,甚至导致右心功能衰竭;⑵对刺激的高应激反应,如气管插管、手术切皮和锯胸骨等刺激时血压急剧上升、心率突然增快,可诱发室上性心动过速而危及生命。因此,麻醉管理的重点在于如何维持血流动力学的稳定、保护右心功能和防控室上性心动过速的发生[5]。
既往Ebstein根治术的麻醉多应用丙泊酚、依托咪酯联合麻醉性镇痛药诱导,并以吸入麻醉联合静注大剂量麻醉性镇痛药维持。此种麻醉方法多可保证手术的平稳和患者的安全。然而,大剂量麻醉性镇痛药的应用不但容易导致苏醒延迟,且可引发患者术后持续性低血压。此外,阵发性室上性心动过速等严重心律失常也无法得到有效控制。因此,有效稳定血流动力学、保护心脏功能、防控心律失常的药物可能成为此类患者全身麻醉诱导和维持的理想选择。
Dex是一种高选择性α2受体激动药,其药理作用为激动脑和脊髓的α2肾上腺素受体,减少去甲肾上腺素和中枢交感性神经介质的释放,进而抑制交感神经、增强迷走神经兴奋性,产生镇静、镇痛、抑制交感活动的效应。既往研究显示,Dex可增进冠脉搭桥患者的血流动力学稳定,减轻心肌缺血的发生[6];而其在Ebstein根治术患者中应用的相关报道则较少。本研究显示,Dex的负荷剂量持续应用,不仅明显减轻了气管插管、切皮和锯胸骨等重要手术刺激引发的血压增高和心率增快,且无低血压的发生。分析其原因,可能因该药作用于中枢α2肾上腺素受体,而对交感神经突触后受体无阻滞作用,从而保存了交感神经对意外低血压、低血容量的反应能力,从而避免了低血压的发生[7]。以往右美托咪定的负荷剂量推荐选用1 μg/kg在10 min内给予,但可引发血压升高和心动过缓。由于Ebstein患者并发三尖瓣关闭不全,应维持稍快的心率以减轻返流。因此,本研究将负荷剂量减为0.5 μg/kg,且给药时间增加至15 min,有效地避免上述情况的发生。
急性右心功能衰竭是Ebstein根治术患者围手术期死亡的常见原因之一。本研究应用经食管超声心动图测量阻断前和复跳后30 min的RVEF、RVMPI及TAM-MDV,作为右心室舒张及收缩功能指标[8]。结果显示,对照组复跳后30 min右心功能明显低于阻断前,而D组明显好于C组,且与阻断前相比,差异无统计学意义,表明体外循环后可发生右心室功能减退,而Dex对右心功能具有保护作用。分析其原因,可能由于Dex降低了儿茶酚胺的浓度且减慢心率,进而减少心肌的氧耗[9],改善心肌的氧供平衡。此外,有研究显示,Dex具有减少炎症介质释放的作用[10],也可能参与其右心保护作用。
Ebstein患者围手术期心律失常多为阵发性室上性心动过速,这不仅由于此类患者具有心肌传导解剖异常(预激综合征),还可因麻醉和手术过度刺激所诱发。本研究中,D组无一例发生室上性心律失常。这不仅由于Dex的抗交感和稳定血流动力学作用,还可能因其直接激活血管突触后α2肾上腺素受体,导致一氧化氮和三磷酸腺苷敏感的钾离子通道激活[11],进而增加心肌细胞膜的稳定性,减少快速性心律失常的发生。
综上所述,Dex有利于维持Ebstein畸形矫治术中血流动力学稳定、维护右心室功能,并减少室上性心动过速的发生,可安全有效地应用于此类患者的麻醉。但由于本研究样本量较小,有待增加患者例数以进一步验证。
[1]吴清玉,张怀军,许建屏.108例三尖瓣下移的矫治[J].中华外科杂志,1999,37(11):663-665.
[2]Makous N,Vandervere JB.Ebstein’s anomaly and life expectancy:report of survival to over age 79[J].Am J Cardiol,2010,18(1):100-104.
[3]Piao G,Wu J.Systematic assessment of dexmedetomidine as an anesthetic agent:a meta-analysis of randomized controlled trials[J].Arch Med Sci,2014,10(1):19-24.
[4]Protopapa KL,Simpson JC,Smith NC,et al.Development and validation of the Surgical Outcome Risk Tool(SORT)[J].Br J Surg,2014,101(13):1774-1883.
[5]Roten L,Lukac P,DE Groot N,et al.Catheter ablation of arrhythmias in ebstein’s anomaly:a multicenter study[J].J Cardiovasc Electrophysiol,2011,22(12):1391-1396.
[6]Kim HJ,Kim WH,Kim G,et al.A comparison among infusion of lidocaine and dexmedetomidine alone and in combination in subjects undergoing coronary artery bypass graft:A randomized trial[J].Contemp Clin Trials,2014,39(2):303-309.
[7]Keniya VM,Ladi S,Naphade R.Dexmedetomidine attenuates sympathoadrenal response to tracheal intubation and reduces perioperative anaesthetic requirement[J].Indian J Anaesth,2011,55(4):352-357.
[8]闫瑞玲,陈昆迪.超声心动图在评价右心功能中的应用与进展[J].西部医学,2014,11(4):409-411.
[9]Gao DW,Talke PO,Dae MW.Effects of reduced sympathetic activity on myocardial metaiodobenzylguanidine(MIBG)washout[J].J Auton Pharmacol,2011,21(3):159-164.
[10]Xu L,Bao H,Si Y,et al.Effects of dexmedetomidine on early and late cytokines during polymicrobial sepsis in mice[J].Inflamm Res,2013,62(5):507-514.
[11]De Man JG,Boeckxstaens GE,Herman AG,et al.lpha-2 and imidazoline receptor agonists:their pharmacology and therapeutic role[J].Anesthesia,2010,54(2):146-165.

