产苦马豆素疯草内生真菌Undifilum oxytropis原生质体的制备和再生
张蕾蕾,余永涛,何生虎,赵清梅,葛 松
(1.宁夏大学农学院,宁夏银川750021;2.北方民族大学生物科学与工程学院,宁夏银川750021;3.国家民委发酵酿造工程生物技术重点实验室,宁夏银川750021;4.韩城市金城办畜牧兽医工作站,陕西韩城715400)
疯草是棘豆属和黄芪属有毒植物的统称,其主要毒性成分为苦马豆素(swainsonine,SW)。动物采食疯草后可引起以神经系统紊乱为特征的疯草中毒病[1],但疯草中SW 的合成机理一直未被阐明。研究表明,疯草内普遍存在能合成苦马豆素的内生真菌-Undifilum oxytropis,该内生真菌与疯草毒性密切相关[2-10],是疯草中合成苦马豆素的主要因素。抑制或消除疯草内产SW 内生真菌将有望降低或消除疯草的毒性,要实现该目标需要对疯草内生真菌合成SW 的分子调控机制进行深入的研究。
原生质体是指完整细胞剥除细胞壁结构后所形成的裸露细胞,为球状的单细胞,对化学诱导剂敏感,易于摄取外源大分子、细胞器及细菌和病毒,是真菌遗传转化和功能研究的重要工具。自Ferenczy L等[11]成功将细胞融合技术引入丝状真菌的研究领域,原生质体技术陆续被应用于丝状真菌融合育种、质粒及线粒体等外源基因的原生质体转化育种、诱变再生育种及遗传性状表达和分析研究中。原生质体的制备方法主要分为机械法、酶解法和超声法3种,其中酶解法条件比较温和、制备量大、对原生质体的损伤小,是目前应用最为普遍的丝状真菌制备方法。研究报道渗透压稳定剂、温度、pH、酶解孵育方式及培养基组分等因素对菌株原生质体的形成和再生均具有不同程度的影响[12-16]。
疯草内生真菌原生质体的制备可为进行疯草内生真菌的遗传转化和基因研究提供重要工具,为进一步研究确定疯草内生真菌合成SW 的相关基因功能,阐明分子调控机制奠定基础。本试验拟采用酶解法制备疯草内生真菌的原生质体,并对获得的原生质体进行生物学特性的初步研究,为进一步研究疯草内生真菌合成SW 相关基因的功能提供转化工具。
1 材料与方法
1.1 材料
1.1.1 菌种 疯草内生真菌菌株U.oxytropis NX-FEL001,由宁夏大学临床兽医学自治区重点学科实验室从宁夏黄花棘豆中分离鉴定并保存[9]。
1.1.2 培养基 PDA 固体培养基,马铃薯浸粉琼脂培养基,蛋白胨无机盐固体培养基[10],CM 培养基[14],酵母浸膏完全培养基(YCM)[14],PDA 液体培养基。
1.1.3 主要试剂和仪器 SW 标准品由宁夏大学农学院临床兽医学重点学科实验室从黄花棘豆草粉中分离和纯化;蜗牛酶(snailase)、溶壁酶(lysing enzyme)、纤维素酶(cellulase)为Sigma公司产品;山梨醇、蔗糖、蛋白胨、酵母膏、琼脂等为国产分析纯。
裂解酶溶液的配制:分别称取1g蜗牛酶,1g纤维素酶,0.1g的溶壁酶,加入少量无菌的1mol/L的山梨醇溶解,定容至100mL,经0.22μm 微孔滤膜过滤除菌,置4 ℃保存备用。
1.1.4 主要仪器设备 RE-52AA 型旋转蒸发仪为上海亚荣生化仪器厂产品;KG-SX-500型高压锅为三洋电机株式会社日本产品;MIP-250型霉菌培养箱为上海精宏实验设备有限公司产品;QYC-2102C型摇床为上海福玛实验设备有限公司产品;酶标仪为Thermo Fisher公司产品;E438酸度计为Mettler Toledo 有限公司产品;超纯水仪为Thermo Fisher公司产品;高速离心机为Eppendorf公司产品;数码照相机为日本佳能公司产品;Neofugel 5R型台式高速冷冻离心机为上海力申科学仪器有限公司产品;CKx41SF 倒置显微镜为日本Olympus公司产品。
1.2 方法
1.2.1 菌种的培养 固体培养:将U.oxytropis NX-FEL001菌株接种于PDA 固体培养基22 ℃培养30d后,无菌刮取菌丝,将收集的菌丝用研磨棒研磨制备成均一的菌悬液(1×106个/mL)。取500μL涂布于蛋白胨无机盐固体平板上,22 ℃静置培养7d~30d,培养结束后,无菌刮取菌丝,将菌丝用研磨棒研磨成匀浆,并用1.0 mol/L 山梨醇溶剂洗涤3次。
液体培养:用打孔器取直径6 mm 的菌饼(15个/瓶)接种到100 mL PDA 液体培养基中,22 ℃振 荡 培 养7 d ~30 d,培 养 结 束 后,5 000r/min,离心30min,弃上清,将菌丝用研磨棒研磨成匀浆,并用1.0mol/L山梨醇剂洗涤3次。
1.2.2 原生质体的制备 称量培养好的湿的菌丝体400mg,按质量体积比为1∶10加入4mL 裂解酶液,35℃,80r/min振荡孵育,分别在孵育后1、2、3、4、4.5h取孵育的菌丝悬液于血球计数板上,置显微镜下观察,统计原生质体的数量,筛选适宜的酶解时间。酶解结束后,加入0.5倍酶体积的1.0mol/L山梨醇,涡旋混匀,3 层擦镜纸过滤除去残余的菌丝,先用5mL 的1.0mol/L 山梨醇冲洗2次,滤液5 000r/min离心15 min,弃上清,再用5mL的1.0mol/L山梨醇重悬,5 000r/min离心15min,弃上清,此过程重复3次,将制备好的原生质体重悬于适量的1.0mol/L山梨醇,4 ℃保存备用。
1.2.3 培养方式的筛选 分别取1.2.1中固体培养、液体培养的菌丝,按1.2.2中试验步骤制备原生质体,分别比较菌丝培养7d后固体培养和液体培养的方式原生质体的产量。
1.2.4 菌龄的筛选 取固体培养的菌丝,按1.2.2中的试验步骤制备原生质体,分别比较菌龄为7、15、30、35d时原生质体的产量。
1.2.5 孵育温度和孵育时间的筛选 固体培养15d的菌丝,以10g/L蜗牛酶+10g/L纤维素酶+1g/L溶壁酶组成的复合酶溶液为酶解系统。据报道,丝状真菌菌丝细胞壁的酶解最适温度一般为20 ℃~40℃,因此本试验分别比较28、30、35、37℃时孵育3h后原生质体的产量;35 ℃孵育1、2、3、4、4.5h后原生质体的产量。
1.2.6 菌丝与酶解液质量体积比的筛选 固体培养15d的菌丝,以10g/L 蜗牛酶+10g/L 纤维素酶+1g/L溶壁酶组成的复合酶溶液为酶解系统,分别比较质量体积比为1∶10、1∶25时,原生质体的释放量。
1.2.7 原生质体的再生 将新鲜制备的原生质体2倍稀释,取200μL分别涂布于含有1.0mol/L 山梨醇的PDA 固体培养基、马铃薯浸粉培养基、YCM琼脂培养基、CM 琼脂培养基、蛋白胨无机盐固体培养基上,置22 ℃培养15d,对形成的菌落进行计数(A),为消除由残余菌丝再生出的菌落所带来的误差,同时将原生质体涂布于未添加1.0mol/L 山梨醇的培养基上,其再生菌落数作为对照(B),并根据下列公式计算不同培养基中原生质体的再生率。

1.2.8 再生菌丝及野生菌株菌丝中SW 的检测
1.2.8.1 再生菌丝及野生菌株菌丝中SW 的提取分别刮取再生出的真菌菌丝和野生菌株菌丝0.5g~1g,65 ℃烘至恒重,然后研磨成粉末于10mL离心管中,加入体积分数为30mL/L 的乙酸溶液8mL,60℃超声波提取3次,每次30min,合并3次提取液,3 000r/min 离心15 min,收集上清液并用旋转蒸发仪浓缩挥干[12]。2mL 的pH 4.5柠檬酸盐缓冲液溶解,12 000r/min离心5 min,取上清液,用pH 4.5 柠檬酸盐缓冲液定容至10 mL,4 ℃保存待用。
1.2.8.2 再生菌丝及野生菌株菌丝中SW 含量的检测 分别配制4、2、1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 625μg/mL等9个梯度的SW 标准溶液。取40μL不同浓度的苦马豆素标准品溶液分别加入96孔板的各孔中,每个浓度的溶液同时做3个重复,另将60μL 柠檬酸盐缓冲液加入空白孔中作为空白对照,然后在每孔中加入95μL 的底物溶液,轻微振荡混匀,置37 ℃孵育1h;孵育结束后在每孔加入20μL的酶溶液,但空白对照中不加酶溶液,轻微振荡混匀,置37 ℃孵育1h。孵育结束后,每孔加入100μL 的反应终止液,轻微振荡混匀,置405nm 波长处测定各孔吸光度值。以ɑ-甘露糖苷酶抑制率y对SW 浓度x进行回归分析,绘制标准曲线。将1.2.8.1中制备的待检液做适当的稀释后,然后按照上述的方法测定其中SW 的含量,将ɑ-甘露糖苷酶的抑制率代入回归方程计算出样品溶液中SW 的含量,并与野生型菌株中SW 含量作对比。
2 结果
2.1 原生质体的制备
2.1.1 原生质体的形成及释放 当酶反应1h后,菌丝部分隔膜开始断裂(图1A);反应2h后,菌丝的隔膜完全溶解,呈念珠状(图1B),此时原生质体开始从菌丝侧面的细胞壁破口处释放出来(图1C);反应3h~4h后,菌丝中大量细胞破壁,原生质体大量的释放,其浓度达105个/mL以上,呈圆球形散在分布(图1D)。

图1 Undifilum oxytropis NX-FEL001原生质体的形成过程Fig.1 Process of release of the Undifilum oxytropis NX-FEL001protoplast
2.1.2 真菌培养方式对原生质体制备的影响 试验结果表明,在裂解酶溶液的作用下,固体和液体振荡培养的NX-FEL001 的菌丝细胞壁均可被溶解,但固体培养方式获得的真菌菌丝经裂解液作用后产生的原生质体数量要显著高于液体振荡培养方式,原生质体的产量高达0.5×105个/mL,而液体振荡培养原生质体的产量仅为0.4×105个/mL。
2.1.3 菌龄对原生质体制备的影响 处于不同生长时期的菌丝体对酶解液的敏感程度也存在较大的差异,当培养7d时,菌丝细胞壁过早溶解,并导致原生质体发生自溶,释放量少;当菌龄为15d时,真菌细胞壁逐渐增厚,但又不会过多损伤释放的原生质体,原生质体的产量最高。但随着菌龄的增加,菌丝体细胞壁的结构越趋稳定,对酶解液的敏感度下降,原生质体产量趋向于降低(图2)。

图2 菌龄对原生质体产量的影响Fig.2 Effects of cultivation time on protoplast yield
2.1.4 孵育温度和孵育时间对原生质体释放的影响 结果表明,35 ℃时原生质体的释放量最大,原生质体的制备率最高,可达2.7×105个/mL。酶解液孵育1h后,仅有部分菌丝的细胞壁溶解,并释放出少量的原生质体,但随着孵育时间的延长,大部分菌丝的细胞壁溶解,释放的原生质体逐渐增加,当孵育3h时,从溶解的菌丝中释放的原生质体的数量最多,孵育4h后其数量反而降低(图3A)。可能因为酶解的时间过长,原生质体的质膜损伤,导致原生质体破碎。因此,本试验确定最佳孵育时间是3h(图3B)。
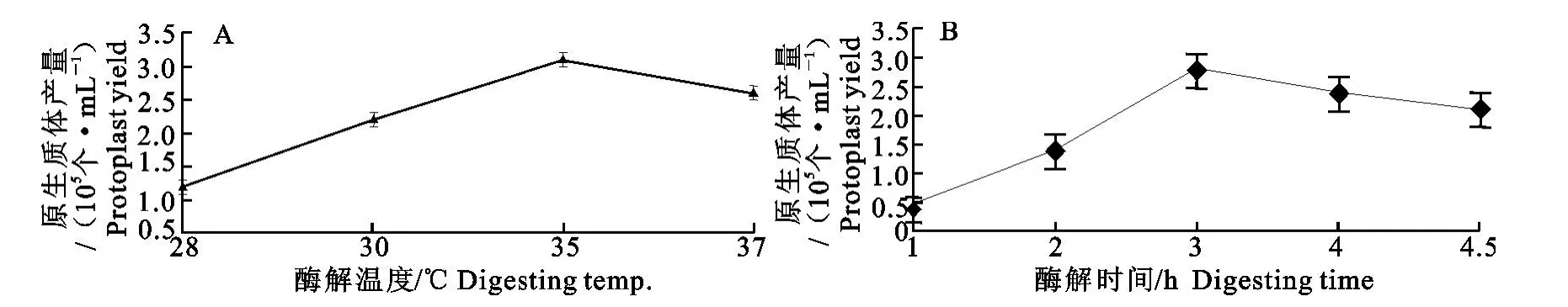
图3 孵育温度和时间对原生质体产量的影响Fig.3 Effects of digesting temperature and time on protoplast yields
2.1.5 菌丝与酶解液质量体积比对原生质体释放量的影响 结果显示,菌丝和酶解液的质量体积之比为1∶10 时,有利于原生质体的释放,释放量达3.2×105个/mL;菌丝和酶解液的质量体积之比为1∶25时,原生质的释放量达2.5×105个/mL,远小于质量体积比为1∶10时原生质体的释放量。
2.2 原生质体的再生
2.2.1 再生培养基组分对原生质体再生率的影响
菌株NX-FEL001原生质体可分别在含1 mol/L山梨醇的蛋白胨无机盐固体培养基、马铃薯浸粉琼脂培养基、PDA 固体培养基、CM 琼脂培养基、YCM琼脂培养基上再生,但不同培养基上的再生能力存在一定的差异,其再生率分别为6.7%、6.4%、7.1%、7.9%、8.5%,其中在YCM 培养基上再生能力最强,而在马铃薯浸粉琼脂培养基上再生能力较差(图4)。
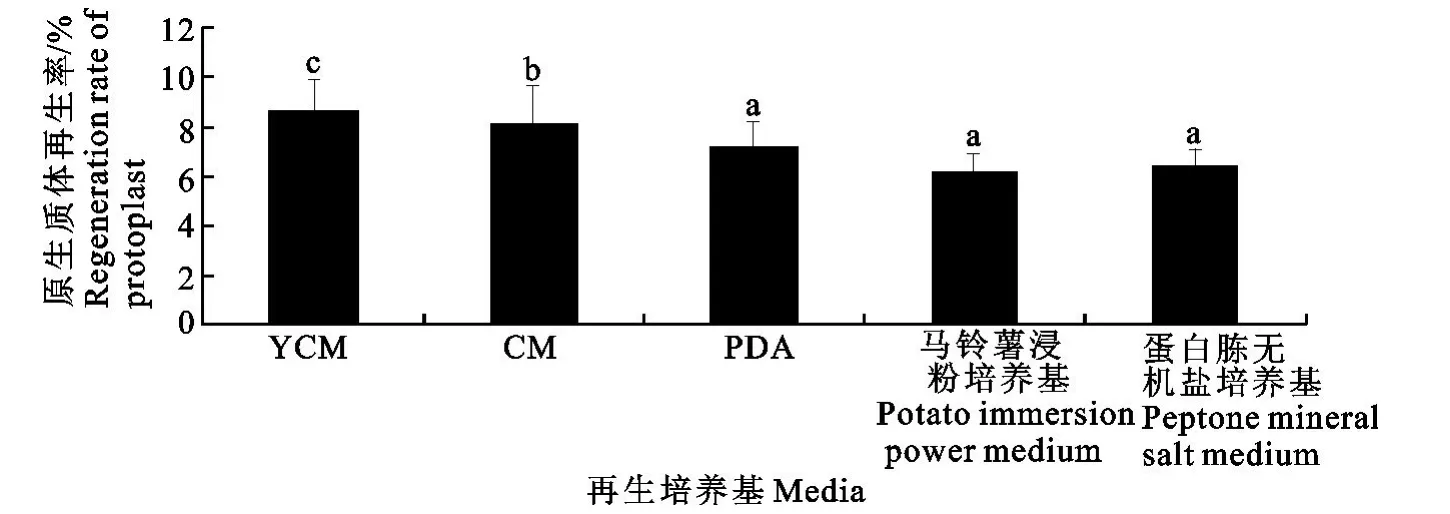
图4 再生培养基的组分对原生质体再生率的影响Fig.4 Effects of regeneration medium on protoplast regeneration rate
2.2.2 再生真菌的形态特征 纯化的原生质体,22 ℃培养30d后,在YCM 琼脂培养基上的菌落呈现白色(图5A),而在其他培养基上再生出的菌落呈黑褐色,与野生菌株相一致(图5B~图5D),但不同再生培养基上菌丝的镜下显微形态无明显差异,与野生菌株的形态特征相一致(图5E,图5F)。
2.2.3 再生真菌中SW 的含量 通过对原生质体再生后菌落菌丝中SW 含量的检测,发现再生的真菌仍具备合成SW 的能力,其菌丝中SW 含量为168.3μg/g,野生型菌丝中的SW 含量为165.6μg/g。
3 讨论
目前,子囊菌的转化技术已经相对比较成熟,但是因为产SW 疯草内生真菌生长比较缓慢,不容易获得该内生真菌的原生质体,原生质体技术在该类真菌上的应用还处在发展的过程中。原生质体的制备是一切原生质体操作技术的前提,裂解酶的种类、配比、酶解的时间、温度、渗透压稳定剂等都会不同程度的影响原生质体的释放和再生能力。
在本试验中U.oxytropis菌丝在蛋白胨无机盐固体培养基上22 ℃培养15d,按照菌丝与酶解液质量体积比为1∶10,35 ℃恒温、80r/min振荡孵育3 h,原生质体释放量最高;原生质体在YCM 培养基上,22 ℃培养9d可以再生形成菌落,培养15d其再生率可达8.5%;原生质体在YCM 培养基上再生后其菌落颜色与野生型U.oxytropis不一致,呈白色,其他培养基上再生后的菌落颜色与野生型菌株相一致。菌丝形态与野生型U.oxytropis相一致,经检测再生后菌丝仍然能够产生苦马豆素,与Mukherjee S等[15-16]研究结果相一致。原生质体的制备只是去除了真菌细胞的细胞壁。原生质体的再生过程是细胞壁再生过程,并未改变真菌的遗传性状,不会影响菌株合成SW 的能力。
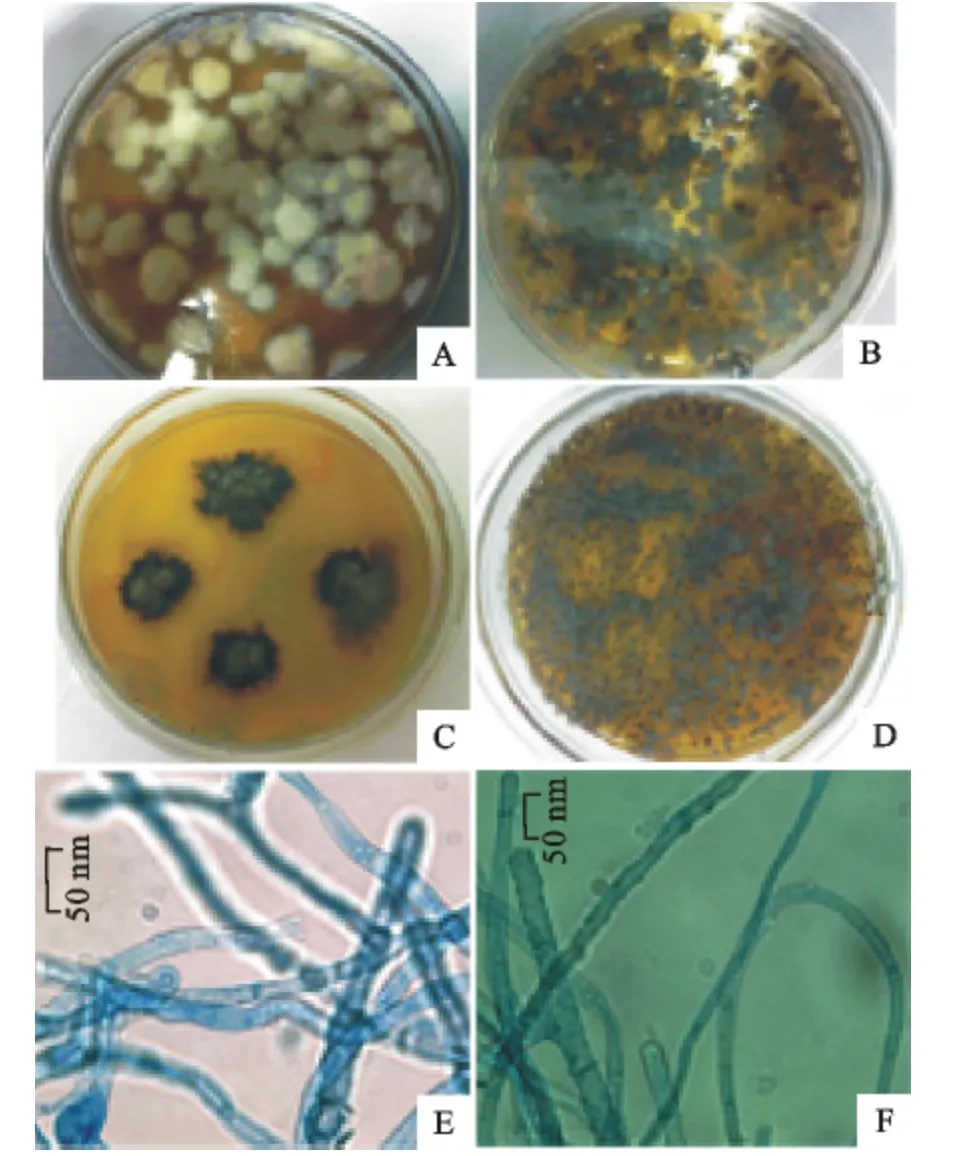
图5 再生真菌的形态特征观察Fig.5 Morphological observation of mycelia
菌丝细胞壁的结构的形成受培养方式的影响,间接地影响菌丝对裂解酶的敏感程度。本试验评估了液体培养和固体培养的方式对原生质体释放的效果,表明固体培养菌丝能释放出更多的原生质体,与朱建勇等[13]研究结果一致。固体培养基获得的真菌培养物中的菌丝体排列较疏松,经研磨后,菌丝体能够与酶解液充分接触,有利于原生质体的释放。而液体振荡培养后所得的真菌培养物呈球状、索状,菌丝体排列致密,导致菌丝与酶解液不能完全充分的接触,将不利于原生质体的释放。
菌丝处于不同生长时期,其细胞壁的结构组成有所不同。菌龄过小,细胞壁薄,酶解后所形成的原生质体大小不均匀,且容易溶解;菌龄过大,菌丝细胞壁较厚,细胞壁不易破碎,不利于原生质的释放[12]。本试验最终确定22 ℃培养15d,有利于U.oxytropis原生质体的释放。
酶的本质是蛋白质,几乎所有酶参与的反应都受温度、时间条件的影响。不同种类的酶都有其作用的最适温度、时间,在该温度、时间下其活性最高,偏离该温度、时间,酶的活性将会受到抑制,甚至变性失去活性;酶解温度越低、时间过短,菌丝质膜不能完全溶解,细胞壁不能彻底被剥除,原生质体制备率过低;孵育温度过高、时间过长,会对一些早期释放的原生质体质膜造成损伤,导致原生质体的稳定性下降[13]。本试验最终确定35 ℃恒温孵育3h,混合酶液活性最佳,原生质体的释放量最大,高达2.7×105个/mL。
菌丝与酶解液的质量体积比过大,不利于菌丝与混合酶解液的接触,细胞壁破损不完全,阻碍了原生质体的释放;菌丝与酶解液的质量体积比过小,混合酶液浓度相对过大,会导致原生质体的质膜破损和溶解,降低其再生能力。试验最终确定菌丝与酶解液的质量体积比1∶10。
再生培养基的成分、培养的方式会影响原生质体细胞壁的再生能力,导致再生率不同[13]。本试验只做了5种固体培养方面的研究,发现YCM 培养基上再生效果最好,与徐峰等[14]试验结果相一致。有关原生质体在液体培养基中再生菌丝的形态及再生能力有待进一步研究。
U.oxytropis原生质体的制备及再生为进一步研究SW 合成机理及产SW 内生真菌原生质体的制备提供思路,为后续开展U.oxytropis菌株原生质体诱变、融合、转化、诱变育种奠定基础。一方面从疯草毒性来说,通过原生质体技术构建低毒或无毒的疯草;另一方面,从SW 药用价值来说,通过该技术构建高产SW 的突变菌株。
[1] Chenchen W,Wenlong W,Xiaoxue L,et al.Pathogenesis and preventive treatment for animal disease due to locoweed poisoning[J].Environ Toxicol Pharmacol,2014,37(1):336-347.
[2] Cook D,Gardner D R,Pfister J A.Swainsonine-containing plants and their relationship to endophytic fungi[J].J Agri Food Chem,2014,62(30):7326-7334.
[3] 吴晨晨,赵宝玉,路 浩,等.中国主要疯草中苦马豆素的动态变化规律[J].西北农业学报,2014,23(5):51-58.
[4] 王志伟,陈永敢,王庆璨,等.中国植物内生微生物研究的发展和展望[J].微生物学通报,2014,41(3):482-496.
[5] 郭 伟,李勤凡,张美先,等.变异黄芪内生真菌FEL1A 菌株固体培养条件优化[J].动物医学进展,2010,31(7):41-44.
[6] 陈基萍,马 尧,路 浩,等.疯草内生真菌研究进展[J].动物医学进展,2011,32(2):77-81.
[7] 胡延春,刘 玲,刘 鹏,等.疯草的生态学研究概况[J].动物医学进展,2011,32(3):108-112.
[8] Yu Y T,Zhao Q M,Wang J N,et al.Swainsonine-producing fungal endophytes from major locoweed species in China[J].Toxicon,2010,56:330-338.
[9] 张蕾蕾,何生虎,余永涛,等.宁夏黄花棘豆中产苦马豆素内生真菌的分离及鉴定[J].中国畜牧兽医,2013,40(12):77-84.
[10] 杨国栋.疯草内生真菌合成苦马豆素的研究[D].陕西杨凌:西北农林科技大学,2012.
[11] Ferenczy L,Kevei F,Zsolt J.Fusion of fungal protoplasts[J].Nature,1974,248:793-794.
[12] 王国平,周转忠,陈雄燕,等.紫杉木霉菌株ZJUF0986原生质体的制备及诱变抗性菌株的选育[J].植物保护学报,2009,36(5):397-402.
[13] 朱建勇,胡 凯,胡丽涛,等.产紫杉醇内生真菌XT5原生质体制备与再生[J].西南大学学报:自然科学版,2008,30(5):90-93.
[14] 徐 峰,陶文沂,程 龙,等.产紫杉醇内生真菌Fusarium maire的原生质体制备和再生[J].食品与生物技术学报,2006,25(5):20-24.
[15] Mukherjee S,Dawe A L,Creamer R.Development of a transformation system in the swainsonine producing,slow growing endophytic fungus,Undifilum oxytropis[J].J Microbiol Meth,2010,81(2):160-165.
[16] Mukherjee S,Creamer R.Transformation methods for slowgrowing fungi[M].Laboratory Protocols in Fungal Biology.Springer New York,2013:467-473.

