麦洼牦牛NOBOX 基因克隆与序列分析
李博浩,符 梅,兰道亮,熊显荣,李 键.*
(1.西南民族大学生命科学与技术学院,四川成都610041;2.西南民族大学青藏高原研究院,四川成都610041)
NOBOX(新生儿卵巢同源基因)是一个卵母细胞特异性表达的同源基因,在早期滤泡发生中起重要的作用[1]。NOBOX 是第一个被发现的卵巢特异性表达同源盒基因,最早可于小鼠胚胎形成的15.5d以后检测到,其mRNA 和蛋白质都可在生殖细胞和各级卵泡中检测到。同源盒基因均含有180bp的高度保守序列,且在进化上高度保守,位于靠近3′端的分散的外显子上。这段序列编码60个氨基酸的同源结构域(homeodomain,HD)。HD 折叠成4个α螺旋结构,X 射线晶体学研究表明,螺旋Ⅰ与Ⅱ平行,螺旋Ⅲ与前2个基本垂直,Ⅱ、Ⅲ螺旋和它们之间的转折形成HTH(helix-turn-helix)结构。NOBOX 基因敲除小鼠表现为原始卵泡发育停滞,不能进入初级卵泡以后的生长发育阶段。在出生后14d,卵巢被纤维组织填充,卵巢原始卵泡所剩无几,原因可能是NOBOX 基因失活后,其下游基因的转录表达异常而导致卵巢衰竭与不孕。通过免疫组化检测并观察NOBOX 基因敲除新生仔鼠和正常小鼠的卵巢组织切片,发现在缺失NOBOX 基因的仔鼠卵巢中,一些卵巢特异性表达的基因如Gdf9、Bmp15、Oct4 的表达显著下降。因此,我们推断NOBOX 可能直接或间接地调控卵母细胞特异基因的转录[2]。
牦牛是生活在高原环境下的特有物种,其繁殖具有明显的季节性,繁殖率为60%~75%,成活率为45%~75%,其繁殖性能低等问题一直制约着牦牛产业的发展。牦牛繁殖率低除与其生长环境、营养状况等有关外,也与其受精后的胚胎发育潜能有直接的关系。目前尚未见到关于牦牛NOBOX 基因克隆的报道,本试验通过RT-PCR 技术首次克隆得到牦牛NOBOX 基因的全长编码区,并对获得的目的基因进行了序列分析,为进一步研究牦牛卵母细胞成熟及早期胚胎发育的分子机制上积累资料。
1 材料与方法
1.1 材料
1.1.1 试验样品 屠宰麦洼牦牛的不同组织,采自成都市青白江区某屠宰场,屠宰后分别采集3头公牦牛与3头母牦牛心、肝、脾、肺、肾、睾丸、脑、大肠、肌肉和卵巢10种组织,所有样品采集好后立即投入液氮中速冻,之后置-70 ℃保存备用。
1.1.2 主要试剂 感受态大肠埃希菌DH5α为天根生化科技(北京)有限公司产品;pMD19-T 克隆载体为TaKaRa公司产品;凝胶回收试剂盒为Axygen(北京)公司产品;Trizol为Invitrogen公司产品;反转录酶为Fermentas公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中登录的牛NOBOX(登录号为HQ589330.1)基因序列,用Premier 5.0软件设计2对引物,分两段扩增麦洼牦牛的NOBOX 基因片段。引物序列与预期扩增片段长度如表1,引物由上海Invitrogen公司合成。

表1 用于扩增NOBOX 基因的引物序列Table 1 Primer sequences for amplification of NOBOX genes
1.2.2 组织RNA 的提取和cDNA 的合成 根据RNA 裂解液Trizol说明书,取牦牛组织100mg,加入1 mL Trizol液氮研磨提取总RNA,按照Fermentas 公司的RevertAidTMFirst Strand cDNA Synthesis Kit反转录酶说明书,采用20μL 反转录体系:oligo dT18 1μL,5×Reaction buffer 4μL,RibolockTMRNase Inhibitor(20 g/L)1 μL,10mmol/L dNTP Mix 2 μL,RevertAidTMMMμLV Reverse transcriptase(200g/L)1μL,模板1μL,最后用RNase free dH2O 补足20μL。按以下程序进行反转录反应:42 ℃60min;70 ℃5min,合成cDNA,置-20 ℃保存备用。
1.2.3 目的基因的克隆 以牦牛组织cDNA 为模版,引物为F1,R1;F2,R2,进行普通PCR 扩增,反应体系为50μL。所有PCR 产物经体积分数10g/L琼脂糖凝胶电泳观察扩增结果,用Axygen 的凝胶回收试剂盒回收纯化PCR 产物,取适量已纯化PCR产物与克隆载体pMD19-T 进行连接,转化DH5α感受态细胞并在Amp+琼脂平板上涂菌。挑取单个菌落接种于含Amp+的LB液体培养基培养中。经PCR 鉴定后,将阳性重组质粒送往Invitrogen(英潍捷基上海)公司进行测序。
1.2.4 目的基因序列分析 将测序结果进行拼接,用DNA Star和Cltulax等软件进行分析。
2 结果
2.1 目的基因的扩增与拼接
牦牛NOBOX 基因扩增结果如图1。由图1可知,扩增片段大小分别在889bp和1 086bp左右,与预期扩增片段大小基本相符。利用扩增片段测序结果的重复序列进行拼接,克隆获得牦牛目的基因序列。

图1 牦牛NOBOX 基因PCR 扩增结果Fig.1 PCR results of NOBOX gene in yak
2.2 基因序列分析
扩增到的牦牛NOBOX 基因片段大小为1 975bp(GenBank登录号:KJ863560),开放阅读框全长1 500bp,编码499 个氨基酸,分子质量为53.12ku,理论等电点为6.008。氨基酸组成中,正电荷残基总数41个,负电荷残基总数47个,整个蛋白带负电荷。
将牦牛NOBOX 基因开放阅读框编码的氨基酸序列在http://cn.expasy.org/进行ScanProsite分析,得到1 个HOMEOBOX 2 蛋白家族标记,为QVRKKTRTLYRSDQLEELERLFQDDHYPDSD KRREIAQTVGVTPQRIMVWFQNRRAKWRK(第115位~第175位氨基酸,编号:PS50071)。
2.3 蛋白结构和功能预测
用DNA Star软件的子程序Protean预测牦牛NOBOX 基因的亲水性、柔韧性、表面可能性及抗原性,结果如图2所示。由图2可知,牦牛NOBOX 基因亲水性残基所占比例远大于疏水性残基,因此推测其编码蛋白整体表现为亲水性。NOBOX 基因柔韧性区域分布相对均匀,提示该蛋白肽段的柔韧性较大,形成抗原表位的可能性较大,容易与抗体结合。从图2还可以明显看出,抗原表位区域较大,并且与柔韧性区域和表面可能性区域出现了较多的重叠区,这些区域相对易于变形,便于抗原、抗体的自由结合,可能是抗原位点的富集区。
2.4 同源性比较
利 用DNA Star 软 件 子 程 序 MegAlign 的Clustal W 方法与GenBank 中公布的部分物种NOBOX 基因序列进行同源性比较结果如图3 所示。结果显示:8条基因序列的同源性介于48.2%~97.0%之间;与牦牛NOBOX 基因同源性最高的是牛的NOBOX 基因序列,为97.0%;最低的是大鼠的NOBOX 基因序列,为48.2%;其次,与山羊的的NOBOX 基因序列同源性较接近,为85.3%;与野猪和人的NOBOX 基因序列同源性分别为69.5%和67.3%。该结果说明牦牛NOBOX 基因序列具有较高的保守性。

图2 牦牛NOBOX 基因亲水性、柔韧性及抗原性的预测结果Fig.2 Predictive results of hydrophilicity,flexibility,surface probability and antigenicity of NOBOX gene in yak

图3 NOBOX 基因的核苷酸序列同源性比较Fig.3 Homological alignment of NOBOX gene nucleotide sequences
2.5 NOBOX 蛋白质二级结构预测
运用 在 线 软 件(http://npsa-pbil.ibcp.fr/cgibin/npsa automat.pl?page=npsa gor4.html)对耗牛NOBOX 基因编码的蛋白质二级结构进行预测。如 图4 所 示,该 蛋 白α-螺 旋(Alpha helix)占13.43%;自由卷曲(random coil)占79.96%;延伸链(extended strand)占6.61%。

图4 NOBOX 蛋白二级结构的预测Fig.4 Prediction of secondary structure of NOBOX protein
2.6 进化树分析
用MEGA 5.0软件的Neighbor-Joining法,重复1 000次,对获得的8 条NOBOX 基因序列构建Bootstrap验证的系统发育树,结果如图5所示。由图5可见,牦牛与牛NOBOX 基因的亲缘关系最近,与山羊、野猪、老虎、人形成一个分支,大鼠和小鼠形成另一个分支。
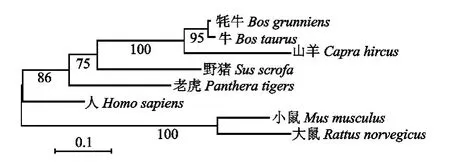
图5 NOBOX 基因的核苷酸序列系统进化树Fig.5 Phylogenetic tree of NOBOX gene nucleotide sequences
3 讨论
本研究利用PCR 技术首次扩增获得了牦牛NOBOX 基因,测序结果表明,其与牛的基因序列相比,具有极高的同源性,通过同源序列的比较,他们的同源性高达97%,说明NOBOX 基因在不同物种中具有保守性。
NOBOX作为同源盒蛋白家族成员,通过DNA-同源盒结构域相互作用调控下游基因的转录表达,在卵子早期发生过程发挥重要作用[3]。在脊椎动物胚胎发育的最初阶段,主要依赖于母体RNA 和卵子发生过程中合成的蛋白质[4-5]。新生卵巢同源基因(NOBOX)是来自于新生卵巢的转录因子,在表达序列标签(ESTs)的硅片减法中被确定[3]。NOBOX的mRNA 和蛋白在整个卵泡中优先表达,并控制着几个与卵泡成熟有关的其他基因[6]。在Rajkovic A等[6-7]之 前 的 试 验 中 得 到,NOBOX 基 因 敲 除 小 鼠 不育的原因包括卵泡发育受阻及很多生殖细胞特定基因与miRNA 表达的干扰。此外,在卵巢早衰(premature ovarian failure,POF)相关的NOBOX 基因突变已在人类中得到体现[8-9]。原发性卵巢功能不全(primary ovarian insufficiency,POI)患 者 的NOBOX 基因是部分高加索POI和(或)POF患者的致病基因,但不是亚洲POI和(或)POF 人群的常见的致病基因[10-11]。目前已经有科学家尝试用海参花醇提物对卵巢早衰小鼠进行试验,并且证明了海参花醇提物可增加子宫内膜厚度,对卵巢早衰发挥防治作用,对雌性小鼠生殖系统有促进作用[12]。最新研究还指出,NOBOX 是FOXL2关键的伙伴基因,互相作用并共同参与卵巢发育[13-14],而后者更对性别的影响起着至关重要的作用[15-16]。因此,继续深入的研究NOBOX 基因,将会对人类医学及治愈卵巢早衰等疾病,有着巨大的影响。
本研究首次成功克隆了牦牛NOBOX 基因,并进行了相关序列分析,旨在为进一步深入研究NOBOX 基因在牦牛卵泡发育等方面所发挥的功能和作用提供基础。
3.1 NOBOX 基因结构和功能
目前已见到关 于人[17]、小鼠[3,7]、牛[18]、猪[19]等NOBOX 基因克隆的报道,但是关于牦牛的尚未见到。Swamy K 等[18,20]从牛的各组织中提取克隆了NOBOX 基因,包括肝脏、肾脏、肌肉、心脏、大脑、下丘脑、脾、肺、小肠及胎儿的卵巢,并通过试验,证明其具有1 500bp开放阅读框,编码500个氨基酸,与其他物种氨基酸序列进行比较发现具有很高的相似性,这与本试验克隆所得目的基因序列的开放阅读框大小、编码氨基酸个数及分子质量大小基本相似。蛋白结构和功能预测结果显示,NOBOX 基因所编码的蛋白质以亲水性区域为主,柔韧性区域分布相对均匀,提示该蛋白肽段的柔韧性较大,形成抗原表位的可能性较大,容易与抗体进行嵌合,抗原与抗体结合时会发生蛋白构象变化[21]。抗原表位区、柔韧性区域和表面可能性区域出现了较多的重叠区,这些区域相对易于变形,便于抗原、抗体的自由结合,可能是抗原位点的富集区,综上所述,并且通过研究得出,NOBOX 是一卵子特异性表达的转录调控因子,是参与早期卵泡发育过程的关键蛋白质。
3.2 NOBOX 基因同源性和遗传进化关系
核苷酸序列同源性分析及进化分析显示NOBOX 基因与其他哺乳动物的核苷酸序列同源性参差不齐,从48.2%~97.0%不等,其中与牛的同源性最高,同时与牛的亲缘关系也最近。
综上所述,本研究成功克隆了牦牛NOBOX 基因,并进行了序列分析,其基因序列与其他物种基因序列相比,尤其在近缘物种中NOBOX 具有较高的保守性。具有一定的保守性,提示可能与该基因在生物体内发挥的重要作用有关,同时也为进一步研究卵母细胞成熟及早期胚胎发育分子机制上提供基础。
[1] 李贵强,李美丽,方 威,等.NOBOX 基因的cDNA 克隆及其特性分析[J].生物工程学报,2009,25(8):1130-1137.
[2] 秦莹莹.卵巢特异性转录因子NOBOX、NANOS3、LHX8在卵巢早衰发病机制中的作用研究[D].山东泰安:山东大学,2007.
[3] Suzumori N,Yan C,Matzuk M M,et al.Nobox is a homeobox-encoding gene preferentially expressed in primordial and growing oocytes[J].Mechanisms of Development,2002,111(1):137-141.
[4] Schultz R M.The molecular foundations of the maternal to zygotic transition in the preimplantation embryo[J].Human Reproduction Update,2002,8(4):323-331.
[5] Li L,Zheng P,Dean J.Maternal control of early mouse development[J].Development,2010,137(6):859-870.
[6] Rajkovic A,Pangas S A,Ballow D,et al.NOBOX deficiency disrupts early folliculogenesis and oocyte-specific gene expression[J].Science,2004,305(5687):1157-1159.
[7] Choi Y,Qin Y,Berger M F,et al.Microarray analyses of newborn mouse ovaries lacking Nobox[J].Biol Reprod,2007,77(2):312-319.
[8] Qin Y,Choi Y,Zhao H,et al,NOBOX homeobox mutation causes premature ovarian failure[J].Am J Human Genetics,2007,81(3):576-581.
[9] Qin Y,Shi Y,Zhao Y,et al.Mutation analysis of NOBOX homeodomain in Chinese women with premature ovarian failure[J].Fertility and Sterility,2009,91(4):1507-1509.
[10] 陈子江,秦莹莹.原发性卵巢功能不全与卵巢早衰的病因学研究进展[J].中华妇产科杂志,2008,43(2):897-899.
[11] 焦智慧,史惠蓉.卵巢早衰诊治进展[J].国际妇产科学杂志,2014,41(4):108-111.
[12] 张 婕,刘 坤,高 华,等.海参花醇提物对卵巢早衰小鼠生殖系统的作用研究[J].国际妇产科学杂志,2014,33(4):70-73.
[13] Bouilly J,Veitia Reiner A,Nadine B.NOBOX is a key FOXL2partner involved in ovarian folliculogenesis[J].J Mol Cell Biol,2014,6(2):175-177.
[14] Georges A,Auguste A,Bessière L,et al.(2014).FOXL2:a central transcription factor of the ovary[J].J Mol Endocrinol,2014,52(1):R17-R33.
[15] 鲁 毅,李任峰,徐 萍,等.FOXL2与脊椎动物性别决定研究进展[J].河南农业科学,2012,41(1):16-20.
[16] 高 敏.FOXL2敲除小鼠的雌性生殖器官向雄性转化[J].生理科学进展,2010,41(5):364.
[17] Huntriss J,Hinkins M,Picton H M.cDNA cloning and expression of the human NOBOX gene in oocytes and ovarian follicles[J].Mol Human Reprod,2006,12(5):283-289.
[18] Tripurani S K,Lee K B,Wang L,et al.A novel functional role for the oocyte-specific transcription factor newborn ovary homeobox(NOBOX)during early embryonic development in cattle[J].Endocrinology,2010,152(3):1013-1023.
[19] Li G,Li M,Fang W,et al.Cloning and characterization of porcine NOBOX gene[J].Chinese J Biotechnol,2009,25(8):1130-1137.
[20] Tripurani S K,Xiao C,Salem M,et al.Cloning and analysis of fetal ovary microRNAs in cattle[J].Anim Reprod Sci,2010,120(1):16-22.
[21] 侯佩莉,杨宏军,王洪梅,等.牛流行热病毒山东流行株G 基因的克隆及序列分析[J].动物医学进展,2012,33(10):1-5.