鸭疫里默杆菌mazp 基因克隆表达及免疫原性分析
王秀祯,罗永芳,夏文君,罗雪刚,彭少静,周 念,李继祥
(西南大学荣昌校区动物医学系,重庆402460)
鸭疫里默杆菌(Riemerella anatipestifer,RA)是一种不运动、无芽胞的革兰阴性菌,主要感染2周龄~8周龄鸭,病死鸭以纤维素性心包炎、肝周炎及气囊炎为主要特征[1]。该菌是当前危害养鸭业最重要的病原菌之一,可使鹅、火鸡、鸡[2]等多种家禽及野鸟感染发病。RA 全基因组序列分析发现,有多种胞外蛋白酶基因且菌株间高度保守[3-5]。胞外蛋白酶作为病原性细菌的重要毒力因子,具有溶组织、抗吞噬和促进细菌扩散等多种作用,是多种细菌的保 护 性 抗 原 之 一,且 不 具 有 血 清 型 特 异 性[6-8]。Pathanasophon P等[9]发现,RA 肉汤培养物的无菌滤液(铝胶佐剂)可以诱导小鸭获得对攻毒的保护;我们在前期进行比较基因组学研究中发现,自然弱毒RA-DY9株[10]缺失胞外蛋白酶membrane-associated zinc metalloprotease(mazp)基因(资料未发表)。为探索RA 各血清型菌株共同的保护性抗原,本研究对鸭疫里默杆菌胞外蛋白酶基因mazp进行原核表达,并通过动物试验测定表达蛋白的免疫原性。
1 材料与方法
1.1 材料
RA-AF 株(血 清2 型)、RA-BSY 株(血 清1型),试验感染鸭能引起典型的“三炎”[11];RA-DY9株,对14 日龄鸭无毒力的自然弱毒株[10]。E.coli DH5α、E.coli BL21(DE3)、pET-32a(+)、RA-AF株细菌抗血清、RA-AF株肉汤培养物无菌滤液鼠抗血清由西南大学荣昌校区兽医公共卫生研究室保存;pMD19-T Vector、PCR 试 剂、DNA 胶 回 收 和DNA 连接试剂盒为宝生物工程(大连)有限公司产品;His-Bind树脂为德国Merck公司产品;Western blot试剂盒为加拿大BioBasic公司产品。5 日龄、12日龄花边鸭由重庆永健生物技术有限公司实验动物基地提供。
1.2 方法
1.2.1 mazp基因的克隆 参照GenBank 已发表的RA-GD 株mazp基因核苷酸序列(CP002562.1),利用引物设计软件设计1 对上、下游引物(P1:5′-GGATCCGATTTGTTAACCCAAAT-3′,P2:5′-AAAGCTTAATGTCACTTCCAATAATGAG-3′),在上、下游引物的5′端分别引入BamHⅠ和HindⅢ酶切位点,预计扩增片段大小为1 326bp左右,引物由上海生工生物工程技术服务有限公司合成。
按照参考文献[12]利用SDS/CTAB 法提取RA-AF 株细菌基因组DNA。以提取的基因组DNA 为模板扩增目的基因片段。PCR 反应体系(25.0μL):基因组DNA 1.0μL,10×PCR buffer(Mg2+free)2.5μL,dNTPs(各2.5 mmoL/L)2.0μL,MgCL2(25mmoL/L)2.0μL,上、下游引物(10μmoL/L)各2.0μL,TaKaRa r Taq(5 U/μL)0.25μL,加水至总体积为25.0μL。PCR 扩增程序:95 ℃3 min;95 ℃1 min,49 ℃1 min,72 ℃1.5min,30个循环;72 ℃10 min。10g/L 的琼脂糖凝胶电泳观察,利用TaKaRa公司的胶回收试剂盒回收PCR 产物,纯化产物与pMD19-T 载体在经16 ℃过夜连接,转化E.coli DH5α,蓝白斑筛选阳性克隆并扩大培养后寄上海生工生物工程技术服务有限公司测序。测序结果在NCBI中利用Blast进行比对分析。
1.2.2 原核表达载体的构建及诱导表达 利用最小碱裂解法提取含mazp基因的重组质粒和原核表达质 粒pET-32a(+),并 分 别 利 用HindⅢ 和BamHⅠ在30 ℃水浴中作用2h 进行双酶切;10g/L琼脂糖凝胶电泳,切胶回收mazp基因和线性化pET-32a(+)并用T4DNA 连接酶连接后转化E.coli DH5α感受态细胞;阳性重组表达质粒转化E.coli BL21(DE3),IPTG(1 mmol/L)诱导菌液用SDS-PAGE进行重组蛋白的检测。表达融合蛋白按说明书用His.Bind树脂进行纯化及用RA-AF株肉汤培养物无菌滤液鼠抗血清进行Western blot检测。
1.2.3 mazp蛋白免疫小鸭的攻毒保护试验 mazp蛋白经纯化后利用生理盐水配置成0.6mg/mL,按1∶2(V/V)与矿物油佐剂(柏油、司班、硬脂酸铝)乳化为油包水的免疫抗原。88只5日龄鸭随机分成8组,每组11只;第1组、第2组每只鸭颈部皮下接种免疫抗原0.5 mL(免疫原蛋白含量0.2 mg/mL),第3组、第4组每只免疫油包水RA-AF株全菌抗原0.5mL(免疫原细菌含量1.0×1010cfu/mL),第5组、第6组每只免疫油包水pET-32a(+)标签蛋白(免疫原蛋白含量0.2mg/mL),第7组、第8组为空白对照组;免疫后15d,第1组、第3组、第5组、第7组小鸭用RA-AF 株菌悬液经腿部皮下接种0.2mL/只(100LD50),第2组、第4组、第6组、第8组接种RA-BSY 株0.2mL/只(100LD50);攻毒后连续观察10d,记录发病及死亡情况。
1.2.4 mazp蛋白抗血清的被动免疫保护试验 用1.2.3制备的mazp蛋白和标签蛋白免疫抗原分别免疫健康家兔制备抗血清,免疫程序为:第1次背部皮下多点注射1.5mL/只,每间隔14d进行一次加强 免 疫,第2 次 免 疫2.0 mL/只,第3 次 免 疫3.0mL/只。第3次免疫后14d采血分离血清用于被动免疫保护试验。88只12日龄鸭随机分成8组,每组11 只;第1 组、第2 组每只鸭颈部皮下注射mazp蛋白抗血清2.0mL,第3、4组注射RA-AF株细菌抗血清2.0mL,第5、6组注射标签蛋白抗血清2.0mL,第7、8组注射生理盐水作对照组。注射血清后24h,第1 组、第3 组、第5 组、第7 组用RAAF 株菌悬液经腿部皮下接种0.2mL/只(100LD50),第2、第4、第6、第8组接种RA-BSY 株0.2mL/只(100LD50);攻毒后连续观察10d,记录发病及死亡情况。
1.2.5 数据处理 按Sandhu的方法[13]计算保护指数(PI),并进行卡方检验。
2 结果
2.1 鸭疫里默杆菌mazp基因的扩增
琼脂糖凝胶电泳检测结果显示,以RA-AF株细菌基因组DNA 为模板扩增获得一条介于1 000bp~2 500bp的DNA 条带(图1)。将纯化的扩增产物克隆、测序得到1 326bp的核苷酸序列。该序列在核苷酸和氨基酸水平与 RA-ATCC 11845(CP003388.1)和RA-GD(CP002562.1)株mazp 基因的相似性均在99%以上。

图1 RA-AF株细菌mazp基因的PCR 结果Fig.1 PCR result of mazp gene of RA-AF strain
2.2 mazp基因的原核表达
利用pET-32a(+)构建的重组表达载体pET-32a-mazp 转 入E.coli BL21(DE3),并 经IPTG(1mmoL/mL)在37℃诱导5h,表达蛋白以包涵体形式存在。包涵体经尿素变性,利用His.Bind树脂纯化获得mazp 蛋白(图2)。Western blot结果显示,mazp蛋白能与RA-AF株肉汤培养物无菌滤液鼠抗血清发生特异性反应(图3)。

图2 SDS-PAGE检测重组蛋白Fig.2 Detection of recombinant protein by SDS-PAGE

图3 重组蛋白Western blot检测Fig.3 Western blot analysis of recombinant protein
2.3 攻毒保护
试验鸭经免疫抗原免疫15d后的攻毒保护结果见表1。mazp 蛋白抗原免疫动物经RA-AF 株(血清2型)细菌攻毒的死亡率和保护指数分别为27.3%和62.4,RA-BSY 株(血清1型)攻毒的死亡率和保护指数分别为18.2%和77.8,二者死亡率间的差异不显著(X2=0.009)。
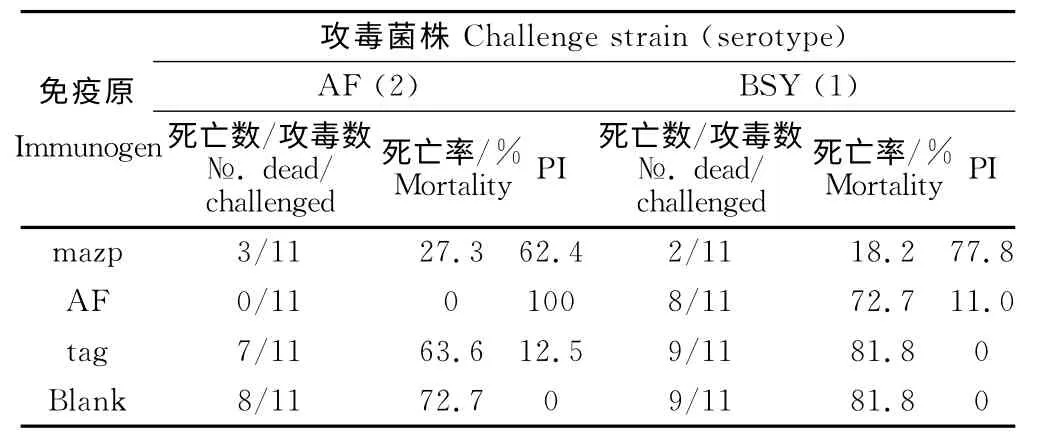
表1 主动免疫鸭的攻毒保护试验Table 1 Protection of ducks by active immunization against challenge with RA
在抗血清的被动免疫保护试验中,注射mazp蛋白抗血清动物在RA-AF和RA-BSY 株细菌攻毒后第5天开始发病,第7天开始死亡,注射标签蛋白抗血清和空白对照在攻毒后第2天开始发病及第3天开始死亡。mazp蛋白抗血清对RA-AF和RA-BSY的攻毒保护指数分别为45.5和27.3,二者间差异不显著(P>0.05)(表2)。
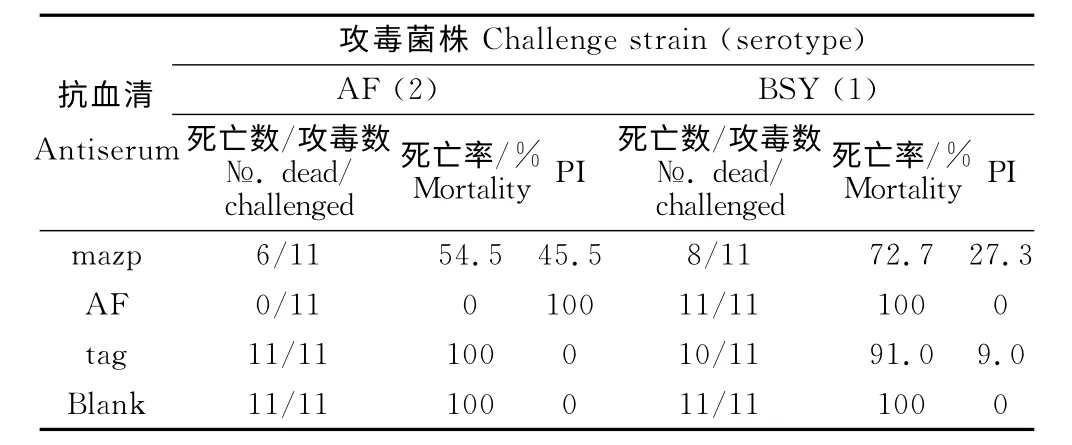
表2 被动免疫鸭的攻毒保护试验Table 2 Protection of ducks by passive immunization against challenge with RA
3 讨论
RA 感染对我国养鸭业危害严重,在使用化学药物的情况下,许多养鸭场的发病率仍超过50%、病死率在80%以上。疫苗免疫预防已被证实在RA感染防控中是有效的,但现有菌体疫苗具有型特异性,在生产中广泛使用受到限制[14]。因此,不具有型特异性的保护性抗原是今后RA 疫苗研究需要重点解决的问题。随着RA-GD[3]、RA-MY[4]和RAATCC11845[5]等全基因组序列的测定及各基因的功能注释,为研究不同血清型菌株共同保护性抗原提供了新的思路。本文在前期研究发现自然弱毒RA-DY9株缺失胞外蛋白酶基因mazp的基础上研究原核表达mazp蛋白的免疫原性,是探索RA 各血清菌株共同保护性抗原的一次有益尝试。
mazp蛋白是一种不具有型特异性的保护性抗原,但不具有完全免疫保护作用。RA-AF肉汤培养物的无菌滤液中除有部分在培养过程中死亡溶解菌体结构成分外,主要是细菌在生长繁殖过程中分泌的可溶性成分,胞外蛋白酶就是其中之一。由于没有纯化RA 胞外蛋白酶mazp及制备抗血清,本文用肉汤培养物的无菌滤液抗血清替代进行Western blot。Western blot结果显示,表达mazp蛋白具有反应原性。在主动免疫保护试验中,mazp蛋白免疫鸭获得攻毒保护指数(PI)在60以上,无血清型间的差异;在被动免疫保护试验中,mazp蛋白抗血清能延缓攻毒动物的发病和死亡时间、降低发病率和死亡率。胞外蛋白酶为病原性细菌合成并分泌到细胞外的非结构成分,其抗体仅能通过影响蛋白酶自身来实现抑制细菌扩散和对组织的损伤等,对菌体无影响,这是mazp蛋白抗原在动物试验中不具有完全保护作用的原因。在今后RA 疫苗研究工作中,应将mazp蛋白与其他结构成分联合使用以提高免疫保护率。
[1] Saif Y M.禽病学[M].苏敬良,高 福,索 勋,译.11版.北京:中国农业出版社,2005,7:767-772.
[2] Li J X,Tang Y,Gao J Y,et al.Riemerella anatipestifer infection in chickens[J].Pak Vet J,2011,31(1):65-69.
[3] Yuan J,Liu W,Sun M,et al.Complete genome sequence of the pathogenic bacterium Riemerella anatipestifer strain RAGD[J].J Bac,2011,193(11):2896-2897.
[4] Zhou Z,Zhou X,Xiao Y,et al.Genome sequence of poultry pathogen Riemerella anatipestifer strain RA-YM[J].J Bac,2011,193(5):1284-1285.
[5] Mavromatis K,Lu M,Misra M,et al.Complete genome sequence of Riemerella anatipestifer type strain (ATCC 11845T)[J].Standards Genomic Sci,2011(4):144-153.
[6] 李瑞武,陈怀青,陆承平.细菌蛋白酶的致病作用[J].国外医学:微生物学分册,1998(3):22-27.
[7] 潘晓艺,沈锦玉,余旭平,等.哈维氏弧菌胞外蛋白酶基因的克隆表达及免疫原性[J].水生生物学报,2010,34(1):152-156.
[8] 张念章.副猪嗜血杆菌hhdA 基因缺失株的构建及胞外丝氨酸蛋白酶免疫原性的研究[D].甘肃兰州:中国农业科学院兰州兽医研究所,2011.
[9] Pathanasophon P,Sawada T,Pramoolsinsap T,et al.Immunogenicity of Riemerella anatipestifer broth culture bacterin and cell-free culture filtrate in ducks[J].Avian Pathol,1996,25(4):705-719.
[10] 高继业,唐 妤,赵 洁,等.一株鸭疫里默杆菌自然弱毒株的分离鉴定[J].中国畜牧兽医,2010,37(6):141-144.
[11] 李继祥,黄 伟,高继业,等.西南地区鸭传染性浆膜炎病原流行病学研究[C]//中国畜牧兽医学会家畜传染病学分会成立2 0周年庆典暨第十次学术研讨会论文集,2003:995-997.
[12] Ausubel F M,Brent R,Kingston R E,et al.精编分子生物学实验指南[M].金由辛,包慧中,赵丽云,等,译.5版.北京:科学出版社,2008:55.
[13] Sandhu T S.Immunization of white Pekin ducklings against Pasteurella anatipestifer infection[J].Avian Dis,1979,23:662-669.
[14] 王小兰,胡青海,童永亮,等.血清1型鸭疫里默杆菌灭活油乳剂疫苗的研制[J].中国预防兽医学报,2012,34(4):313-316.

