牛病毒性腹泻病毒抗原捕获ELISA 方法的建立
范 晴,谢芝勋,谢志勤,刘加波,庞耀珊,邓显文,谢丽基,罗思思
(广西兽医研究所广西动物疫苗和新技术重点实验室,广西南宁530001)
牛病毒性腹泻是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的一种牛的呼吸道及繁殖障碍综合征[1]。该病可通过血液、鼻黏液、粪便等多种途径水平传播[2]。据调查该病在我国大部份地区广泛存在,病感染率高,牛群中相当一部分是BVDV 的携带者,虽然它们不表现临床症状,但终身带毒,持续排毒;该病还可以病垂直传播,当孕期的母牛感染BVDV,会引起死产,胚胎畸形,流产,或者分娩出外表正常的但持续感染的犊牛,当这些持续感染的犊牛再次接触抗原相似性BVDV 即会转变为黏膜病,出现急性脱水性腹泻,1月~2月内死亡,死亡率高达100%[3]。这些持续感染BVDV牛的是养牛业潜在的隐患,一旦发病会成巨大的经济损失[4]。
目前对该病的防控主要依靠疫苗免疫接种,并利用特异性诊断方法检测出持续感染牛,淘汰持续感染牛遂步净化牛群[5-6]。由于BVDV 可引起免疫抑制,即使感染BVDV 也不会产生相应的抗体,因此BVDV 的确诊需检测其抗原,常见的抗原检测方法有PCR、LAMP和ELISA[7-9]。但PCR 和LAMP有一定的局限性,需不断更新引物才能适应BVDV的变异(目前已知的BVDV 有15个基因)。ELISA方法操作简单,快速,一次可检测数百份样品,非常适合大规格疫情的检测。由于BVDV 仅有一种血清型,更适合于用ELSIA 进行检测。本研究利用NS3单克隆抗体为捕获抗原,建立BVDV 抗原捕获ELISA 方法,为今后BVDV 的防控奠定基础。
1 材料与方法
1.1 材料
BVDV 毒 株Oregon CV24,NADL 株,BVDV标准阳性血清等均购自中国兽药监察所;牛肾细胞MDBK 为中国细胞典藏中心产品;抗BVDV NS3蛋白单克隆抗体,2个广西分离株GX-4,GX-6136由广西兽医研究所生物技术实验室分离;牛轮状病毒(Bovine rotavirus,BRV),牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV),牛分支杆菌(Mycobacterium bovis,MB),猪瘟病毒(Classical swine fever virus,CSFV)由广西兽医研究所生物技术实验室保存;50 份阴性样品(经国标[10]检测后,结果为阴性的样品),45份待检临床牛粪便棉拭子样品采集自广西各地牛场;HRP-羊抗鼠IgG 为索莱宝公司产品;TMB 底物显色剂为天根公司产品。
1.2 方法
1.2.1 病毒增殖 MDBK 细胞培养至单层,参考文献繁殖CV24毒株[11]。CV24接毒96h后,细胞出现典型病变,收获细胞复冻融3 次,10kg 离心10min,收集上清,用差速离心及不连续蔗糖密度梯度离心纯化病毒,按照ReeD-Muench 计算TCID50为10-6.9/0.1 mL,将纯化后的病毒无菌分装后置-70 ℃保存。
1.2.2 兔多克隆抗体的制备与纯化 纯化后的CV24细胞培养液无菌取出后与弗氏完全佐剂按1∶1的均匀混合,分3次免疫1月龄母兔,每次间隔10d,背部肢肌肉分点注射抗原2 mL/只,三免后,间隔1周心脏采血并分离血清,采用辛酸-硫酸铵法纯化血清,置于-20 ℃保存备用。
1.2.3 抗原捕获ELISA 方法的建立
1.2.3.1 包被抗体的确定 用pH 9.6的碳酸盐缓冲液分别包被1.2.2制备好的兔抗BVDV 多抗和BVDV 标准阳性血清,100μL/孔,37 ℃1h转4 ℃过夜,包被的浓度依次是1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800,试验重复3次,比较两种多抗作为捕获抗体的效果,其余步骤均按ELISA 标准步骤进行操作,并设立阴性对照。
1.2.3.2 单抗使用浓度的确定 用10g/L BSA(牛血清白蛋白)作稀释剂,BVDV NS3单克隆抗体作为捕获抗体,每列按1∶1 000、1∶2 000、1∶3 000、1∶4 000、1∶5 000稀释,设立阴性对照,采用方阵滴定法进行测定,重复试验3次,检测OD450nm 值,选择P/N值最大的一组为最佳捕获抗体浓度[10]。
1.2.3.3 酶标抗体使用浓度的确定 HRP-羊抗鼠IgG 按1∶1 000、1∶2 000、1∶3 000、1∶4 000、1∶5 000 稀释进行ELSIA,重复试验3 次,检测OD450nm值,选择P/N 值最大的一组为最佳捕获抗体浓度。
1.2.3.4 阴阳性临界值的确定 用已建立的抗原捕获ELISA 检测50 份阴性临床样品,取其OD450nm的平均值¯x,进行样本OD450nm 平均值和标准差(SD)的计算。根据统计学原则,若样品的OD450nm 值>阴性样本OD450nm 值的¯x+3SD 时,可以在99.9%水平上判为阳性,当测结果仍大于临界值,则判定为阳性。
1.2.3.5 特异性试验 将对照病毒(BRV、IBRV、HCV)和细菌(MB)用培养物作待检样品,100μL/孔,用上述建立的ELISA 方法检测测定其OD450nm值,以评价该方法的特异性。
1.2.3.6 敏 感 性 试 验 将TCID50为10-6.9/0.1mL的CV24的细胞培养液从1∶10开始系列稀释,各个稀释度的病毒液100μL 用进行ELISA 测定,确定该方法对病毒的最低检出量。
1.2.3.7 临床样品的检测 参照国标合成引物,并进行RT-PCR 检测[10]。45份临床牛粪便棉拭子样品采集自广西各地牛场,用DMEM 培养基洗脱棉拭子,5 000r/min离心10min后取上清作为待检样品,用建立的抗原捕获ELISA 和RT-PCR 方法检测,同时检测检测NADL 株,2 个广西分离株GX-4,GX-6136。
2 结果
2.1 抗原捕获ELISA 方法的确定
根据间接ELISA 方阵试验结果,最佳的包被抗体为兔抗BVDV 多抗,浓度为1∶1 600,最佳捕获抗体浓度为1∶2 000。当包被抗体量为1∶1 600/孔,捕获抗体浓度为1∶2 000 时,阳性样品OD450nm 与阴性对照OD450nm 的比值(P/N)最高,酶标抗体最佳工作浓度为1∶4 000(表1,图1)。
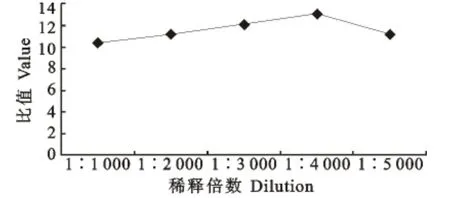
图1 酶标抗体工作浓度的确定Fig.1 Determination of optimum working concentration of antibody labeled with enzyme
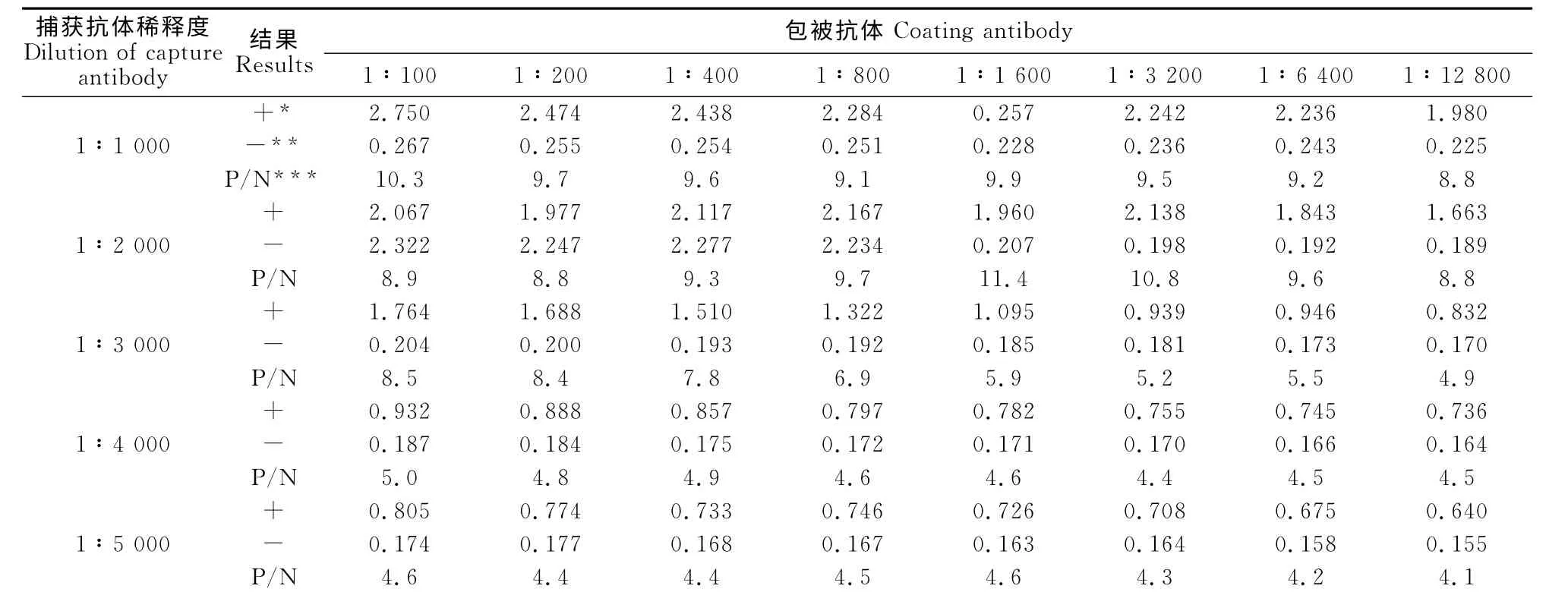
表1 最佳抗体包被浓度和捕获抗体浓度的确定Table 1 Determination of optimum working concentration of coating antibody and capture antibody
操作步骤确定后如下:兔抗BVDV 多抗1∶1 600包被,100μL/孔,37 ℃作用1h 后,4 ℃过夜;PBST 洗板3次;50g/L 脱脂奶封闭60min,PBST洗板3次;加待检样品(临床样品)100μL/孔,作用60min;PBST 洗板3次;加捕获抗体(NS3单抗1∶2 000稀释),100μL/孔,作用1h 后;HRP-羊抗鼠IgG 1∶4 000稀释作用60min;PBST 洗板3次;显色;最后2 mol/L 的硫酸终止反应,置酶标仪读取OD450nm 的值。
2.2 阴阳性临界值的确定
取50份阴性牛血清,用所建立的ELISA 进行检测,OD450nm 的平均值为0.327 和标准差为0.089确定其临界值为0.327+0.89×3=0.594,定义E2-ELISA 检测样品OD450nm≥0.319为阳性,OD450nm<0.594为阴性。
2.3 特异性试验
建立的ELISA 方法检测BRV、IBRV、MD、HCV 测定OD450nm 值,均低于0.594,视为阴性,可见该方法特异性好,结果见表2。
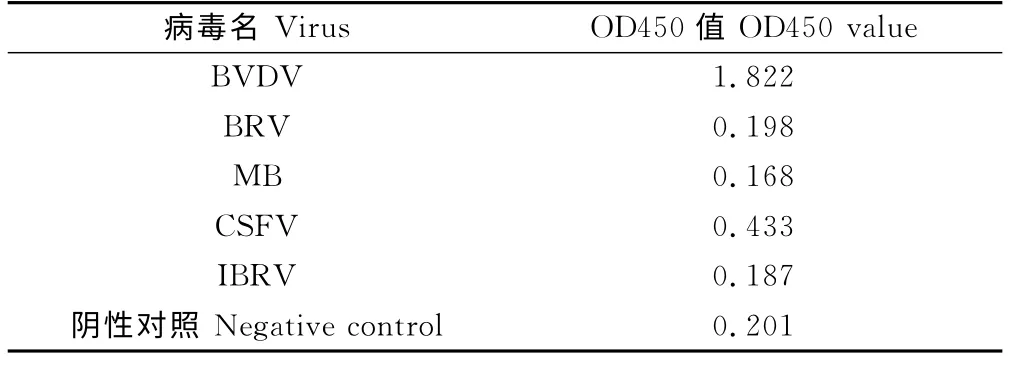
表2 抗原捕获ELISA 方法特异性试验结果Table 2 The specificity test result of Ag-capture ELISA
2.4 敏感性试验
将CV24细胞培养液(10-6.9/0.1mL)从1∶10开始系列稀释进行ELISA 测定。结果表明,细胞病毒液最低检出量为7.9×103TCID50(表3)。
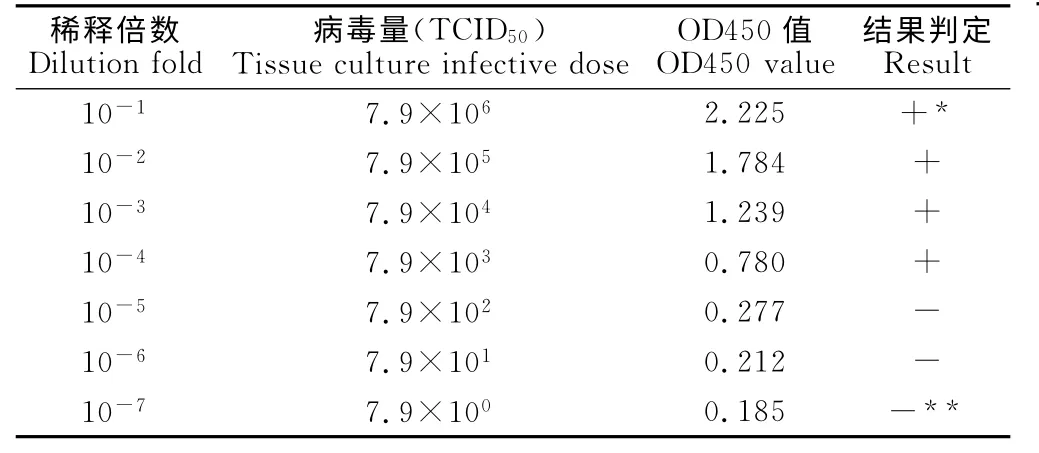
表3 抗原捕获ELISA 敏感性试验结果Table 3 The sensitivity test result of Ag-capture ELISA
2.5 与RT-PCR方法比较结果
用建立的抗原捕获ELISA 和RT-PCR 方法检测BVDV NADL 株,2 个 广 西 分 离 株GX-4,GX-6136,以及本实验室所保存45份临床牛粪便棉拭子(其中18份为阳性样品,27份为阴性样品),符合率为100%,结果见表4(阴性样品结果省略)。

表4 RT-PCR与抗原捕获ELISA 方法的比较Table 4 The comparing result of RT-PCR and Ag-capture ELISA
3 讨论
BVDV 感染机体后免疫系统的CD4+T 细胞主要识别NS3和E2两种蛋白,并可诱导免疫细胞产生针这两种蛋白的抗体[12]。但囊膜蛋白E2在各个毒株中变异较大,存在两个可变区(V1、V2)[13-14]。NS3核苷酸序列分析表明,NS3 编码区不仅在BVDV 各毒株间都较保守,且在不同基因型(BVDV1和BVDV2)和生物型(细胞病变型和非细胞病变型),以及瘟病毒属中都是是非常保守的[12]。因此,本研究选择BVDV NS3的单克隆抗体作为捕获抗体。
本研究比较了BVDV 标准阳性血清和兔抗BVDV 多抗2种抗体作为包被抗的效果,结果发现,兔抗BVDV 多抗效果较好,P/N 值高,特异性好。推测BVDV 标准阳性血清中存在抗牛的某些抗体,会BVDV 抗原发生非特异性结合;另外本试验是采用蔗糖密度梯度离心纯化后的病毒免疫家兔,产生的抗体经过纯化后,纯度较好,因此特异性好。
据报道BVDV 在我国广泛在,安徽、江苏、广西各 省BVDV 感 染 率 为 分 别 为34.2%、8.4%、10%[3]。2009年-2012 年,广西地区的BVDV 感染率高达24.8%(间接ELISA 方法检出)和27.3%(荧 光 定 量RT-PCR 检 测 出)[9]。通 常 情 况 下,BVDV 是以持续性感染不发病的形式存在于牛身体内以,且BVDV 可引起免疫耐受,即使感染BVDV也不会产生相应的抗体。由前面感染的数据可见,BVDV 抗体检测率低于抗原检出率。鉴于BVDV发病机理及临床特征的复杂性,需要对其抗原的检测才能准确诊断牛是否感染了BVDV。本研究所建立的BVDV 抗原捕获ELSIA 方法一次可以检测数百个样品,特异性好,敏感性高,最低可以检测到7.9×103TCID50,操作方便,所需设备简单,数小时内可完成,可合适于大规模的检测。对牛场进行定期监测,获知全群感染水平,可初步确定BVDV 阳性感染场。在此基础上,再结合其他诊断方法,才能逐步开展BVDV 的净化,今后BVDV 的防制提供技术保障。
[1] 殷 震,刘景华.动物病毒学报[M].2 版.北京:科学出版社,1997:562-571.
[2] Meyling A,Houe H,Jensen A M.Epidemiology of bovine virus diarrhoea virus[J].Rev Sci Tech,1990(9):75-93.
[3] 邱昌庆,郭慧琛,程淑敏,等.安徽、江苏、广西部分地区水牛牛病毒性腹泻/粘膜病血清学监测[J].中国预防兽医学报,2000,22(6):453-454.
[4] BVDV virus causes heavy losses in a Scottish cattle herd[J].Vet Rec,2007,160(9):281-284.
[5] Negron M,Raizman E A,Pogranichniy R,et al.Survey on management practices related to the prevention and control of bovine viral diarrhea virus on dairy farms in Indiana,United States[J].Prev Vet Med,2011,99(2-4):130-135.
[6] Walz P H,Grooms D L,Passler T,et al.Control of bovine viral diarrhea virus in ruminants[J].J Vet Intern Med,2010,24(3):476-486.
[7] Qing F,Zhixun X,Liji X,et al.A reverse transcription loopmediated isothermal amplification method for rapid detection of bovine viral diarrhea virus[J].J Viro Meth,2012,186(1-2):43-48.
[8] 范 晴,谢芝勋,刘加波,等.牛病毒性腹泻病毒实时荧光定量RT-PCR检测方法的建立[J].动物医学进展,2010,30(10):10-14.
[9] 范 晴,谢芝勋,刘加波.牛病毒性腹泻病毒三种核酸检测方法的比较[J].中国兽医科学,2012,42(3):294-298.
[10] SN/T1905-2007.牛病毒性腹泻/粘膜病反转录聚合酶链反应操作规程[S].
[11] 王树成,林建辉,刘 宏,等.用MDBK 传代细胞繁殖BVD毒株的研究[J].中国动物检疫,1995,12(4):6-8.
[12] Dirk D,Edward J D,Michael J,et al.Mapping of two antigenic domains on the NS3protein of the pestivirus bovine viral diarrhea virus[J].Vet Microbiol,2005,108(1-2):1322.
[13] Marzocca M P,Seki C,Giambiagi S M,et al.Truncated E2 of bovine viral diarrhea virus(BVDV)expressed in Drosophila melanogaster cells:a candidate antigen for a BVDV ELISA[J].J Virol Meth,2007,144(1-2):49-56.
[14] Ferrer F,Zoth S C,Calamante G,et al.Induction of virusneutralizing antibodies by immunization with Rachiplusia nu per os infected with a recombinant baculovirus expressing the E2glycoprotein of bovine viral diarrhea virus[J].J Virol Meth,2007,146(1-2):424-427.