高效光合细菌菌剂对土壤微生物的影响
杨盼盼, 张海春, 刘丽辉, 蒲 强, 彭桂香
华南农业大学资源环境学院,广东省微生物信号与作物病害防控重点实验室,广州510642
高效光合细菌菌剂对土壤微生物的影响
杨盼盼, 张海春, 刘丽辉, 蒲 强, 彭桂香∗
华南农业大学资源环境学院,广东省微生物信号与作物病害防控重点实验室,广州510642
为了筛选在盆栽试验条件下适宜的高效光合细菌菌剂浓度以促进番茄生长,研究了高效光合细菌菌剂的3种浓度对番茄种植土壤中微生物特性的影响。试验结果表明:高效光合细菌菌剂的施用可以显著提高土壤中细菌和放线菌的数量,降低土壤中真菌数量;不同程度提高土壤脲酶、酸性磷酸酶和过氧化氢酶的活性。其中以稀释100倍的光合细菌菌剂+化肥处理效果最明显,稀释100倍的菌剂+化肥处理最有利于土壤中微生物的生长繁殖,对土壤环境的改善效果最显著。
光合细菌;土壤微生物;土壤酶
土壤微生物是土壤生态系统的重要组成部分,其参数综合反映了土壤的物理、化学和生物特性。土壤微生物对土壤结构的改善,养分元素的积累、转化、维持和土壤矿物质的分解起促进作用,有利于土壤团粒结构的形成与稳定。土壤微生物数量与作物根重及地上部分的生长有密切关系,土壤-作物系统与土壤微生物之间存在相互作用、互为条件的关系[1,2],土壤微生物的数量在一定程度上反映了土壤的肥力状况。土壤酶是指土壤微生物、植物根系和土壤中其他生物细胞产生的胞内酶和胞外酶的总称[3]。土壤酶参与土壤的许多重要生物化学过程和元素循环,是土壤生物化学特征的重要组成部分,是评价土壤肥力的一项重要指标,目前已经把土壤酶活性作为检测土壤肥力和土壤环境变化的重要指标[4~7]。土壤微生物和土壤酶的改变反映了土壤养分的循环潜能,因此研究土壤微生物和土壤酶的变化过程对农业生产有重要指导意义。
光合细菌(photosynthetic bacteria,PSB)是具有原始光能合成体系的原核生物的总称[8]。光合细菌是一种多功能益生菌,近年来,光合细菌除了应用在制氢、食品、医药保健、饲料添加剂和水质净化剂等方面外[9~19],也在农业领域得到越来越广泛的应用。已有研究表明,光合菌剂能有效改善植物根际土壤的微生态环境,提高土壤肥力[20,21]和植物的抗病能力[22~24]。 本试验将光合细菌以菌肥形式施入土壤,测定其对土壤微生物和土壤酶的调节作用,并与化肥进行比较,评价光合细菌对土壤的生态学效应。本试验主要探索在盆栽试验条件下光合细菌菌剂的最佳施肥浓度,以期发挥光合细菌菌剂的最佳促生长作用,为光合细菌菌剂应用于大田试验提供参考,有利于光合细菌菌剂在田间的大面积推广和应用,同时为光合细菌应用于农业生产、开发新型肥料等提供理论依据。
1 材料与方法
1.1 材料
番茄(Lycopersicun esculentum Mill)品种为金冠一号,由广东省农业科学院蔬菜研究所提供;光合细菌菌剂为胶状红长命菌(Rubrivivax gelatinosus),由华南农业大学农学院分子遗传实验室提供。
本实验用土为赤红壤发育而成的水稻土,采自华南农业大学跃进北农学院实验基地,土壤的肥力指标:pH 6.47,有机质25.63 g/kg,碱解氮100.86 mg/kg,速效磷 30.69 mg/kg,速效钾158.29 mg/kg。

表1 盆栽试验施肥处理Table 1 Fertilizer treatments of pot experiment.
1.2 试验设计
盆栽试验设5个处理和1个对照,具体施肥情况见表1,设3次重复,随机排列,盆高20 cm,上口直径为25 cm,下口直径为18.5 cm,置于网棚中。盆栽试验2012年8月开始,2012年12月结束。在移栽10 d、25 d、40 d、55 d、70 d时各施肥一次,每次施入光合细菌菌剂10 mL/株(OD600约 0.2),每次施尿素 0.24 g/kg、过磷酸钙0.12 g/kg、氯化钾0.12 g/kg。除P6处理外,所有处理氮、磷、钾的施入总量相等。
1.3 测定方法
采用稀释涂平板法[25]测定土壤中细菌、真菌和放线菌数量。细菌采用牛肉膏蛋白胨培养基,于25~28℃培养5 d;放线菌采用改良高氏一号培养基,于25~28℃培养7 d;真菌采用孟加拉红培养基,于25~28℃培养3 d。番茄生长期每隔15 d (每次施肥后5 d)采土样 1次,采样深度为0~20 cm。
本试验3种酶活性测定的土样均为过1 mm筛的风干土样。采用靛酚蓝比色法测定土壤脲酶活性;高锰酸钾滴定法测定土壤过氧化氢酶活性;Gibbs试剂比色法测定土壤酸性磷酸酶活性[3]。
1.4 数据分析
用SASV8软件对数据进行处理,采用Duncan’s法对数据进行差异显著性分析。
2 结果与分析
2.1 对土壤微生物群落多样性的影响
2.1.1 对土壤细菌数量的影响 从图1可以看出,在移栽10 d时P1处理细菌数量均高于其余处理,在30 d、45 d、60 d时P2处理高于其余处理,说明光合细菌菌剂可以显著提高土壤中细菌的数量,其中稀释100倍的光合细菌菌剂在提高土壤中细菌数量方面的作用更加显著,稀释100倍的光合细菌菌剂能够更好地为植物生长提供有益环境。P4处理细菌数量高于P5、P6处理,说明稀释100倍灭菌处理的光合细菌菌剂也能提高土壤中的细菌数量,但效果不如光合细菌菌剂,可能是光合细菌菌剂中含有大量的光合细菌,使得土壤中细菌的数量增加。P5处理后期采样时细菌数量显著低于其余各处理,说明单施化肥对土壤中细菌的生长繁殖不利。光合细菌菌剂为土壤提供光合细菌,促进土壤细菌生长,从移栽15~45 d,土壤中细菌的数量呈增加趋势,在采样后期(60 d),土壤中细菌的数量开始下降,这与试验期气候条件有关,12月连续阴雨天气,且气温有所降低,造成土壤细菌数量减少。
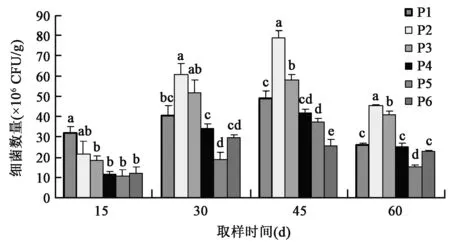
图1 不同处理对土壤中细菌数量的影响Fig.1 Effects of different treatments on bacterium population in soil.
2.1.2 对土壤真菌数量的影响 从图2可以看出,土壤中真菌的数量呈现先上升后下降的趋势。在移栽后30 d采样时,P1、P2、P3处理真菌数量高于其余各处理,说明光合细菌菌剂的施入能提高土壤中真菌的数量;但在45 d、60 d采样时,P1、P2、P3处理真菌数量又逐渐降低,且P2处理土壤中真菌数量最低,说明光合细菌菌剂在植物生长后期对土壤中的真菌有抑制作用。P4处理在移栽后15 d、30 d、45 d采样时,土壤中真菌数量一直处于增长的趋势,在60 d采样时,土壤中真菌数量高于其余各处理,说明稀释100倍经灭菌处理的光合细菌菌剂为土壤中真菌的生长提供了有益的环境。P5、P6处理土壤中真菌数量的变化趋势与P4处理相似,含量略低于P4处理,说明光合细菌菌剂中的细菌抑制了土壤中原有真菌的正常生长繁殖。从45~60 d各施肥处理整体数量表现为下降趋势,这可能与试验期气候条件有关,造成土壤真菌数量减少。
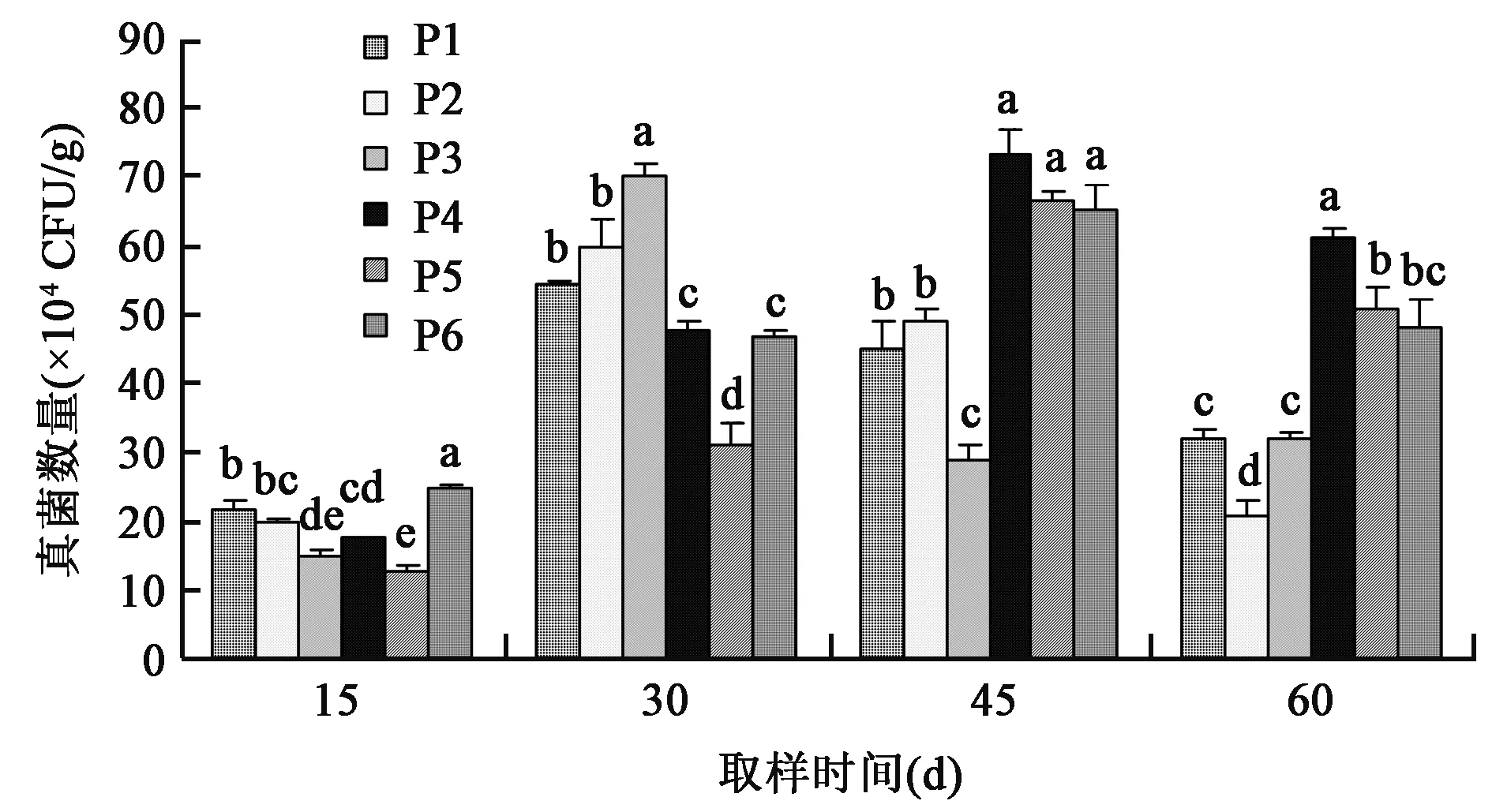
图2 不同处理对土壤中真菌数量的影响Fig.2 Effects of different treatments on fungus population in soil.
2.1.3 对土壤放线菌数量的影响 从图3可以看出,P2处理在每次采样时,土壤中放线菌的数量均高于其余各处理,说明光合细菌菌剂稀释100倍时对土壤中放线菌数量的提高效果最显著。P1处理在各次采样时放线菌数量均低于P2、P3处理,说明光合细菌菌剂稀释50倍时对土壤中放线菌数量的提高效果不如稀释100倍和200倍的效果。P4处理在移栽后15 d采样时放线菌数量显著高于P6处理,在45 d采样时显著高于P5、P6处理,在30 d、60 d采样时与P5、P6处理无显著差异,说明稀释100倍经灭菌处理的光合细菌菌剂对土壤放线菌数量有提高,但不如稀释100倍的光合细菌菌剂效果显著。从采样15~45 d,不同处理土壤中放线菌数量呈增加趋势,随着采样后期气候条件的改变,不同施肥处理土壤中放线菌的数量减少。
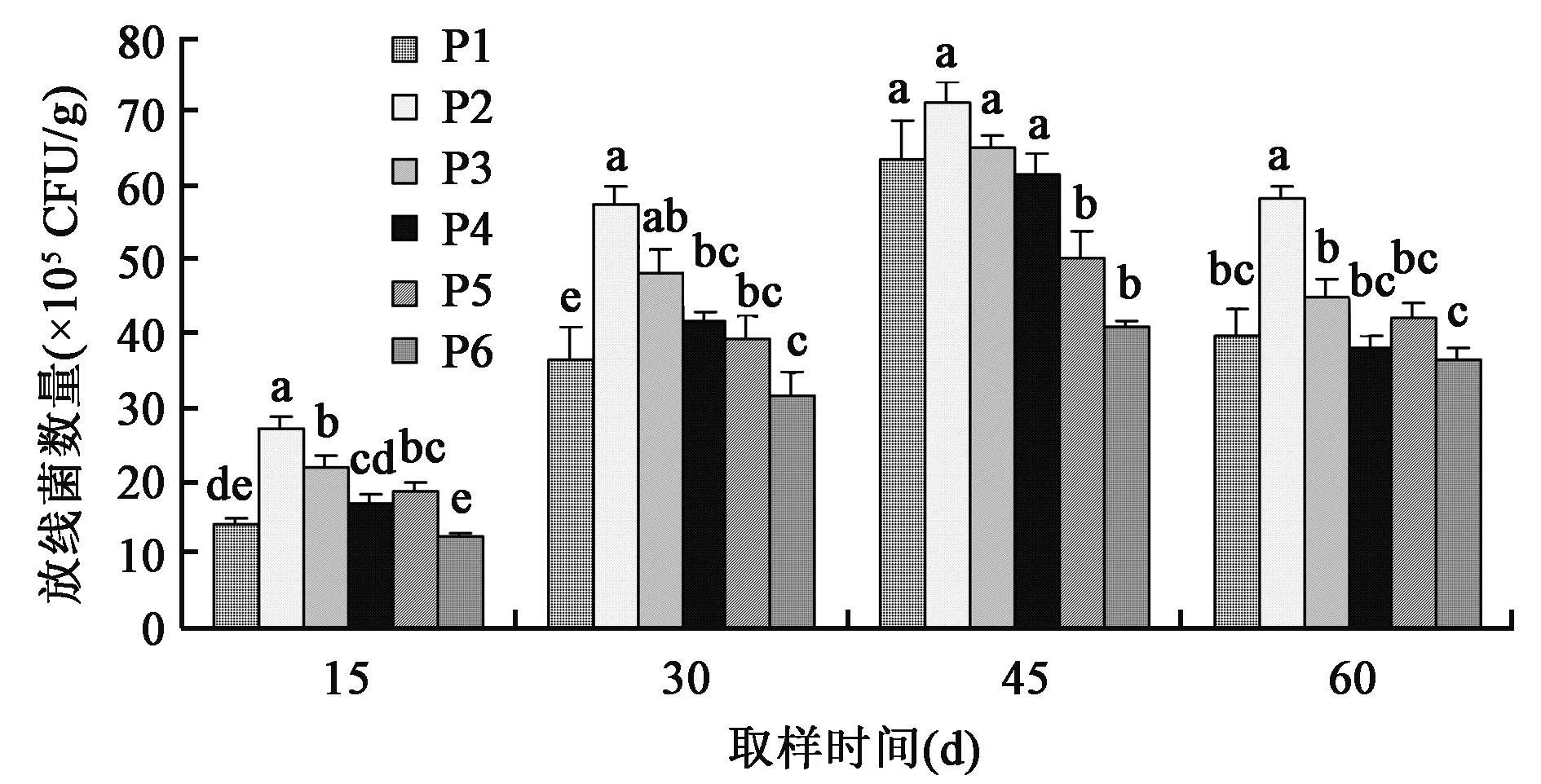
图3 不同处理对土壤中放线菌数量的影响Fig.3 Effects of different treatments on actinomyce population in soil.
2.2 对土壤酶活性的影响
2.2.1 对土壤脲酶活性的影响 从图4可以看出,P1、P2、P3处理在移栽后15 d、30 d采样时,脲酶活性均高于其他各处理且P2脲酶活性最高,说明施用光合细菌菌剂能够提高土壤脲酶活性且P2处理效果最明显。在45 d、60 d采样时P4处理脲酶活性高于P1、P5、P6处理,说明稀释100倍经灭菌处理的光合细菌菌剂也能够提高脲酶活性,但效果不如稀释100倍和200倍的光合细菌菌剂;在45 d、60 d采样时P1处理脲酶活性呈下降趋势,说明稀释50倍的光合细菌菌剂在后期不利于土壤中脲酶活性的提高。P5处理在15 d、30 d、60 d采样时脲酶的活性均低于其余各处理,说明单施化肥对土壤中脲酶活性有抑制作用。
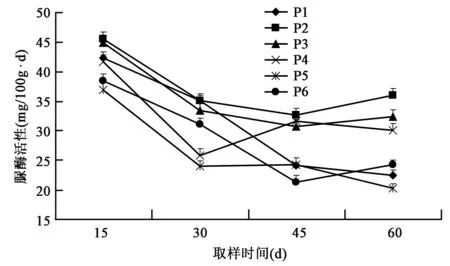
图4 不同处理对土壤脲酶活性的影响Fig.4 Effects of different treatments on activity of soil urease.
2.2.2 对土壤酸性磷酸酶活性的影响 从图5可以看出,P1处理在移栽后15 d、30 d采样时土壤中酸性磷酸酶活性与P2、P3处理非常接近,但45 d、60 d采样时土壤中酸性磷酸酶活性低于P2、P3处理,P2、P3处理土壤中酸性磷酸酶活性均高于其余各处理,说明稀释100倍和稀释200倍的光合细菌菌剂能够提高土壤中酸性磷酸酶的活性,稀释50倍的光合细菌菌剂在前期能够提高土壤中酸性磷酸酶活性,但后期却又抑制了土壤中酸性磷酸酶活性。P4处理在30 d、45 d、60 d采样时土壤中酸性磷酸酶活性低于P2、P3处理但高于P5、P6处理,说明稀释100倍经灭菌处理的光合细菌菌剂对土壤中酸性磷酸酶活性的提高效果不及稀释100倍和稀释200倍的光合细菌菌剂,但高于单施化肥和清水对照处理的土壤磷酸酶活性。
2.2.3 对土壤过氧化氢酶活性的影响 从图6可以看出,P1、P2、P3、P4处理在不同采样时期中,土壤中过氧化氢酶活性高于P5、P6处理,说明光合细菌菌剂和经灭菌处理的光合细菌菌剂均能提高土壤中过氧化氢酶的活性。P2处理在不同时期的采样中土壤过氧化氢酶活性均高于其余各处理,说明稀释100倍的光合细菌菌剂对土壤中过氧化氢酶活性的提高效果更好。P5、P6处理土壤中过氧化氢酶活性几乎一样,说明单施化肥对土壤中过氧化氢酶活性的影响较小。
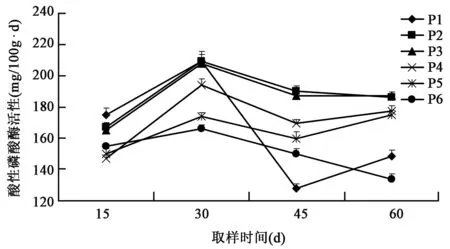
图5 不同处理对土壤酸性磷酸酶活性的影响Fig.5 Effects of different treatments on activity of soil acid phosphatase.
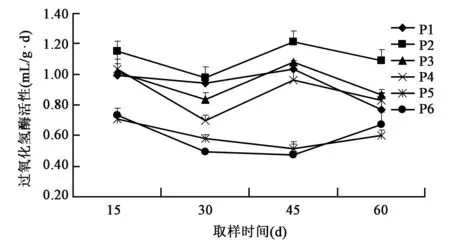
图6 不同处理对土壤过氧化氢酶活性的影响Fig.6 Effects of different treatments on activity of soil catalase.
3 讨论
土壤的肥力水平能够影响微生物的活动,改变微生物的类群,同时,大量的微生物又反过来对土壤结构的改善以及养分积累、转化和维持起促进作用。已有研究表明,光合细菌能显著提高土壤中细菌和放线菌数量,抑制真菌的数量[26~29]。本实验结果表明:稀释100倍和200倍的光合细菌菌剂在不同时期对土壤中细菌和放线菌数量有显著的提高效果,对真菌数量的影响表现为: 15 d、30 d采样时,对土壤中真菌数量有提高作用;45 d、60 d采样时,对土壤中真菌数量有显著的抑制效果;稀释50倍的光合细菌菌剂前期对土壤中细菌和放线菌的提高效果显著,但后期效果却显著低于稀释100倍和200倍的光合细菌菌剂。因此光合细菌通过提高放线菌数量、抑制真菌的增殖,减少作物病害的发生,为作物提供健康的生活环境。
土壤酶作为土壤的组成部分,对土壤营养物质转化、有机质分解、污染物降解及修复等起着重要的作用。土壤过氧化氢酶、磷酸酶、脲酶之间存在一定的关系,它们之间的关系及其总体活性对评价土壤肥力水平有重要意义[30]。本研究结果表明,施用光合细菌菌剂的土壤中脲酶、酸性磷酸酶、过氧化氢酶的活性显著高于化肥和清水处理,这与前人的研究结果[26,32~34]相一致。其中稀释100倍的光合细菌菌剂处理效果最明显,这可能是因为光合细菌菌剂中含有大量的光合细菌,光合细菌的加入丰富了土壤中的微生物,同时也刺激了土壤中土著微生物的代谢作用,从而增加了以上4种酶的活性;也可能是因为光合细菌菌剂中本身含有光合细菌代谢产生的各种酶类。试验中稀释50倍的光合细菌菌剂在后期不利于土壤中酶活性的提高,可能是因为高浓度的光合细菌菌剂抑制了番茄的生长,番茄根系代谢活动减弱导致土壤环境不利于微生物的生长,土壤中各种酶类的活性也受到影响。土壤中单施化肥处理的酸性磷酸酶活性高于对照,其余2种酶表现为单施化肥处理低于对照,这可能是因为化肥的施用提高了土壤中全氮的质量分数,而相关研究也表明,土壤中磷酸酶活性与土壤中氮质量分数呈正相关[35],所以磷酸酶较对照有一定的提高。
光合细菌能通过调节土壤的微生物结构,促进土壤物质转化和循环,提高土壤肥力,为植物提供更多的可利用物质;同时又能提高土壤酶的活性,提高土壤细菌、放线菌数量,增加土壤有益微生物数量,抑制真菌的增殖,抑制病害和提高植物的抗病力,从而为植物生长创造了良好健康的土壤环境。这一研究结果为大面积推广利用光合细菌提供了理论依据,光合细菌在复合肥的研发生产中有广阔的应用前景。
[1] 王超,吴凡,刘训理,等.不同肥力条件下烟草根际微生物的初步研究[J].中国烟草科学,2005,2:12-14.
[2] 贾志红,孙敏,杨珍平,等.施肥对作物根际微生物的影响[J].作物学报,2004,5:491-495.
[3] 关松荫.土壤酶及其研究法[M].北京:中国农业出版社,1986,274-323.
[4] 薛立,陈红跃,邝立刚.湿地松混交林地土壤养分、微生物和酶活性的研究[J].应用生态学报,2003,1:157-159.
[5] Paul E A,Clack FE.Soil Microbiology and Biochemistry[M]. USA San Diego CA:Academic Press,1996,104-109.
[6] Elizabeth A F,Dan B,David V.Soil chemistry changes after 27 years and under four tree species in southern Ontario[J]. Can.J.Forest Res.,1989,19(12):1648-1650.
[7] 曾玲玲,张兴梅,洪音,等.长期施肥与耕作方式对土壤酶活性的影响[J].中国土壤与肥料,2008,2:27-30,60.
[8] 徐芬芬,俞晓凤.光合细菌的光合作用及应用展望[J].生物学教学,2011,6:2-3.
[9] John A H.Photosynthetic suspended-growth systems in aquaculture[J].Aqua.Engin.,2006,34(3):344-363.
[10] Gomelsky M,Zeilstra-Ryalls J H.The living genome of a purple nonsulfur photosynthetic bacterium:Overview of the Rhodobacter sphaeroides transcriptome landscapes[J].Adv. Bot.Res.,2013,66:179-203.
[11] Oleg S P,Raul E M,Elena IK,et al..Interaction ofmetals and protons with anoxygenic phototrophic bacteria Rhodobacter blasticus[J].Chem.Geol.,2013,335(6):75-86.
[12] Cai JL,Wang G C.Hydrogen production by a marine photosynthetic bacterium,Rhodovulum sulfidophilum P5,isolated from a shrimp pond[J].Int.J.Hydr.Energy,2012,37: 15070-15080.
[13] 赵微,张光明.光合细菌处理废水过程中生物产氢技术研究进展[J].中国生物工程杂志,2012,32(12):130-135.
[14] 李军,张辉,李建文,等.光合细菌菌剂在提高板蓝根品质中的应用研究[J].中国医药导报,2011,8(13):58-59.
[15] 陈颖,孙红文,张峻,等.光合细菌的固定化及对养殖水体的净化作用[J].水产科技情报,2011,5:234-238.
[16] 张松柏,张德咏,刘勇,等.光合细菌PSB07-15对水培黄瓜体系中甲氰菊酯污染的生物修复[J].农业环境科学学报,2009,28(10):2198-2203.
[17] Tim H,Damien JB,Jürg K.Phototrophic bacteria for nutrient recovery from domestic wastewater[J].Water Res.,2014,50: 18-26.
[18] Kong F Y,Wang A J,Ren H Y,et al..Improved dechlorination and mineralization of 4-chlorophenol in a sequential biocathode-bioanode bioelectrochemical system with mixed pho-tosynthetic bacteria[J].Bioresour.Technol.,2014,158:32 -38.
[19] da Silva M L B,MezzariM P,Ibelli AM G,et al..Sulfide removal from livestock biogas by Azospirillum-like anaerobic phototrophic bacteria consortium[J].Int.Biodeter.Biodegrad.,2014,86:248-251.
[20] 田俊岭,彭桂香,李永涛,等.一种高效光合菌剂对辣椒生长及土壤微生物的影响[J].生物技术进展,2014,3:197 -200.
[21] Gorlenko V M.History of the study of biodiversity of photosynthetic bacteria[J].Microbiology,2004,73(5):541-550.
[22] 王馥迪,李征,黄秋生,等.光合细菌在植物上的应用现状及展望[J].广东蚕业,2012,2:36-38.
[23] 谢修志,谢向坚.光合细菌菌剂对蔬菜品质影响的初报[J].广东农业科学,2009,12:86-87.
[24] 史清亮,贺跃武,马玉珍,等.光合细菌在农业上的应用研究[J].山西农业科学,2000,28(2):59-62.
[25] 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985,54-57.
[26] 张信娣,曹慧,徐冬青,等.光合细菌和有机肥对土壤主要微生物类群和土壤酶活性的影响[J].土壤,2008,40(3): 443-447.
[27] 张信娣,史永军,陈银科.光合细菌和有机肥对土壤主要微生物类群的影响[J].中国土壤与肥料,2007,3:59-62.
[28] 杨芳,田俊岭,杨盼盼,等.高效光合细菌菌剂对番茄品质、土壤肥力及微生物特性的影响[J].华南农业大学学报,2014,35(1):49-54.
[29] 何云辉.光合细菌的培养及其对土壤肥力的影响[D].成都:四川师范大学,硕士学位论文,2014,41-43.
[30] Gianfreda L,Sannino F,Vtoante A.Pesticide effects on the activity of free,immobilized and soil invertase[J].Soil Biol. Biochem.,1995,27(9):1201-1208.
[31] 王桂芳.沼液配施钾肥对苹果园土壤酶活性和土壤微生物数量及果实品质的影响[D].陕西杨凌:西北农林科技大学,硕士学位论文,2009,14-16.
[32] 蒲铃铃,刘桦,曾莉萍.光合细菌对土壤主要微生物类群的影响试验分析[J].生物技术世界,2012,4:11,27.
[33] 白红娟,肖根林,贾万利,等.光合细菌提高污染土壤中酶活性的研究[J].工业安全与环保,2011,6:13-15.
[34] 肖根林,白红娟,贾万利.光合细菌提高铅、镉及呋喃丹复合污染土壤中酶活性的研究[J].化工技术与开发,2011,2:47-50.
[35] 王延军,宗良纲,李锐,等.不同肥料对有机栽培番茄生长和土壤酶及微生物量的影响[J].南京农业大学学报,2007,30(3):83-87.
Effects of Photosynthetic Bacteria Inoculants on Soil Microorganism s
YANG Pan-pan,ZHANG Hai-chun,LIU Li-hui,PU Qiang,PENG Gui-xiang∗
Key Laboratory of Microbial Signals and Disease Control of Guangdong Province,College of Natural Resources and Environment,South China Agricultural University,Guangzhou 510642,China
In order to select a suitable photosynthetic bacteria inoculants concentration to improve the tomato growth with pot experiment,we studied the effects of three concentrations of high efficient photosynthetic bacteria inoculants on soil microbial properties.The experimental results showed that,significant increases was observed in the population of soil bacteria and soil Actinomycetes with photosynthetic bacteria inoculants,and prominent decrease in thatof soil fungi.Soil urease,acid phosphatase and catalase activities were all improved by the application of photosynthetic bacterial inoculants.The photosynthetic bacterial inoculants diluted 100 times plus chemical treatment was the most remarkable in the experiment,which was more conducive to the soilmicrobes and environment.
photosynthetic bacteria;soil microorganism;soil enzymes
10.3969/j.issn.2095-2341.2015.05.08
2015-03-31;接受日期:2015-05-07
广东省烟草专卖局资助项目(粤烟科[2012]26号);国家自然科学基金项目(31370052);国家 973计划项目(2010CB126502);广东省养分资源循环利用与耕地保育重点实验室开放基金项目(TFS2011-04)资助。
杨盼盼,硕士研究生,研究方向为土壤微生物学。E-mail:yangpanpan929@163.com。∗通信作者:彭桂香,副教授,博士,研究方向为土壤微生物学。E-mail:gxpeng@scau.edu.cn

