食线虫真菌圆锥掘氏梅里霉的高效培养基研究
郭倩楠, 周正富, 徐玉泉, 张 维
中国农业科学院生物技术研究所,北京100081
食线虫真菌圆锥掘氏梅里霉的高效培养基研究
郭倩楠, 周正富, 徐玉泉, 张 维∗
中国农业科学院生物技术研究所,北京100081
作为一种内寄生食线虫真菌,圆锥掘氏梅里霉(Drechmeria coniospora)在常规真菌培养基(如PDA、SDAY和CMA)中生长周期较长(最短为13 d),不利于对其进行科学研究。应用LK-100固体培养基常温培养D.coniospora,通过显微镜观察其生长状态,确定生长周期。研究表明,D.coniospora在LK-100培养基中的生长周期仅8 d,远短于在常规培养基上的生长周期。此外,与常规培养基相比,该培养基获得的D.coniospora分生孢子具有更强的侵染宿主秀丽隐杆线虫(Caenorhabditis elegans)的能力。LK-100培养基为进行D.coniospora相关研究提供了快速、高效的培养方法。
圆锥掘氏梅里霉;LK培养基;生长周期;侵染能力
全球每年由植物寄生线虫造成的作物经济损失高达1 570亿美元[1],开发高效的杀线虫制剂成为全人类面临的重要挑战。因此,研究高效专一、环境效益好、成本低的生物防治线虫制剂成为科学家的共同目标[2,3]。食线虫真菌(nematophagous fungi)能够以一定方式(寄生、捕捉、定殖或毒杀)侵染线虫[4],是防治线虫病害的有效途径。
圆锥掘氏梅里霉(Drechmeria coniospora),是一种专性内寄生食线虫真菌,最早由Drechsler[5]于1941年分离发现。该菌可有效防治多种线虫,包括植物病原线虫(如草莓芽叶线虫Aphelenchoides fragariae、马铃薯腐烂线虫Ditylenchusdestructor和南方根结线虫 Meloidogyne incognita[6~8])和食细菌线虫(全齿复活线虫Panagrellus redivivus[9]和秀丽隐杆线虫 Caenorhabditis elegans[10])等。扫描电子显微镜观察显示,D.coniospora通过分生孢子特异地侵染C.elegans,侵染过程主要为识别、附着、侵入、萌发和产孢[11]。作为内寄生食线虫真菌的典型代表,D.coniospora常被科学家用于研究食线虫真菌与线虫的识别机制[12~19]。
1942年,Glaser等[20]首次使用由牛肝脏和肾脏制成的培养基(牛肝脏或肾脏浓度为200 g/L)培养线虫(Neoaplectana glascri)和 Neoaplectana chresimn,培养23 d时,线虫达到稳定期。1966年,Poinar和Thomas[21]应用浓度均为100 g/L的牛肝脏和肾脏组织为培养基,培养新无小纹虫属线虫(Neoaplectana sp.)。此后,该种培养基陆续被用于小卷蛾斯氏线虫(Steinernema carpocapsae)及其他斯氏线虫(Steinernema)等的培养及相关研究,被培养的线虫由卵发育为成虫约21 d[22~24]。但是,迄今为止,并未见利用LK培养基培养真菌的相关报道。
作为典型的内寄生食线虫真菌,D.coniospora在常规真菌培养基(包括PDA、SDAY和CMA)上培养周期较长(培养周期最短的为SDAY,13 d),一定程度上影响了对D.coniospora的实验研究。因此,寻找一种高效培养D.coniospora的培养基显得尤为重要。本研究利用LK-100固体培养基在室温条件下成功培养D.coniospora,较常规真菌培养基显著缩短了培养周期,有效避免了长时间培养易造成的染菌现象。并且,培养所得D.coniospora分生孢子侵染天然宿主C.elegans能力增强。LK培养基在真菌培养中的应用,为食线虫真菌的深入研究提供了技术支撑。
1 材料与方法
1.1 菌株
Drechmeria coniospora ARSEF 6962由美国农业部提供;Caenorhabditis elegans N2和Escherichia coli OP50由中国科学院生物物理研究所提供。
1.2 培养基及培养条件
LK培养基:称取若干质量猪肝和猪肾,切成小块,放入匀浆机打碎。在上述所得组织匀浆中分别加入5 g NaCl和15 g琼脂,蒸馏水定容至1 L。1×105Pa灭菌30 min。其中,试验所用不同肝肾组成的LK培养基成分见表1。
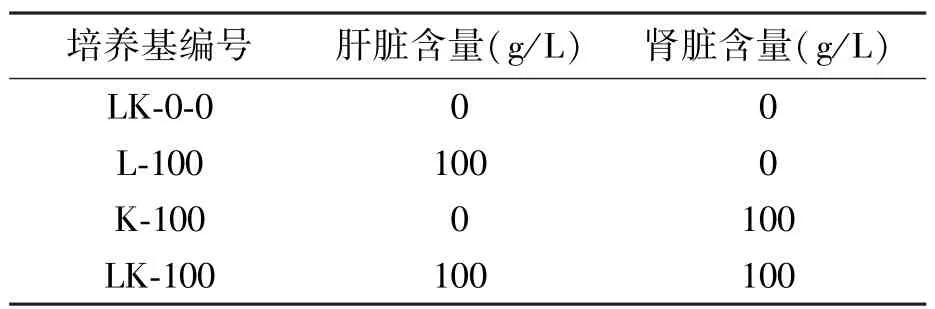
表1 不同肝肾组成的LK培养基成分Table 1 Composition of different LK medium.
SDAY(dextrose neopeptone yeast extract agar)培养基:细菌蛋白胨(BD公司)10 g/L,酵母提取物(OXOID公司)10 g/L,葡萄糖(西陇化工有限公司)40 g/L,琼脂 15 g/L;PDA(potato dextrose agar)培养基购自北京奥博星生物技术有限责任公司;CMA(corn meal agar)培养基购自北京陆桥技术有限责任公司;培养条件为常温培养。
1.3 D.coniospora培养方法
吸取 200μL浓度为 1×108/mL的 D. coniospora孢子悬浮液,涂布固体培养基平板,封口膜封口,倒置于25℃培养箱中培养。
1.4 D.coniospora生长状态鉴定
用无菌接种环挑取微量菌体,均匀涂布于载玻片上,盖上盖玻片,即为样本。通过光学显微镜观察样本,确定菌株的生长状态,记录不同生长阶段所用的培养时间。
1.5 D.coniospora侵染线虫(C.elegans)效率实验
收集培养基上的D.coniospora分生孢子,将分生孢子重悬于0.85%的生理盐水中,使终浓度为1×108/mL,孢子重悬液涂布水-琼脂培养基。筛选100~200条处于L3~L4期的C.elegans,加到含有D.coniospora分生孢子的水-琼脂培养基上。25℃孵育,分别共培养1~10 d取样(取样间隔为1 d)。光学显微镜观察侵染情况,记录被侵染线虫数量,计算侵染效率[6,25]。该实验重复3次,绘制侵染效率曲线图。
2 结果与分析
2.1 D.coniospora的生长周期
D.coniospora在培养基中的生长周期主要分为3个阶段(图1,彩图见图版二)。阶段1:菌丝体时期,菌体以丝状菌丝体形态存在(图1A);阶段2:产孢子时期,菌丝体上产生分生孢子梗,在孢子梗顶端或旁侧的产孢细胞产生瓶梗,瓶梗顶端产孢垫上产生泪滴状分生孢子(图1B);阶段3:孢子成熟期,分生孢子从分生孢子梗上脱落,并在其顶端长出微小的芽体,形成成熟的泪滴状分生孢子(图1C)。形成的新一代分生孢子会休眠,直到处于合适的环境中,才会重新萌发。2.2 LK培养基中肝和肾含量分别对D.coniospora生长的影响
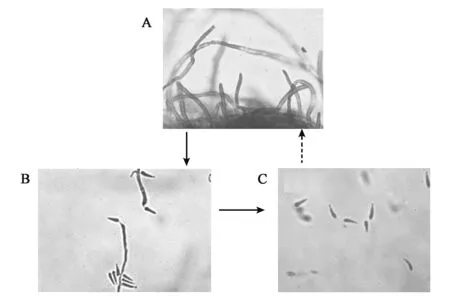
图1 D.coniospora在培养基中的生长周期Fig.1 The growth cycle of D.coniospora in medium.
为了探究LK培养基中肝、肾添加量对D.coniospora生长周期的影响,试验观察了 D. coniospora分生孢子在 LK-0-0、L-100、K-100和LK-100培养基中的生长周期,结果如图2所示。
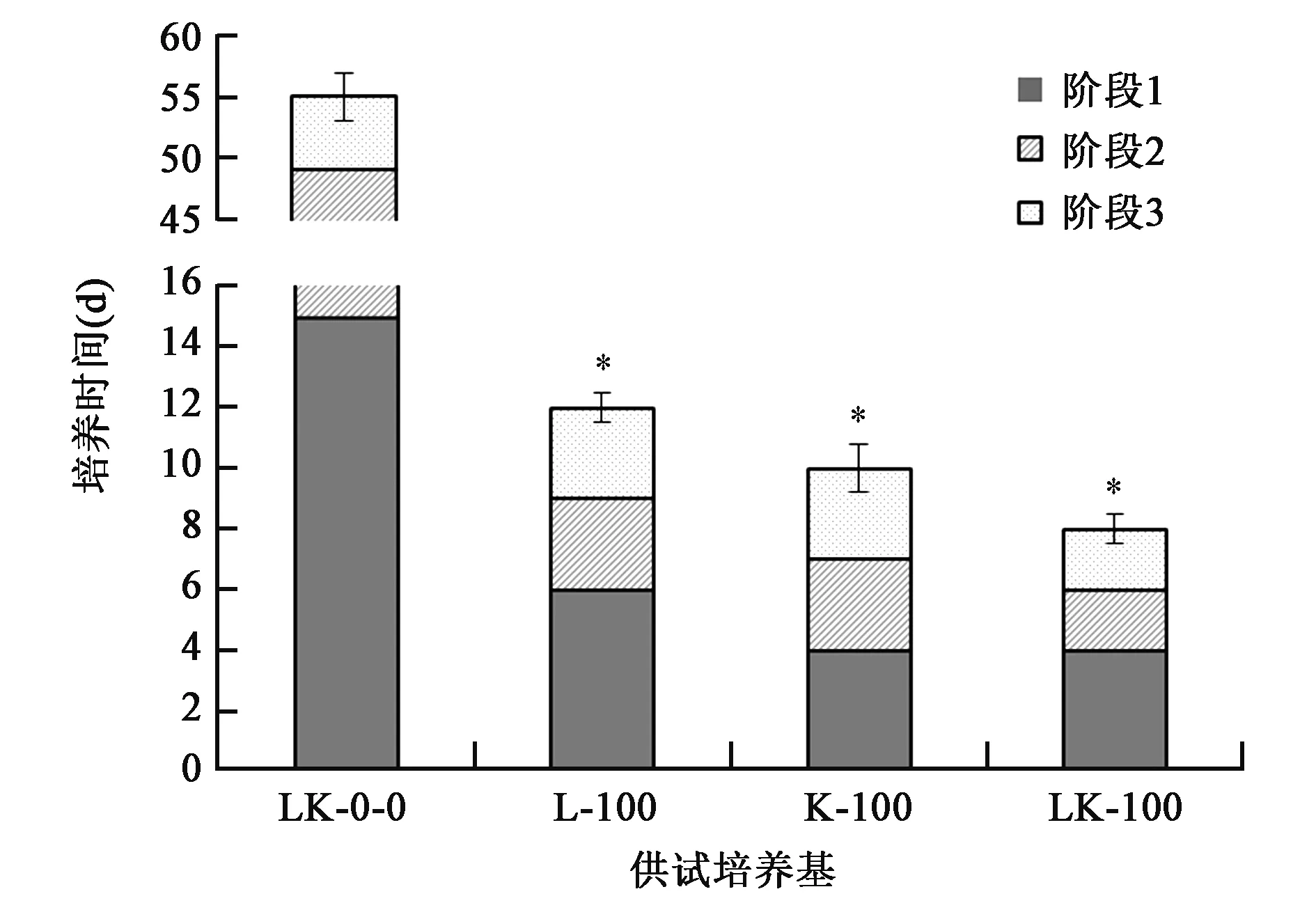
图2 D.coniospora在不同LK培养基中的生长周期Fig.2 Growth cycle of D.coniospora in different LK medium.
D.coniospora在L-100、K-100和LK-100培养基上的生长周期分别为12 d、10 d和8 d,表明肾脏组织对D.coniospora菌株生长的促进作用优于肝脏组织。进一步分析发现,D.coniospora在K-100和LK-100培养基中的阶段1所用培养时间(平均值)相同,说明培养基中肾脏组织或其某种成分能够促进D.coniospora菌丝的萌发。
试验发现,D.coniospora分生孢子在LK-0-0培养基(阴性对照培养基)中虽然能够萌发形成菌丝,但是生长周期长达55 d。其中,从接种D. coniospora孢子液到萌发形成菌丝(阶段1)需要15 d,而从菌丝进一步形成成熟的分生孢子(阶段2和阶段3)需要40 d。
综上,虽然LK-0-0培养基能使D.coniospora孢子萌发并产孢(初步推测D.coniospora能够分泌琼脂酶),但是琼脂作为LK-0-0培养基中的唯一碳源,并不能提供良好的营养条件。因此,LK-100培养基中的肝脏和肾脏组织对D.coniospora的生长和发育有显著的促进作用。
2.3 不同培养基中D.coniospora的生长周期
D.coniospora在常规真菌培养基(PDA、SDAY和CMA)及LK-100培养基中的生长周期显著不同,结果如图3所示。
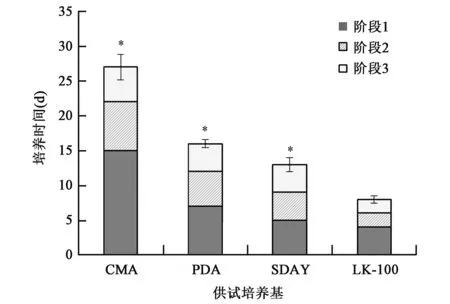
图3 D.coniospora在不同真菌培养基中的生长周期Fig.3 The growth cycle of D.coniospora in different fungimedium.
由图2可知,D.coniospora在CMA、PDA和SDAY等常规真菌培养基中的生长周期分别为27 d、16 d和13 d,而在LK-100培养基中的生长周期大大缩短,仅需8 d。另外,D.coniospora在LK-100培养基中的生长周期与侵染宿主 C. elegans的周期[11]相同,均为8 d。
2.4 不同培养基的D.coniospora分生孢子侵染线虫能力的研究
观察LK-100、PDA、SDAY和CMA等不同培养基获得的D.coniospora分生孢子在一定时间侵染的线虫数,绘制侵染效率曲线图(图4)。
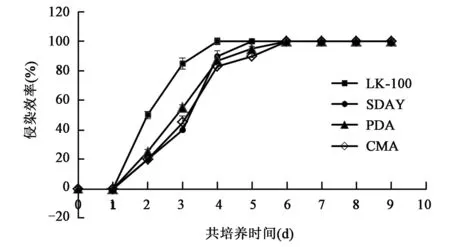
图4 不同培养基培养的D.coniospora侵染线虫效率曲线图Fig.4 Infection efficiency graph of D.coniospora in differentmedium
从LK-100培养基上收集的D.coniospora分生孢子在与线虫共培养4 d时,完成对所有线虫的侵染,即侵染率达到100%;从SDAY培养基收集的D.coniospora分生孢子完成对所有线虫的侵染约需要5 d;PDA和CMA培养基则需要6 d。以上侵染实验结果表明,LK-100培养基培养获得的D.coniospora分生孢子侵染线虫能力略高于其他培养基,这可能与LK培养基缩短了D.coniospora的生长周期有关,而D.coniospora在其他培养基上生长周期较长,一定程度上影响了其复苏过程及侵染活力。
3 讨论
本研究针对D.coniospora在常规真菌培养基上生长周期长,影响对D.coniospora进行相关深入研究这一难题,研究应用LK固体培养基高效培养D.coniospora。本研究也是首次成功将LK-100培养基应用于食线虫真菌乃至真菌的培养。实验表明,D.coniospora在LK-100培养基中生长周期仅为8 d,产孢期集中,培养获得的分生孢子侵染天然宿主C.elegans的能力较常规培养基获得的分生孢子有所增强。
LK-100固体培养基使D.coniospora生长周期缩短的原因可能是:D.coniospora为专性内寄生食线虫真菌,特异地侵染富含蛋白质和脂肪等营养物质的天然宿主线虫。因此,由富含蛋白质的肝脏和肾脏组织制成的LK-100培养基模拟了线虫的营养组成,使得D.coniospora的生长周期与侵染其天然宿主的周期相同,均为8 d。而常规真菌培养基成分则不能较好的满足D.coniospora的生长需要,培养周期长达13 d。而且,LK-100固体培养基培养获得的D.coniospora分生孢子的侵染能力较PDA、CMA和SDAY等常规培养基稍有增强,这一现象可能与LK培养基的营养组成与线虫类似有关。此外,据实验结果推测,肾脏在D.coniospora生长周期的菌丝体期发挥重要作用,但是,肝脏和肾脏对D.coniospora生长发育的具体促进因子及作用机制有待进一步研究。
LK-100培养基使 D.coniospora的培养周期缩短为8 d,解决了D.coniospora培养周期长这一技术难题,为进一步研究和阐明D.coniospora侵染C.elegans的机制,加快内寄生食线虫真菌在生物防治中的应用等提供理论和技术支撑。
[1] Abad P,Gouzy J,Aury JM,et al..Genome sequence of the metazoan plant-parasitic nematode Meloidogyne incognita[J]. Nat.Biotechnol.,2008,26(8):909-915.
[2] MoosaviM R,Zare R.Fungi as biologicalcontrol agents of plant-parasitic nematodes[J].Prog.Biol.Control,2012,12: 67-107.
[3] Dong L Q,Zhang K Q.Microbial control of plant-parasitic nematodes:a five-party interaction[J].Plant Soil,2006,288 (1-2):31-45.
[4] 张颖,李国红,张克勤.食线虫真菌资源研究概况[J].菌物学报,2011,30(6):836-845.
[5] Drechsler C.Some hyphomycetes parasitic on free-living terricolous nematodes[J].Phytopathology,1941,31:773-802.
[6] Jansson H B,Nordbring-Hertz B.The endoparasitic nematophagous fungus Meria coniospora infects nematodes specifically at the chemosensory organs[J].J.Gen.Microbiol.,1983,129 (4):1121-1126.
[7] McClure M A,Zuckerman B M.Localization of cuticular binding sites of Concanavalin A on Caenorhabditis elegans and Meloidogyne incognita[J].J.Nematol.,1982,14(1):39.
[8] Sun M H,Gao L,Shi Y X,et al..Fungiand actinomycetes associated with Meloidogyne spp.eggs and females in China and their biocontrol potential[J].J.Invertebr.Pathol.,2006,93 (1):22-28.
[9] Jansson H B.Adhesion of conidia of Drechmeria coniospora to Caenorhabditis elegans wild type and mutants[J].J.Nematol.,1994,26(4):430-435.
[10] Migliori M L, Simonetta S H, Romanowski A, et al.. Circadian rhythms in metabolic variables in Caenorhabditis elegans[J].Physiol.Behav.,2011,103:315-320.
[11] 郭倩楠,周正富,徐玉泉,等.圆锥掘氏梅里霉侵染秀丽隐杆线虫周期的扫描电镜观察[J].中国农业科技导报,2015,17(2):81-86.
[12] Pujol N,Cypowyj S,Ziegler K,et al..Distinct innate immune responses to infection and woundingin the C.elegans epidermis[J].Curr.Biol.,2008,18(7):481-489.
[13] Rouger V,Bordet G,Couillault C,et al..Independent synchronized control and visualization of interactionsbetween living cells and organisms[J].Biophys.J.,2014,106(10):2096 -2104.
[14] Lamitina T,Chevet E.A new role for a BiP/GRP78 protein in the control of antimicrobial peptide expression in C.elegans epidermis[J].Virulence,2012,3(3):238-240.
[15] Couillault C,Fourquet P,Pophillat M,et al..A UPR-independent infection-specific role for a BiP/GRP78 protein in the control of antimicrobial peptide expression in C.elegans epidermis[J].Virulence,2012,3(3):299-308.
[16] Sa L,Omi S,GutM,et al..The pseudokinase NIPI-4 is a novel regulator of antimicrobial peptide gene expression[J]. PLoSONE,2012,7(3):e33887.
[17] Engelmann I,Griffon A,Tichit L,et al..A comprehensive analysis of gene expression changes provoked by bacterial and fungal infection in C.elegans[J].PLoS ONE,2011,6 (5):e19055.
[18] Lee K Z,Kniazeva M,Han M,et al..The fatty acid synthase fasn-1 acts upstream of WNK and Ste20/GCK-VI kinases to modulate antimicrobial peptide expression in C.elegans epidermis[J].Virulence,2010,1(3):113-122.
[19] Zugasti O, Ewbank J J. Neuroimmune regulation of antimicrobial peptide expression by a noncanonical TGF-βsignaling pathway in Caenorhabditis elegans epidermis[J].Nat. Immunol.,2009,10(3):249-256.
[20] Glaser RW,McCoy E E,Girth H B.The biology and culture of Neoaplectana chresima,a new nematode parasitic in insects [J].J.Parasitol.,1942,28(2):123-126.
[21] Poinar G O,Thomas GM.Significance of Achromobacternematophilus Poinar and Thomas(Achromobacteraceae:Eubacteriales)in the development of the nematode,DD-136(Neoaplectana sp.Steinernematidae)[J].Parasitology,1966,56(02): 385-390.
[22] Sugar D R,Murfin K E,Chaston JM,et al..Phenoty pic variation and host interactions of Xenorhabdus bovienii SS-2004,the entomopathogenic symbiontof Steinernema jollieti nematodes [J].Environ.Microbiol.,2012,14(4):924-939.
[23] Sicard M,Le Brun N,Pages S,et al..Effect of native Xenorhabdus on the fitness of their Steinernema hosts:contrasting types of interaction[J].Parasitol.Res.,2003,91(6):520 -524.
[24] Martens E C,Goodrich-Blair H.The Steinernema carpocapsae intestinal vesicle contains a subcellular structurewith which Xenorhabdus nematophila associates during colonization initiation [J].Cell Microbiol.,2005,7(12):1723-1735.
[25] Jansson H B,Nordbring-Hertz B.Involvement of sialic acid in nematode chemotaxis and infection by an endoparasitic nematophagous fungus[J].Microbiology,1984,130(1):39-43.
Study on an Efficient Medium to Culture the Nematophagous Fungus Drechmeria coniospora
GUO Qian-nan,ZHOU Zheng-fu,XU Yu-quan,ZHANGWei∗
Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081,China
There is an obstacle to doing scientific research on nematophagous fungus Drechmeria coniospora,owing to the shortest growth cycle of the microbe in conventional medium(including PDA,SDAY and CMA)is 13 days at least.In this study,we utilized LK-100 medium to culture D.coniospora at room temperature,and observed its growth status under microscope.The results showed that growth cycle of D.coniospora on LK-100 medium was only 8 days.Furthermore,the infection efficiency of conidia,obtained from LK-100 medium,to natural host Caenorhabditis elegans was higher than that obtained from conventional fungimedia.LK-100 medium,a kind of effectivemedium,will contribute to the further study of D.coniospora.
Drechmeria coniospora;LK medium;growth cycle;infection ability
10.3969/j.issn.2095-2341.2015.05.10
2015-05-18;接受日期:2015-06-16
国家973计划项目(2015CB755703);国家转基因生物新品种培育重大专项(2014ZX0800301B)资助。
郭倩楠,硕士研究生,主要从事环境微生物基因工程研究。E-mail:guoqiannan0709@163.com。∗通信作者:张 维,研究员,主要从事环境微生物分子生物学研究。E-mail:zhangwei01@caas.cn

