微波诱变结合抗性突变筛选放线菌素D高产菌株
任林英, 张祝兰, 王徳森, 杨煌建, 唐文力, 孙 菲
福建省微生物研究所,福建省新药(微生物)筛选重点实验室,福州350007
微波诱变结合抗性突变筛选放线菌素D高产菌株
任林英, 张祝兰∗, 王徳森, 杨煌建, 唐文力, 孙 菲
福建省微生物研究所,福建省新药(微生物)筛选重点实验室,福州350007
采用微波结合链霉素抗性筛选法选育放线菌素 D的高产菌株。通过考察链霉素对 Streptomyces rubiginosohelvolus FIM-N31菌株孢子生长情况的影响确定链霉素致死浓度,出发菌株FIM-N31的孢子经微波辐照处理后,涂布在含链霉素致死浓度(50μg/mL)的培养基平板上培养,获得了大量的链霉素抗性基因突变株。摇瓶发酵筛选突变株,结果获得一株遗传性状稳定的放线菌素D高产菌Str186,其产放线菌素D的能力比出发菌株提高了8倍以上。
:链霉菌;放线菌素D;抗生素抗性筛选;复合诱变
放线菌素D是一种色素肽内酯抗生素,是经典的抗肿瘤药物之一[1~3],与其他抗肿瘤药物联合使用,并配合放射治疗能够取得良好的效果[4~6],其抗癌作用可能与其色基结构有较为密切的关系,而其环肽部分可能起到一种载体的作用[7]。其独特的环肽化学结构、抑制RNA合成的抗肿瘤机理,以及不易与其他化疗药物产生交叉耐药性的特点是化疗药物难得的优点,因此,近年来对其研究一直非常活跃,不断发现新的靶点和抗肿瘤作用的新机制。但天然放线菌素D有较大的毒性,限制了其在临床上的应用范围,因此对放线菌素D进行结构改造以降低其毒性作用、对不同来源的产生菌进行研究以获得高效生产菌种及筛选低毒高效抗肿瘤活性的类似物等成为药物开发者的新关注点。前期在定向筛选抗肿瘤活性先导物的过程中,分离获得产放线菌素D的菌株FIM-N31,鉴定其为锈赤蜡黄链霉菌(Streptomyces rubiginosohelvolus)。本研究在初步探索菌株FIMN31生物合成放线菌素D培养条件的基础上,运用微波诱变与抗药性基因突变组合技术对该野生菌株FIM-N31进行理性筛选,旨在获得放线菌素D高产菌株,为其工业化生产提供优良菌种。
1 材料与方法
1.1 菌种
链霉菌 Streptomyces rubiginosohelvolus FIMN31由福建省微生物研究所提供。
1.2 培养基配方
斜面培养基(%,w/V):可溶性淀粉1.0,葡萄糖1.0,硫酸镁0.05,硝酸钾0.1,磷酸氢二钾0.05,琼脂2.0,pH 7.0~7.2;种子培养基(%,w/V):可溶性淀粉2.5,葡萄糖0.5,黄豆粉1.0,蛋白胨0.5,酵母膏0.3,pH 7.0~7.2;发酵培养基(%,w/V):可溶性淀粉2.5,黄豆粉3.5,蛋白胨0.5,玉米粉1.0,磷酸氢二钾0.05,pH 7.0~7.2。
1.3 方法
1.3.1 原始菌悬液的制备 取4℃保存的原始菌FIM-N31试管斜面生长物适量,划线接种在斜面培养基上30℃培养8 d后,刮取生长良好的菌苔,置于装有适量无菌生理盐水和玻璃珠的三角瓶中振荡,制备均匀的菌悬液。
1.3.2 链霉素最低抑菌浓度的测定 分别取上述菌悬液100μL均匀涂布在不同浓度(5μg/mL、10μg/mL、25μg/mL、50μg/mL、100μg/mL和200μg/mL)链霉素的分离平板培养基上,30℃培养并观察菌落的生长情况。将没有菌落形成的链霉素最低浓度即抗生素对出发菌株的孢子致死浓度确定为链霉素的最低抑菌浓度(MIC)。
1.3.3 原始菌悬液的微波诱变 在无菌条件下,取原始菌悬液6 mL装入预先灭菌的15 mL试管中并加防菌硅胶透气塞,以冰浴法消除微波的热效应,将试管插入盛有适量冰水(作为冷却剂)的三角瓶里,使菌悬液的上液面没入冰水中,将三角瓶移置微波炉中,对菌悬液进行不同时间(15 s、30 s、45 s、60 s、90 s和120 s)的微波辐照处理。
1.3.4 链霉素抗性筛选 取经微波诱变处理后的菌悬液适当稀释后各100μL,分别均匀涂布在含有MIC浓度链霉素的分离培养基平板上,于30℃培养8 d,在平板上生长出的菌落均为链霉素抗性基因(sir)突变株。挑取单菌落划线接种于平板斜面培养基上培养,并保存于4℃冰箱中。
1.3.5 发酵培养与样品处理 将突变株分别接种于装有50mL液体培养基的250mL三角瓶中,30℃、250 r/min摇床发酵5 d,取发酵液适量,加入2倍于发酵液体积的无水乙醇,充分振荡、静置、离心,取上清液过滤后进行HPLC检测。
1.3.6 含量(效价)测定 采用HPLC法,分离条件:Gemini C18(4.6 mm×250 mm,5μm)色谱柱,波长254 nm,以甲醇∶水=78∶22(V/V)为流动相,流速 1.0 mL/min,柱温:35℃。以放线菌素 D (Sigma公司)为对照品,根据公式(1)计算效价,发酵效价为3次平均值,以相对值标示。

1.4 主要设备
WD800型微波炉(Galanz公司);1360B型超净工作台(北京亚泰科隆公司);MIR-253型微生物培养箱(日本三洋公司);ZHWY-2102大型恒温摇床(上海智城分析仪器制造有限公司);Allegra X-15R型离心机(德国BECKMAN公司);LC-20A型高效液相色谱仪(日本岛津公司)。
2 结果与分析
2.1 M IC值测定
经多次平行实验,链霉素对链霉菌FIM-N31菌株孢子的致死浓度测定结果见表1,表明链霉素对链霉菌 FIM-N31菌株孢子的 MIC值为50μg/mL,以此为致死抗药性突变标志。
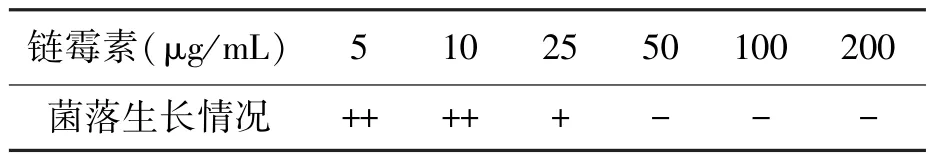
表1 链霉素对FIM-N31菌株孢子致死浓度测定Table 1 Lethal concentration determination of streptomycin on FIM-N31 spore.
2.2 微波诱变效应
取微波辐照前后FIM-N31的菌悬液适当稀释后各100μL,分别均匀涂布在平板培养基上,30℃培养8 d,结果发现,FIM-N31在处理前生长良好,菌落生长数量随着微波辐照时间的增长呈减少趋势,经微波辐照90 s以上生长受到明显抑制,平板上只有少数的菌落生长,易于单菌落挑选,如图1(彩图见图版二)所示。
2.3 链霉素抗性基因突变株筛选
在15~120 s范围内的不同时间微波辐照后进行链霉素抗性基因突变株的筛选试验,其微波辐照时间与筛选获取抗性突变株数目之间的关系曲线如图2所示,结果表明获取的抗性突变株数目随微波辐照时间的增多而呈现先增后减的分布趋势,诱变效应存在一个最佳区域,微波辐照时间为60 s时诱变效果最佳,获得突变株数达高峰,因此初步认为筛选获得FIM-N31链霉素抗性基因突变株的最佳微波辐照诱变时间应为60 s。
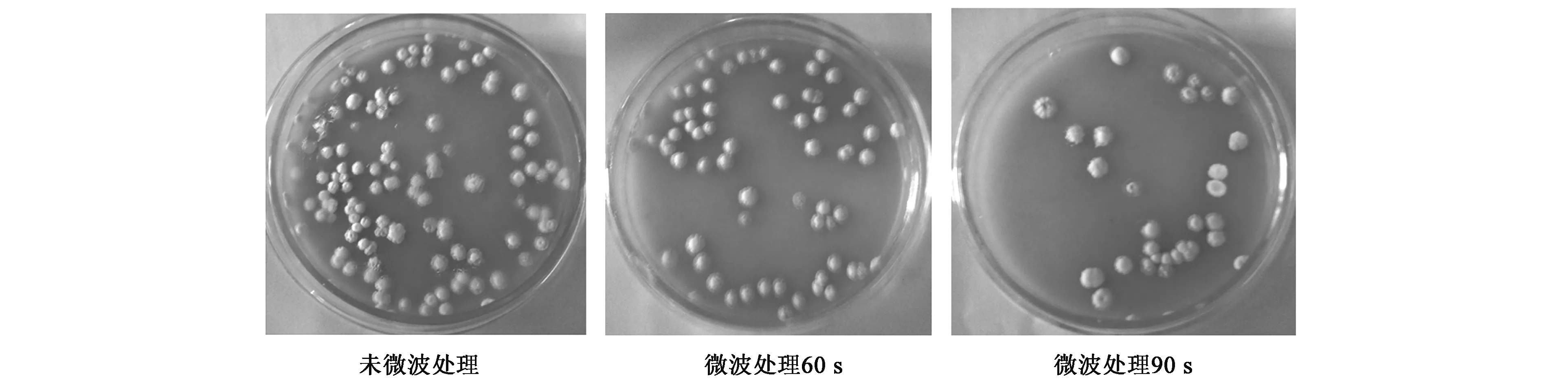
图1 FIM-N31菌株微波处理前后生长菌落比较Fig.1 Growth comparison of FIM-N31 strain before and aftermicrowave treatment.
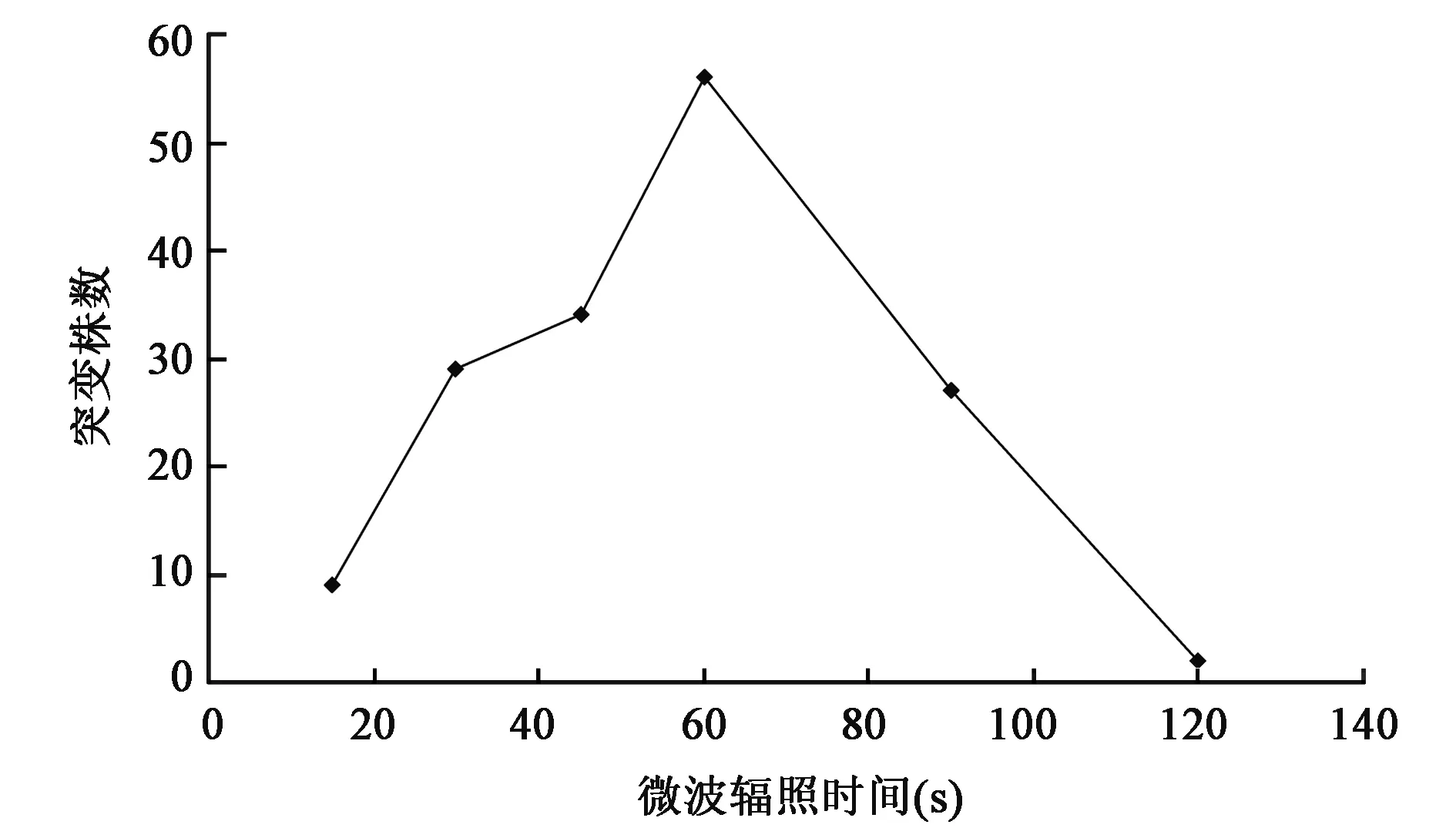
图2 微波辐照时间与筛选获得突变株之间的关系曲线Fig.2 Relation curve between microwave irradiation and mutants obtained.
经微波诱变结合链霉素抗性筛选,获得链霉素抗性基因突变株共计213株。对所得菌株进行摇瓶发酵初筛,通过摇瓶发酵培养及发酵样品的处理,采用HPLC检测其放线菌素D含量。以诱变出发菌株的发酵效价为100,计算突变株的发酵相对效价,初筛结果71株为正突变菌株(相对效价在110以上),50株为未突变菌株(相对效价在90~110),92株为负突变菌株(相对效价在90以下),如表2所示。
取初筛入选菌株进行二级摇瓶发酵复筛,在反复的筛选中,5株微波诱变突变株发酵水平较出发株FIM-N31提高50%以上,显示出较好的产放线菌素D能力,分别为Str059、Str152、Str178、 Str186和Str195,其中突变株Str186产放线菌素D较出发株FIM-N31提高8倍(表3)。图3为突变株Str186发酵液与FIM-N31发酵液的HPLC图谱,表明突变株Str186发酵液的目标产物放线菌素D含量大幅度提高,而小组分放线菌素S含量仅为出发菌株的2倍多,初步提示所获得的突变株Str186更利于制备高纯度放线菌素D,即更利于放线菌素D分离纯化的开展。
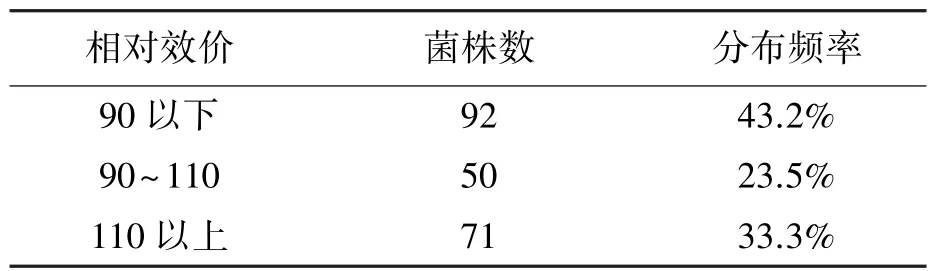
表2 抗链霉素突变株初筛结果Table 2 The preliminary results of streptomycin-resistant mutants.
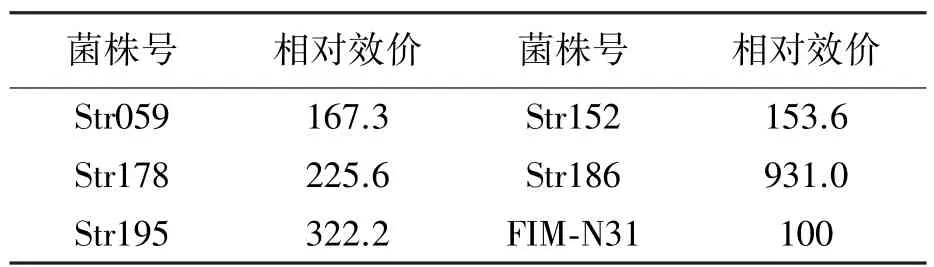
表3 抗性突变高产菌株的摇瓶发酵情况Table 3 Fermentation of the high-producing streptomycin-resistant mutants.
2.4 Str 186菌株稳定性考察
将菌株Str186接种于斜面培养基上,待生长好后置于4℃保藏,考察保藏不同时间的菌株Str186发酵水平,结果(表4)表明菌种斜面在4℃保藏3个月效价稳定;同时对菌株Str186连续传代培养考察菌种的传代稳定性,检测其生物合成能力,以4℃保存7 d生长良好的第一代菌株为对照,结果见表5,表明菌株Str186传5代对发酵水平无明显影响,提示菌株Str 186遗传稳定性较好。
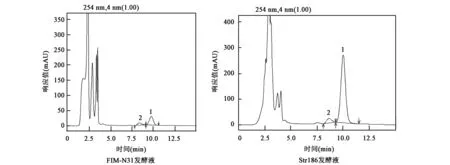
图3 HPLC图谱比较Fig.3 Comparison of HPLC spectra.

表4 Str186菌株保藏时间稳定性试验Table 4 The stability test of preservation times for Str186.
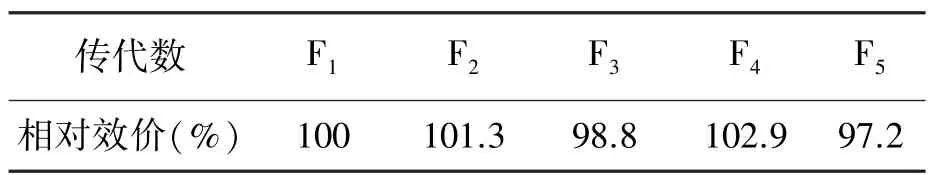
表5 Str186菌株传代稳定性试验Table 5 The test of passage stability for Str186.
3 讨论
放线菌素D的研究目前主要集中于放线菌素D的生物学功能和临床药理学,并己广泛用于恶性肿瘤的临床治疗,但对微生物发酵和分离纯化方面的研究报道较少,目前国内放线菌素D生产中存在菌种发酵水平低、产率低、单耗高的缺陷,菌种选育已成为提高放线菌素D产量和质量的重要课题。廖爱芳等[8]采用紫外线诱变结合缬氨酸耐性变种的筛选,得到产量提高2倍的放线菌素D突变株,本研究应用分子育种中关于抗生素产生菌抗性基因与抗生素合成的结构基因和调控基因连锁而易发生共突变理论,首次将微波诱变结合抗生素抗性筛选方法应用于放线菌素D的选育,获得良好的效果。在微波诱变试验中采用低温热分散法消除微波的热效应,经试验发现,微波辐照45 s后作为冷却剂的冰水仍有部分冰未完全融解,受试菌悬液的温度也并未升高。因此,在微波辐照实际操作中,每辐照45 s即更换冰水,尽可能消除微波热效应对受试菌的影响,同时凸显出非热效应对受试菌的诱变作用。链霉素抗性筛选具有广谱性、正突变率和增产百分率高等特点,以链霉素抗性作为选择压力,对许多抗生素产生菌进行推理选育所得到的突变株中都能获得较高频率的高效价突变株[9~13]。
本试验中通过组合运用微波诱变与链霉素抗性突变筛选技术,改造了Streptomyces rubiginosohelvolus FIM-N31菌株的代谢功能,筛选所获取的抗性突变株数目较多,随之筛选较好的活性突变株的几率亦提高,有利于高效获得遗传稳定的优良高活性突变株,其中突变菌株Str186遗传性状稳定,产放线菌素D能力强,为其工业化生产奠定了基础。
影响菌种的菌体生长和产素能力的因素很多,如发酵培养基成分与初始pH、生长因子与前体物、溶氧、发酵温度和发酵时间等影响因子,某种代谢产物的诱导或抑制、菌体生长形态与目标产物合成之间的关系,优良菌种在最适宜发酵条件下才能充分发挥菌株的遗传潜力,因此突变菌株Str186生物合成放线菌素D的调控过程的优化也有待深入探究。
[1] 李长春,潘毅生,黄培根,等.放线菌素23-21的抗癌药理研究[J].福建医学院学报,1992,26(1):9.
[2] 林菁,李常春,黄自强.放线菌素23-21对敏感肿瘤细胞生物大分子的影响[J].福建医科大学学报,1997,31(3): 247-251.
[3] 孙肇暘,杨秀萍.放线菌素研究进展[J].首都师范大学学报:自然科学版,2011,32(1):54-58.
[4] 洪静娟.5-氟尿嘧啶联合更生霉素治疗恶性滋养细胞肿瘤疗效评价[J].海南医学,2004,15(1):99-100.
[5] 梁平,李济培,王洪乾.新福菌素配合放射治疗鼻咽癌近期疗效观察[J].右江医学,2005,33(5):476-477.
[6] 侯森,侯君,朱志真,等.新福菌素注射液治疗恶性胸腔积液临床观察[J].四川肿瘤防治,2006,19(3):203-204.
[7] 李述文,郑亚平,高怡生.放线菌素类似物的合成Ⅳ—2-氨基-4,6-二甲基吩嗯嗪酮-(3)-1,9-双多肽的合成[J].药学学报,1982(5):20-25.
[8] 廖爱芳,刘勇,王建民,等.放线菌素D产生菌浅藤黄链霉菌N45诱变育种研究[J].药物生物技术,2002,9(2):88 -90.
[9] 涂国全,钟承赞,黄 林,等.通过获得链霉素抗性基因突变株筛选小诺霉素高产菌株[J].微生物学通报,2004,31 (4):19-22.
[10] 陶纯长,谌颉,郭美锦,等.链霉素抗性突变理性筛选avermectin高产菌株[J].中国抗生素杂志,2002,27(9):521-523,528.
[11] 孙玉雯,崔承彬.抗生素抗性筛选在微生物菌株选育中的作用[J].国际药学研究杂志,2008,35(3):213-217.
[12] Hosoya Y,Okamoto S,Muramatau H,et al..Acquisition of certain streptomycin-resistant(str)mutations enhances antibiotic production in bacteria[J].Antimicrob.Agents.Chemother,1998,42(8):2041-2047.
[13] 刘体颜,邢玉华,戴素琴,等.达托霉素生产菌(ATCC31568)的紫外诱变和抗生素抗性筛选[J].中国抗生素杂志,2013,38(9):664-669.
Screening of Actinomycin D High-producing Strain by Streptomycin Resistant Mutant Selection Coupled with Microwave Mutagenesis
REN Lin-ying,ZHANG Zhu-lan∗,WANG De-sen,YANG Huang-jian,TANGWen-li,SUN Fei
Fujian Provincial Key Laboratory of Screening for Novel Microbial Products,Fujian Institute of Microbiology,Fuzhou 350007,China
Microwave mutagenesis and streptomycin resistance screening was applied to screen actinomycin D high-producting strain.After testing the resistance of Streptomyce rubiginosohelvolus FIM-N31 to streptomycin,the lethal concentration of streptomycin was determined.A lot of streptomycin-resistant mutants were screened after the spores regenerated on the lethal streptomycin concentration(50μg/mL)media when they were treated with microwave irradiation.Itwas eventually found that the high-yield strain Str186 from these mutants which was stably inheritable,and the productivity was beyond eight times higher than the original strains in the rotation-flask experiments.
Streptomyces;actinomycin D;antibiotics resistance gene screening;compound mutation
10.3969/j.issn.2095-2341.2015.05.09
2015-05-08;接受日期:2015-06-15
福建省科技项目(2014R1009-10)资助。
任林英,高级工程师,研究方向为微生物药物。E-mail:rlymary@aliyun.com。∗通信作者:张祝兰,研究员,研究方向为微生物药物。E-mail:jessylan9963@sina.com

