玉米bHLH类转录因子ABP7的启动子克隆及其活性分析
王银晓, 赵 军
中国农业科学院生物技术研究所,作物基因组与遗传改良研究室玉米功能基因组创新团队;农作物基因资源与基因改良国家重大科学工程,北京100081
玉米bHLH类转录因子ABP7的启动子克隆及其活性分析
王银晓, 赵 军∗
中国农业科学院生物技术研究所,作物基因组与遗传改良研究室玉米功能基因组创新团队;农作物基因资源与基因改良国家重大科学工程,北京100081
bHLH类转录因子广泛存在于植物中,在花的形态建成、光和激素信号转导等方面发挥着重要作用,但其表达调控机理尚待深入研究。从玉米中克隆了bHLH类转录因子ABP7,初步研究结果显示它可能参与了籽粒形成、激素应答等多个信号转导途径的调控。为进一步阐明ABP7基因上游调控途径,克隆了ABP7的5′侧翼序列,利用原生质体瞬时转化体系验证了其启动子活性,并对其顺式作用元件进行了分析。结果显示,位于ABP7基因起始密码子上游长为2 266 bp的DNA序列具有启动子活性,能够启动报告基因的表达,并且存在许多潜在的与GA、IAA和ABA激素信号转导和逆境胁迫响应相关的元件,为进一步鉴定ABP7基因发挥作用的信号途径、上游调控因子和分子机理以及ABP7基因在玉米生长发育和逆境应答中的功能奠定了基础。
bHLH;启动子;瞬时表达
bHLH类转录因子广泛存在于真核生物中,是一个巨大的转录因子家族[1],其参与调控了大量的生物学过程。目前在植物中已经克隆到500多条bHLH类转录因子基因序列[2]。对这些基因的研究表明,在植物中bHLH类转录因子主要与生长发育、胁迫应答和次生代谢等生物学过程相关。如HECATE(HEC)基因涉及雌性生殖组织的发育调节,在HEC1、HEC2和HEC3 3种同源基因突变体的不同组合中,植物表现出了不同程度的不育[3]。位于拟南芥第 5号染色体上的GLABRA3(GL3)也是一个编码bHLH蛋白的基因,其突变后会使表皮毛数量减少,反之,较高的表达则造成表皮毛数量的增加[4]。同样,来自拟南芥的ICE1也是一种bHLH类转录因子,它能够特异性地结合位于CBFs基因启动子上的E-BOX (CANNTG)序列,调控CBFs基因的表达,从而参与对逆境胁迫的应答[5,6]。总的来说,尽管bHLH类转录因子在植物生长发育的各个阶段都发挥着重要的作用,但与动物中的bHLH类蛋白相比,在植物中的研究起步较晚,对其表达调控的信号途径和分子机制的研究还有待深入研究。
本课题组在前期研究中从授粉后17 d的玉米幼胚的cDNA文库中克隆了bHLH类转录因子ABP7(未发表数据)。在转基因拟南芥中的初步研究结果显示,ABP7可能参与了逆境和激素应答、籽粒发育等多个生物学过程的调控[7],但其发挥作用的信号途径和上游调控因子还不清楚。因此,本文克隆了ABP7的5′侧翼序列,分析了其序列特征并在瞬时表达体系中证明了其具有启动子活性,为进一步阐明ABP7上游调控网络和ABP7在玉米中的生物学功能奠定了基础。
1 材料与方法
1.1 实验材料
实验所用的玉米齐319自交系和构建瞬时表达载体的载体骨架均由本实验室保存;原生质体转化所用的纤维素酶R10(cellulase R10)和离析酶R10(macerozyme R10)由日本Yakult公司生产;GUS酶促反应底物4-甲基伞型酮-B-D-葡糖苷酸(4-MUG)和产物4-甲基伞形酮(4-MU)、2-(N-吗啡啉)乙磺酸(MES)、甘露醇(mannitol)、聚乙二醇4000(PEG4000)和氯化钾等无机盐购自Sigma公司;启动子克隆所用的Trans Start Fastpfu DNA聚合酶及pEasy-blunt原核表达载体购自北京全式金生物技术有限公司;用于酶切和PCR等DNA片段纯化回收的试剂盒购自北京康为世纪生物科技有限公司;Luciferase酶活测定试剂盒(Luciferase Assay System with Reporter Lysis Buffer)购自Promega公司。
1.2 试验方法
1.2.1 启动子克隆 取玉米齐319大喇叭口期长约5 cm、宽1 cm的叶片,用CTAB法[8]提取玉米叶片基因组DNA,于-20℃保存。根据已知的玉米B73自交系基因组序列设计引物,正向引物位于B73基因组ABP7基因起始密码子上游2 274 bp,反向引物位于ABP7编码区第一个外显子中,距离起始密码子300 bp。引物序列Foward:5′-TTCGCTTTCATGTAATCGTTGTGC-3′,Reverse:5′-CTGAAGAATCCAGTCTGCGC-3′。以提取的齐319自交系基因组DNA为模板进行PCR扩增和克隆。PCR反应体系(50μL)如下:1×pfu Buffer,0.3 mmol/L dNTPs,0.4 pmol/L正、反向引物,50 ng基因组模板,20 units Fastpfu DNA聚合酶。PCR扩增程序为:94℃预变性2 min;94℃变性20 s,56℃退火20 s,72℃延伸70 s,33个循环;72℃延伸5 min。回收PCR产物,同pEasy-blunt原核表达载体连接,构建的pEasy-blunt-Pabp7载体转化至大肠杆菌后,筛选得到阳性克隆。
1.2.2 Pabp7:GUS瞬时表达载体的构建 根据实验室保存的p IG46(含mini35S:GUS)瞬时表达载体的序列图谱设计方案。用 PCR方法将Pabp7序列两端加上ClaⅠ和PstⅠ限制性内切酶酶切位点,其中正向引物位于-2 266 bp,反向引物位于-1 bp,引物序列 Foward:5′-ATCGATTTCGCTTTCATGTAATCGTTGTGC-3′,Reverse:5′-CTGCAGGCTGTCCGTTGAAAGAGAG-3′,以pEasyblunt-Pabp7质粒为模板,PCR体系如下:1×pfu Buffer,0.3 mmol/L dNTPs,0.4 pmol/L正、反向引物,50 ng基因组模板,20 U Fastpfu DNA聚合酶。PCR反应条件为:94℃预变性2 min;94℃变性20 s,54℃退火20 s,72℃延伸70 s,33个循环;72℃延伸5 min。ClaⅠ和PstⅠ限制性内切酶双酶切所得PCR产物和p IG46载体,回收Pabp7目的片段及pIG46载体片段。连接转化,筛选得到阳性克隆即为Pabp7:GUS瞬时表达载体。
1.2.3 Pabp7:GFP瞬时表达载体的构建 同Pabp7:GUS瞬时表达载体的构建相似,所用骨架为pIG46-Pabp7:GUS瞬时表达载体。用PCR方法将GFP-Tnos序列两端加上PstⅠ和Eco RⅠ限制性内切酶酶切位点,引物序列Forward:5′-CTGCAGATGAGTAAAGGAGAAGAA-3′,Reverse:5′-GAATTCCCGATCTAGTAACATAGATG-3′,以实验室保存的pRTL(含35S:GFP)质粒为模板扩增目的片段,PCR体系和反应条件同Pabp7:GUS瞬时表达载体的构建过程。PstⅠ和Eco RⅠ限制性内切酶双酶切所得PCR产物和p IG46-Pabp7:GUS载体,回收得到 GFP-Tnos目的片段及 p IG46-Pabp7:GUS载体片段。连接转化,筛选得到阳性克隆即为Pabp7:GFP瞬时表达载体。
1.2.4 玉米原生质体分离及转化 采用CsCl密度梯度离心法纯化5~8 mg的质粒DNA[9],选取黑暗条件下生长的齐319二叶一心的玉米幼苗,取其第一片真叶中部5~6 cm,将其切成宽为1 mm左右的细丝置于10mL酶解液(1.5%纤维素酶 R10,0.4%离析酶 R10,0.02 mol/L KCl,0.02 mol/L MES,0.4 mol/L甘露醇,0.01 mol/L GaCl2,0.1%BSA)中,避光酶解5 h,酶解过程始终保持40 r/min持续震荡。此过程细胞壁不断酶解,使玉米叶肉原生质体从组织中分离出来。
参考Yoo等[10]和谢礼[9,11]的PEG诱导叶肉细胞原生质体瞬时转化法,对实验细节略加改动。主要改动包括:①在洗去酶解液后,用W5溶液(0.154 mol/L NaCl,5 mmol/L KCl,2 mmol/L MES,0.125 mol/L GaCl2)轻柔重悬收集到的原生质体,冰上放置40min,以达到彻底沉降原生质体的目的;②完成原生质体沉降后,50 g离心1 min,以避免过高的离心力导致细胞间压力过大,减小对原生质体的伤害;③加入220μL 30%的PEGGa2+溶液(30%PEG,0.1 mol/L GaCl2,0.2 mol/L甘露醇)后,室温诱导10 min,这样既可以保证有较高的诱导效率,又可以减少PEG对原生质体造成的伤害。
1.2.5 GUS酶活测定 收集过夜培养的原生质体,100 g离心2 min,弃上清,向沉淀中加入Reporter Lysis Buffer裂解原生质体,此时的溶液即为含有GUS蛋白和荧光素酶蛋白的粗提液。参照Loffler等[12]的GUS酶活测定方法,以4-MUG为底物,通过测定反应生成的4-MU的量来检测GUS的酶量。LUC酶活的测定按Luciferase Assay System with Reporter Lysis Buffer试剂盒使用说明所述方法进行。以组成型表达的LUC酶活值作为内参,计算p IG46和Pabp7:GUS质粒转染原生质体时GUS的相对表达量。
1.2.6 绿色荧光光蛋白(GFP)自发荧光观察 将构建的Pabp7:GFP载体转染原生质体,在LSM 700激光共聚焦显微镜下观察并照相。
2 结果与分析
2.1 ABP7启动子的克隆和序列分析
为了研究ABP7上游调控网络,需要克隆和分析ABP7启动子序列。由于ABP7基因最初是从玉米自交系齐319中克隆的,为保持研究的一致性,仍从该自交系中克隆ABP7启动子序列。为此,参照B73基因组序列中ABP7基因的高度同源序列,分别在其起始 ATG的+303 bp和-2 274 bp位点设计引物,以齐319基因组DNA为模板,进行了PCR扩增,并比较了所得序列在齐319和B73两个自交系中的差异。
如图1所示,从玉米齐319基因组中克隆了长为2 569 bp的DNA片段。经测序和序列比对,其中2 266 bp位于ABP7基因起始密码子ATG上游,303 bp位于ABP7基因编码区内。
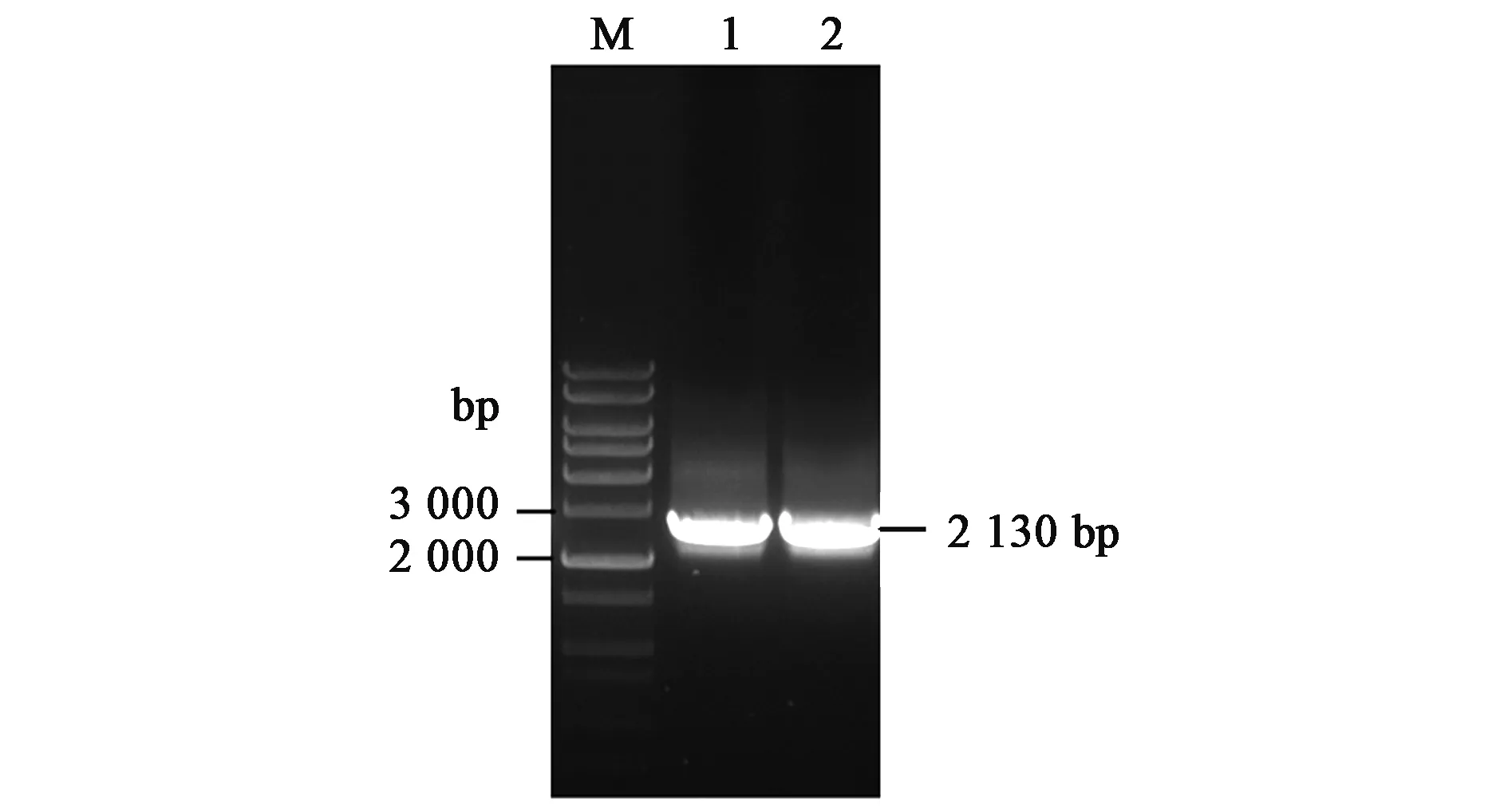
图1 ABP7基因5′侧翼区的克隆
序列比较(图2)发现,克隆的ABP7的5′侧翼序列在齐319和B73自交系基因组间相似度高达99%;差异在于:有1个位点发生多碱基插入,2个位点存在核苷酸的转换。具体来说,在-2 130 bp位点,较之B73,齐319中的ABP7的启动子序列多出一段TATATATA序列;在-1 142 bp位点,齐319中为腺嘌呤脱氧核糖核苷酸(A),而B73中为鸟嘌呤脱氧核糖核苷酸(G);在-438 bp位点,在齐319中为胸腺嘧啶脱氧核糖核苷酸(T),取代了 B73中的胞嘧啶脱氧核糖核苷酸(C)。
2.2 启动子活性检测
为验证克隆得到的ABP7的5′侧翼序列是否具有启动子活性,用Pabp7分别驱动GUS和GFP报告基因表达的两种瞬时表达载体,转染玉米叶肉原生质体,进行了GUS酶活测定和GFP荧光观察。
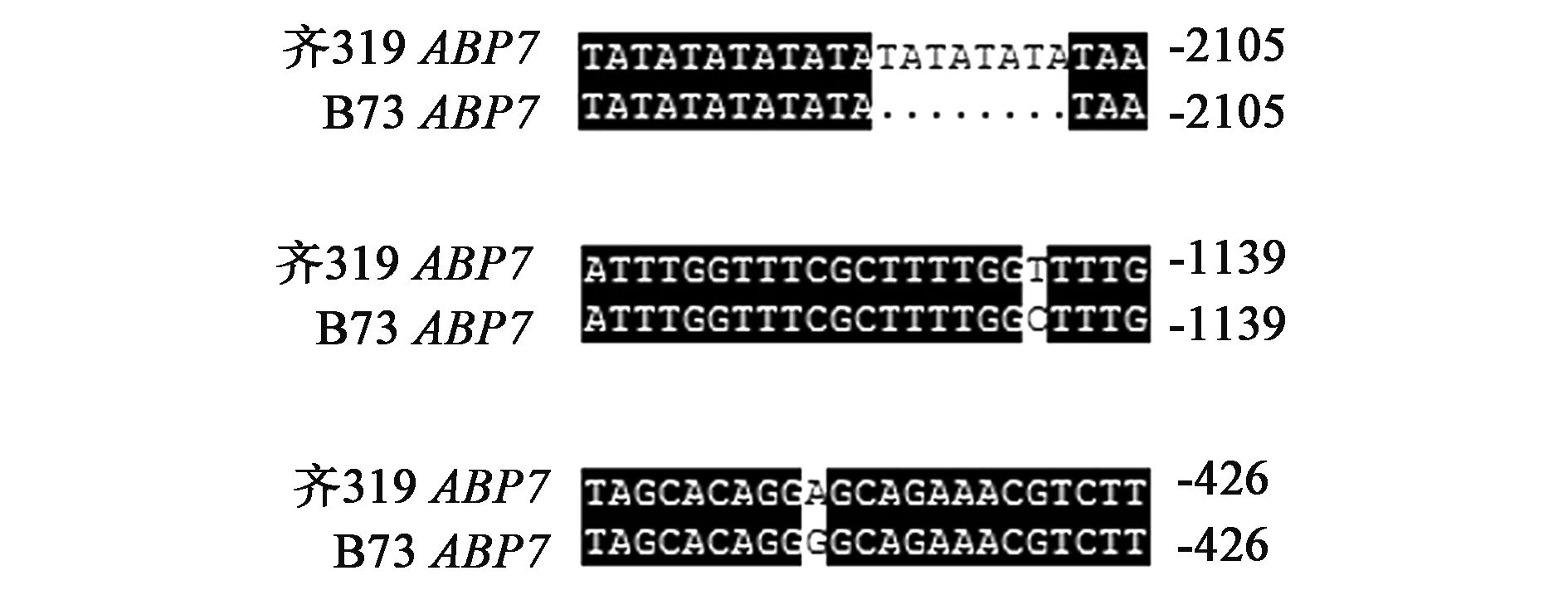
图2 ABP7基因在两个自交系中的序列差异分析Fig.2 Alignmen results in B73 and Qi319 of ABP7 gene.
GUS酶活测定结果显示,转染Pabp7:GUS质粒的原生质体中GUS的相对酶活显著高于转染mini35S:GUS的原生质体中的相对酶活(图3A,彩图见图版一)。通过观察GFP的发光情况可知,转染Pabp7:GFP质粒的原生质体中可见GFP的自发荧光(图3B)。这表明克隆到的长为2 266 bp的DNA片段具有启动子活性,能够启动报告基因的表达。
2.3 启动子结构的分析
为获得控制ABP7表达的上游调控因子的线索,本文利用PLACE[13]在线网站分析了ABP7启动子的序列结构(表1)。由分析结果可知,在克隆到的长为2 266 bp的ABP7启动子中主要包含了核心启动子序列和其上游的调控元件。核心启动子序列包括:精确启动必须的TATA区和控制转录频率的CAAT区。上游调控元件主要分为3大类:①与基因表达组织特异性相关的元件,这类元件主要包括了CACTFTPPCA1、DOFCOREZM、DPBFCOREDCDC3、ACIPVPAL2和NTBBF 1ARROLB;②与激素信号转导相关的元件,主要包括DPBFCOREDCDC3、NTBBF1ARROLB、CATATGGMSAUR、GARE2OSREP1、GCCCORE、SBOXATRBCS、SURECOREATSULTR11、ASF1MOTIFCAMV、TATCCAOSAMY和WRKY71OS;③与植物逆境胁迫响应相关的元件,主要包括 ACGTATERD1、CBFHV、MYBCORE、P1BS、WRKY71OS和ABRELATERD1。
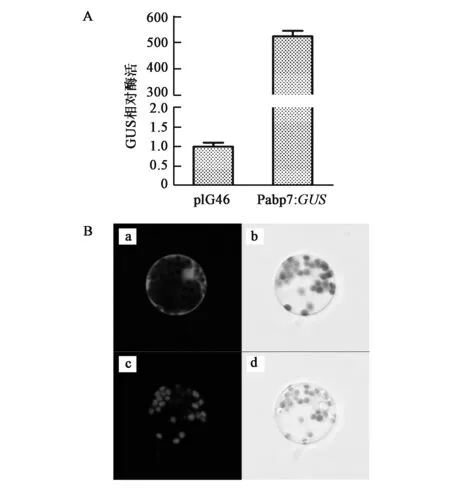
图3 ABP7基因5′侧翼区的启动子活性检测结果Fig.3 Promoter activity assays of the 5′flanking sequence of ABP7 in transformed protoplasts.
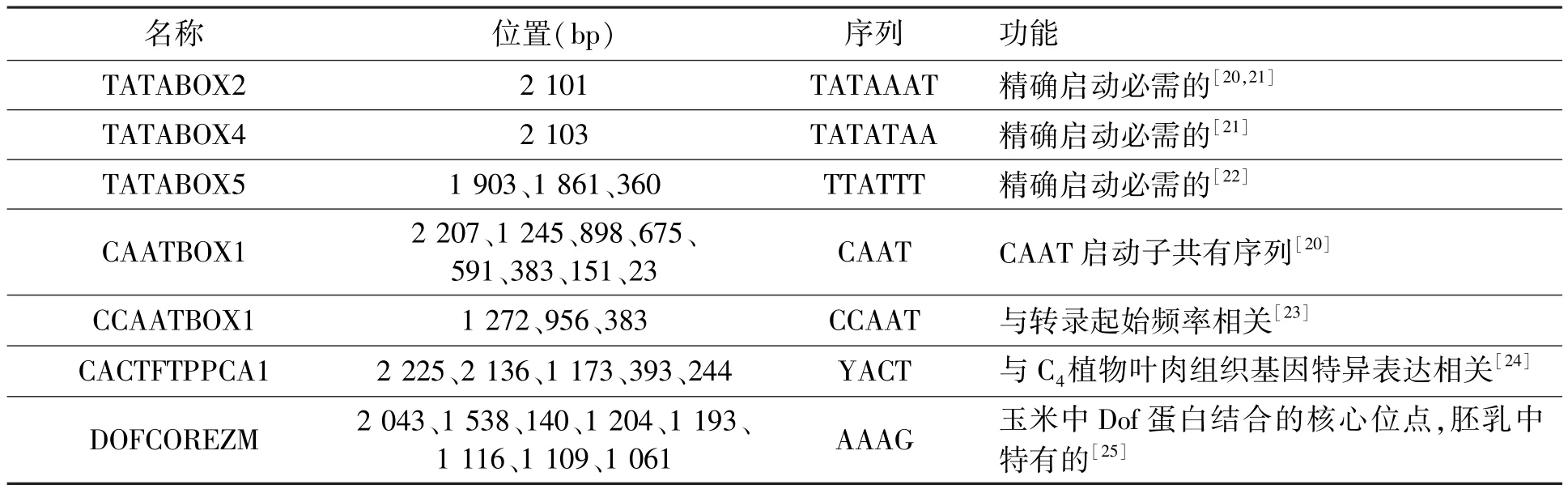
表1 ABP7启动子中顺式元件预测Table 1 Potential cis-acting elements in ABP7 promoter.
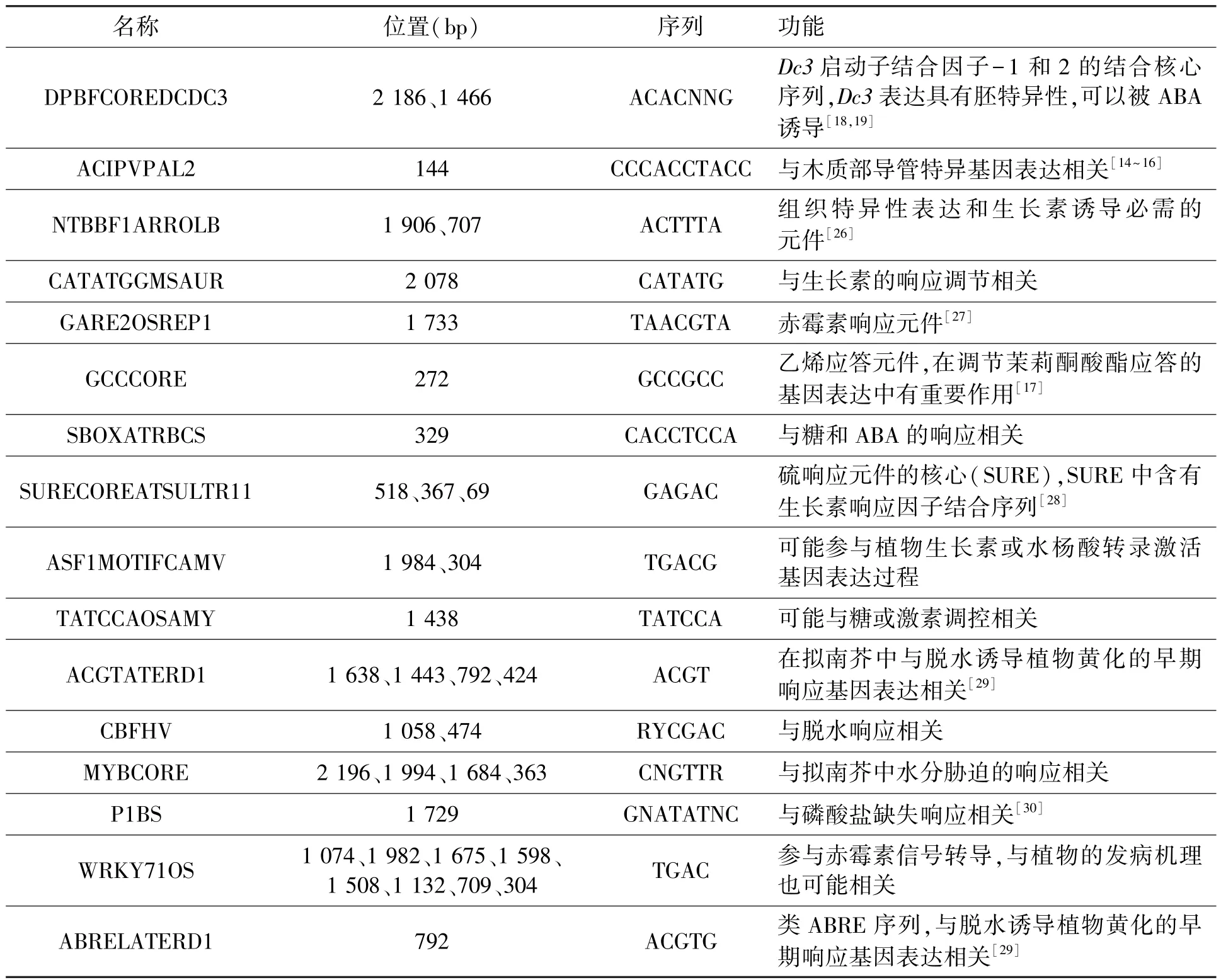
续表
2.4 ABP7启动子的聚类分析
为了进一步分析ABP7可能参与的信号转导途径及其具体作用,本实验利用MEGA软件Blast出同ABP7启动子相似性较高的其他基因的启动子序列,并构建进化树(图4)。结果显示,GrmZm2g14475(ABP7)基因启动子与属于玉米中的GrmZm2g083504基因启动子的相似度最高,其次是高粱中Sb07g026610基因启动子和水稻日本晴中 Os08g0524800基因启动子,而与水稻中Os09g0501600基因启动子和高粱中Sb03g043690基因启动子的相似性最低。NCBI数据库标注显示GrmZm2g083504为一种HLH转录因子,其可能参与了包括细胞伸长、花粉发育在内的生长发育过程,而其他几种基因启动子和功能则研究较少,几乎没有相关报道。

图4 ABP7启动子的聚类分析图Fig.4 Dendrogram of ABP7 promoter.
3 讨论
本研究成功克隆了ABP7的5′侧翼序列,并在玉米原生质体瞬时转化体系中证实其能够启动下游基因的表达,是一个功能启动子。这一结论得到了序列分析和比对结果的支持:所克隆的ABP7的5′侧翼序列不但具有核心启动子序列,还包括生长发育、激素信号传导和逆境应答相关顺式元件。本研究获得的ABP7启动子为进一步分析ABP7基因所参与的信号途径、上游调控因子和分子机理提供了研究靶标,并为鉴定ABP7在玉米生长发育和逆境应答中的功能提供了时空调控元件。
序列比对结果显示,在克隆的ABP7启动子序列中,存在与IAA、ABA、GA等激素信号响应、逆境信号响应和组织特异性表达相关的顺式作用元件。例如,ACIPVPAL2元件可能是基因在维管组织中特异表达所必需的[14~16];ACGTATERD1元件在拟南芥中可能与早期响应干旱胁迫、诱导植物黄化的基因表达有关;GCCCORE是一种乙烯应答元件,在调节茉莉酮酸酯应答的基因表达中有重要作用,番茄的Pti4(ERF)通过GCC Box和non-GCC Box顺式元件[Myb1(GTTAGTT)和GBox(CACGTG)]调控着防御相关基因的表达[17];DPBFCOREDCDC3是 bZIP类转录因子DPBF-1和DPBF-2(Dc3启动子结合因子-1和2)结合的核心序列,发现于胡萝卜Dc3基因启动子中,Dc3表达具有胚特异性,并且可以被ABA诱导[18,19]。这些结果暗示ABP7基因可能具有组织表达特异性并受多种激素的调控,在植物生长发育和响应逆境胁迫中发挥着重要作用。据此,后续将以ABP7启动子驱动的报告基因表达为指标对ABP7基因可能参与的信号转导途径、上游调控因子和分子机理开展深入研究;同时利用ABP7启动子驱动ABP7过表达和下调表达在转基因玉米中分析 ABP7在生长发育和逆境应答中的作用。
比较分析ABP7启动子在B73和齐319两种自交系中的序列异同发现,在两种自交系中ABP7启动子的序列相似性高达99%,虽然较之B73,在齐319中存在8个核苷酸的插入和2个核苷酸的转换,但是这些差异并没有分布在预测到的可能的调控元件上。这暗示在B73和齐319两个玉米自交系中,ABP7参与的信号转导途径和上游调控网络可能没有本质的差异。
[1] Riechmann JL,Heard J, Martin G, et al..Arabidopsis transcription factors:genome-wide comparative analysis among eukaryotes[J].Science,2000,290:2105-2110.
[2] Pires N,Dolan L.Origin and diversification of basic-helixloop-helix proteins in plants[J].Mol.Biol.Evol.,2010,27 (4):862-874.
[3] Gremski K,Ditta G,Yanofsky M F.The HECATE genes regulate female reproductive tract development in Arabidopsis thaliana[J].Development,2007,134(20):3593-3601.
[4] Payne C T,Zhang F,Lloyd AM.GL3 encodes a bHLH protein that regulates trichome development in Arabidopsis through interaction with GL1 and TTG1[J].Genetics,2000,156(3): 1349-1362.
[5] Chinnusamy V,Ohta M,Kanrar S,et al..ICE1:a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis [J].Genes Dev.,2003,17(8):1043-1054.
[6] Liu Y J,Ji X Y,Nie X G,et al..Arabidopsis AtbHLH112 regulates the expression of genes involved in abiotic stress tolerance by binding to their E-box and GCG-box motifs[J]. New Phytol.,2015,207(3):692-709.
[7] 温洪涛.玉米bHLH类转录因子ABP7基因功能分析[D].北京:中国农业科学院,博士学位论文,2011.
[8] RiahiM,Zarre S,Maassoumi A A,et al..An inexpensive and rapid method for extracting papilionoid genomic DNA from herbarium specimens[J].Genet.Mol.Res.,2010,9(3): 1334-1342.
[9] Lehnert S,Okada S.Cesium chloride density-gradient studies of nuclear proteinsstudies with control and irradiated nuclei [J].Biochim.Biophys.Acta,1965,109(2):557-567.
[10] Yoo SD, Cho Y H, Sheen J.Arabidopsis mesophyll protoplasts:a versatile cell system for transientgene expression analysis[J].Nat.Protoc.,2007,2(7):1565-1572.
[11] 谢礼,宗娜,赵军.玉米生长条件对玉米原生质体转化的影响研究[J].中国农业科技导报,2014,16(5):147-153.
[12] Loffler B M,Hesse B,Kunze H.A combined assay of three lysosomal marker enzymes: acid phosphatase, β-D-glucuronidase and β-N-acetyl-D-hexosaminidase[J].Anal. Biochem.,1984,142(2):312-316.
[13] A database of plant cis-acting regulatory DNA elements [Z/OL].http://www.dna.affrc.go.jp/PLACE/.
[14] Hatton D,Sablowski R,Yung M H,et al..Two classes of cis sequences contribute to tissue-specific expression of a PAL2 promoter in transgenic tobacco[J].Plant J.,1995,7(6):859 -876.
[15] Patzlaff A,Newman L J,Dubos C,et al..Characterisation of Pt MYB1,an R2R3-MYB from pine xylem[J].Plant Mol. Biol.,2003,53(4):597-608.
[16] Gomez-Maldonado J, Avila C, De La Torre F, et al.. Functional interactionsbetween a glutamine synthetase promoterand MYB proteins[J].Plant J.,2004,39(4):513-526.
[17] Chakravarthy S,TuoriR P,D′AscenzoM D,et al..The tomato transcription factor Pti4 regulates defense-related gene expression via GCC box and non-GCC box cis-elements[J]. Plant Cell,2003,15(12):3033-3050.
[18] Kim SY,Chung H J,Thomas T L.Isolation of a novel class of bZIP transcription factors that interactwith ABA responsive and embryo-specification elements in the Dc3 promoter using a modified yeast one-hybrid system[J].Plant J.,1997,11(6): 1237-1251.
[19] Finkelstein R R,Lynch T J.The Arabidopsis abscisic acid response gene ABI5 encodesa basic leucine zipper transcription factor[J].Plant Cell,2000,12(4):599-609.
[20] Shirsat A,Wilford N,Croy R,et al..Sequences responsible for the tissue specific promoter activity of a pea legumin gene in tobacco[J].Mol.Gen.Genet.,1989,215(2):326-331.
[21] Grace M L,Chandrasekharan M B,Hall TC,et al..Sequence and spacing of TATA box elements are critical for accurate initiation from theβ-phaseolin promoter[J].J.Biol.Chem.,2004,279:8102-8110.
[22] Tjaden G,Edwards JW,CoruzziGM.Cis elements and transacting factors affecting regulation of a nonphotosynthetic lightregulated gene for chloroplast glutamine synthetase[J].Plant Physiol.,1995,108(3):1109-1117.
[23] Rieping M,Schoffl F.Synergistic effectof upstream sequences,CCAAT box elements,and HSE sequences for enhanced expression of chimaeric heat shock genes in transgenic tobacco [J].Mol.Gen.Genet.,1992,231(2):226-232.
[24] Gowik U,Burscheidt J,Akyildiz M,et al..cis-Regulatory elements formesophyll-specific gene expression in the C4plant Flaveria trinervia,the promoter of the C4phosphoenolpyruvate carboxylase gene[J].Plant Cell,2004,16:1077-1090.
[25] Yanagisawa S,Schmidt R J.Diversity and similarity among recognition sequences of Dof transcription factors[J].Plant J.,1999,17(2):209-214.
[26] Baumann K,De Paolis A,Costantino P,et al..The DNA binding site of the Dof protein NtBBF1 is essential for tissuespecific and auxin-regulated expression of the rolB oncogene in plants[J].Plant Cell,1999,11(3):323-334.
[27] Sutoh K,Yamauchi D.Two cis-acting elements necessary and sufficient for gibberellin-upregulated proteinase expression in rice seeds[J].Plant J.,2003,34(5):635-645.
[28] Maruyama-Nakashita A,Nakamura Y,Watanabe-Takahashi A,et al..Identification of a novel cis-acting element conferring sulfur deficiency response in Arabidopsis roots[J].Plant J.,2005,42(3):305-314.
[29] Simpson SD,Nakashima K,Narusaka Y,et al..Two different novel cis-acting elements of erd1,a clpA homologous Arabidopsis gene function in induction by dehydration stress and darkinduced senescence[J].Plant J.,2003,33:259-270.
[30] Rubio V,Linhares F,Solano R,et al..A conserved MYB transcription factor involved in phosphate starvation signaling both in vascular plants and in unicellular algae[J].Genes Dev.,2001,15:2122-2133.
The Promoter Cloning and Activity Analysis of Maize bHLH Transcription Factor ABP7
WANG Yin-xiao,ZHAO Jun∗
Faculty of Maize Functional Genomics,Department ofCrop Genome Research and Genetic Improvement;National Key Facility forCrop Gene Resources and Genetic Improvement,Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081,China
Basichelix-loop-helix(bHLH)transcription factors are widely present in plants,which play important roles in flower morphogenesis,light signal transduction and hormonal signal transduction.However,the molecular mechanisms regulating their expression remain largely unknown.In this paper,we previously cloned a bHLH transcription factor gene from maize,designated ABP7,and preliminary data suggestted that it might be involved in multiple signal transduction pathways such as kernel development and hormone response.For further elucidation of the upstream pathways regulating ABP7 expression,we cloned the 5′flanking sequence of ABP7,verified its promoter activity by transient expression in maize protoplasts,and predicted its cisacting elements.The results showed that the cloned 2 266 bp 5′flanking region is a functional promoter which is capable to drive the expression of downstream reporter,and contains many potential cis-acting elements involved in the signaling of hormones such as GA、IAA and ABA,and responses to adverse environments.These results set a base for future studies in identification of upstream regulatory networks that control ABP7 expression,and in unraveling the specific roles of ABP7 in plant growth,development and stress response.
bHLH;promoter;transient expression
10.3969/j.issn.2095-2341.2015.05.06
2015-05-08;接受日期:2015-06-02
国家转基因生物新品种培育重大专项(2014ZX0800941B)资助。
王银晓,硕士研究生,主要从事植物非生物逆境传导研究。E-mail:hengshuiyin@163.com。∗通信作者:赵 军,研究员,博士,主要从事植物抗逆性和籽粒发育分子生物学和分子育种研究。E-mail:zhaojun01@caas.cn

