铁过载引发人肝细胞HH4 N-糖链表达差异研究
李士伟,关 锋,李 想
(1.江南大学糖化学与生物技术教育部重点实验室,江苏无锡214122 2.江南大学生物工程学院,江苏无锡214122 3.江南大学无锡医学院,江苏无锡214122)
铁过载引发人肝细胞HH4 N-糖链表达差异研究
李士伟1,2,关 锋1,2,李 想3
(1.江南大学糖化学与生物技术教育部重点实验室,江苏无锡214122 2.江南大学生物工程学院,江苏无锡214122 3.江南大学无锡医学院,江苏无锡214122)
肝脏铁过载是血液系统疾病患者进行骨髓移植后的典型并发症之一,长期铁过载可引发肝脏细胞凋亡和器官损坏,然而铁过载的分子调控机理迄今仍不清楚。以培养的枸橼酸铁铵过载人肝细胞HH4和正常人肝细胞HH4为研究对象,细胞裂解提取总蛋白,分子筛超滤管分离获得总糖肽,PNGase F酶解释放出N-糖链,Sepharose 4B除盐纯化N-糖链,再利用基质辅助激光解析电离飞行时间质谱(MALDI-TOF/TOF-MS)技术比较N-糖链变化情况。同时,采用荧光细胞凝集素免疫组化方法验证糖链分析结果。结果在铁过载人肝细胞和正常细胞中均检测到16种N-糖链,但糖链丰度存在明显差异。与正常人肝细胞相比,铁过载人肝细胞中高甘露糖型糖链的含量降低,而杂合型、复杂型、平分型、岩藻糖化和唾液酸化糖链的含量明显升高。凝集素免疫组化结果显示铁过载后细胞对凝集素ConA的亲和作用减弱,而对PHA-E、AAL、LCA和MAL-II的亲和作用增强,与糖链质谱分析结果相一致。研究为进一步探索人肝细胞铁过载模式下N-糖链表达差异的分子机理提供了技术支持。
铁过载;人肝细胞HH4;MALDI-TOF/TOF-MS;N-糖链;凝集素免疫组化
骨髓移植是当前临床根治急慢性白血病、严重型再生不良性贫血、地中海性贫血、淋巴瘤以及多发性骨髓瘤等恶性疾患的主要手段[1],然而越来越多的证据发现骨髓移植后,病人的肝脏出现典型的铁过载症状进而引发肝损伤[2-3]。早在2000年,国际上已经开始关注和研究作为骨髓移植并发症存在的肝脏铁过载现象,但是迄今肝脏铁过载的具体分子调控机理仍不清楚。
鉴于先前肝脏铁过载研究大多集中于基因组学和蛋白质组学方面,本实验拟利用MALDI-TOF/TOF-MS技术从糖组学角度观察铁过载中糖链表达的状态。糖组学的主要研究对象为糖链,通常生物体在内质网中将糖链附加到蛋白质或脂质上以形成功能性糖缀合物,这个过程称之为糖基化。其中,蛋白质的糖基化作用是最普遍和最主要的蛋白质翻译后加工方式之一,蛋白质的糖基化有助于肽链的正确折叠,保护蛋白质免受水解以及影响蛋白质的正确投送和定位[4-5]。研究表明真核生物中约50%以上的蛋白质是被糖基化的,而在人类蛋白质中更高达70%[6]。生物体内糖基化修饰根据寡糖链与蛋白质连接方式的不同主要分为4种:N-连接糖链,O-连接糖链,糖基磷脂酰肌醇(GPI)锚和糖胺聚糖[7]。哺乳动物中的糖链主要存在于多种膜蛋白、酶、激素、生长因子、抗体和免疫球蛋白中,因此糖链可以参与调节细胞的许多重要功能,如分子及细胞间的相互识别,胞内或胞外信号传导,免疫应答以及炎症发生等[8]。
当前糖组学研究主要利用高相液相色谱(HPLC)、毛细管电泳(CE)、核磁共振(NMR)以及生物质谱技术对糖链进行定性定量分析和结果解析。而生物质谱中的基质辅助激光解析电离飞行时间质谱(MALDI-TOF/TOF-MS)更是因其具有灵敏快捷、图谱解析简单、质量检测上限高、对杂质的包容性强、无需预分离混合物和可分析fmol至pmol范围内的糖链结构等优点,被广泛应用于糖类物质的结构分析中。此外,凝集素作为一类源于各种植物、无脊椎动物和高等动物的糖结合蛋白具有能特异性识别特定糖链结构的性质,而以荧光标记凝集素作为探针分子的凝集素组织化学技术能够直观显示细胞中糖蛋白糖链结构的差异变化,已被广泛应用于不同组织或细胞糖缀合物研究。
本研究以枸橼酸铁铵(FAC)过载前后的人肝细胞HH4为研究对象,利用MALDI-TOF/TOF-MS技术和凝集素组织化学技术比较分析N-糖链谱的变化差异,拟为糖组学水平以及糖蛋白质组学水平上深入研究肝细胞铁过载的分子机制提供技术支持。
1 材料与方法
1.1 材料
非转化人肝细胞株HH4获赠于美国西雅图Fred-Hutchinson Cancer Research Center(FHCRC)Joachim Deeg教授实验室。Williams'medium E培养基、HEPES(20mmol/L)和丙酮酸钠(1mmol/L)购于Gibco公司;胎牛血清和青霉素溶液购于Life Technologies公司;地塞米松(0.04μg/m L)和庆大霉素(50μg/m L)购于美国 Sigma-Aldrich公司;ITS(Insulin-transferrinselenium)购于美国BD公司;
苯甲基磺酰氟(PMSF)和抑肽酶购自Thermo Scientific公司;T-PER组织总蛋白抽提试剂购于美国Thermo公司;BCA蛋白检测试剂盒和4',6-二脒基-2-苯基吲哚(DAPI)染色液购自碧云天生物技术研究所;离心超滤管Am icon Ultra-0.5 10 kD购于美国M illipore公司;柠檬酸铁铵(FAC)、琼脂糖凝胶Sepharose 4B、尿素(UREA)、碳酸氢铵、二硫苏糖醇(DTT)、碘乙酰胺(IAM)、正丁醇、乙醇和2,5-二羟基苯酸乙酯(DHB)购于美国Sigma-Aldrich公司;PNGase F酶购自美国New England Biolabs公司;Sephadax G-25(葡聚糖凝胶柱)购自Amersham Pharmacia Biotech公司;氨基反应性Cyanine3 NHS ester(花青素3-N-羟基琥珀酰亚胺酯)购于Lumiprobe公司;凝集素ConA、PHA-E、AAL、LCA和MAL-II购自Vector公司。
1.2方法
1.2.1 细胞培养
HH4细胞在含10%胎牛血清(FBS)、0.1%ITS、0.04μg/m L地塞米松、50μg/m L庆大霉素、20mmol/L的HEPES和1mmol/L的丙酮酸钠的Williams培养基中培养;培养条件为37℃、5%CO2。
1.2.2细胞总蛋白的提取
0、5和10mmol/L枸橼酸铁铵分别处理HH4细胞24 h后,胰酶消化收集细胞。冷1×PBS洗细胞3次,加入适量T-PER组织蛋白裂解液、PMSF(工作浓度1%)和抑肽酶(工作浓度1‰)冰浴30min,12000 r/min离心15min,取上清利用BCA法测定蛋白浓度。
1.2.3 N-糖链的释放
取2mg细胞总蛋白加入到10 kD离心超滤管中13800 r/min离心5m in浓缩。加入8M尿素(8M高浓度尿素使蛋白质变性溶解)、10mM的DTT溶液和20 mM的IAM溶液使蛋白质变性溶解。弃流出液。加入PNGaseF酶解缓冲液,37℃酶解反应12 h。收集样品冷冻干燥,于-20℃保存备用。
1.2.4 N-糖链的除盐纯化
取适量Sephrose4B至微量离心管中,向离心管中加入1∶1的甲醇∶水溶液和5∶1∶1的正丁醇∶甲醇∶水溶液(体积分数)离心清洗Sephrose 4B。加入500μL的5∶1∶1的正丁醇∶甲醇∶水溶液溶解冻干的糖链样品,上样至Sephrose 4B中,25℃振荡反应45m in。5∶1∶1的正丁醇∶甲醇∶水溶液清洗3次后,采用1∶1的甲醇∶水溶液洗脱糖链,收集洗脱液冷冻干燥。
1.2.5糖链的质谱分析
应用 Bruker Daltonics公司的 UltrafleXtreme MALDI-TOF/TOF-MS解析糖蛋白的N-连接糖链。加入5μL的1:1的甲醇:水溶液溶解冻干糖链样品,取2μL糖链溶液点样于MTPAnchorchip 384点的靶板上。晾干后,再加1μL的20mg/m L的基质DHB至样品板上。以反射阳性离子模式鉴定多糖。一级质谱参数如下:离子源1,7.50 kV;离子源2,6.75 kV;反射电压1,29.5 kV;反射电压2,13.95 kV;LIFT 1,19 kV;LIFT 2,3.7 kV。激发光源为N2激光(337 nm),分子量检测范围为700~4000。用多肽校正混合物作为外标校正质谱仪。检测时每个样品在多点采集图谱,每个图谱扫描1500次,最后将所有谱图叠加得到最后的多糖一级图谱。从一级图谱中选择信噪比大于6的质谱峰进行二级质谱分析。
通过软件FlexAnalysis v3获得糖链质谱图和原始数据。利用软件Glycoworkbench 2分析并获得可能性最高的糖链结构。
1.2.6荧光细胞凝集素免疫组化
用1μL Cy3(10μg/μL)对应200μg凝集素,在Na2CO3溶液中反应3 h,用Sephadax G-25分离收集标记后的凝集素。将HH4细胞接种于装有灭菌盖玻片的24孔板中培养,待细胞融合约70%时,用0、5和10 mmol/L枸橼酸铁铵分别处理HH4细胞24 h。PBS漂洗后,2%多聚甲醛固定15min。再用PBS振荡漂洗3次。0.2%Triton X-100溶液通透细胞10m in,PBS漂洗3次,5%BSA溶液4℃封闭过夜。每孔分别加入Cy3标记凝集素室温避光振荡孵育3 h,PBS振荡清洗3次。0.5μg/m LDAPI室温下避光染色15m in,PBS振荡清洗3次。将盖玻片倒扣在滴有Glycergel固定剂的载玻片上,利用激光共聚焦显微镜(Nikon Eclipse E600)对细胞样本进行扫描和分析。
2 结果与分析
2.1 HH4细胞铁过载前后N-糖链的质谱分析
本研究借助Am icon Ultra-0.5 10 kD滤膜的分子筛效应对HH4胞内糖链进行释放和分离,使用亲水树脂Sepharose 4B对分离的糖链除盐纯化,通过UltrafleXtremeMALDI-TOF/TOF-MS获得HH4细胞铁过载前后N-糖链的指纹图谱,最后利用软件GlycoWorkbench对信噪比高于6的糖链质谱峰进行结构信息注释(图1)。在此之上,本实验又对各分子量的糖链进行了二级质谱解析,图2所示为2个随机挑选的N-糖链二级质谱峰图,分别为m/z 1743.695的高甘露糖型N-糖链和m/z 2174.901的岩藻糖化修饰的N-糖链。从正常肝细胞HH4和铁过载肝细胞HH4 N-糖链一级质谱图中可以看出N-连接糖链结构主要分布在1200~2600之间,且各实验组糖链指纹图谱非常相似。结合二级质谱分析结果,确定正常肝细胞HH4和铁过载肝细胞HH4含有16个相对不同强度的糖链结构,各N-糖链质谱数据以及结构信息如表1所示。为分析正常肝细胞HH4和铁过载肝细胞HH4N-糖链的表达,根据糖链分子量大小、天线的数目和糖残基的丰度对N-糖链进行了分类比较。如表2所示,本实验将表1中HH4细胞N-糖链分类成高甘露糖型、杂合型、复杂型(包括二天线型、三天线型和四天线型)、平分型、岩藻糖化和唾液酸化,然后分别累加每个实验组各类型糖链的相对强度值并计算各类型糖链在对应实验组中所占比重。结果表明,与正常人肝细胞相比,5mM枸橼酸铁铵处理肝细胞和10mM枸橼酸铁铵处理肝细胞高甘露糖型糖链的含量呈枸橼酸铁铵浓度依赖性降低,而杂合型、复杂型(包括二天线型、三天线型和四天线型)、平分型、岩藻糖化和唾液酸化糖链的含量呈明显枸橼酸铁铵浓度依赖性升高。
2.2 HH4细胞铁过载前后凝集素免疫组化分析结果

图1 正常肝细胞HH4和铁过载肝细胞HH4 N-糖链一级质谱图Fig 1 MALDI-TOF-MSspectra of N-glycans from HH4 cellsand iron overloaded HH4 cells
为了进一步验证N-糖链质谱分析结果的准确性,实验针对性的选取了凝集素ConA、PHA-E、AAL、LCA和MAL-II进行凝集素组织化学分析。吲哚菁荧光染料Cy3摩尔吸光系数高且性能优良已作为生物荧光探针分子广泛用于蛋白、抗体、核酸及其他生物分子的标记和检测。本实验利用Cy3对5种凝集素进行荧光标记,然后分别与铁过载前后HH4细胞孵育,最后通过激光共聚焦显微镜进行扫描分析。荧光扫描结果如图3所示,与正常人肝细胞相比,凝集素ConA耦合后的铁过载肝细胞荧光强度明显降低,表明铁处理后胞内高甘露糖型糖链结构的表达下降;凝集素PHA-E耦合后的铁过载肝细胞荧光强度明显增强,表明铁处理后胞内平分型N-乙酰葡萄糖胺糖链结构(bisecting GlcNAc)的表达上升;凝集素AAL和LCA耦合后的铁过载肝细胞荧光强度明显增强,表明铁处理后胞内末端岩藻糖化(TerminalαFuc)和α1-6核心岩藻糖(Fucose α1-6GlcNAc)化的糖链结构表达上升;凝集素MAL-II耦合后的铁过载肝细胞荧光强度明显增强,表明铁处理后胞内α2-3唾液酸(Sia2-3Galβ1-4GlcNAc)化的糖链结构表达上升。以上5种凝集素的铁过载前后化学分析结果均与糖链质谱分析结果相一致。
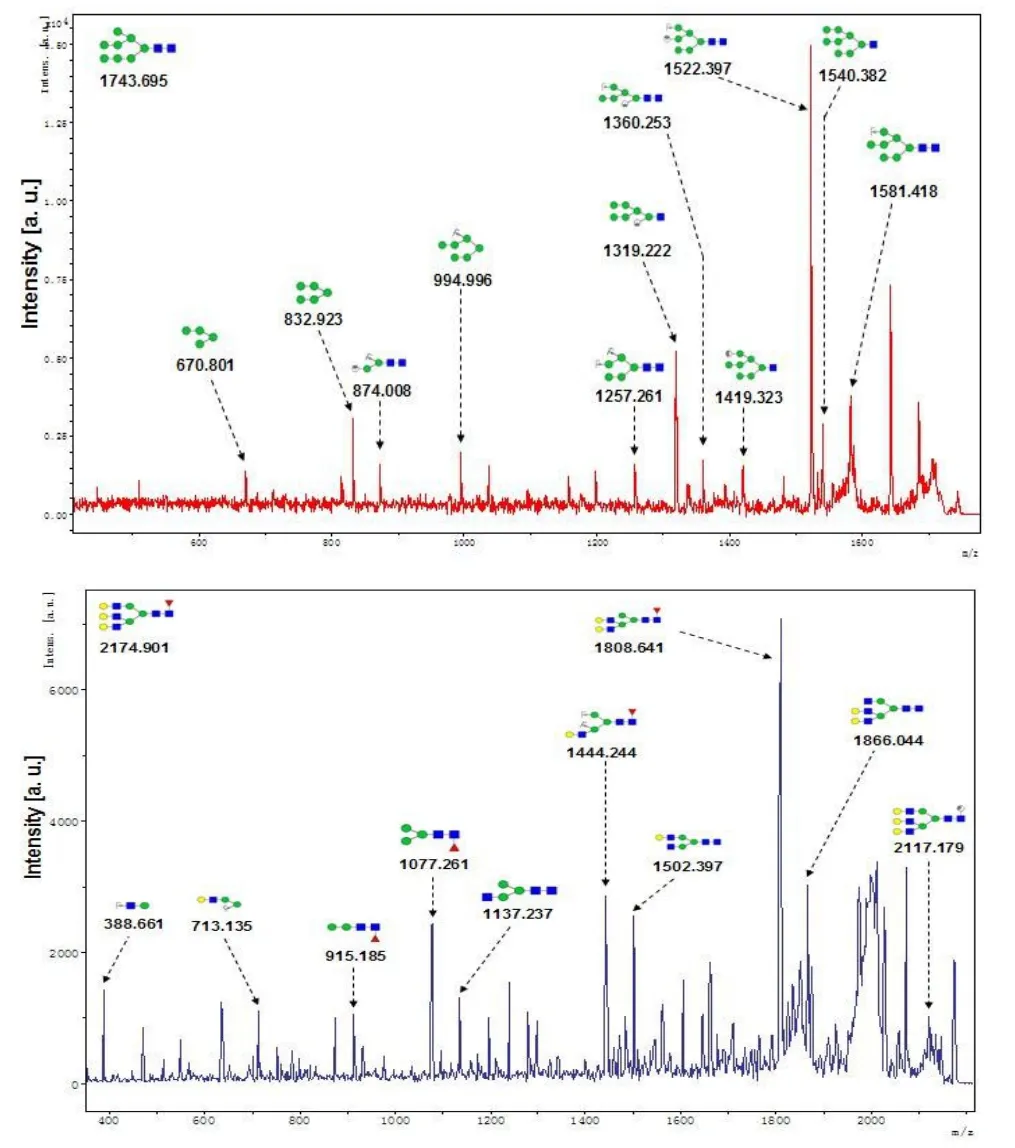
图2 m/z 1743.613和2174.901的糖链二级图Fig 2 MALDI-TOF/TOF-MS/MSanalysisof glycansw ith m/z 1743.695 and 2174.901
3 讨论
铁元素是人体内必需的微量元素,为几乎所有的生命体所必需,在DNA合成、电子传递、氧气运输等生物代谢过程中发挥了重要的作用[9-10]。当机体内铁过多时则被称为“铁负荷过载”,主要体现在血清游离铁和结合铁的浓度增高。一般认为男性血清铁蛋白质量浓度>300 ng/m L,女性血清铁蛋白>200 ng/m L,或转铁蛋白饱和度>45%即可以诊断为铁过载[11]。近年来陆续有研究证实血液系统疾病患者骨髓移植后铁代谢存在明显紊乱,表现为不同程度的铁负荷过高,而长期铁过载可引发肝实质细胞损伤乃至肝脏器官纤维化、肝硬化和肝癌等严重的病理改变[12]。目前临床上利用地拉罗司(Deferasirox,DFX或ICL670)等祛铁药物降低实质细胞铁水平并改善MDS患者预后,但祛铁药物治疗是一个漫长且昂贵的过程[13]。基于此,近年来国际上关于铁过载的研究越来越受到关注,但是其表达调控的分子机制仍不清晰。当前很多的研究多从基因水平和蛋白质水平解析铁过载导致的肝细胞损伤机制[14-17],而铁过载引发的肝细胞糖谱变化迄今尚未见报道,因此本文拟从糖组学角度阐述肝细胞铁过载前后全糖链变化,为肝细胞铁过载研究提供新的思路。

表1 正常肝细胞HH4和铁过载肝细胞HH4各N-糖链质谱数据以及结构信息Table 1 Proposed structuresand theirmolecular ions in MALDI spectraof N-Glycans from control,5mM FAC-treated and 10mM FAC-treated groups

表2 不同类型N-糖链的相对变化Table2 Relative variation of different typesof N-Glycans
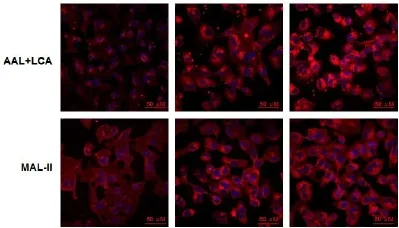
图3 铁过载前后HH4细胞与凝集素相结合的荧光细胞凝集素免疫组化图(60×)Fig 3 Theaffinity of different lectins to HH4 cellsbeforeand after FAC treatmentanalyzed by fluorescence cell lectin-immunochem istry(60×)
实验利用布鲁克公司新型1 kHz高通量质谱仪UltrafleXtremeMALDI-TOF/TOF-MS对枸橼酸铁铵过载人肝细胞HH4前后N-糖链的指纹图谱进行鉴定,然后筛选信噪比高于6的糖链质谱峰依托Glycoworkbench软件进行注释。结果表明枸橼酸铁铵过载人肝细胞HH4后N-糖链发生明显的差异变化,细胞高甘露糖型表达呈现浓度依赖性降低,而杂合型、复杂型、平分型、岩藻糖修饰以及唾液酸修饰则表现为浓度依赖性升高(图1和表1)。其中,m/z为1793.760、1955.826和2101.891岩藻糖化和唾液酸化的N-糖链含量增加最为明显。本文接着利用荧光Cy3标记的凝集素ConA、PHA-E、AAL、LCA和MAL-II对铁处理前后的肝细胞进行免疫亲和反应,激光共聚焦扫描结果显示铁处理导致细胞对凝集素ConA亲和降低,而对凝集素PHA-E、AAL、LCA和MAL-II亲和增强,验证了质谱数据结果(图3)。
另据报道,胞内铁稳态调节相关蛋白具有较普遍的糖基化修饰现象,例如转铁蛋白受体2(TfR2)的胞外域上携有的4个潜在的N-糖基化位点能促进TfR2亚基间二硫键高效形成以及维持TfR2蛋白稳定[21]。此外,近年来相关研究发现胞内N-糖链岩藻糖化和唾液酸化水平变化与细胞凋亡的发生有一定的关联。例如,α-1,6核心岩藻糖基转移酶(Fut8)能够催化岩藻糖分子转移到N-糖链核心五糖最内侧的与Asn相连的β-N-乙酰葡糖胺基上添加岩藻糖,而Goupille等报道在小鼠结肠癌细胞中过表达岩藻糖基转移酶能够抑制凋亡[18],同时杨雪松等也证实岩藻糖基转移酶IV过表达能够抑制A43l细胞凋亡[19]。溶酶体唾液酸酶(Neu1)能够水解运输至溶酶体的糖蛋白酮糖苷键而释放出非还原末端的唾液酸,而赵豫刚等人的研究则表明大鼠睾丸上皮细胞唾液酸含量与凋亡呈明显负相关[20]。本实验室先前的研究证实肝细胞铁过载能够激活胞内铁稳态相关蛋白的表达以及细胞凋亡,基于此实验下一步计划利用凝集素亲和CLINPROT技术(液体蛋白芯片指纹图谱解决方案)筛选观察肝细胞铁过载模式下铁稳态相关蛋白的表达情况并明确糖链修饰变化对其蛋白功能发挥的影响,以及分析铁过载前后多种糖基转移酶和相关糖苷酶的表达差异。
总之,本实验利用MALDI-TOF/TOF-MS技术和凝集素免疫组化方法首次证实枸橼酸铁铵过载能够诱导HH4细胞杂合型、复杂型、平分型、岩藻糖修饰以及唾液酸修饰N-糖链的表达,同时抑制高甘露糖型N-糖链的表达,研究将有助于阐明铁过载引发的肝细胞糖谱变化,为骨髓移植引发肝细胞铁过载的具体分子机理提供重要的理论参考。
[1]M cKay P,Murphy J,Cameron S,etal.Iron overload and liver dysfunction after allogeneic or autologous bone marrow transplantation[J].BoneMarrow Transplantation,1996,17(1):63-66.
[2]Platzbecker U,Bornhäuser M,Germing U,et al.Red blood cell transfusion dependence and outcome after allogeneic peripheral blood stem cell transplantation in patientsw ith de novomyelodysplastic syndrome(MDS)[J].Biology of Blood and Marrow Transplantation,2008,14(11):1217-1225.
[3]AliS,Pimentel JD,Munoz J,etal.Iron overload in allogeneic hematopoietic stem cell transplant recipients[J].Archivesof Pathology&Laboratory Medicine,2012,136(5):532-538.
[4]Ghazarian H,Idoni B,Oppenheimer S B.A glycobiology review: carbohydrates,lectins and implications in cancer therapeutics[J]. Acta Histochem ica,2011,113(3):236-247.
[5]Dwek R A.Glycobiology:toward understanding the function of sugars[J].Chem icalReviews,1996,96(2):683-720.
[6]Apweiler R,Herm jakob H,Sharon N.On the frequency of protein glycosylation,as deduced from analysis of the SW ISS-PROT database[J].Biochimica et Biophysica Acta(BBA)-General Subjects, 1999,1473(1):4-8.
[7]Ohtsubo K,Marth JD.Glycosylation in cellularmechanisms of health and disease[J].Cell,2006,126(5):855-867.
[8]Larsson O,Carlberg M,Zetterberg A.Selective killing induced by an inhibitor of N-linked glycosylation[J].Journal of Cell Science,1993,106:299-307.
[9]Lieu PT,HeiskalaM,Peterson PA,etal.The rolesof iron in health and disease[J].Molecular Aspects of Medicine,2001,22(1/2):1-87.
[10]王 伟,肖 明.微生物嗜铁素介导的铁摄取[J].生物学杂志, 2005,22(4):11-13,15.
[11]Esterao I,Junior P P,Bonini-Dom ingos C.Serum ferritin and transferrin saturation levels inβoandβ(+)thalassem ia patients[J].Geneticsand Molecular Research,2011,10(2):632-639.
[12]Lu W,Zhao M,Rajbhandary S,etal.Free iron catalyzes oxidative damage to hematopoietic cells/mesenchymal stem cells in vitro and suppresses hematopoiesis in iron overload patients[J]. Eur JHaematol,2013,91(3):249-261.
[13]Shirley M,Plosker G L.Deferasirox:a review of its use for chronic iron overload in patients w ith non-transfusion-dependent thalassaem ia[J].Drugs,2014,74(9):1017-1027.
[14]Andrews N C.Forging a field:the golden age of iron biology[J].Blood,2008,112(2):219-230.
[15]CuiR,Gale R P,Zhu G,etal.Serum ironmetabolism and erythropoiesis in patientsw ithmyelodysplastic syndrome not receiving RBC transfusions[J].Leukem ia Research,2014,38(5):545-550.
[16]Ganz T.Hepcidin and iron regulation,10 years later[J].Blood, 2011,117(17):4425-4433.
[17]Kautz L,Besson-Fournier C,Meynard D,etal.Iron overload induces BMP6 expression in the liver butnot in the duodenum[J]. Haematologica,2011,96(2):199-203.
[18]Goupille C,Marionneau S,Bureau V,et al.alpha 1,2 Fucosyltransferase increases resistance to apoptosisof ratcolon carcinoma cells[J].Glycobiology,2000,10(4):375-382.
[19]王 娇.岩藻糖基转移酶Ⅶ的表达促进A431细胞增殖[D].大连:大连医科大学,2011.
[20]赵豫刚,郑新民,杨志伟,等.大鼠睾丸扭转复位后附睾上皮细胞凋亡及唾液酸变化[J].中国男科学杂志,2004:19-21.
[21]Zhao N,Enns C A.N-linked glycosylation is required for transferrin-induced stabilization of transferrin receptor 2,but not for transferrin binding or trafficking to the cell surface[J].Biochemistry,2013,52(19):3310-3319.
Study on differentialexpression of N-linked glycans in iron overload-induced human hepatocytesHH 4
LIShi-wei1,2,GUAN Feng1,2,LIXiang3
(1.Key Laboratory of Carbohydrate Chemistry&Biotechnology M inistry of Education;
2.Schoolof Biotechnology; 3.WuxiMedical School,Jiangnan University,Wuxi214122,China)
Hepatic iron overload is common in patients undergoing hematopoietic cell transplantation and may be associated w ith hepatic injury.Here iron overloadmodel of HH4 cells induced by FAC(ferric ammonium citrate)was established.The total proteins of HH4 cells treated w ith or w ithout FAC were extracted,and total glycopeptides were isolated by an ultrafiltration unit.The glycopeptides were enzymatically hydrolyzed by Peptide-N-glycosidase F(PNGase F)and the released N-linked glycans were desalinated using Sepharose 4B.The structures of the purified N-glycans were identified by matrix-assisted laser desorption ionization time of flightmass spectrometry(MALDI-TOF/TOF-MS).Furthermore,the comparative expression of N-glycans was analyzed by lectin immunohistochem istry.The result indicated that 16 N-glycanswere differentially expressed in HH4 cells treated w ith orw ithout FAC.The levels of high-mannose-type N-glycanswere decreased significantly,while the expression of hybrid type, complex type,bisecting type,fucosylation and sialylation of glycanswere enhancedmarkedly in FAC-treated HH4 cells.Consistentw ith MS analysis,lectin immunohistochem istry study showed that the binding affinity to lectin ConA was reduced in FAC-treated HH4 cells,but the binding affinities to 4 lectins PHA-E,AAL,LCA and MAL-IIwere significantly increased.The present research provides the fundamentalobservations for furtherunderstanding functional rolesof differentialexpression of N-linked glycans in ironoverload HH4 cells.
iron overload;human hepatocytes HH4;MALDI-TOF/TOF-MS;N-linked glycans;lectin immunohistochem istry
R735.7
A
2095-1736(2015)03-0009-06
10.3969/j.issn.2095-1736.2015.03.009
2014-10-24;
2014-12-15
国家自然科学青年基金(31400691);江苏省自然科学基金(BK20140169)
关锋,教授,主要从事糖生物学方面研究,E-mail:fengguan@jiangnan.edu.cn;李想,副教授,研究方向为骨髓微环境对造血干细胞的发育以及分化的影响,E-mail:xiangli@jiangnan.edu.cn。

