NF-κB-p65信号分子参与重组蛋白药物Kallistatin抑制人脐静脉内皮细胞侵袭作用
黄恺飞
(1.厦门市医药研究所药物研发中心,福建 厦门361008;2.厦门南方海洋研究中心,福建 厦门361008)
NF-κB-p65信号分子参与重组蛋白药物Kallistatin抑制人脐静脉内皮细胞侵袭作用
黄恺飞1,2
(1.厦门市医药研究所药物研发中心,福建 厦门361008;2.厦门南方海洋研究中心,福建 厦门361008)
通过构建NF-κB-p65真核表达质粒,研究NF-κB-p65在重组Kallistatin(rhKal)抑制内皮细胞侵袭中的作用及其分子机制。利用基因重组技术构建NF-κB-p65真核表达质粒载体,转染入HUVEC细胞,检测NF-κB-p65蛋白表达变化;Transwell小室观察重组Kallistatin对转染NF-κB-p65真核表达质粒HUVEC细胞侵袭的影响;Western blotting检测过表达p65对重组Kallistatin对内皮细胞侵袭相关蛋白抑制作用的影响。人脐静脉内皮细胞转染NF-κB-p65真核表达质粒载体后,细胞内p65蛋白表达明显升高;p65过表达可以逆转rhKal对HUVEC细胞体外侵袭的抑制作用;过表达p65可以明显抵抗rhKal对NF-κB信号通路下游相关靶基因的抑制作用。研究表明重组Kallistatin明显抑制HUVEC细胞体外侵袭,其分子机制可能与NF-κB信号通路相关。
Kallistatin;HUVEC;NF-κB;侵袭;信号通路
Kallistatin(Kal)又称组织激肽释放酶结合蛋白,具有独特的丝氨酸蛋白酶抑制剂活性,随后发现其参与高血压[1-2]、炎症[3-4]、血管生成[5-6]、肿瘤[7-8]等多种疾病的发生和发展过程,是一个极具临床应用前景的蛋白类药物。近些年来,Kallistatin的抗血管生成作用倍受大家的关注[9-10]。血管生成过程伴随着血管内皮细胞的增殖、迁移和重构。抑制血管内皮细胞的增殖或侵袭成为抗血管生成的重要靶标之一。
p65具有TAD反式激活结构域,是NF-κB家族中含量最丰富、功能最重要的亚基,其参与了多种靶基因的表达调控,从而影响了多种生理还能,是目前研究NF-κB信号通路的关键分子[11]。目前认为NF-κB刺激癌症发生与刺激促进肿瘤转移、细胞生长、抑制凋亡、促进血管生成等密切相关[12-13]。本研究首先通过基因工程方法获得高纯度的Kallistatin蛋白;构建NF-κB-p65真核表达质粒载体,转染HUVEC细胞;观察重组Kallistatin对转染NF-κB-p65真核表达质粒HUVEC细胞侵袭的影响;最后检测过表达p65对重组Kallistatin对内皮细胞侵袭相关蛋白抑制作用的影响,明确NF-κB-p65信号分子在Kallistatin抑制人脐静脉内皮细胞侵袭中的作用。
1 材料与方法
1.1材料
1.1.1 试剂
转染试剂Lipofectamin TM 2000(美国Invitrogen公司);RPM I1640培养基、胎牛血清(GIBCO公司);琼脂糖(赛百盛公司);限制性内切酶(NEB公司);Taq polymerase、dNTP(Takara公司);蛋白裂解液、蛋白提取试剂(海门碧云天公司);双抗(青链霉素)(Hyclone公司);硝酸纤维素(NC)膜(厦门泰京生物有限公司);NF-κB65,NF-κB50,ICAM-1,MMP-2,MMP-9, VEGF,酶标二抗多克隆抗体(武汉博士德公司);YPD液体培养基、BMG培养基、FM 21基础发酵培养基(由本实验室配置),细胞培养板(CorningCostar公司);Thincert小室(Greiner公司)。
1.1.2 仪器和细胞株
荧光倒置显微镜(日本Nikon);多功能酶标仪(美国MD公司);PCR仪(美国Bio-RAD公司);水平、垂直电泳槽(美国Bio-RAD公司);CO2培养箱(新加坡ESCO公司);人脐静脉血管内皮细胞(HUVEC细胞)由本实验室提供。
1.2 方法
1.2.1 rhKal蛋白的表达和纯化
取实验室保存的含有pPIC9-Kal质粒的GS115 (His4)菌30μL接入8m L YPD液体培养基中,恒温摇床内,28℃,220 r/min培养18~24 h,D(λ)值达到0.5以上,培养的发酵种液再以1∶50的比例接种于250 m LBMG培养基中,诱导表达16 h左右,当D(λ)值达到0.5以上,并镜检没有染菌,再以1∶20比例接种于4 L FM 21基础发酵培养基中扩大培养。连续培养108 h放罐后,菌液10000 r/min,4℃离心30m in,弃菌体,收集上清进行纯化。Western blotting方法对重组Kallistatin蛋白进行鉴定。
1.2.2 p65真核表达载体构建
人脐静脉内皮细胞用含有10%小牛血清的RPM I-1640培养基,放置于37℃、5%CO2和100%湿度条件下培养,利用酸性异硫氰酸胍法提取总RNA,用M-MLV逆转录酶和Oligo(dT)18引物逆转录合成cDNA第一链,并作为模板进行PCR扩增。根据GenBank中人p65序列(登录号:RELA NM-021975)设计引物,上游引物P1:5'-CGCAAATGGGCGGTAGGCGTG-3',下游引物P2:5'-TTATTAGGAAAGGACAGTGGG-3',分别引入了Xho I/Kpn I酶切位点。PCR反应条件为:94℃预变性5min;94℃变性30 s,55℃退火30 s,72℃延伸2min,共30个循环;72℃延伸10m in;4℃保存。将PCR扩增得到的p65片段切胶回收后,同时与质粒GV141一起进行Xho I/Kpn I酶切,纯化试剂盒纯化酶切PCR产物,4℃下T4连接酶连接过夜。连接产物转化入大肠杆菌DH 5α中保存,筛选阳性克隆菌,提取质粒进行PCR、酶切验证,并测序。重组质粒GV141-p65经鉴定引物为上游:CCACCTCGACGCATTGCTG;下游:TTATTAGGAAAGGACAGTGGG。
1.2.3真核表达质粒p65 cDNA细胞转染
转染前1 d将HUVEC细胞培养于含10%胎牛血清的1640培养基中,调整细胞浓度为3×105/m L,接种于24孔培养板中培养24 h,待达到80%~90%细胞融合,弃上清,用无血清1640培养基洗涤细胞2~3次,加Opti-MEM I无血清培养基培养细胞,准备转染。移去24孔板中的原培养基,用Opti-MEM I培养基清洗细胞3次。将转染混合液加入细胞板中,每孔100μL,轻轻混匀。空质粒以200μLOpti-MEM I无血清培养基代替。用Opti-MEM I培养基补液到总体积500μL,培养12 h。用10%1640培养液洗细胞3遍,加入1m L 1640完全培养基继续培养。
1.2.4 Transwell侵袭小室实验
HUVEC细胞分别转染p65cDNA及GV141空载体24 h后,加入80μg/m L rhKal继续培养20 h后,制备成单细胞悬液,调整浓度为2.5×105个/m L;加入Thincert侵袭小室,培养20 h后,取出Thincert小室,擦除膜表面细胞;沿小室边缘将膜切下,膜下表面向上放入24孔培养板的孔中;甲醇∶冰醋酸(3∶1)固定10min,10%姬姆萨染液染色15~30m in;漂洗干净后随机选取6个视野计数细胞(呈紫色,200×)。
1.2.5 Western blotting实验
取20μL蛋白质样品,进行12%SDS-PAGE电泳;半干式电转移法将凝胶上的蛋白质转移到NC膜上,恒流1 mA/cm2,3 h;将NC膜在丽春红中染色30 s,dH2O脱色至有清晰条带,将右上角剪去以区分蛋白面;将NC膜用封闭液室温封闭1.5 h;PBST洗膜2~3次,每次5~10min。加入一抗,4℃过夜或37℃1.5 h;PBST洗膜3~5次,每次5~10min。加入二抗,室温孵育1h;PBST洗膜3~5次,每次5~10m in。在暗室(允许红色光源)中,将NC膜蛋白面朝上放在保鲜膜上,向表面均匀滴加发光液,反应5min;将NC膜包裹在保鲜膜中,剪下一块等大的X光胶片,放置夹片盒曝光0.5~5min(视条带光强度而定);取出X光胶片,在显影剂中漂至条带出现,放到停影液(5%冰醋酸)中停影1min,用流水冲洗1min后在定影剂中漂至背景部分透明,最后流水冲洗20m in固定影像。
1.2.6统计分析
结果以±S表示(n=3),采用Dunnett’s t-检验进行统计分析。*P<0.05,**P<0.01。
2 结果
2.1 rhKal蛋白的纯化和鉴定
重组Kallistatin蛋白通过疏水作用和亲和层析纯化后,SDS-PAGE电泳后如图1A所示。为了进一步确定纯化后的蛋白,Western blotting对重组Kallistatin进行鉴定,实验结果表明在50 ku左右发现明显条带(图1B)。通过蛋白定量计算,1 L的发酵液里可以纯化出20mg的重组Kallistatin蛋白。
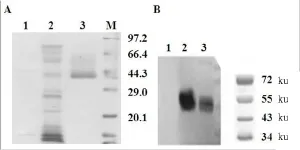
图1 rhKal蛋白的检测和鉴定Fig 1 Characterization of expressed rhKalby SDS-PAGE andwestern blottingA为SDS-PAGE染色后考马斯亮蓝染色:1—肝素柱上样穿透峰;2—0.1mol/L NaCl洗涤峰;3—0.5mol/L NaCl洗脱峰;M—蛋白Marker。B为Western-bloting检测rhKal蛋白:1—野生型酵母发酵液;2—原液1;3—原液2。
2.2表达载体构建及验证
提取总RNA后,通过PCR扩增获得全长为1657 bp的目的基因,琼脂糖电泳观察分子量大小。如下图所示(图2)。
重组质粒GV 141-p65经过PCR扩增后,0.8%琼脂糖电泳可得到891 bp的目的条带,证明p65已经成功插入到GV141载体的多克隆位点中(图3)。测序结果也表明目的片段插入方向正确,而且与GenBank中的序列(NM_021975)完全相同,证明重组质粒GV141-p65构建成功。
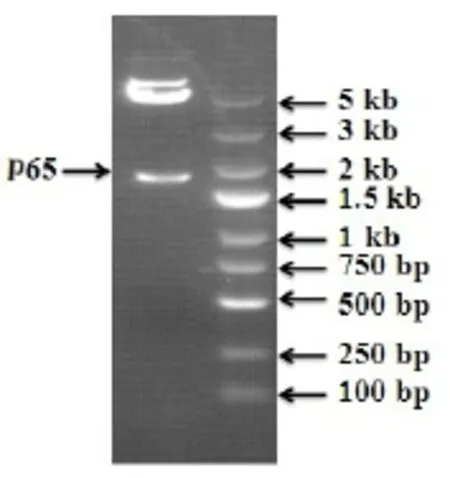
图2 p65电泳图Fig 2 p65 geneelectrophoresis
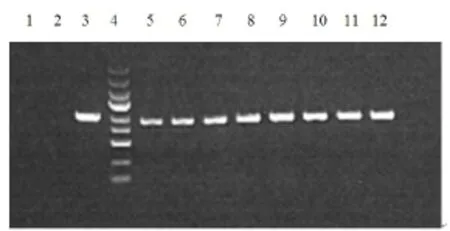
图3 构建后p65 PCR鉴定Fig 3 The identification of p65 gene in the restructuring plasmid1—阴性对照(ddH2O);2—阴性对照(空载自连对照组);3—阳性对照(GAPDH);4—Marker自上而下依次为5 kb,3 kb,2 kb,1.5 kb,1 kb,750 bp,500 bp,250 bp,100 bp;5-12:RELA 1-8号转化子。
2.3真核表达质粒p65cDNA瞬时转染细胞
利用不同浓度配比的转染复合物分别转染HUVEC细胞后,Western blotting法检测结果显示,瞬时转染p65cDNA可以显著增加HUVEC细胞p65蛋白表达量。如图4所示。
2.4过表达p65对rhKal抑制HUVEC细胞侵袭作用的影响
为了进一步探明p65是否逆转rhKal对HUVEC细胞的侵袭抑制作用,我们在HUVEC细胞分别转染p65cDNA及GV141空载体24 h后,加入80μg/m L rh-Kal继续培养20 h,结果显示,rhKal可以显著抑制转染空质粒载体细胞的侵袭,但过表达p65的实验组细胞侵袭抑制率明显低于空白载体对照组,差异具有统计学意义。说明p65过表达可以逆转rhKal对HUVEC细胞体外侵袭的抑制作用。如图所示(图5)。
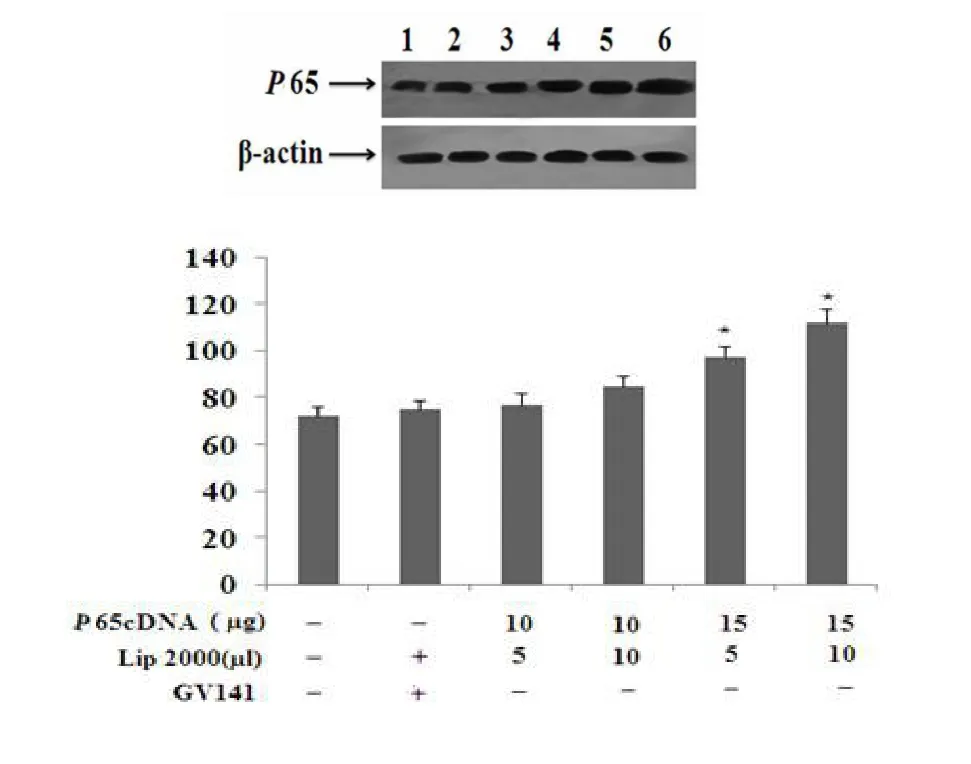
图4 转染后p65蛋白的鉴定Fig 4 Identification of p65 protein in the restructuring plasm id(The p65 protein in HUVECwasdetected byWestern blotting after transfected w ith various concentration of transfectcomplex)(Western blotting法检测不同浓度配比的转染复合物转染HUVEC细胞后胞内p65蛋白的表达)
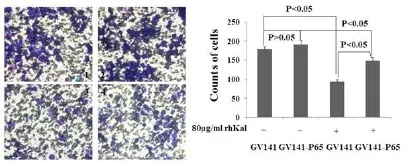
图5 过表达p65逆转rhKal对HUVEC细胞侵袭抑制作用(p65表达载体和空质粒转染后的细胞分别给予rhKal处理20 h)Fig 5 p65 gene reverse the inhibition of invasion for HUVEC cellafter treated w ith rhKal(The cells transfected w ith expression vectorsand empty vectorwere treated w ith rhKal for20 h)
2.5 过表达p65对rhKal对血管生成相关基因抑制作用的影响
本实验将重点考察过表达p65对rhKal对血管生成相关基因抑制作用的影响。结果表明:rhKal可以显著抑制转染组和空白载体对照组MMP-9、MMP-2、VEGF蛋白的表达,但对p65过表达组蛋白表达抑制率显著低于空载体对照组,具有统计学意义(图6)。说明了p65过表达可以抵抗rhKal对NF-κB信号通路下游靶基因的抑制作用。
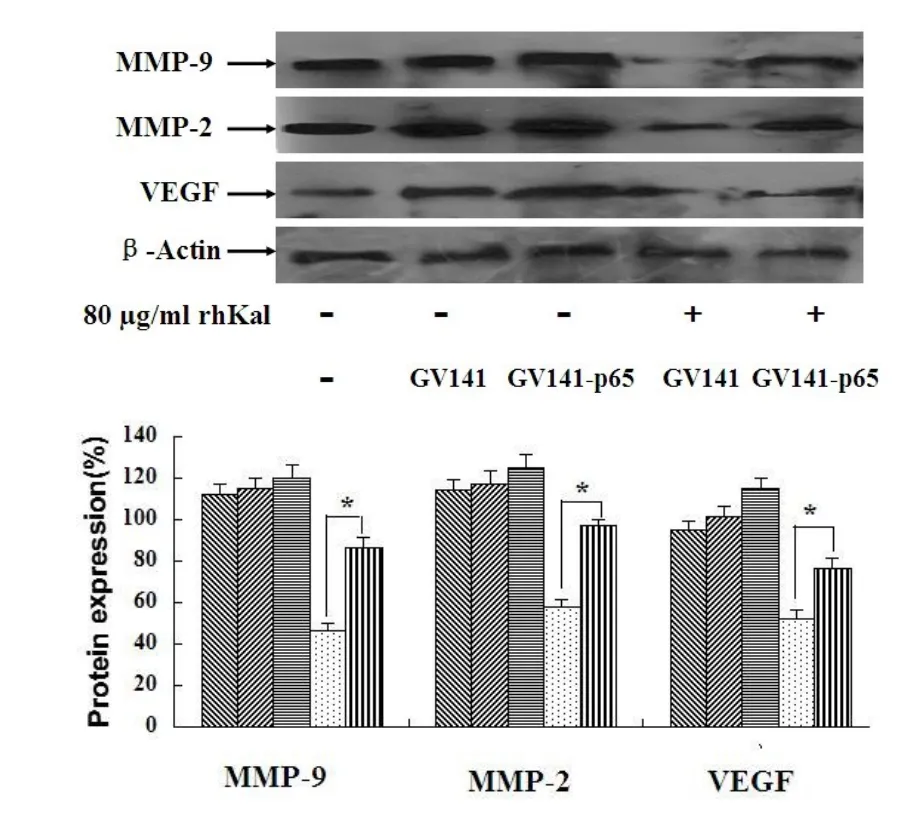
图6 p65基逆转rhKal对NF-κB信号通路下游靶基因抑制作用(p65表达载体和空质粒转染后的细胞分别给予rhKal处理48 h)Fig 6 p65 gene reverses the inhibition of downstream genesof NF-κB signaling pathway by rhKal(The cells transfected w ith expression vectorsand empty vectorwere treatedw ith rhKal for48 h)
3 讨论
NF-κB作为一种重要的核转录因子,可以上调许多与血管生成相关的因子的表达和功能,从而增强细胞的粘附、侵袭及血管生成[14]。尤其在肿瘤的血管生成中,NF-κB通过调节VEGF、b-FGF等血管生成调节因子的表达影响了肿瘤血管的发生、生成[15-17]。因此,NF-κB在血管的发生发展中的作用十分重要,其功能有待于进一步探索。
本研究首先成功表达了重组Kallistatin蛋白,同时构建了p65基因的表达载体,并通过脂质体转染细胞,在细胞内过表达。转染后的细胞,当给予rhKal蛋白后,p65cDNA转染组和阴性对照组的侵袭力明显被抑制,但转染p65cDNA组细胞的侵袭力显著高于转染空载体质粒组,表明p65过表达可以对抗rhKal对HUVEC细胞体外侵袭作用。
p65不仅参与细胞凋亡过程,同时增强细胞穿越基质膜的趋化能力,促使VEGF、MMP-2、MMP-9等表达水平的上升。肿瘤细胞大量合成的VEGF,与VEGFR-2受体结合,促进血管生成。MMP-2、MMP-9过表达及有效激活可以加快肿瘤细胞介导的细胞外基质降解,促进内皮细胞的增殖、形成血管,MMP-2、MMP-9在各种实体瘤的发展进程中起到了重要的作用。为了说明以上p65逆转rhKal对细胞侵袭抑制作用的分子机制,通过Western blotting实验检测了rhKal蛋白对转染质粒载体细胞血管生成相关的蛋白,结果表明,p65胞内过表达明显扭转了rhKal对血管生成相关蛋白的抑制作用,同时证明了NF-κB信号通路在其抗血管生成活性中的重要意义。
以上实验结果共同提示,rhKal蛋白具有显著抑制血管生成的作用,并对NF-κB信号通路具有抑制作用,进而抑制了其下游基因产物的合成。p65的过表达逆转了rhKal的血管生成抑制作用,其分子机制可能与调控NF-κB信号通路下游靶蛋白相关,同时也表明了p65在血管形成中的关键作用,具有明显的临床意义。
[1]Wang M Y,Day J,Chao L,et al.Human kallistatin,a new tissue kallikrein-binding protein:purification and characterization[J]. Adv Exp Med Biol,1989,247:1-8.
[2]Chao J,Stallone JN,Liang Y M,et al.Kallistatin is a potent new vasodilator[J].JClin Invest,1997,100(1):11-17.
[3]Shen B,HagiwaraM,Yao Y Y,etal.Salutary effectof kallistatin in salt-induced renal injury,inflammation,and fibrosis via antioxidative stress[J].Hypertension,2008,51(5):1358-1365.
[4]Wang CR,Chen SY,Wu C L,etal.Prophylactic adenovirus-mediated human kallistatin gene therapy suppresses rat arthritis by inhibiting angiogenesis inflammation[J].Arthritis Rheum,2005,52 (4):1319-1324.
[5]M iao R Q,Agata J,Chao L,et al.Kallistatin is a new inhibitor of angiogenesis and tumor grow th[J].Blood,2002,100(9):3245-3252.
[6]WolfW C,Evans D M,Chao L,etal.A synthetic tissue kallikrein inhibitor suppresses cancer cell invasiveness[J].Am Pathol, 2001,159(5):1797-1805.
[7]Jiang X,Li H,Qiao H,et al.Combining kallistatin gene therapy andmeloxicam to treathepatocellular carcinoma inmice[J].Cancer Sci,2009,100(11):2226-2233.
[8]Shiau A L,Teo M L,Chen S Y,et al.Inhibition of experimental lung metastasis by systemic lentiviral delivery of kallistatin[J]. BMCCancer,2010,10(1):245.
[9]Huang K F,Huang X P,Xiao G Q,etal.Kallistatin,anovelanti-angiogenesis agent,inhibitsangiogenesis via inhibition of the NF-kB signaling pathway[J].Biomedicine&Pharmacotherapy,2014,68: 455-461.
[10]Huang K F,Yang H Y,Xing Y M,etal.Recombinant human kallistatin inhibits angiogenesis by blocking VEGF signaling pathway[J].JCell Biochem,2014,115(3):575-584.
[11]Basak S,Hoffmann A.Crosstalk via the NF-κB signaling system[J].CytokineGrow th FactorRev,2008,19(3/4):187-197.
[12]Nolan G P,Ghosh S,Liou H C,et al.The DNA binding and IκB inhibition of the cloned p65 subunitof NF-κB,a rel-related polypeptide[J].Cell,1991,64(5):961-969.
[13]Van ED,Engist B,NatoliG,etal.Twomodes of transcriptional activation atnative promotersby NF-κB p65[J].Plos Biol,2009, 7(3):e73.
[14]YiCA,Lee K S,Kim EA,etal.Solitary pulmonary nodules:dynam ic enhanced multi-detector row CT study and comparison w ith vascular endothelial grow th factor and microvessel density[J].Radiology,2004,233(8):191-199.
[15]Valera FC P,Queiroz R,ScrideliC,etal.Expression of transcription factors NF-κB and AP-1 in nasal polyposis[J].Clin Exp A llergy,2008,38:579-585.
[16]Chen Y,Kijlstra A,Chen Y,et al.IL-17A stimulates the production of inflammatory mediators via Erk1/2,p38 MAPK,PI3K/ Akt,and NF-κB pathways in ARPE-19 cells[J].Molvis,2011, 17:3072-3077.
[17]Sung B,Pandey M K,Ahn K S,etal.Anacardic acid(6-nonadecyl salicylic acid),an inhibitor of histone acetyltransferase,suppressesexpression of nuclear factor-kappa B-regulated gene products involved in cell survival,proliferation,invasion,and inflammation through inhibition of the inhibitory subunitof nuclear factor-kappa B alpha kinase,leading to potentiation of apoptosis[J].Blood,2008,111:4880-4891.
NF-κB-p65 signalingmolecules involved in the inhibition by kallistatin on the invasion of human umbilical vein endothelial cells
HUANG Kai-fei1,2
(1.Xiamen Medicine Research Institute,Xiamen 361008;2.Xiamen Research Centerof the Southern Ocean,Xiamen 361008,China)
The effection and themolecularmechanism of recombinant Kallistatin(rhKal)on the anti-invasion of endothelial cell were studied by transfected NF-κB-p65 eukaryotic expression plasmid.HUVEC cellswere transfected by NF-κB-p65 eukaryotic expression vector which was constructed by genetic recombination technology.The expression of p65 protein was also detected by Western blotting.The invasion of transfected HUVEC cells was detected by Transwell chamber after treated w ith recombinant Kallistatin.The expression of invasion associated proteinwas detected byWestern blotting in endothelial cellswhich were transfected by NF-κB-p65 expression vector.The results showed that the expression of p65was significantly increased after transfected w ith NF-κB-p65 eukaryotic expression vector.Overexpression of p65 gene can reverse the inhibitory of invasion on HUVEC cells by rhKal. Overexpression of p65 gene can significantly increase downstream targetgenes of NF-κB signaling pathway after treated w ith rhKal. In conclusion,This study showed that the recombinant Kallistatin could inhibit HUVEC cell invasion in vitro,and itsmolecular mechanism may be related to the NF-κB signaling pathway.
kallistatin;HUVEC;NF-κB;invasion;signaling pathway
R363.1
A
2095-1736(2015)03-0004-05
10.3969/j.issn.2095-1736.2015.03.004
2014-10-23;
2014-11-30
国家自然科学基金(81271691);福建省卫生厅青年项目(2013-2-110);厦门市科技计划项目(3502Z2013043)
黄恺飞,博士,主要从事药物研发工作,E-mail:hkf5306@163.com。

