腹膜透析患者心血管钙化的发生率及影响因素
尹飞挺 周婷婷 周 岩 周玉超 刘志红 俞雨生
腹膜透析患者心血管钙化的发生率及影响因素
尹飞挺 周婷婷 周 岩 周玉超 刘志红 俞雨生
目的:调查腹膜透析(PD)患者心血管钙化的发生率并分析影响因素。 方法:选取2013年12月至2014年8月的PD患者,测定其血清钙、磷、全段甲状旁腺激素(iPTH),评估患者透析状态;应用多层螺旋CT计算冠状动脉钙化积分(CACS,Agatston方法),腹部侧位平片计算腹主动脉钙化积分(AACS,Kauppila方法),超声心动图检测心脏瓣膜钙化(CVC)。采用 Logistic回归分析心血管钙化的相关危险因素。 结果:150例入选 PD患者血清校正总钙、血磷、血 iPTH 的达标率分别为58.0%、46.0%、23.3%(参照中华医学会肾脏病学分会发布的指导)。共计57.3%患者发生钙化,其中CAC、AAC、CVC的发生率分别为40.7%、32.7%、27.3%。任意部位钙化的发生率(除个别组别外) 均随着年龄、透析龄增长而增加。Logistic回归分析显示高龄(OR=1.10)、透析龄长(OR=1.03)是 CAC 的独立危险因素,尿素清除指数(Kt/V)(OR=0.27)是其保护性因素;高龄(OR=1.07)、高磷(OR=1.94)是 CVC的独立危险因素。 结论:尽管本组PD患者有较低的心血管钙化发生率(CAC 40.7%,AAC 32.7%,CVC 27.3%),但高磷血症、iPTH异常仍很突出。高龄、透析龄长、高磷仍是钙化的传统危险因素。
腹膜透析 心血管钙化 发生率 影响因素
随着腹膜透析(PD)技术不断成熟,患者的透析龄及生存时间逐渐延长,心血管钙化成为其主要的并发症。2009年,改善全球肾脏病预后组织(KDIGO)提出慢性肾脏病矿物质与骨异常(CKD-MBD)的概念[1],无论是血管钙化(VC)还是瓣膜钙化均可导致心血管疾病(CVD)高发,而 CVD是 CKD患者死亡的主要原因[2-3];因此 KDIGO建议,当CKD 3~5D期患者合并血管和(或)瓣膜钙化时,其CVD风险列为最高级别[1]。本研究为横断面研究,参照中华医学会肾脏病学分会《慢性肾脏病矿物质和骨异常诊治指导》观察PD患者的血清钙、磷、全段甲状旁腺激素(iPTH)的达标率及冠状动脉钙化(CAC)、腹主动脉钙化(AAC)、心脏瓣膜钙化(CVC)的发生率[4],并分析钙化的相关影响因素。
对象和方法
研究对象 选取2013年12月至2014年08月在南京军区南京总医院腹膜透析中心的PD患者。入选标准:(1)≥18周岁,性别、民族不限;(2)正在接受稳定 PD治疗≥3个月的终末期肾病(ESRD)患者;(3)患者自愿加入本项研究并签署知情同意书。排除标准:(1)急性肾损伤;(2)活动性炎症性疾病;(3)甲状旁腺切除;(4)其他影响到体内钙、软组织钙化的伴随疾病(如恶性肿瘤);(4)妉、瓣膜钙化检 重的周围血管病变)。
一般诊疗及透析方式 入选患者设立目标体重并保持体重稳定。控制血压≤140/90 mmHg,同时限制食盐摄入量。血脂异常可采用他汀、贝特类进行干预,糖尿病患者予皮下注射胰岛素。根据患者腹膜平衡试验(PET)、透析充分性、心功能情况选择采用持续不卧床腹膜透析(CAPD)或者日间不卧床腹膜透析(DAPD)模式、不同浓度的乳酸葡萄糖透析液(1.5%、2.5%、4.25%)及个体化透析剂量,并根据患者血清钙浓度、是否使用碳酸钙采用PD2(钙离子浓度1.75 mmol/L)、PD4(钙离子浓度1.25 mmol/L)透析液。
观察指标
一般情况、病史及伴随用药 记录患者年龄、性别、透析龄、ESRD病因。记录目前用药情况(降压药物、他汀类、磷结合剂、活性维生素D)及剂量。
物理体检 包括身高,体重,体质量指数(BMI),体表面积(BSA)[5];收缩压(SBP),舒张压(DBP),脉压差(PP=SBP-DBP),平均动脉压(MAP=DBP+PP/3),踝部收缩压,计算踝臂指数(ABI)。
实验室检查 矿物质指标包括血清钙、磷、iPTH、25(OH)D3,血清校正总钙(mg/dl)的计算公式=总钙(mg/dl)+0.8×[4.0-血清白蛋白(g/dL)],钙(mmol/L)=钙(mg/d1)×0.249 5;代谢指标包括血糖、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)、三酰甘油(TG),血清白蛋白(Alb)、铁蛋白、尿酸、尿素氮、肌酐、碱性磷酸酶、同型半胱氨酸、高敏C反应蛋白(hsCRP),血常规中的血红蛋白(Hb)、红细胞压积(Hct)。
影像学检查 (1)胸部螺旋CT检测CAC(Agatston method):冠状动脉钙化积分(CACS)由左主干、左前降支、左回旋支、右冠状动脉病变的分值相加获得[6],CACS>0即认为存在钙化。(2)腹部侧位平片检测AAC(Kauppila 24点动脉钙化评分法):0分(无主动脉钙化沉积),1分(钙化沉积<动脉壁纵轴长度的1/3),2分(1/3动脉壁纵轴长度≤钙化沉积<2/3动脉壁纵轴长度),3分(钙化沉积≥2/3动脉壁纵轴长度);每个椎体水平范围为0~6分,腹主动脉钙化评分(AACS)范围为0~24分,AACS>0即认为存在钙化[7]。 (3)二维M型彩色超声心动图测量CVC:在二尖瓣主动脉瓣有超过1 mm的强回声,即认为存在 CVC;由于现今尚无量化瓣膜钙化的工具,因而仅能评价有或无。计算左室质量(LVM,g)、左室质量指数(LVMI=LVM/BSA,g/m2);当LVMI>125 g/m2(男性)或>120 g/m2(女性)时诊断左心室肥厚(LVH)[5,8]。
透析状况 记录患者的透析模式、透析液剂 rGFR)、尿量(UV)、超滤量、液体清除量(UV与超滤量总和)、尿素清除指数(Kt/V)、肌酐清除率(Ccr)、标准蛋白分解率(nPCR)。
统计方法 采用SPSS 19.0软件进行统计学分析。正态计量资料以均数±标准差表示;偏态资料采用中位数(四分位间距)表示;分类变量采用频数和频率表示。对应分类变量,组间比较采用卡方检验(列联表任何一个单元格的理论频数<5时,用Fisher精确检验代替卡方检验)。对于连续变量,选择t检验(或秩和检验)进行组间比较。心血管钙化的相关影响因素通过Logistic回归进行分析。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般情况、物理体检及伴随用药 共入组150例PD患者,ESRD 病因中慢性肾小球肾炎129例(86.0%),糖尿病肾病(DN)6例(4.0%),高血压肾损害5例(3.3%),狼疮性肾炎4例(2.7%),多囊肾病3例(2.0%),间质性肾炎2例(1.3%),过敏性紫癜性肾炎1例(0.7%)。其中男性70例(46.7%),女性80例(53.3%),平均年龄(46.5±13.1)岁,有107例(71.3%)患者使用碳酸钙,72例(48.0%)患者使用活性维生素 D,30例(20.0%)使用碳酸镧(表1)。
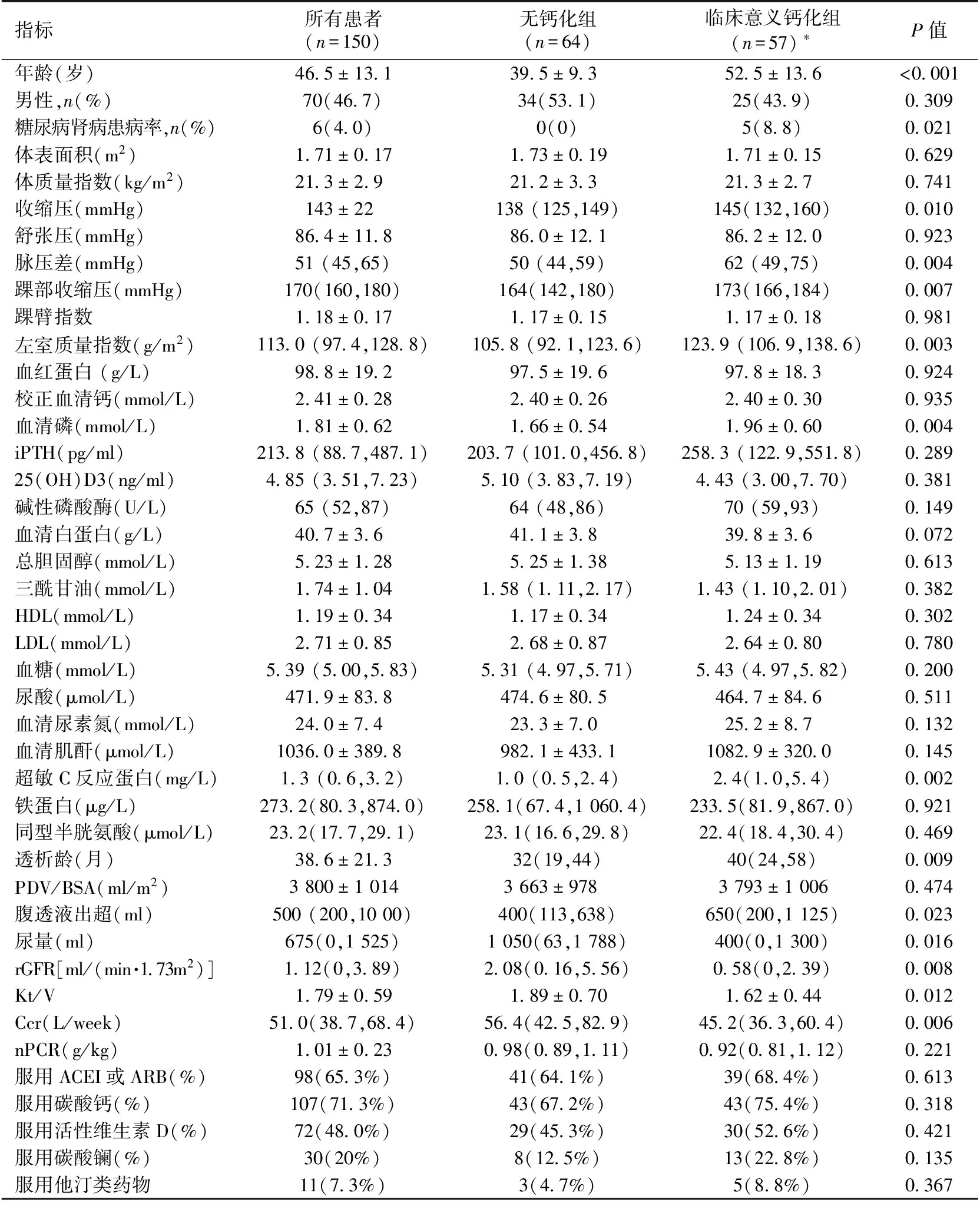
表1 PD患者的临床资料及无钙化组与临床意义钙化组的比较
LDL:低密度脂蛋白胆固醇;PDV /BSA:单位体表面积透析剂量;rGFR:残余肾小球滤过率;Kt/V:尿素清除指数;Ccr:肌酐清除率;nPCR:标准蛋白分解率;ACEI:血管紧张素转换酶抑制剂;ARB:血管紧张素受体拮抗剂;*:包括下列任意1种或多种情况:CACS>100、AACS≥5、CVC:心脏瓣膜钙化;iPTH:全段甲状旁腺激素;HDL:高密度脂蛋白胆固醇
实验室指标 入选患者的Hb平均(98.8±19.2) g/L,Alb(40.7±3.6) g/L,血糖5.39(5.00,5.83) mmol/L(表1)。
矿物质指标 依据血清校正总钙、血磷、血 iPTH的目标值分别为2.1~2.5 mmol/L、1.13~1.78 mmol/L、150~300 pg/ml[4],计算出150例PD患者血清校正总钙、血磷、血iPTH的达标率分别为58.0%(87例)、46.0%(69例)、23.3%(35例)。而高钙、高磷、高iPTH分别为33.3%(50例)、44.0%(66例)、38.0%(57例),低钙、低磷、低 iPTH分别为8.7%(13例)、10.0%(15例)、38.7%(58例)。
透析状态 150例PD患者中16例(10.7%)采用CAPD模式,133例(88.7%)采用DAPD模式,1例(0.7%)采用自动化腹膜透析(APD);有6例(4%)患者使用PD2透析液,143例(95.3%)患者使用PD4透析液,1例(0.7%)患者使用 PD2+PD4透析液。入选患者平均透析龄为(38.6±21.3)月;其中透析龄≤18月:26例(17.3%),19~36月:46例(30.7%),37~60月:61例(40.7%),>60月:17例(11.3%)。rGFR为1.12(0,3.89) ml/(min·1.73m2),Kt/V平均为1.79±0.59(表1)。
心血管钙化的发生率及分布发生率 入选患者中共有86例(57.3%)患者发生心血管钙化,而CAC、AAC、CVC的发生率分别为40.7%、32.7%、27.3%。在 CVC中,仅主动脉瓣、仅二尖瓣、主动脉瓣及二尖瓣联合钙化的发生率分别为12.0%、7.3%、8.0%(表2)。
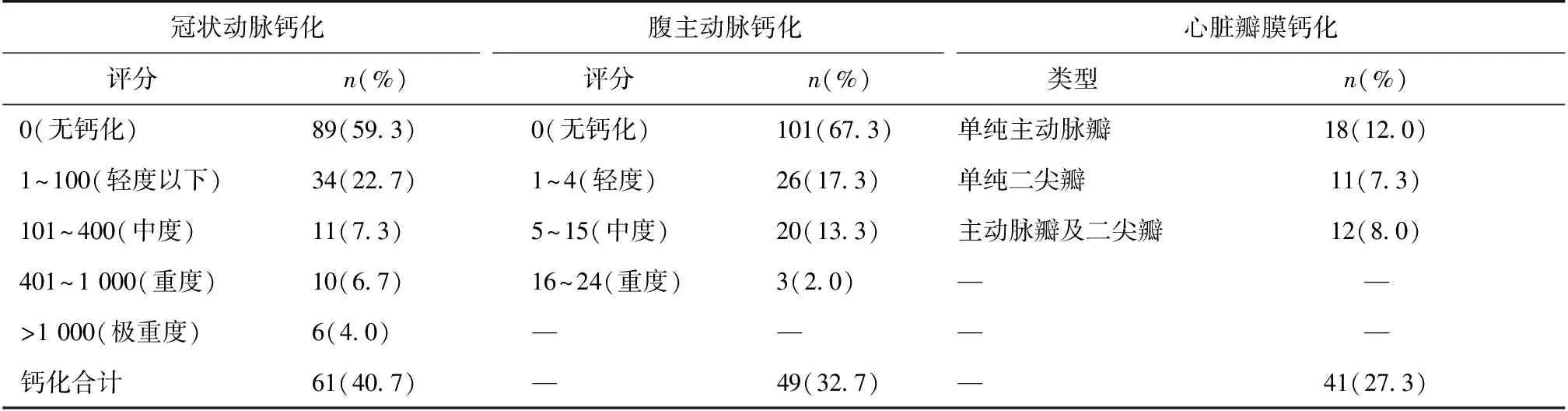
表2 腹膜透析患者钙化的发生率及严重程度
钙化部位 仅有 CAC 或 AAC 或 CVC的发生率分别为12.0%(18例)、6.7%(10例)、7.3%(11例),而在上述任意两个部位钙化中,同时具有CAC、AAC 钙化的发生率最高为11.3%(17例),而CAC、AAC、CVC同时存在的发生率为12.0%(表3)。
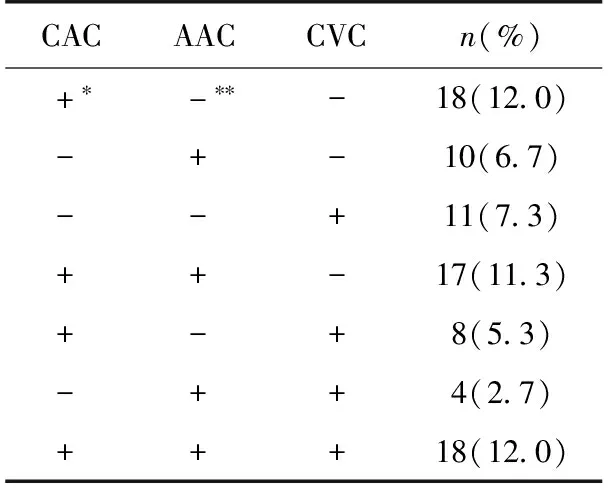
表3 PD患者钙化部位分布
CAC:冠状动脉钙化;AAC:腹主动脉钙化;CVC:心脏瓣膜钙化;*:该部位存在钙化;**:该部位无钙化
不同性别、年龄和透5%(50例)据年龄分为五组:<40岁、40~49岁、50~59岁、60~69岁、≥70岁,结果显示仅40~49岁患者瓣膜钙化率低于<40岁患者,其余组别的CAC、AAC、CVC发生率及总体钙化率均随年龄增加而增加,而≥70岁的患者总体钙化率甚至达100%。入选患者分为透析龄≤18个月、19~36个月、37~60个月、>60个月四组,结果显示除个别组别外,CAC、AAC、CVC的发生率及总体钙化率也随着透析龄增加而增加,而透析龄>60个月的患者总体钙化率达88.2%,明显高于其他组别(表4)。CAC、AAC、CVC同时存在的患者中:年龄<40岁、40~49岁、50~59岁、60~69岁、≥70岁的钙化率分别为0、2.2%、17.2%、33.3%、63.6%;透析龄≤18个月、19~36个月、37~60个月、>60个月的钙化率分别为0、10.9%、11.5%、35.3%。提示复合钙化也随着年龄、透析龄的增加而增加(CAC合并CVC、AAC合并CVC仅8例、4例患者,故未分组计算)。
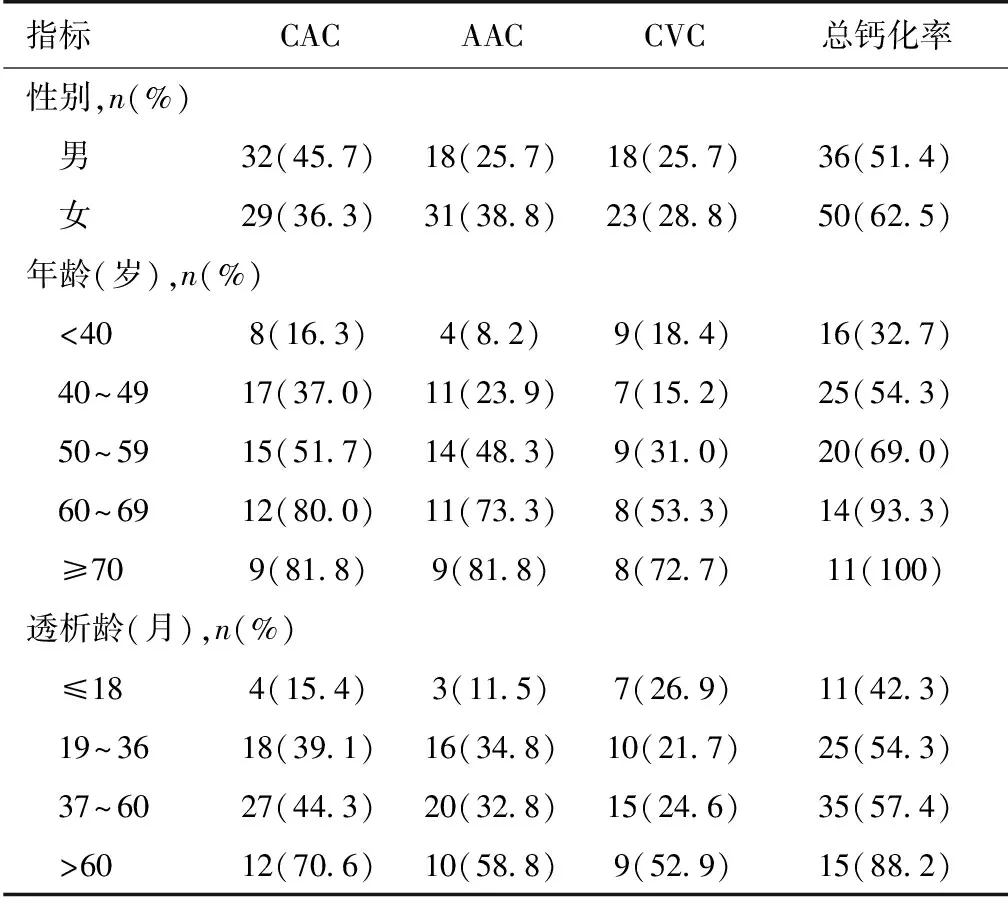
表4 不同性别、年龄和透析龄的钙化分布*
CAC:冠状动脉钙化;AAC:腹主动脉钙化;CVC:心脏瓣膜钙化;*:钙化分布中的百分数=每组的钙化人数/每组的总人数
有临床意义钙化组与非钙化组的比较 由于轻度以下CAC、轻度AAC发生CVD的风险非常低,目前认为CACS>100、AACS≥5有临床意义[9-10]。150例患者中,将无任何钙化的64例患者与有临床意义钙化(包括下列任意1种或多种情况:CACS>100、AACS≥5、CVC)的57例患者进行人口学数据、物理及辅助检查指标、透析参数、用药情况的比较。结果显示,两组存在年龄、DN患病率、SBP、PP、踝部收缩压、LVMI、血清磷、hsCRP、透析龄、透析液超滤量、UV、rGFR、Kt/V、Ccr的差异(表1)。
心血管钙化的相关因素的分析 以 PD患者是否存在临床意义钙化(CACS>100或AACS≥5或CVC)作为因变量,首先将其分别与人口学数据、用药情况、物理及辅助检查指标、透析参数(作为自变量)进行单变量 Logistic 回归分析,然后选择P<0.15的自变量(CAC:年龄、透析龄、铁蛋白、LVMI、LVH、Kt/V、使用ACEI或ARB,CVC:年龄、性别、身高、BMI、血磷、25(OH)D3、尿酸、同型半胱氨酸、nPCR、使用碳酸镧)分别纳入 CAC、CVC进行多变量Logistic回归进行分析;结果显示年龄(OR=1.10)、透析龄(OR=1.03)是 CAC的独立危险因素,而 Kt/V(OR=0.27)是其保护因素,年龄(OR=1.07)、血磷(OR=1.94)是 CVC的独立危险因素;且存在统计学意义。但 AAC的单变量Logistic回归模型中,没有P<0.15的自变量,因此无任何变量纳入 AAC的多变量Logistic回归模型(表5)。
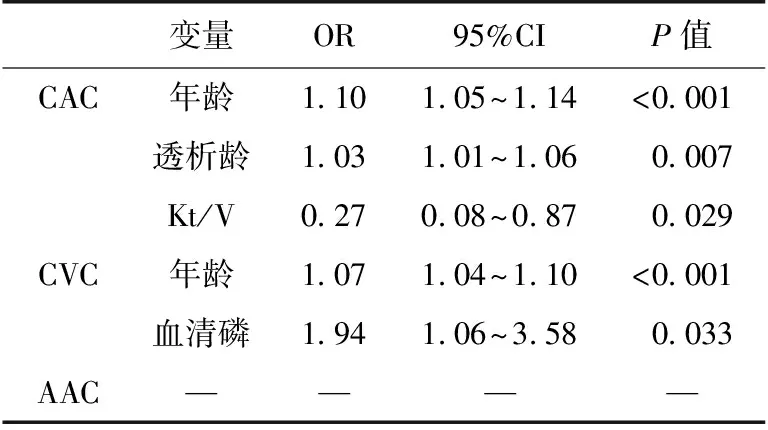
表5 心血管钙化的多变量Logistic回归
CAC:冠状动脉钙化;AAC:腹主动脉钙化;CVC:心脏 瓣膜钙化
讨 论
目前绝大多数的研究表明,>80%的PD患者合并血管钙化,其中瓣膜钙化的发生率>33%[2]。Janicka等[11]研究发现CAC的发生率为66%,且在这些患者中39%合并CVC。Martino等[12]观察证明仅有20.3%的 PD患者无AAC,且AAC是CVD的独立预测因素。Avila-Díaz等[13]调查显示 PD患者 CVC的发生率为46%。本研究中57.3%的PD患者发生心血管钙化,CAC、AAC、CVC的发生率分别为40.7%、32.7%、27.3%,低于多数以往研究。张炯等[14]证明PD患者使用低钙透析液,能有效预防高钙血症,从而可能减少心血管钙化。自2007年起,本中心开始增加PD4透析液的使用,可能是本中心心血管钙化发生率较低的重要原因。
VC是ESRD患者CVD的主要病因[15],VC的存在和严重程度能够预测CVD的发生率和病死率,而CVD是PD患者技术失败及死亡的主要原因[16]。年龄、透析龄、炎症、糖尿病、血脂异常、高磷血症和异常钙负荷是CKD患者进行性 VC的主要危险因素[17]。本研究显示任意部位钙化的发生率(除个别组别外) 均随着年龄、透析龄增加而增加,≥70岁的患者总体钙化率甚至达100%,而透析龄>60个月的患者总体钙化率也达88.2%;且高龄是CAC(OR=1.10)及CVC(OR=1.07)的独立危险因素,透析龄长是CAC的独立危险因素(OR=1.03)。Asci等[18]研究发现,有CAC与无CAC患者的年龄分别为(63±12岁vs47±15岁),提示高龄与CAC相关。Wang等[19]对117例PD患者研究表明高龄是二尖瓣(OR=3.179)及主动脉瓣(OR=1.965)钙化的独立危险因素。Gallieni等[20]进行世界上最大的PD样本量的心血管钙化的前瞻性研究显示基线时无血管钙化的患者占23.4%,而36个月随访后,仍无血管钙化的患者仅占9.9%,且存在多支动脉、多个部位钙化,提示随着透析时间的延长,血管钙化的进展。
现有的研究已经证实高磷血症增加瓣膜钙化的风险[21]。Rroji 等[22]研究证实血磷与PD患者的瓣膜钙化有很强的相关性(Kendall’s 系数=0.28)。Linefsky等[23]曾对1 938例患者进行研究发现,血清磷每升高0.125 mmol/L,即有更大风险的瓣膜钙化(OR值=1.12)。高磷血症被认为是CKD患者心血管钙化的发生、发展的始动和关键因素,高磷血症通过多种可能机制触发和促进了钙化的进展[23-24]。
本研究显示Kt/V是CAC的保护因素(OR=0.27),且临床意义钙化组与无钙化组Kt/V存在统计学差异。推测良好的透析充分性能更有效地清除磷、保持液体平衡等,使得 PD患者不宜发生CAC[25]。由于入选PD患者中AAC >4分的仅占15.3%,可能导致其 Logistic 回归模型中无有意义的变量。
本文的局限性在于单中心、横断面研究,无法对心血管钙化的发生率、相关因素、对CVD的影响、预后进行长期观察;由于DN患者较少,未能分析 DN患者与非DN患者MBD的差别。
综上所述,尽管本中心 PD患者有较低的心血管钙化的发生率;但高磷血症、iPTH异常仍很突出,CKD-MBD仍是PD患者的主要合并症之一,需要我们更有效地控制其危险因素。
1 Kidney Disease Improving Global Outcomes (KDIGO) CKD-MBD Work Group.KDIGO Clinical Practice Guideline for the Diagnosis,Evaluation,Prevention,and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD).Kidney Int Suppl,2009,(113):S1-S130.
2 Wang AY.Calcium balance and negative impact of calcium load in peritoneal dialysis patients.Perit Dial Int,2014,34(4):345-352.
3 Collins A J,Foley R N,Herzog C,et al.US Renal Data System 2012 annual data report.Am J Kidney Dis, 2013, 61(1 Suppl 1):A7.
4 王莉,李贵森,刘志红.中华医学会肾脏病学分会《慢性肾脏病矿物质和骨异常诊治指导》.肾脏病与透析肾移植杂志,2013,22(6):554-559.
5 胡咏梅,武晓洛,胡志红,等.关于中国人体表面积公式的研究.生理学报,1999,5(1):45-48.
6 Agatston AS,Janowitz WR,Hildner FJ,et al.Quantification of coronary artery calcium using ultrafast computed tomography.J Am Coll Cardiol,1990,15(4):827-832.
7 Kauppila LI,Polak JF,Cupples LA,et al.New indices to classify location,severity and progression of calcific lesions in the abdominal aorta:a 25-year follow-up study.Atherosclerosis,1997,132(2):245-250.
8 Lang RM,Bierig M,Devereux RB,et al.Recommendations for chamber quantification:a report from the american society of echocardiography’s guidelines and standards committee and the chamber quantification writing group,developed in conjunction with the european association of echocardiography,a branch of the european society of cardiology.J Am Soc Echocardiogr,2005,18(12):1440-1463.
9 Xiao DM,Wu Q,Fan WF,et al.Effect of serum FGF-23,MGP and fetuin-A on calcium-phosphate metabolism in maintenance hemodialysis patients.Hemodial Int,2013,17(4):483-492.
10 An WS,Lee SM,Park TH,et al.Association between diastolic dysfunction by color tissue doppler imaging and vascular calcification on plain radiographs in dialysis patients.Kidney Blood Press Res,2012,35(6):619-626.
11 Janicka L,Duma D,Grzebalska AM,et al.Analysis of some risk factors of coronary and valvular calcification in peritoneal dialysis.Dialysis & Transplantation,2011,40(3):118-122.
12 Martino F,Di Loreto P,Giacomini D,et al.Abdominal aortic calcification is an independent predictor of cardiovascular events in peritoneal dialysis patients.Ther Apher Dial,2013,17(4):448-453.
13 Avila-Díaz M,Mora-Villalpando C,Prado-Uribe Mdel C,et al.De novo development of heart valve calcification in incident peritoneal dialysis patients.Arch Med Res,2013,44(8):638-644.
14 张炯,俞雨生,胡伟新等.不同腹膜透析液对钙磷代谢的影响.肾脏病与透析肾移植杂志,2007,16(4):329-335.
15 Mizobuchi M,Towler D,Slatopolsky E.Vascular calcification:the killer of patients with chronic kidney disease.J Am Soc Nephrol,2009,20(7):1453-1464.
16 Sipahioglu MH,Kucuk H,Unal A,et al.Impact of arterial stiffness on adverse cardiovascular outcomes and mortality in peritoneal dialysis patients.Perit Dial Int,2012,32(1):73-80.
17 Ketteler M,Rothe H,Krüger T, et al.Mechanisms and treatment of extraosseous calcification in chronic kidney disease.Nat Rev Nephrol,2011,7(9):509-516.
18 Asci G,Ok E,Savas R,et al.The link between bone and coronary calcifications in CKD-5 patients on haemodialysis.Nephrol Dial Transplant,2011,26(3):1010-1015.
19 Wang C,Jiang L,Feng S,et al.Risk factor analysis of calcification in aortic and mitral valves in maintenance peritoneal dialysis patients.Kidney Blood Press Res,2013,37(4-5):488-495.
20 Gallieni M,Caputo F,Filippini A, et al.Prevalence and progression of cardiovascular calcifications in peritoneal dialysis patients:A prospective study.Bone,2012,51(3):332-337.
21 Wang AY.Vascular and valvular calcification in chronic peritoneal dialysis patients.Int J Nephrol,2011,2011:198045.
22 Rroji M,Seferi S,Cafka M,et al.Is residual renal function and better phosphate control in peritoneal dialysis an answer for the lower prevalence of valve calcification compared to hemodialysis patients? Int Urol Nephrol,2014,46(1):175-182.
23 Linefsky JP,O'Brien KD,Katz R,et al.Association of serum phosphate levels with aortic valve sclerosis and annular calcification the cardiovascular health study.J Am Coll Cardiol,2011,58(3):291-297.
24 Rattazzi M,Bertacco E,Del Vecchio A, et al.Aortic valve calcification in chronic kidney disease.Nephrol Dial Transplant,2013,28(12):2968-2976.
25 Sevinc Ok E,Asci G,Kircelli F,et al.Relationship between glucose exposure via peritoneal dialysis solutions and coronary artery calcification in non-diabetic peritoneal dialysis patients.Int Urol Nephrol,2012,44(6):1847-1853.
(本文编辑 心 平)
The morbidity and related factors of cardiovascular calcification in peritoneal dialysis patients
YINGFeiting,ZHOUTingting,ZHOUYan,ZHOUYuchao,LIUZhihong,YUYusheng
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolMedicine,NanjingCorrespondingauthor:YUYusheng(E-mail:yuyusheng@medmail.com.cn)
Objective:To explore the incidence of cardiovascular calcification and related factors in patients with peritoneal dialysis (PD) . Methodology:From December 2013 to August 2014, one hundred fifty PD patients were enrolled in this study. Laboratory measurements included serum calcium (Ca), phosphorus (P), intact parathyroid hormone (iPTH), and dialysis status was evaluated. Coronary Artery Calcification Score (CACS) was assessed with multi-slice spiral computed tomography (MSCT, Agatston method). Abdominal Aortic Calcification Score (AACS) was assessed with lateral plain radiograph of the abdomen (Kauppila method). Echocardiography was used to detect the cardiac valve calcification (CVC). The related factors of cardiovascular calcification were analyzed by binary logistic regression. Results:Only 58.0%, 46.0% and 23.3% of 150 patients reached the target for serum Ca, P and iPTH defined by Chinese Society of Nephrology (CSN). The total 57.3% patients had calcification. The incidence of CAC, AAC and CVC was found in 40.7%, 32.7% and 27.3% patients respectively. In addition to the individual groups, the incidence of calcification of any part increased with age and dialysis vintage. Using binary logistic regression, age (OR=1.10), dialysis vintage (OR=1.03) were independent risk factors for CAC, but Kt/V as a protect factor (OR=0.27), the independent risk factors for CVC included age (OR=1.07) and serum P(OR=1.94). Conclusion:Although our PD patients had low incidence of cardiovascular calcification (CAC: 40.7%, AAC: 32.7%, CVC: 27.3%), hyperphosphate and abnormal iPTH were still prominent. Age, dialysis vintage and serum P were traditional risk factors for calcification in patients with PD.
peritoneal dialysis cardiovascular calcification prevalence related factors
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05);江苏省临床医学中心项目(BL2012007)
南京大学医学院附属金陵医院(南京军区总医院)肾脏科 硕士研究生(尹飞挺),国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
俞雨生(E-mail:yuyusheng@medmail.com.cn)
2015-01-03
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有

