血栓性微血管病相关肾脏疾病患者的临床病理特点及预后
梁少姗 任 强 徐 峰 乐伟波 梁丹丹 李世军 刘志红 曾彩虹
血栓性微血管病相关肾脏疾病患者的临床病理特点及预后
梁少姗 任 强 徐 峰 乐伟波 梁丹丹 李世军 刘志红 曾彩虹
目的:比较血栓性微血管病(TMA)相关肾脏疾病的临床、病理特征及预后。 方法:选取肾活检病理为TMA病变的患者,选其中非典型溶血尿毒综合征(aHUS)38例、狼疮性肾炎相关性TMA(LN-TMA)37例、妊娠相关性TMA(P-TMA)22例,比较三组患者的临床、病理及预后。 结果:aHUS组患者临床表现最重,血清肌酐水平[aHUS 791.2 μmol/L(396.9~1 148.3 μmol/L)vsLN-TMA 388.1 μmol/L(189.2~581.7 μmol/L)vsP-TMA 69.8 μmol/L(53.9~556.9 μmol/L)]及贫血的发生率(aHUS 100%vsLN-TMA 97.3%vsP-TMA 63.6%)均高于其他两组,肾脏病理TMA病变表现多样。P-TMA组病情最轻,肾功能不全的发生率(aHUS 100%vsLN-TMA 89.2%vsP-TMA 50.0%)、血小板减少的发生率(aHUS 76.3%vsLN-TMA 75.7%vsP-TMA 27.3%)及贫血的发生率均显著低于其他两组,病理以肾小球基膜双轨病变(aHUS 55.3%vsLN-TMA 45.9%vsP-TMA 95.5%)最为突出。LN-TMA组蛋白尿水平[aHUS 1.38 g/24h(0.74~2.58 g/24h)vsLN-TMA 2.65 g/24h(1.87~5.33 g/24h)vsP-TMA 1.18 g/24h(0.68~1.64 g/24h)]及镜下血尿的发生率(aHUS 65.8%vsLN-TMA 89.2%vsP-TMA 50.0%)最高,病理上动脉血栓(aHUS 57.9%vsLN-TMA 83.8%vsP-TMA 22.7%)及肾小球袢腔内血栓(aHUS 26.3%vsLN-TMA 59.5%vsP-TMA 4.5%)均位列三组之首。随访末aHUS组预后最差,P-TMA组预后最好(ESRD发生率aHUS 63.2%vsLN-TMA 24.3%vsP-TMA 18.2%,P<0.01),LN-TMA组肾功能完全恢复比例最高(aHUS 15.8%vsLN-TMA 27.0%vsP-TMA 18.2%)。肾小管间质慢性病变与肾脏长期预后独立相关,动脉内膜纤维性增生、球性硬化及肾小管间质慢性病变比例高是影响肾功能不全逆转的危险因素。 结论:TMA相关肾脏疾病临床特点、肾脏病理改变及预后存在显著差异,三组患者中aHUS组预后最差,LN-TMA组及P-TMA组预后相对较好。
血栓性微血管病 非典型溶血尿毒综合征 狼疮性肾炎 妊娠 肾脏病理 预后
血栓性微血管病(TMA)是一类由不同原因导致血管内皮损伤所造成的各种微血管病变。TMA相关疾病复杂多样,包括溶血尿毒综合征(HUS)、血栓性血小板减少性紫癜(TTP)、系统性红斑狼疮、妊娠、药物、恶性高血压、系统性硬化、造血干细胞移植、肾移植排斥反应等。TMA的临床表现包括微血管病性溶血性贫血(MAHA)、血小板减少、肾功能不全、发热及神经精神异常等。TMA的病理改变累及肾小球及动脉,主要表现肾小球毛细血管袢内血栓、基膜双轨及不同程度的系膜溶解;动脉常累及小动脉,小叶间动脉少见,主要表现血栓、纤维素样坏死、内膜黏液样增厚、“葱皮样”改变及纤维性增生;严重时可出现肾皮质坏死。
尽管这一类微血管病变称为TMA,但临床表现及病理改变并不均一,目前具有肾活检病理资料的TMA相关疾病的报道较少[1-10],不同相关疾病的比较罕见[10]。本研究选取非典型HUS(aHUS)、狼疮性肾炎相关性TMA(LN-TMA)、妊娠相关TMA(P-TMA)三组常见的TMA相关肾脏疾病患者,观察和比较其临床、病理特点及预后。
对象和方法
病例选择 回顾性分析1995年9月至2013年2月经南京军区南京总医院肾脏科经肾活检证实为TMA相关肾脏疾病的aHUS、LN-TMA、P-TMA进行分析。各组患者入选标准如下:(1)aHUS:MAHA[定义为贫血,乳酸脱氢酶(LDH)升高,末梢血红细胞碎片阳性,Coombs试验阴性],血小板减少,肾脏损害(血尿、蛋白尿或肾功能不全),除外血管性血友病因子裂解酶13(ADAMTS13)严重缺乏或抗体阳性的患者,除外血性腹泻或侵袭性肺炎链球菌感染的患者,除外具有其他明确病因的TMA患者;(2)LN-TMA:符合1997年美国风湿病学会修订的系统性红斑狼疮(SLE)诊断标准,肾活检符合LN;(3)P-TMA:产前、产时、产后出现肾脏损害,产后12周内行肾活检。入选患者肾活检病理均符合TMA形态学改变,至少存在以下病变之一[11]:肾小球内纤维素样血栓、红细胞碎片;肾小球内皮细胞肿胀,内皮下间隙疏松、增宽,慢性期可见基膜“双轨样”改变(电镜下为系膜插入、基膜分层);肾小球系膜溶解;动脉管腔内纤维素样血栓、红细胞碎片;动脉内膜黏液样增厚;动脉纤维素样坏死;动脉葱皮样改变或动脉内膜纤维性增生;肾皮质坏死。
临床指标 包括性别、年龄、病程、血压、肾脏及肾外表现,治疗方案及预后。记录患者入院后反映病情最活动的实验室检查指标,包括血红蛋白(Hb)、血小板计数、LDH、末梢血红细胞碎片,Coombs试验;血清白蛋白(Alb)、血清肌酐(SCr);抗心磷脂抗体(ACL)/狼疮抗凝样物质(LA),补体C3;尿沉渣红细胞计数(RBC),24h尿蛋白定量。
定义 高血压:收缩压≥140 mmHg和/(或)舒张压≥90 mmHg;肾功能不全:SCr>110.0 μmol/L;贫血:男性Hb<120 g/L、女性Hb<110 g/L;血小板减少:血小板<100×109/L; LDH增高:LDH>240 U/L;末梢血红细胞碎片阳性:破碎红细胞≥10个/HP;补体C3下降:C3<0.8 g/L;镜下血尿:RBC>10万/ml;神经精神症状:烦躁、抽搐、谵妄、嗜睡、意识丧失、昏迷、感觉异常、瘫痪、视物障碍等。
病理 所有患者肾活检标本肾小球数≥8个,间质小动脉和小叶间动脉总数≥8条。病理观察指标包括TMA病变部位:肾小球、间质小动脉、小叶间动脉;肾小球TMA病变:肾小球基膜双轨改变、袢腔内纤维素血栓/变形红细胞、肾小球系膜溶解;肾小球一般病变:肾小球球性硬化、缺血皱缩及袢坏死;动脉TMA病变:慢性病变为葱皮样改变和内膜纤维性增生,急性病变为管腔内纤维素血栓/变形红细胞、管壁纤维素样坏死,内膜黏液样增厚;肾小管间质的急性和慢性病变的百分比;有无肾皮质坏死。
随访及预后 随访终点SCr作为主要观察指标,疾病转归分为三组:(1)终末期肾病(ESRD):SCr>530.0 μmol/L、维持性血液透析治疗或肾移植,一旦进入ESRD则为随访终点;(2)慢性肾功能衰竭(CRF):SCr>110.0 μmol/L,但未达到ESRD;(3)肾功能正常:随访末SCr≤110.0 μmol/L。
统计学分析 采用SPSS 18.0统计软件进行数据处理。正态分布连续性变量以均数±标准差表示,组间比较采用t检验;非参数变量以中位数(四分位数)表示,组间比较拟采用Man-Whitney- Wilcoxon检验;分类变量以率表示,组间比较拟采用卡方检验。利用Kaplan-Meier(K-M)法计算患者的累积肾存活率。采用单因素COX回归模型计算各个指标的风险比值(HR),并将单因素分析有差异性的变量纳入多因素COX回归模型分析,以进一步明确独立的预后因素。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
临床特点 本研究共纳入aHUS 38例,LN-TMA 37例,P-TMA 22例。三组患者的临床表现及实验室检查特点见表1。活检时aHUS组年龄最大、LN-TMA组年龄最小。aHUS组患者临床表现最严重,SCr水平、贫血发生率均高于其他两组患者。P-TMA组患者临床表现最轻,其肾脏功能受损、贫血、血小板减少程度均显著轻于其他三组患者。LN-TMA组的患者蛋白尿水平、血尿发生率最高。
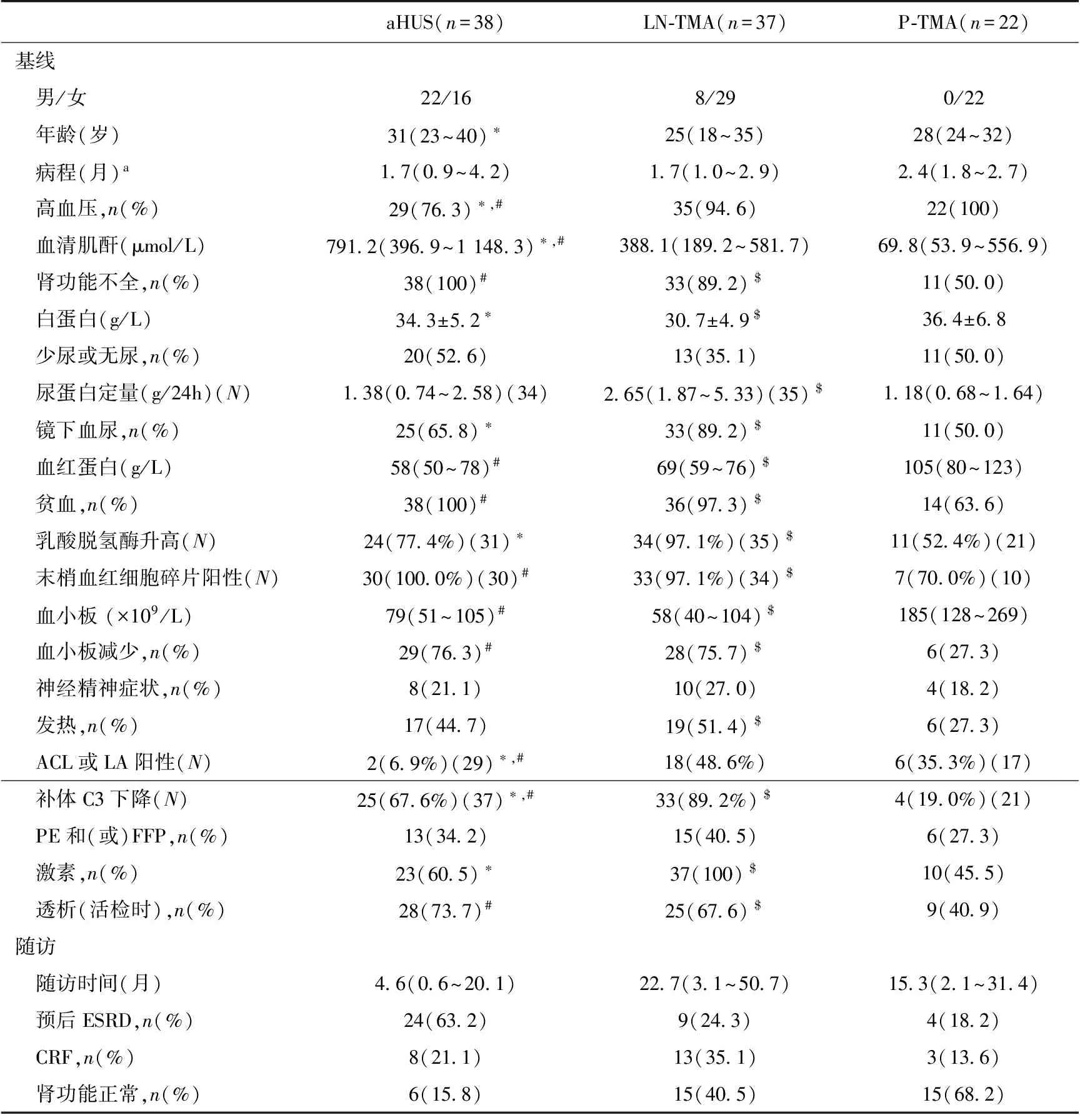
表1 三组TMA患者活检时临床特点的比较
TMA:血栓性微血管病;aHUS:非典型溶血尿毒综合征;LN-TMA:狼疮性肾炎相关性TMA;P-TMA:妊娠相关性TMA;ACL:抗心磷脂抗体;LA:狼疮抗凝样物质;PE:血浆置换;FFP:输注新鲜冰冻血浆;ESRD:终末期肾病;CRF:慢性肾功能衰竭;N:被检测的例数;a:aHUS、LN-TMA指最近一次发作与肾活检之间的时间间隔;P-TMA:指妊娠期间或产后出现肾脏损害与肾活检之间的时间间隔;*:aHUS组与LN-TMA组比较,P<0.05,#:aHUS组与P-TMA组比较,P<0.05,$:LN-TMA组与P-TMA组比较,P<0.05;
病理学特点 患者的病理特点见表2。aHUS组肾小球及动脉均可受累,相应的肾小球缺血性改变及肾小管间质慢性病变比例最高。LN-TMA组动脉受累率高于其他两组,动脉及肾小球内血栓发生率最高。P-TMA组以肾小球受累为主,肾小球基膜双轨病变最为突出,袢内血栓仅1例。1例aHUS、1例LN-TMA、4例P-TMA出现肾皮质坏死。

表2 三组TMA患者肾活检病理特点的比较
TMA:血栓性微血管病;aHUS:非典型溶血尿毒综合征;LN-TMA:狼疮性肾炎相关性TMA;P-TMA:妊娠相关性TMA;*:aHUS组与LN-TMA组比较,P<0.05,#:aHUS组与P-TMA组比较,P<0.05,$:LN-TMA组与P-TMA组比较,P<0.05
治疗与预后转归 LN-TMA患者均使用了糖皮质激素治疗,而aHUS基线行血液透析的比例位列三组之首,PE/FFP治疗在三组患者比较无统计学差异(表1)。分析三组患者的累计肾脏存活率发现,aHUS组肾存活率最低,与其他两组相比具有统计学差异(图1)。多数患者在随访的第1年进入ESRD,aHUS组的1年肾存活率为52.8%,LN-TMA组为75.8%,P-TMA组为84.0%。
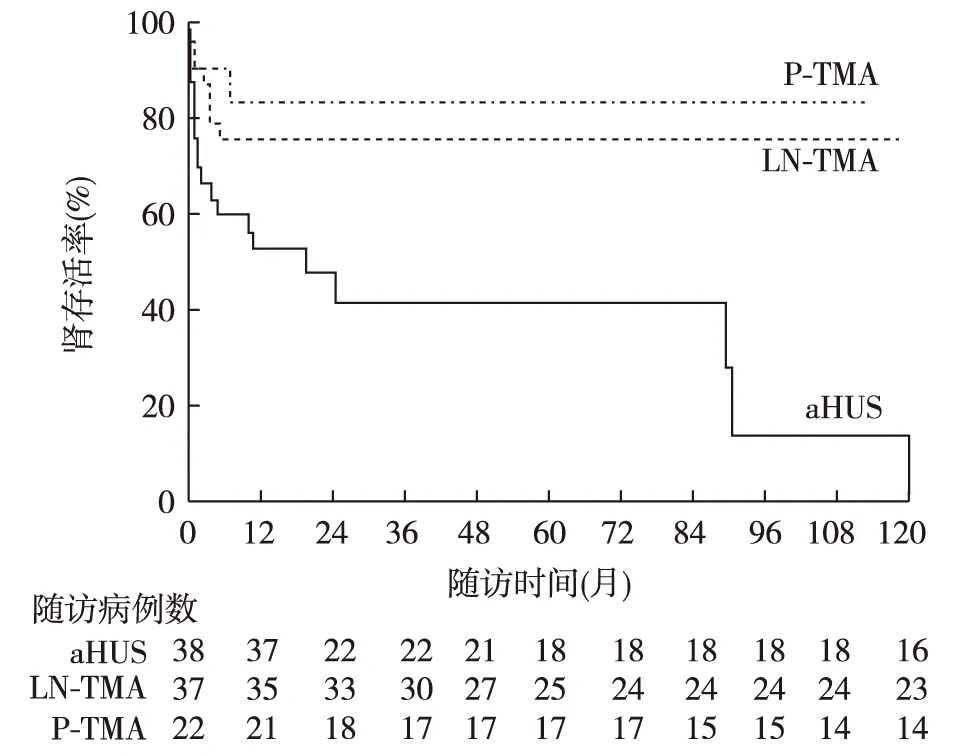
图1 三组不同病因TMA患者肾脏生存曲线的比较TMA:血栓性微血管病;aHUS:非典型溶血尿毒综合征;LN、TMA:狼疮性肾炎相关性TMA;P-TMA:妊娠相关性TMA;aHUS组与LN-TMA组比较,P=0.001; aHUS组与P-TMA组比较,P=0.005;LN-TMA组与P-TMA组比较,P=0.649
随访过程中,aHUS、LN-TMA、P-TMA 肾功能不全完全恢复的患者比例分别为15.8%(6/38)、27.0%(10/33)、18.2%(4/11),中位恢复时间分别为0.8月、3月、7天。
病理指标与临床表现及肾脏预后的关系 单因素回归分析显示动脉内膜纤维性增生进入ESRD的风险明显高于无内膜纤维性增生(HR 3.58,P=0.003),动脉黏液样增厚的风险明显高于无黏液样增厚(HR 2.35,P=0.011),动脉管腔内血栓形成的风险明显高于无血栓(HR 2.71,P=0.012),肾小管间质慢性病变每增加10%则ESRD风险增加1.30倍(P<0.001),球性硬化每增加10%则ESRD风险增加1.25倍(P<0.001)。多因素回归分析显示肾小管间质慢性病变(HR 1.28,P<0.001)是进展至ESRD的独立危险因素。分析肾功能不全未能完全恢复患者的肾脏病理改变发现,aHUS组肾功能不全未恢复者动脉内膜纤维性增生发生率、球性硬化及肾小管间质慢性病变比例高于肾功能不全完全恢复者(P=0.001,P=0.018及P=0.033)。在LN-TMA组,肾功能不全未恢复者动脉内膜纤维性增生发生率及球性硬化比例较高(P=0.042及P=0.008)。P-TMA组中11例患者出现AKI,其中4例患者仅出现肾小球基膜双轨病变,肾功能均恢复正常。
讨 论
TMA是一个病理诊断名词,其病因多样[12]。我们选取了aHUS、LN-TMA及P-TMA三组常见肾脏病理改变为TMA的患者,发现aHUS组的临床表现最重,TMA病变多样,肾小球缺血性改变及肾小管间质慢性病变比例最重,预后最差,P-TMA组临床表现最轻,病理改变以肾小球基膜双轨病变为主,预后最好,LN-TMA组临床上尿检最为活动,血栓性病变突出。
HUS包括腹泻相关HUS(D+HUS)和aHUS,前者多见于儿童,由于本研究绝大多数为成人患者,故未将D+HUS纳入本研究。本研究中aHUS组患者SCr水平最高,肾脏病理改变多样,肾脏预后最差。目前aHUS被认为是先天性或获得性补体旁路途经(CAP)调节因子异常所致,CAP被激活后,大量C3b聚集在内皮细胞表面,通过级联反应造成内皮细胞损伤,促使血栓形成[13]。复杂机制使该组患者的临床表现和病理多样,既往数个研究均提示aHUS肾脏病理改变存在多样性[6,14-15],不同补体相关因子异常所致的aHUS,治疗干预和预后也不同[13],不同基因突变及不同补体调节因子异常的亚组人群的差异值得进一步探讨。
LN-T 栓的发生率均高于aHUS组,然而经过治疗后,肾脏预后却较aHUS组好,肾功能完全恢复的比例亦较高。该研究结果提示LN-TMA中的血栓这一急性TMA病变可能对治疗反应较aHUS好。LN-TMA可能与aHUS的发病机制不一致[16-18],有作者认为该类型的TMA患者自身存在CAP或ADAMTS13酶异常,SLE是TMA的触发因素[19],此外,补体经典途径也被认为与LN-TMA有关[16]。
在子痫前期/子痫的情况下,肾小球的内皮细胞肿胀,堵塞袢腔,称为内皮细胞病(endotheliosis),是TMA病变的一种特殊形式[20]。本研究中,肾小球基膜双轨病变是P-TMA的主要病理表现,这一病变可能与子痫前期发作到肾活检的时间间隔较长有关。P-TMA伴肾功能不全患者肾脏病理仅出现肾小球基膜双轨病变,肾功能可完全恢复正常。Fakhouri等[21]认为妊娠相关的急性肾损伤(AKI)患者出现TMA的机制不尽相同,其本质上可能是aHUS或TTP,妊娠只是诱发因素。本研究是回顾性分析,CAP相关蛋白及其抗体在这组患者中均未进行检测,但补体C3低下的4例患者可能与CAP异常有关[22]。此外,ACL/LA阳性同时病理上见动脉血栓形成或肾皮质坏死,不能除外磷脂抗体综合征可能[23]。总之,P-TMA患者临床及病理改变多样,肾皮质坏死的发生率高,肾活检病理出现动脉TMA病变时提示我们需要寻找潜在病因,如CAP异常等。
本研究发现,肾脏病理改变对预测患者预后仍有较大价值。在单因素回归分析中,肾小球球性硬化、肾小管间质慢性病变、动脉指标(动脉纤维性增厚、黏液样增厚、动脉血栓)是预后不良的危险因素,但多因素回归分析中肾小管间质慢性病变是预后不良的独立危险因素。既往研究中,动脉TMA病变包括动脉内膜增厚、动脉血栓被认为是预后不良的危险因素[4-6,9]。亦有研究认为肾皮质坏死及肾小球TMA病变是预后不良的危险因素[8]。肾小管间质慢性病变与肾脏预后密切相关,在本文中首次被提出。动脉内膜纤维性增生和肾小球球性硬化这两项在aHUS和LN-TMA肾功能不全未恢复患者中的发生率更高,这些病变是肾功能不恢复的危险因素,仍应作为TMA患者肾脏病理重点观察的指标之一。
小结:TMA是具有特定微血管损伤的一类病变,临床表现及肾脏病理改变具有多样性。接受肾活检的三组患者中,aHUS组临床表现最重,病理TMA表现多样,预后最差;P-TMA组系统受累最轻,病理主要表现为肾小球基膜双轨样改变,预后最好;LN-TMA组尿检最为活动,血栓性病变突出。
1 Zhang W,Shi H,Ren H,et al.Clinicopathological characteristics and outcome of Chinese patients with thrombotic thrombocytopenic purpura-hemolytic uremic syndrome:a 9-year retrospective study.Nephron Clin Pract,2009,112(3):c177-183.
2 Hollenbeck M,Kutkuhn B,Aul C,et al.Haemolytic-uraemic syndrome and thrombotic-thrombocytopenic purpura in adults:clinical findings and prognostic factors for death and end-stage renal disease.Nephrol Dial Transplant,1998,13(1):76-81.
3 Tostivint I,Mougenot B,Flahault A,et al.Adult haemolytic and uraemic syndrome:causes and prognostic factors in the last decade.Nephrol Dial Transplant,2002,17(7):1228-1234.
4 Matsumae T,Takebayashi S,Naito S.The clinico-pathological characteristics and outcome in hemolytic-uremic syndrome of adults.Clin Nephrol,1996,45(3):153-162.
5 Morel-Maroger L,Kanfer A,Solez K,et al.Prognostic importance of vascular lesions in acute renal failure with microangiopathic hemolytic anemia (hemolytic-uremic syndrome):clinicopathologic study in 20 adults.Kidney Int,1979,15(5):548-558.
6 Mehrazma M,Hooman N,Otukesh H.Prognostic value of renal pathological findings in children with atypical hemolytic uremic syndrome.Iran J Kidney Dis,2011,5(6):380-385.
7 Argyle JC,Hogg RJ,Pysher TJ,et al.A clinicopathological study of 24 children with hemolytic uremic syndrome.A report of the Southwest Pediatric Nephrology Study Group.Pediatr Nephrol,1990,4(1):52-58.
8 Gagnadoux MF,Habib R,Gubler MC,et al.Long-term (15-25 years) outcome of childhood hemolytic-uremic syndrome.Clin Nephrol,1996,46(1):39-41.
9 Taylor CM,Chua C,Howie AJ,et al.Clinico-pathological findings in diarrhoea-negative haemolytic uraemic syndrome.Pediatr Nephrol,2004,19(4):419-425.
10 Yu XJ,Yu F,Song D,et al.Clinical and renal biopsy findings predicting outcome in renal thrombotic microangiopathy:a large cohort study from a single institute in China.ScientificWorldJournal,2014,2014:680502.
11 Laszik ZG,Kambham N,Silva FG.Thrombotic Microangiopathies//Jennette JC,D′Agatl VD,Olson JL,et al.Heptinstall Pathology of the Kidney,7th ed.Lippincott,Williams & Wilkins,2014:754.
12 Besbas N,Karpman D,Landau D,et al.A classification of hemolytic uremic syndrome and thrombotic thrombocytopenic purpura and related disorders.Kidney In,2006,70(3):423-431.
13 Noris M,Remuzzi G.Atypical hemolytic-uremic syndrome.N Engl J Med,2009,361(17):1676-1687.
14 Kamioka I,Nozu K,Fujita T,et al.Prognosis and pathological characteristics of five children with non-Shiga toxin-mediated hemolytic uremic syndrome.Pediatr Int,2007,49(2):196-201.
15 Fakhouri F,Delmas Y,Provot F,et al.Insights from the use in clinical practice of eculizumab in adult patients with atypical hemolytic uremic syndrome affecting the native kidneys:an analysis of 19 cases.Am J Kidney Dis,2014,63(1):40-48.
16 Song D,Wu LH,Wang FM,et al.The spectrum of renal thrombotic microangiopathy in lupus nephritis.Arthritis Res Ther,2013,15(1):R12.
17 Muscal E,Edwards RM,Kearney DL,et al.Thrombotic microangiopathic hemolytic anemia with reduction of ADAMTS13 activity:initial manifestation of childhood-onset systemic lupus erythematosus.Am J Clin Pathol,2011,135(3):406-416.
18 Hill GS,Nochy D.Antiphospholipid syndrome in systemic lupus erythematosus.J Am Soc Nephrol,2007,18(9):2461-2464.
19 George JN,Nester CM.Syndromes of thrombotic microangiopathy.N Engl J Med,2014,371(7):654-666.
20 Spargo B,McCARTNEY CP,Winemiller R.Glomerular capillary endotheliosis in toxemia of pregnancy.Arch Pathol,1959,68:593-599.
21 Fakhouri F,Vercel C,Frémeaux-Bacchi V.Obstetric nephrology:AKI and thrombotic microangiopathies in pregnancy.Clin J Am Soc Nephrol,2012,7(12):2100-2106.
22 Fakhouri F,Roumenina L,Provot F,et al.Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations.J Am Soc Nephrol,2010,21(5):859-867.
23 Ruiz-Irastorza G,Crowther M,Branch W,et al.Antiphospholipid syndrome.Lancet,2010,376(9751):1498-1509.
(本文编辑 心 平 律 舟 莫 非)
Clinico-pathological characteristics and prognosis in patients with thrombotic microangiopathy
LIANGShaoshan,RENQiang,XUFeng,LEWeibo,LIANGDandan,LIShijun,LIUZhihong,ZENGCaihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,ChinaCorrespondingauthor:ZENGCaihong(E-mail:zengch_nj@hotmail.com)
Objective:To compare the clinico-pathological characteristics and prognogy:Ninty seven patients who diagnozed as TMA by renal biopsy were enrolled into this retrospective study. They included atypical hemolytic uremic syndrome (aHUS) (n=38), lupus nephritis-associated TMA (LN-TMA) (n=37), and pregnancy-associated TMA (P-TMA) (n=22). Their clinico-pathological characteristics and the prognoses were compared. Results:The patients with aHUS presented a highest level of serum creatinine 791 (397~1 148) μmol/LvsLN-TMA 388 (189~582) μmol/LvsP-TMA 69.8 (53.9~557) μmol/L),and a highest incidence of anemia (100%vsLN-TMA 97.3%vsP-TMA 63.6%), with a wide variety of TMA lesions. The patients with P-TMA presented the lowest level of systemic involvement, the lowest incidences of renal insufficiency (aHUS 100%vsLN-TMA 89.2%vsP-TMA 50.0%), anemia and thrombocytopenia (aHUS 76.3%vsLN-TMA 75.7%vsP-TMA 27.3%), and the highest incidence glomerular basement membrane (GBM) reduplication (aHUS 55.3%vsLN-TMA 45.9%vsP-TMA 95.5%). However, the patients with LN-TMA presented the highest level of proteinuria (aHUS 1.38 (0.74~2.58) g/24hvsLN-TMA 2.65 (1.87~5.33) g/24hvsP-TMA 1.18 (0.68~1.64) g/24h), the highest incidence of microscopic hematuria (aHUS 65.8%vsLN-TMA 89.2%vsP-TMA 50.0%), and arterial and glomerular thrombi dominantly (aHUS 57.9%vsLN-TMA 83.8%vsP-TMA 22.7%; aHUS 26.3%vsLN-TMA 59.5%vsP-TMA 4.5%, respectively). At the end of follow-up, aHUS patients showed the poorest renal outcomes to end-stage renal disease (aHUS 63.2%vsLN-TMA 24.3%vsP-TMA 18.2%,P<0.001), whereas LN-TMA patients had the highest incidence of recovery of renal insufficiency (aHUS 15.8%vsLN-TMA 27.0%vsP-TMA 18.2%,P<0.001). The percentage of tubular atrophy/interstitial fibrosis (TAIF) independently influenced the renal survival. The presence of arteriolar /arterial intimal fibroplasia, the increased percentages of glomerulosclerosis and TAIF were risk factors for non-recovering from renal insufficiency. Conclusion:The patients with different types of TMA presented a wide variety of clinico-pathological characteristics and prognoses. In these three groups, patients with aHUS had the worst prognoses, whereas patients with LN-TMA and P-TMA had better prognoses.
thrombotic microangiopathy atypical hemolytic uremic syndrome lupus nephritis pregnancy renal biopsy prognosis
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05);江苏省临床医学中心项目(BL2012007)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 博士研究生(梁少姗),南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
曾彩虹(E-mail:zengch_nj@hotmail.com)
2014-07-16
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有

