一种高配位钨酸盐体系Sr3WO6:Eu红色荧光粉的制备与发光性能研究
谢程益,唐先忠,王 毅,杨 光,曾 忱
(电子科技大学 微电子与固体电子学院,四川 成都 610054)
白光LED具有体积小、器件反应速度快、发热量低、耗电量小、寿命长、能效高、符合环保要求等优点,受到了人们的广泛关注,被公认为第4代照明光源[1]。目前白光LED的实现方法主要有2种,即荧光转换型和多芯片组合型。多芯片组合型的效率最高,但是实现起来难度较大,需要复杂的控制电路,因此成本比较高[2]。荧光转换型是目前最主流的实现方法,其中以蓝光芯片加黄色荧光粉的组合最为成熟,效率最高,但是这种组合由于缺少了红光成分,导致显色指数偏低,色温偏高[3],为了克服这个缺点,蓝光芯片加绿粉和红粉的组合以及近紫外光芯片加红绿蓝三基色荧光粉的组合成了人们新的研究方向,然而相对于蓝粉和绿粉,红粉的效率最低,而且不稳定[4-6],多为稀土金属硫化物,限制了白光LED的发展,因此人们急需找到一种高效率、高色纯度、高化学稳定性的红色荧光粉。
钨酸盐化合物具有较高的稀土离子猝灭浓度,基质向激活剂的能量传递效率高以及猝灭温度高等优点被认为是白光LED用红色荧光粉的优质基质材料[7]。钨酸盐化合物作为荧光粉基质材料获得了广泛的研究,常见的钨酸盐化合物有SrWO4、CaWO4[8-9]。目前,典型的钨酸盐体系红色荧光粉基质多为白钨矿结构[10],在这种结构中W6+周围具有4个氧配体,形成空间四面体结构,在受到紫外光激发时均会产生O2--W6+的电荷迁移,即O2-的2p6轨道上的电子迁移到W6+的5d0轨道上,形成较强的电荷迁移带,一般位于约220~300 nm,而在近紫外到蓝光区域只是来自于Eu3+的窄带激发,这与近紫外光芯片匹配并不好,随着W6+的氧配体的配位数增高,其W6+与氧的键能会相应的降低,电荷迁移带会有一定程度上的红移[3]。因此,高配位结构的钨酸盐体系基质材料越来越受到人们的关注。
通常情况下,配位数高的荧光粉材料合成难度较大,采用传统的高温固相法耗能耗时[11-14],多为1 100 ℃以上的高位煅烧几十个小时,并且期间还要研磨几次,而且合成的材料纯度不高,因此,需要探索出一种简单高效的方法来制备高配位结构的荧光粉,并系统地研究其发光特性。
1 实验部分
1.1 试剂与仪器
Eu2O3:4N级,珠江冶炼厂;Sr(NO3)2、LiNO3、NaHCO3、KNO3、(NH4)10W12O41·xH2O、C6H8O7·H2O、浓硝酸、氨水:均为分析纯,国药集团化学试剂有限公司。
分析天平:FA2204B,上海精密科学仪器有限公司;恒温干燥箱:202-1AB,郑州汇成科工贸有限公司;集热式磁力搅拌器:DF-101s,成都康宇科技有限公司;pH计:pHS-25,上海雷磁仪器厂;高温箱式电阻炉:SX3-3-12,杭州卓驰仪器有限公司。
1.2 样品的制备
采用柠檬酸络合法制备Sr3WO6:Eu体系荧光粉。原材料分别为Eu2O3、Sr(NO3)2、LiNO3、NaHCO3、KNO3及(NH4)10W12O41·xH2O,按化学计量比精确称取原材料,首先用硝酸溶解稀土氧化物,加热除去过量的硝酸,然后加入其它硝酸盐和柠檬酸,加入适量蒸馏水并用磁力搅拌器搅拌,待其完全溶解后,加入适量氨水配成溶液A,钨酸铵与柠檬酸混合,加入适量蒸馏水磁力搅拌至其完全溶解,配成溶液B,将B溶液倒入A溶液内,调节pH=2~3,搅拌15~20 mim后,升温至90 ℃继续搅拌至溶液变黏稠,将其放入130 ℃烘箱内直至其变成黑色干胶。最后干胶放入马弗炉内,600 ℃烧结6 h,1 000 ℃烧结6 h,自然冷却至室温,将样品研磨好,便得所制备的荧光粉。上述过程中,n(柠檬酸)∶n(总金属阳离子)=1.5∶1。
1.3 材料表征与性能测试
采用日本理学电机Rigaku/Dmax-2200-X-射线粉末衍射仪分析样品的结构,射线源为Cu靶,Kα,λ=0.154 03 nm,电压为40 kV,电流40 mA,扫描区间为10°~70°,步长为0.02°,扫描速度为10°/min;采用EX-1000荧光粉激发光谱与热猝灭分析系统分析荧光特性,氙灯为光源,带宽为1 nm,夹缝为0.37 mm,参照粉为CaMoO4:Eu。
2 结果与讨论
2.1 Sr3-xEuxWO6的物相分析与发光性能研究
常温下Sr3WO6属于三斜晶系,空间群为C1。Sr3-xWO6:xEu(x=0.1,0.2,0.3,0.4,0.5,0.6)的XRD图见图1。
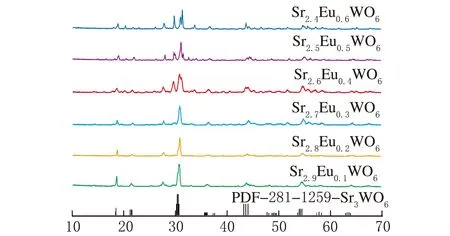
2θ/(°)图1 Sr3-xWO6:xEu的XRD图谱
从图1可以看出,当Eu掺杂浓度较低的时候,制备的样品纯度较高,而随着掺杂浓度的提高,XRD图谱中出现未知的杂峰。同时,随着掺杂浓度的提高,可以观察到特征峰的位置略微向右侧偏移,这是因为Eu3+离子半径小于Sr2+的离子半径,这也说明了所掺杂的Eu3+进入了Sr3WO6晶格结构中取代了Sr2+的位置。
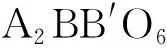
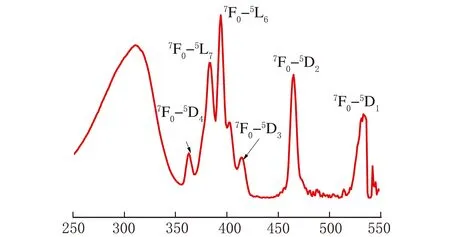
λ/nm图2 Sr2.7Eu0.3WO6的激发光谱
Sr3-xEuxWO6(x=0.1、0.2、0.3、0.4、0.5、0.6)在394 nm激发波长下的发射光谱见图3。
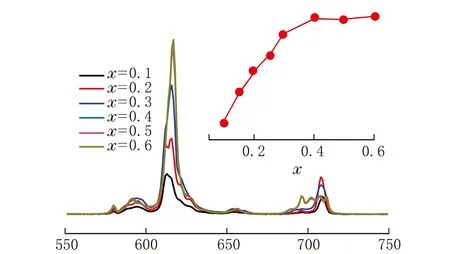
λ/nm图3 394 nm光激发下Sr3-xEuxWO6的发射光谱
图3中的各个峰分别来自于Eu3+的特征发射峰,可以看出样品的发射主要以电偶极跃迁5D0-7F2(~616 nm)为主,发射强度明显高于磁偶极跃迁5D0-7F1(~595 nm),这有利于获得更佳的CIE色坐标和更高的色纯度。由于电偶极跃迁5D0-7F2属于超敏跃迁,受周围的环境影响比较严重,若掺杂的Eu3+占据反演对称中心位置,则会以磁偶极跃迁5D0-7F1为主,说明所掺杂的Eu3+并没有占据反演对称中心位置。
图3中小图为不同激活剂掺杂浓度下的相对发射强度,可以看出随着激活剂浓度的提高,发射强度也相应的提高,当激活剂掺杂浓度x>0.4时,发射强度趋于平稳,而且没有发生浓度猝灭。
2.2 Sr2.4A0.3Eu0.3WO6(A=Li+,Na+,K+)的物相分析与发光性能研究
Sr2.4A0.3Eu0.3WO6(A=Li+,Na+,K+)的XRD图见图4。由图4可以看出电荷补偿后的样品纯度较Sr2.7Eu0.3WO6有所提高,这可能是减少缺陷能级的结果。从图4还可看出,用Li+做电荷补偿后,衍射峰整体向右偏移明显,这是因为Li+离子半径比Sr2+离子半径小的多,而用K+做电荷补偿后的衍射峰与Sr2.7Eu0.3WO6的衍射峰相比也略微向右偏移,这可能是因为K+的引入使得更多的Eu3+进入晶格内的结果。
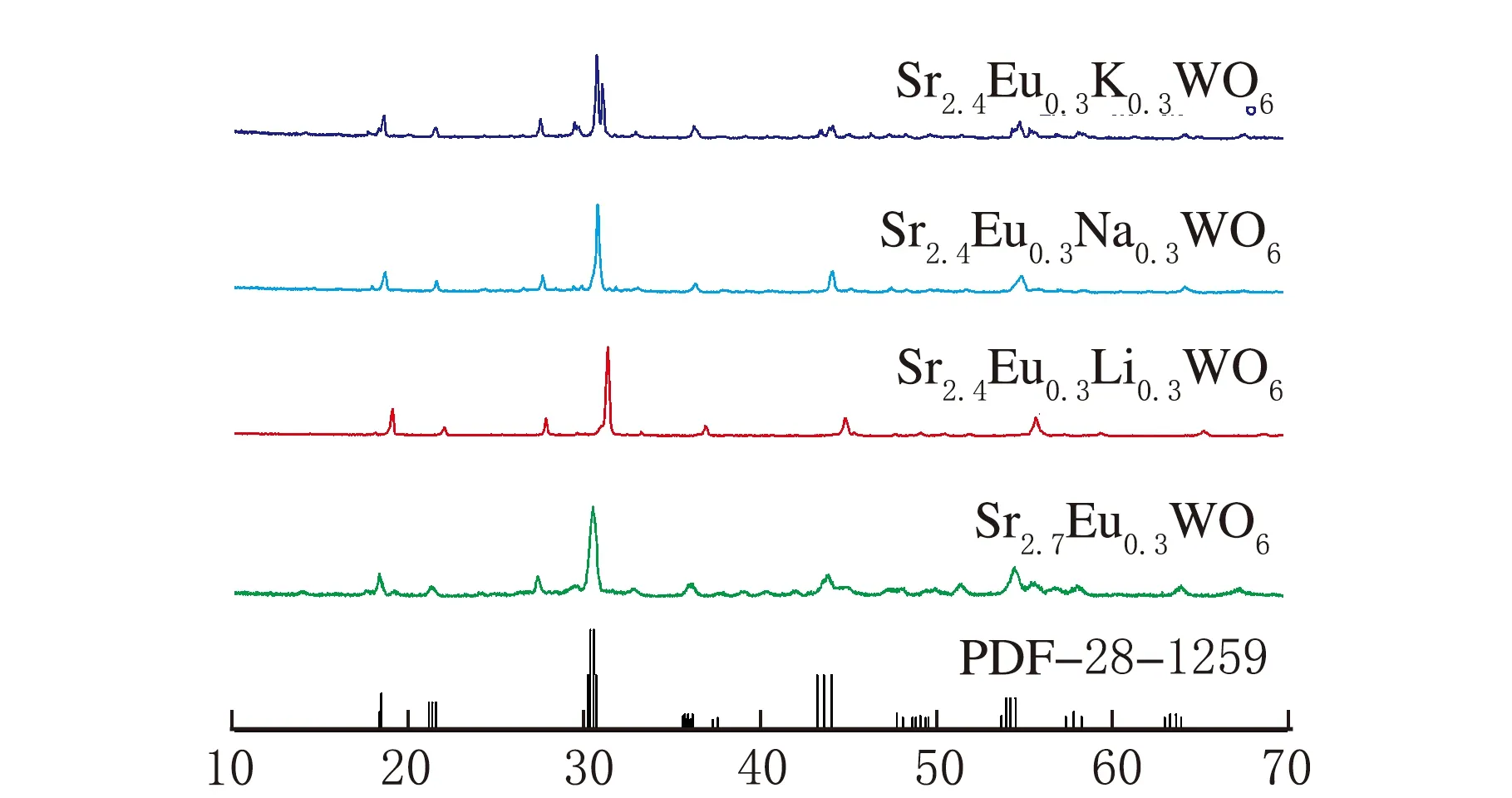
2θ/(°)图4 Sr2.4A0.3Eu0.3WO6(A=Li+,Na+,K+)的XRD图谱
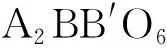
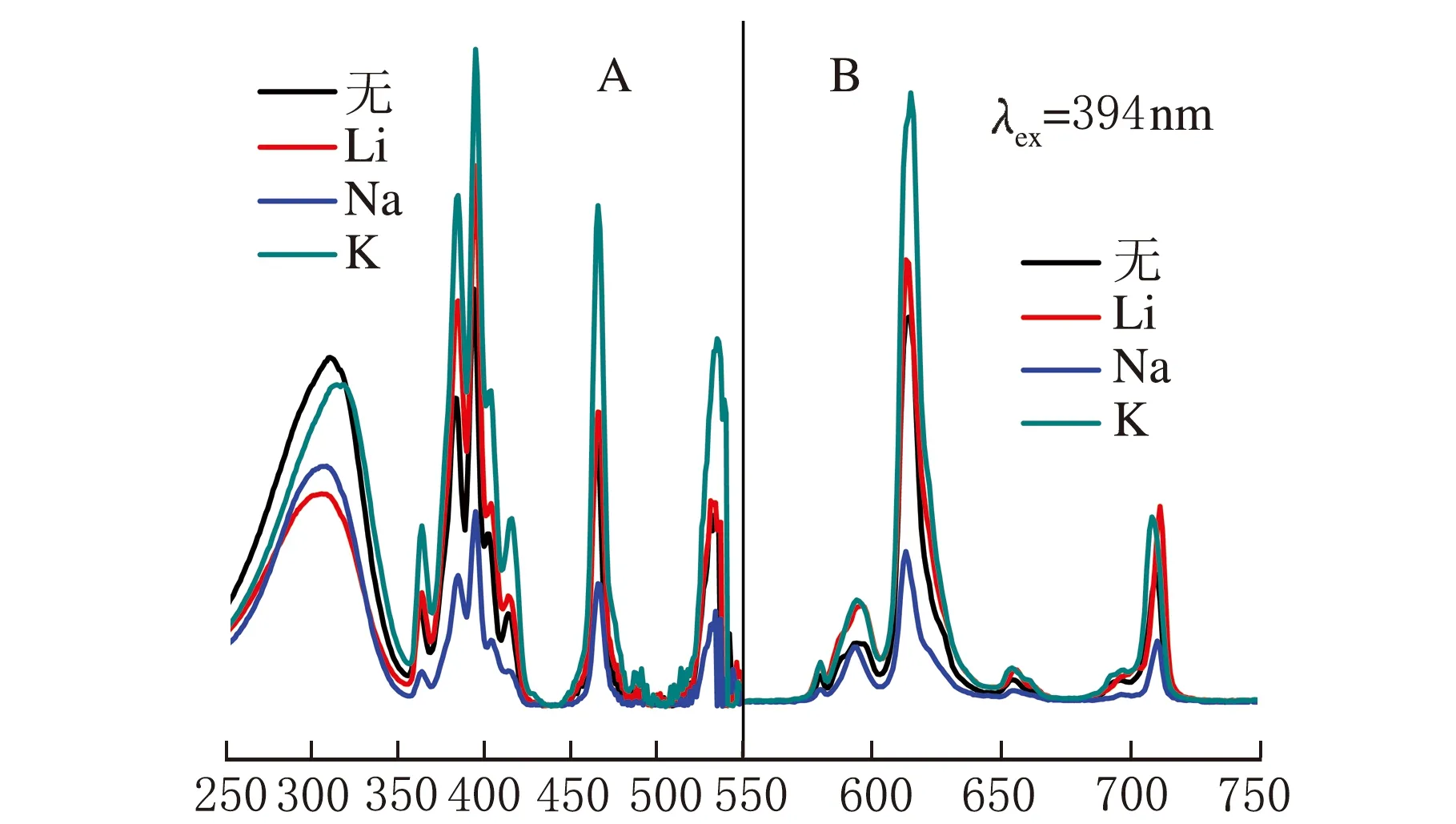
λ/nm图5 Sr2.4A0.3Eu0.3WO6(A=Li+,Na+,K+)的激发与发射光谱
样品在394 nm光激发下样品的相对发射强度与色坐标见表1,将Sr2.7Eu0.3WO6在394 nm光激发下的相对发射强度定为1,其余的几种样品的相对发射强度与其做对比,可以看出使用K+做电荷补偿剂效果最佳。
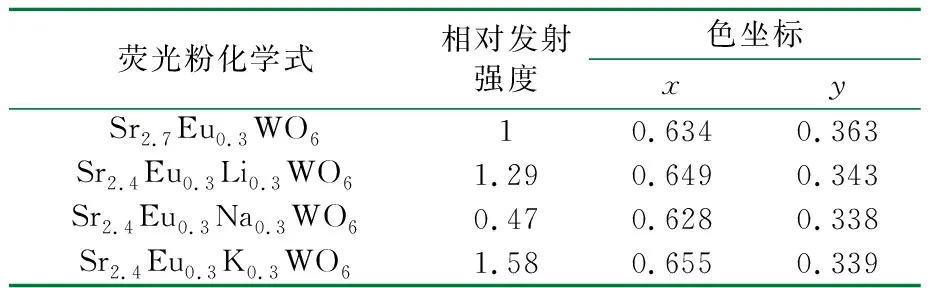
表1 样品在394 nm光激发下样品的相对发射强度与色坐标
3 结 论
采用一种简单的柠檬酸络合法合成了一系列高配位钨酸盐体系Sr3WO6:Eu红色荧光粉,研究了激活剂浓度以及电荷补偿对其发光性能的影响,当使用K+做电荷补偿剂时,其激发效率以及发射强度最高,同时该体系荧光粉在近紫外区域有非常高的激发效率,激发峰的峰值位于~394 nm处,与近紫外光芯片有极好的匹配,同时又具有较高的色纯度,说明该体系荧光粉适合应用在近紫外光芯片上。
[ 参 考 文 献 ]
[1] 韩俊义, 段庆文.白光LED用红色荧光粉的研究进展[J].中国材料进展,2011,30(3):36-43.
[2] 汪正良.碱金属-稀土钼/钨酸盐的合成、发光及其在发光二极管的应用研究[D].广州:中山大学,2006:4.
[3] P S Dutta,A Khanna.Eu3+activated molybdate and tungstate based red phosphors with charge transfer band in blue region[J].Journal of Solid State Science and Technology,2013,2(2):R3153-R3167.
[4] Wenlin Feng,Ye Jin,et al.Co-precipitation synthesis and photoluminescence properties of Ba1-xMoO4:xEu3+red phosphors[J].Journal of Luminescence,2013,134:614-617.
[5] 耿秀娟,田彦文,等.红色荧光粉 MMoO4:Eu3+(M=Ca,Sr,Ba)的水热合成及光谱性质[J].发光学报,2011,32(7):670-673.
[6] G H Lee,S Kang.Solid-solution red phosphors for white LEDs[J].Journal of Luminescence,2011,131(12):2582-2588.
[7] 张乐,鲁加加,等.Eu3+掺杂双钙钛矿Sr2CaMoO6橙红色荧光粉的结构特征及其发光性能[J].无机化学学报,2012,28(10):2036-2042.
[8] 杨艳民,刘冲,等.Eu3+,Dy3+,Sm3+掺杂Ca(Sr,Ba)WO4的光谱性质[J].发光学报,2011,32(7):699-703.
[9] A Khanna,P S Dutta.CaWO4:Eu3+,Dy3+,Tb3+phosphor crystals for solid-state lighting applications[J].ECS Transactions,2012,41(37):39-48.
[10] Yiguo Su,Liping Li,et al.Synthesis and optimum luminescence of CaWO4-based red phosphors with codoping of Eu3+and Na+[J].Chemistry of Materials,2008,20(19):6060-6067.
[11] Xin Zhao,Yufeng Ding,et al.An efficient charge compensated red phosphor Sr3WO6:K+,Eu3+-for white LEDs[J].Journal of Alloys and Compounds,2013,553:221-224.
[12] Xin Zhao,Jiajia Wang,et al.Efficient red phosphor double-perovskite Ca3WO6with A-site substitution of Eu3+[J].Dalton Transactions,2013,42(37):13502-13508.
[13] V Sivakumar,U V Varadaraju.Synthesis,phase transition and photoluminescence studies on Eu3+-substituted double perovskites-a novel orange-red phosphor for solid-state lighting[J].Journal of Solid State Chemistry,2008,181:3344-3351.
[14] H Y Li,H K Yang,et al.Color-conversion and photoluminescence properties of Ba2MgW(Mo)O6:Eu phosphor[J].Journal of Alloys and Compounds,2011,509(35):8788-8793.
[15] G King,A M Abakumov,et al.Crystal structure and phase transitions in Sr3WO6[J].Inorganic Chemistry,2010,49(13):6058-6065.
[16] 谢安.白光LED用钼酸盐红色荧光粉的制备及发光性能研究[D].北京:中国地质大学,2010:35.
[17] M Gateshki,J M Igartua.Crystal structures and phase transitions of the double-perovskite oxides Sr2CaWO6and Sr2MgWO6[J].Journal of Physics:Condensed Matter,2004,16(37):6639-6649.

