小剂量多巴胺对氧化应激诱导大鼠心肌细胞凋亡的影响及其机制*
蔡晓娜, 时 飒, 李鸿珠, 王丽娜, 张 力, 李 弘
(哈尔滨医科大学基础医学院病理生理学教研室, 黑龙江 哈尔滨 150086)
小剂量多巴胺对氧化应激诱导大鼠心肌细胞凋亡的影响及其机制*
蔡晓娜, 时 飒, 李鸿珠, 王丽娜, 张 力, 李 弘△
(哈尔滨医科大学基础医学院病理生理学教研室, 黑龙江 哈尔滨 150086)
目的:探讨小剂量多巴胺(DA)对氧化应激诱导大鼠心肌细胞凋亡的作用及可能机制。方法:采用培养的新生大鼠心肌细胞,随机分为正常对照组(control),过氧化氢处理组(H2O2),小剂量多巴胺干预组(DA+H2O2),多巴胺受体Ⅰ型阻断剂干预组(DR1+DA+H2O2),多巴胺受体II型阻断剂干预组(DR2+DA+H2O2);应用流式细胞仪、MTT检测心肌细胞的凋亡率,透射电子显微镜检测细胞超微结构的变化,比色法检测细胞培养液中乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)活性,Western blot检测Cytochrone c、Caspase 3、Caspase 9的蛋白表达情况。结果:与单纯H2O2组相比,小剂量多巴胺(10 μmol/L)可降低LDH活性,升高SOD活性,抑制心肌细胞凋亡和凋亡相关蛋白的表达;DR1阻断剂SCH-23390干预后,能够部分逆转这种作用,而DR2阻断剂Haloperido干预后没有明显的变化。结论:小剂量多巴胺可能通过DR1抑制氧化应激诱导的心肌细胞凋亡。
凋亡;多巴胺;心肌细胞;氧化应激;大鼠
心力衰竭(heart failure,HF)是各种心血管疾病的终末阶段,是工业化国家首位死亡原因,而心肌细胞凋亡是导致心衰的重要原因。心肌细胞凋亡的发生机制复杂,目前认为主要与氧化应激、心脏负荷增加、炎症反应、缺血缺氧、神经内分泌失调有关[1]。研究证实, 各种类型的心力衰竭患者和动物模型都存在氧自由基过量生成的现象,因此如何通过抑制氧化应激,降低心肌细胞的凋亡率,从而改善心脏功能已成为目前心血管领域研究的热点[2]。
多巴胺(dopamine, DA)是一种重要的神经递质,属于内源性的儿茶酚胺。多巴胺在脑内含量较高,外周相对较低,因此,对多巴胺的研究历来主要集中在神经系统疾病。研究显示,在低温贮存的细胞和肾脏中加入多巴胺,能够抑制氧化应激,改善移植后的细胞和肾脏功能[3,4]。在大鼠血管平滑肌细胞,小剂量多巴胺作为抗氧化剂,抑制平滑肌细胞的增殖[5]。本研究在前期工作的基础上,采用原代培养的大鼠心肌细胞,利用过氧化氢处理作为氧化应激的细胞模型,观察小剂量多巴胺及其受体阻断剂对心肌细胞凋亡的作用[6]。
1 材料与方法
1.1 实验动物
Wistar乳鼠(1~3 d,雌雄不限),由哈尔滨医科大学附属第二医院实验动物中心提供。
1.2 主要试剂
DMEM培养液、优等胎牛血清 (Hyclone);DR1阻断剂SCH-23390、DR2阻断剂Haloperido、MTT(Sigma);Western 及IP细胞裂解液(Beyotime);Western Blue(Promega);Anexin-V凋亡检测试剂盒(北京宝赛);乳酸脱氢酶(lactate dehydrogenase,LDH)和超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(南京建成);Fas、Bcl-2、Caspase 3、Caspase 9抗体(Santa Cruz);其他试剂均为分析纯。
1.3 主要器材
倒置相差显微镜(OLYMPUS IX70),培养箱(SANYO),VS-1300-U净化工作台(苏州安泰空气技术公司),Western blot电泳槽(BIO-RAD),凝胶成像系统2000(美国BIO-RAD),高速低温离心机(美国Beckman),US-640紫外分光光度计(Beckman),酶标仪(美国Biotek)。
1.4 新生大鼠心肌细胞的培养
按文献方法,取出生1~3 d的Wistar乳鼠心脏,经0.25%胰蛋白酶分3次消化成单细胞悬液, 经离心、洗涤后加入含10 %胎牛血清的DMEM培养基中,差速贴壁法于37℃、5% CO2孵箱中培养2 h。将富含心肌细胞的培养液再次接种于含10%胎牛血清、1 μmol/L阿糖胞苷的高糖DMEM中,24 h换液,去除阿糖胞苷后48 h加干预药物。
1.5 实验细胞分组
正常对照组(control):正常培养乳鼠心肌细胞,未做任何干预,培养时间同其他组; 过氧化氢处理组(H2O2):取培养48 h的乳鼠心肌细胞,加入过氧化氢,终浓度为100 μmol/L,继续培养72 h;小剂量多巴胺干预组(DA+H2O2):取培养48 h的乳鼠心肌细胞,加入多巴胺,终浓度为10 μmol/L,培养2 h后加入过氧化氢,终浓度为100 μmol/L,继续培养72 h;多巴胺受体D1阻断剂干预组(DR1+DA+ H2O2):取培养48 h的乳鼠心肌细胞,加入DR1阻断剂,终浓度10 mmol/ L,培养2 h,其他同小剂量多巴胺干预组(DA+H2O2);多巴胺受体D2阻断剂干预组(DR2+DA+H2O2)同DR1。
罗璨璨(1994—),女,福建仙游人,硕士研究生,研究方向为岩土工程数值模拟、大坝与基础工程等方面的研究工作。
1.6 流式细胞仪检测凋亡率
分别取各组培养的心肌细胞,经0.25%胰蛋白酶消化后,用PBS洗涤2次,调整细胞密度为1×106cells/ml,制成单细胞悬液,加入100 μl Binding Buffer和FITC标记的Annexin-V(20 μg/ml)10 μl,室温避光30 min,再加入PI(50 μg/ml)5 μl,避光反应5 min后,加入400 μl Binding Buffer,立即用FACScan进行流式细胞术定量检测。
1.7 透射电镜观察超微结构
0.25%胰蛋白酶消化细胞4 min,PBS洗涤1遍,2 000 r/min离心10 min,弃上清收集细胞;4℃,2.5%戊二醛固定;1%锇酸固定,常规乙醇、丙酮逐级脱水,环氧树脂包埋,超薄切片,铅铀双重染色,透射电镜观察并摄片。
1.8 MTT检测细胞存活率
培养于96孔板中的细胞,经无血清培养后,每孔加入MTT溶液20 μl (5 mg/ml ),37℃继续孵育4 h,弃上清,每孔加入150 μl DMSO,振荡10 min,使结晶物完全溶解。设置空白对照(只有DMSO,没有细胞),490 nm 波长酶标仪检测各孔吸光度( A ) 值。设定正常对照组细胞存活率为100%,实验组细胞存活率=(实验组A值/对照组A值)×100%。
(1)取培养48 h的乳鼠心肌细胞,分别加入不同浓度的过氧化氢0、10、20、50、100、150、200、300、500 μmol/L,培养72 h,利用MTT检测细胞存活率。(2)取培养48 h的乳鼠心肌细胞,分别加入不同浓度的多巴胺0、1、10、20、50、100、500、1 000、10 000 μmol/L,培养72 h,利用MTT检测细胞存活率。(3)取培养48 h的乳鼠心肌细胞,分别加入不同浓度的多巴胺0、100、100、100、100 μmol/L,培养2 h,再分别加入不同浓度的过氧化氢0、0、1、10、20 μmol/L,培养72 h,利用MTT检测细胞存活率。(4)取培养48 h的乳鼠心肌细胞,分为对照组(只加入PBS),单纯过氧化氢组(100 μmol/L),小剂量多巴胺干预组(10 μmol/L多巴胺预孵育2 h,再加入100 μmol/L过氧化氢),多巴胺受体D1阻断剂干预组(预先加入10 mmol/ L DR1阻断剂培养2 h,再加入10 μmol/L多巴胺孵育2 h,最后加入100 μmol/L过氧化氢),多巴胺受体D2阻断剂干预组同多巴胺受体D1阻断剂干预组。利用MTT检测各组细胞存活率。
1.9 LDH和SOD活性检测
取各组细胞的培养液,考马斯亮蓝法测定蛋白浓度;按试剂盒说明书操作,运用紫外分光光度计记录吸光度(OD)值,计算细胞乳酸脱氢酶LDH和SOD活性。
1.10 蛋白质免疫印迹检测凋亡相关蛋白的表达
取各组培养的心肌细胞,PBS洗涤,加入全细胞裂解液,冰上处理10 min,4℃,12 000×g离心15 min,取上清进行蛋白质定量。取50 μg总蛋白样品于10%变性聚丙烯酰胺凝胶电泳,随后转印至PVDF膜,用10%无脂肪牛奶封闭后,分别用1∶1 000抗 Cytochrone c 、Caspase 3、Caspase 9,4℃孵育过夜。再用二抗(碱性磷酸酶标记,稀释度1∶1 000) 室温孵育1 h,最后用Western blue stabilized substrate for AP (Promega)显色,光密度扫描半定量分析显影条带。
1.11 统计学分析
2 结果
2.1 各组细胞存活率变化
(1)随着H2O2浓度增高,细胞存活率逐渐降低,50 μmol/L导致心肌细胞存活率降至(62.68±10.37)%,100 μmol/L为(46.4±9.08)%,200 μmol/L为(43.32±8.47)%。因此后续实验采用100 μmol/L;(2)不同浓度的多巴胺刺激心肌细胞,当浓度超过100 μmol/L,细胞存活率有所降低;(3)与单纯H2O2组相比,1 μmol/L多巴胺干预,细胞存活率没有明显的提高,10 μmol/L,20 μmol/L多巴胺干预,细胞存活率明显的提高,因此后续实验采用10 μmol/L;(4)使用多巴胺受体DR1的阻断剂,能够抑制多巴胺的这种保护作用;而使用多巴胺受体DR2的阻断剂,细胞存活率没有明显变化(图1)。


2.2 各组细胞凋亡率变化
流式细胞仪检测各组细胞凋亡率。(1)过氧化氢处理组的凋亡率(49.27±0.03)%较正常对照组明显增高(6.59±0.03)%(P<0.01);(2)与过氧化氢处理组相比,小剂量多巴胺预处理后,凋亡率明显降低 (18.07±0.02)%(P<0.01);(3)DR1阻断剂处理后取消了这种作用(32.48±0.02)%(P<0.01);(4)DR2阻断剂处理后没有明显的变化(21.47±0.03)%(图2)。
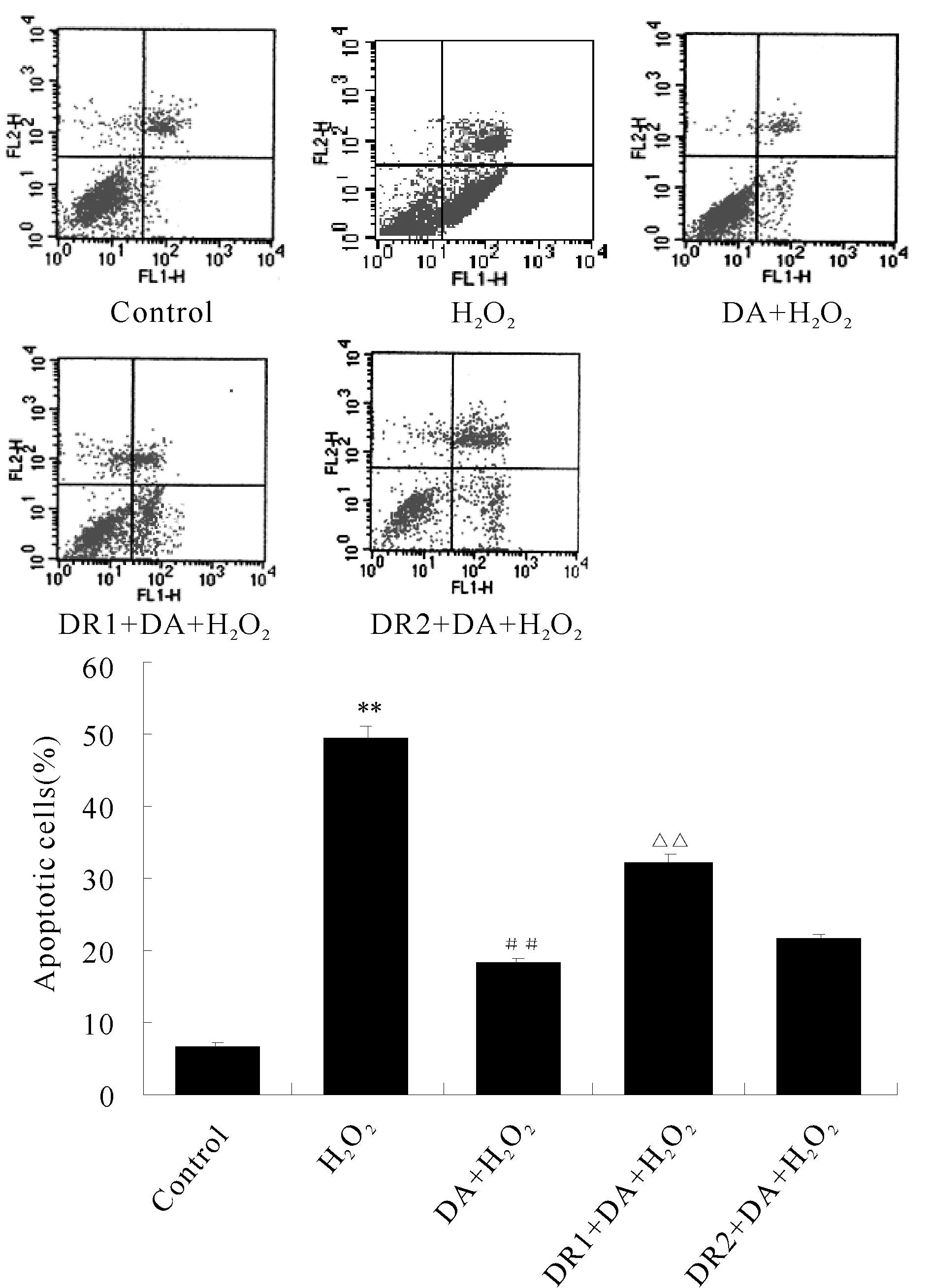
Fig.. 2 Cell apoptosis rate in different groups (n=8) H2O2: Hydrogen peroxide; DR: Dopamine receptor antagonist; DA: Dopamine**P<0.01vscontrol group;##P<0.01vsH2O2group;△△P<0.01vsDA+ H2O2group
2.3 各组细胞超微结构变化
正常对照组心肌细胞核染色质疏松,密度均匀,线粒体结构完好;过氧化氢处理组核膜皱缩、染色质凝聚,线粒体肿胀破裂;小剂量多巴胺干预后,核膜结构较完好,染色质部分凝聚,细胞损伤较过氧化氢处理组轻;DR1阻断剂处理后,细胞超微结构变化与过氧化氢处理组相似,线粒体肿胀和空泡化,肌丝溶解;DR2阻断剂处理后,细胞变化不明显(图3)。
2.4 各组细胞培LDH和SOD活性的变化
与正常对照组相比,过氧化氢处理后LDH活性明显升高,SOD活性明显降低;与过氧化氢处理相比,小剂量多巴胺处理后,降低了LDH活性,升高了SOD活性;DR1阻断剂处理后,取消了上述作用,而DR2阻断剂处理后,没有明显的改变(表1)。

Fig. 3 Morphologic changes with transmission electron microscope H2O2: Hydrogen peroxide; DR: Dopamine receptor antagonist


GroupLDH(U/ml)SOD(U/ml)Control35.55±4.1048.18±6.03H2O295.40±10.05**18.12±3.02**DA+H2O250.64±6.12##41.23±5.04##DR1+DA+H2O285.21±8.02△△22.09±3.01△△DR2+DA+H2O255.32±6.7839.09±4.01
H2O2: Hydrogen peroxide; DA: Dopaminee; DR: Dopamine receptor antagonist; LDH: Lactate dehydrogenase; SOD: Superoxide dismutase
**P<0.01vscontrol group;##P<0.01vsH2O2group;△△P<0.01vsDA+H2O2group
2.5 各组细胞凋亡相关蛋白的表达
Western blot 结果显示,与正常对照组相比,过氧化氢处理后Cytochrome c,Caspase 3,Caspase 9蛋白表达增加;与过氧化氢处理相比,小剂量多巴胺处理后,上述凋亡相关蛋白明显降低;DR1阻断剂处理后,蛋白表达变化同过氧化氢处理组类似,与单纯多巴胺处理组相比,使用DR2阻断剂处理后,凋亡相关蛋白没有明显的改变(图4)。
3 讨论
心肌细胞作为终末分化细胞,正常情况下不存在明显的凋亡。但在疾病状态下,例如心肌梗塞、心肌缺血、缺氧及再灌注损伤,心肌细胞出现明显的凋亡;而活性氧分子(reactive oxygen species, ROS)在细胞凋亡过程中起着举足轻重的作用。ROS是外源性氧化剂或细胞内有氧代谢过程中产生的具有高生物活性含氧化合物的总称,包括超氧化物、过氧化氢、单线态氧和氢氧根阴离子等[7]。本实验利用过氧化氢处理培养的心肌细胞,复制氧化应激的细胞模型。结果显示,随着过氧化氢浓度的增高,细胞存活率明显降低,呈剂量依赖关系;同时凋亡相关蛋白表达也明显增加,提示使用该模型研究氧化应激诱导心肌细胞凋亡是可行的。

Fig. 4 Expression of apoptosis protein in cardiomyocyte of different groups H2O2: Hydrogen peroxide; DA: Dopamine; DR: Dopamine receptor antagonist**P<0.01vscontrol group;##P<0.01vsH2O2group;△P<0.05,△△P<0.01vsDA+H2O2group
生理状态下,多巴胺调节躯体运动和精神活动。在某些病理状态下,例如脑缺血性疾病,多巴胺急剧增加(超过50 mmol/L),会产生毒性而引起细胞凋亡[8]。但研究表明,小剂量的多巴胺则具有抗氧化作用。本实验研究结果显示,当多巴胺浓度超过100 μmol/L , 可降低细胞存活率,而小剂量多巴胺(10 μmol/L)对细胞存活率没有明显的影响。另外使用小剂量多巴胺预处理,使细胞对后来高浓度的过氧化氢刺激作用有了抵抗,引起凋亡率降低,这种保护作用可以看做是一种预适应[9]。因为多巴胺在体内代谢的产物是自由基类物质,预先使用小剂量的自由基,刺激机体产生抗氧化酶类,从而能够抵抗接下来的大剂量自由基对细胞的损伤作用。
无论在中枢,还是在外周,多巴胺执行各种功能,发挥其重要的作用,都需要与相应受体结合才能完成。研究显示,大剂量多巴胺主要与肾上腺素能受体结合,而小剂量多巴胺则与多巴胺受体结合。多巴胺受体属于G蛋白偶联受体超家族成员,根据生化和药理学特性的不同,将其分为D1样和D2样受体,其中D1主要位于突触后,受体与腺苷酸环化酶正性耦联,与G蛋白中刺激亚单位(Gs)结合,激活腺苷酸环化酶(AC),使cAMP增高,刺激磷脂酶C,从而激活钙通道,使细胞内钙增高。D2样受体位于突触前和突触后,与腺苷酸环化酶负性耦联,与 Gi/Gq作用,抑制AC,使cAMP降低,抑制钙通道,调节钾通道[10,11]。研究显示,在血管平滑肌细胞中,多巴胺发挥抗氧化作用主要通过DR1[5]。本实验使用DR1阻断剂,发现的确可以逆转小剂量多巴胺的保护作用,因此证实在心肌细胞中,多巴胺也是通过DR1发挥抗氧化作用。在心肌细胞,ROS的主要来源是线粒体,因此本实验主要观察了细胞色素C的表达情况,结果显示小剂量多巴胺可以抑制线粒体释放细胞色素C,从而降低凋亡率。
综上所述,小剂量多巴胺对氧化应激诱导的心肌细胞的保护作用,主要是通过DR1介导的抑制线粒体途径凋亡的发生。
[1] Zhuo XZ, Wu Y, Ni YJ,etal. Isoproterenol instigates cardiomyocyte apoptosis and heart failure via AMPK inactivation-mediated endoplasmic reticulum stress[J].Apoptosis, 2013, 18(7): 800-810.
[2] 解丽君, 张建新, 李兰芳, 等. 异丙酚对离体大鼠心肌缺血/再灌注损伤后细胞凋亡及其机制研究[J]. 中国应用生理杂志, 2008, 24(1): 56-61.
[3] Talaei F, Bouma HR, Van der Graaf AC,etal. Serotonin and dopamine protect from hypothermia/rewarming damage through the CBS/H2S pathway [J].PLoSOne, 2011, 6(7): e22568.
[4] Schnuelle P, Gottmann U, Hoeger S,etal. Effects of donor pretreatment with dopamine on graft function after kidney transplantation: a randomized controlled trial [J].JAMA, 2009, 302(10): 1067-1075.
[5] Yasunari K, Kohno M, Kano H,etal. Dopamine as a novel antioxidative agent for rat vascular smooth muscle cells[J].Circulation, 2000, 101(19): 2302-2308.
[6] Li H, Shi S, Sun YH,etal. Dopamine D2 receptor stimulation inhibits angiotensin II-induced hypertrophy in cultured neonatal rat ventricular myocytes[J].ClinExpPharmacolPhysiol, 2009, 36(3): 312-318.
[7] Tsai KH, Wang WJ, Lin CW,etal. NADPH oxidase-derived superoxide anion-induced apoptosis is mediated via the JNK-dependent activation of NF-κB in cardiomyocytes exposed to high glucose[J].JCellPhysiol, 2012, 227(4): 1347-1257.
[8] Iuga C, Alvarez-Idaboy JR, Vivier-Bunge A. ROS initiated oxidation of dopamine under oxidative stress conditions in aqueous and lipidic environments[J].JPhysChemB, 2011, 115(42): 12234-12246.
[9] 吕国蔚, 崔秀玉, 赵兰峰, 等. 低氧预适应的脑机制[J]. 中国应用生理杂志, 2004, 20(1): 98-103
[10]Bunzow JR, Vantol HH, Grandy DK,etal. Cloning and expression of a rat D2 dopamine receptor cDNA[J].Nature, 1988, 336(6201): 783-787.
[11]Vallone D, Picetti R, Borrelli E,etal. Structure and function of dopamine receptors[J].NeurosciBiobehavRev, 2000, 24(1): 125-132.
Effects and mechanisms of low concentration dopamine on hydrogen peroxide-induced apoptosis in cultured neonatal rat cardiomyocytes
CAI Xiao-na, SHI Sa, LI Hong-zhu, WANG Li-na, ZHANG Li, LI Hong△
(Department of Pathophysiology, Harbin Medical University, Harbin 150086, China)
Objective: To study the effects of low concentration dopamine(DA) on hydrogen peroxide-induced apoptosis in cultured rat cardiomyocytes as well as the possible molecular mechanisms. Methods: Cultured neonatal rat cardiomyocytes were randomly divided into the following groups: control group(control), hydrogen peroxide group(H2O2), pretreated with low concentration dopamine(DA+ H2O2), dopamine receptor 1(DR1) antagonist group (DR1+DA+H2O2), dopamine receptor 2(DR2) antagonist group (DR2+DA+H2O2). The cell apoptosis was then assessed by MTT and flow cytometry. The cellular ultrastructure changes were observed by transmission electron microscope. The activity of lactate dehydrogenase( LDH )and superoxide dismutase (SOD) in cell medium was analyzed by colorimetry. The protein expressions of Cytochrone c, Caspase 3 and Caspase 9 were obtained by Western blot. Results: Compared with hydrogen peroxide group, low concentration dopamine(10 μmol/L)decreased the apoptosis rate and the expression of protein of apoptosis related protein, enhanced SOD activity, decreased LDH activity. DR1 antagonist SCH-23390 treatment inhibited dopamine induced cardiac protective effect. DR2 antagonist haloperido treatment had no changes compared with dopamine group. Conclusion: Above findings indicate that low concentration dopamine inhibits apoptosis induced by hydrogen peroxide in neonatal rat cardiomyocytes, which is partly associated with the activation of DR1.
apoptosis; dopamine; cardiomyocyte; hydrogen peroxide; rats
黑龙江省自然科学基金项目资助(D200880);黑龙江省教育厅课题(12521181)
2014-09-01 【修回日期】2014-11-03
R363.2
A
1000-6834(2015)01-067-05
10.13459/j.cnki.cjap.2015.01.020
△【通讯作者】Tel: 0451-86699587; E-mail: drlihong1971@163.com

