检测细胞DNA断裂损伤效应的彗星实验法的改良
赖金龙,付倩,任莎,吴国,陶宗娅,*,张红,罗学刚
1.四川师范大学生命科学学院,成都 610101 2.西南科技大学 教育部生物质材料教育部工程研究中心,绵阳 621010
检测细胞DNA断裂损伤效应的彗星实验法的改良
赖金龙1,付倩1,任莎1,吴国1,陶宗娅1,*,张红1,罗学刚2
1.四川师范大学生命科学学院,成都 610101 2.西南科技大学 教育部生物质材料教育部工程研究中心,绵阳 621010
为了解决彗星实验过程中常出现的脱胶、细胞核分离操作繁琐、重复性低等问题,对彗星实验方法进行了改良,初步建立了彗星实验的快速操作流程。结果显示,通过对载玻片进行预处理,可确保凝胶悬挂均匀;采用改良机械法分离的细胞核浓度适中;以0.5%(w/v)涂层琼脂糖作为基层、以1.5%(w/v)低熔点包埋琼脂糖作为叠加层的“双层凝胶法”,辅以“推片法”铺胶,操作便捷且不发生脱胶现象;细胞核膜经裂解处理后再进行电泳和荧光观察,彗星图像清晰,杂质少。应用改良后的彗星实验方法,操作简便,耗时更短,实验效果良好,可快速检测出细胞DNA损伤效应。
铯;蚕豆根尖细胞;遗传毒性;DNA损伤;彗星实验;改良
彗星实验(comet assay)也称单细胞凝胶电泳实验(single cell gel electrophoresis,SCGE),是一种操作简单、有效评估细胞DNA损伤的方法[1]。其原理是器官或组织细胞受外源因素(如辐射、重金属等)影响,细胞中的DNA发生单链或双链断裂,经裂解后,DNA解旋,在电场作用下,DNA断片迁移出细胞核,形成彗星状的电泳图谱;而正常细胞的大分子量DNA在电场作用下迁移距离较短,DNA仍保留在细胞核的范围,形成圆形或轻微拖尾的图谱[2]。根据电泳缓冲液的pH不同,可分为中性彗星实验(pH=8.4)和碱性彗星实验(pH>13),前者主要用于检测DNA双链的断裂损伤,而后者则具有更高的灵敏性,可用于检测更少量的单链和双链断裂损伤[3-5]。目前,彗星实验技术已广泛用于环境毒理学、生物监测、辐射生物学等领域[6-10]。
但彗星实验的灵敏度和结果的重复性易受低熔点琼脂糖浓度、裂解时间、电泳缓冲液组分、电泳条件等较多因素的影响;常用的“三明治”型的包埋法操作繁琐、易脱胶[11],机械法分离细胞核的效果不佳等因素[12],限制了此法的广泛应用。因此,建立一套快速、简单的实验流程尤为重要。本研究室通过对彗星实验方法的改良,已建立一套成熟的彗星实验流程,解决了长期存在的脱胶、机械法分离细胞核效果差、重复性低等问题,可快速检测出DNA的损伤效应。本文选用对环境污染物较为敏感的蚕豆为试材,以铯(133Cs+)为外源处理因子,以“中性彗星实验”为例,详细介绍实验操作流程、比较改良前后的检测效果及数据处理方法,为应用彗星实验检测细胞DNA损伤提供方法学指导。
1 试剂与仪器设备(Reagent and equipment required)
1.1 仪器设备
玻璃培养皿;冰盘;冰盒;1~10 μL,10~100 μL,100~1 000 μL移液器和枪头;1.5 μL扣盖离心管;解剖刀;脱色摇床(KB-900,海门其林贝尔);尼龙布(孔径200 μm);5 mL注射器;天平(精度0.001 g);微波炉(EG823LA3-NR,美的微波电器制造有限公司,佛山);恒温水浴锅(HWS26型,上海百典仪器设备有限公司);载玻片(带磨砂边);盖玻片;水平电泳槽(DYCP 31DN型,北京六一仪器厂);稳压电泳仪(DYY-6C型,北京六一仪器厂);计时器;徕卡正置荧光显微镜(DM3000,德国徕卡微系统有限公司):100~400倍,蓝色激发光波长460~485 nm。
1.2 试剂准备
去离子水(ddH2O);重铬酸钾洗液:称取重铬酸钾20 g,置500 mL烧杯中加入40 mL蒸馏水,加热溶解,冷却后,缓慢加入360 mL浓硫酸,搅匀,冷却后,装入棕色瓶中待用;甲醇;0.2 mmol·L-1磷酸缓冲液(PBS,pH 7.4),4 ℃预冷;涂层琼脂糖溶液(0.5%,w/v):称取250 mg常熔点琼脂糖,加入50 mL ddH2O,微波加热溶解,倒入50 mL离心管中,45 ℃水浴待用;包埋凝胶溶液(1.5%,w/v):150 mg低熔点琼脂糖加入10 mL PBS缓冲液中,微波加热溶解,45 ℃水浴待用(经过多次实验筛选,该浓度的包埋凝胶不脱落);5TBE (Tris-硼酸,pH 8.4)浓储存液(灭菌待用);电泳缓冲液(0.5TBE):量取100 mL TBE浓储存液,用ddH2O定容至1 000 mL,待用;SDS裂解缓冲液(2.5%,w/v,现配现用):称取25 g十二烷基磺酸钠(SDS)用电泳缓冲液溶解后,定容至1 000 mL,混匀备用;吖啶橙染色溶液(5 μg·mL-1):吸取250 μL 100 μg·mL-1吖啶橙贮备液,用PBS缓冲液稀释至5 mL,避光保存。以上所用试剂均为分析纯,购自Sigma公司。
2 实验流程(The testing flow)
2.1 试材及其处理
蚕豆品种为“成胡一号”(Vicia faba L.),购自成都市种子市场。目前我国土壤中Cs+的背景值为8.24 mg·kg-1[13],因此对照组浓度为8.24 mg·L-1(CK);再根据预实验结果,选择损伤效应较为明显的Cs+处理液浓度[ρ(Cs+)]100 mg·L-1和200 mg·L-1作为实验组,溶液配制均用1/6改良霍格兰营养液。
种子经消毒、浸种,适温下萌发至胚根1 cm左右[14]。选择胚根长度一致的蚕豆放入垫有双层滤纸的培养皿中,分组编号,每组分别添加Cs+处理液10 mL。培养皿置于25 ℃恒温培养箱中,避光培养48 h后,选取蚕豆根尖进行彗星实验,其操作步骤依据中华人民共和国国家标准《GB/T 23748—2009 辐照食品的鉴定DNA彗星试验法筛选法》[2],并对其操作流程进行改良和实验条件的优化。
2.2 载玻片涂胶预处理
选取一端带有磨砂的载玻片,置于重铬酸钾洗液中,浸泡至少30 min后,取出,用自来水冲洗,蒸馏水冲洗,晾干后置于甲醇中保存。取1张洁净的载玻片直接放入装有50 mL涂层琼脂糖溶液中(45 ℃),停留5~10 s,取出,观察载玻片表面凝胶是否悬挂均匀,垂直晾干,备用,可保存1周。
2.3 植物组织细胞核悬液的制备
选取处理后的蚕豆根尖6个,置于冰盘上的培养皿中,加入1 mL预冷的PBS缓冲液,用解剖刀快速切成薄片,将缓冲液和组织薄片转入1.5 mL离心管中,放入冰盒内(避光),脱色摇床220 r·min-1震荡10 min。
将离心管中的细胞核悬液及组织薄片全部转移到垫有尼龙布圆片(孔径200 μm)的注射器中,推动活塞,过滤至1.5 mL离心管中,置冰盒内保存待用。
2.4 细胞核的包埋
将细胞核悬液与包埋凝胶溶液以1∶3的比例混合(如:取150 μL细胞核悬液,加入450 μL包埋凝胶溶液快速混匀),置45 ℃水浴保温,用枪头吸取100 μL混合液滴于已涂胶的载玻片上,用洁净盖玻片推片,将混合液铺平,置冰盘上冷却。
2.5 核膜裂解及电泳
将已包埋细胞核的载玻片放入培养皿中,倒入适量的SDS裂解缓冲液(2.5%,w/v),裂解30 min,使核膜溶解。裂解后,将载玻片并排放入水平电泳槽中,加入电泳缓冲液(0.5TBE),稳压10 V,电泳15 min(此条件下易于观察到细胞凋亡现象)。
2.6 染色与荧光观察
取出电泳后的载玻片,置于染色培养皿中,每一张载玻片滴加100 μL吖啶橙染色溶液(5 μg·mL-1),避光染色5 min。染色完成后,流水冲洗多余染液后,放入蒸馏水中保湿(可保存5~6 h),避光待用。
荧光观察:取出已染色的载玻片,吸去多余水分,置于荧光显微镜(物镜10~40倍,460 ~485 nm的蓝色激发光)下观察,采集图像数据并保存,图片格式为TIFF。
3 数据处理及结果分析(Data processing and results analysis)
细胞中的DNA与吖啶橙结合后,在蓝色激发光(460~485 nm)下发出绿色荧光。正常细胞的DNA未受到损伤,核膜裂解后,主要以超螺旋形式存在,在电流作用下,DNA大分子移动距离较短,荧光集中在细胞核(包括大分子量DNA);随着细胞中DNA损伤加剧,DNA出现断裂,在电流作用下,断片(构成彗星尾部)迁移出细胞核(构成彗星头部),其迁移距离和彗星尾部DNA含量即可表示DNA的损伤程度[15]。本研究表明,若不经过核膜裂解而直接电泳,DNA断片无法迁移出细胞核(图1“a”),裂解30 min后,则明显观察到彗星图像(图1“b”)。
彗星分析软件(comet assay software project,CASP)可将图像转化为彗星常用统计量(图1“c”),其中彗星尾长(tail length of comet,TL)在一定程度上反映了DNA损伤程度和DNA断裂片断的大小;彗尾DNA比例 (percent DNA in the tail,TD)表示随DNA损伤加重,尾部DNA含量递增,头部DNA含量递减,则尾部DNA含量比例增加;彗星尾距(tail moment,TM)表示尾部DNA含量和彗尾长度的乘积,是衡量DNA损伤的基本参数[16-17]。
采集样本数据后,通过“3D Bars”图显示各样本详细数据(图2 A1,B1,C1),可见,随Cs+处理浓度增加,样本中受损伤的细胞数及损伤程度均明显增加。通过“箱图”进行统计(图2 A2,B2,C2),结果显示,随Cs+处理浓度增加,TL、TD和TM均呈上升趋势。进行方差分析时为了避免犯“第二类错误”(即处理间实际存在显著差异而未能检验出),因此选用LSD法进行均值多重比较。表1可见,与CK比较,当r(Cs+)为200 mg·L-1时,TL、TD和TM均显著增加(P<0.05),表明蚕豆胚根DNA受到显著的损伤。
4 讨论(Discussion)
应用彗星实验在单细胞水平上检测细胞的DNA损伤程度,简单有效。但常规操作较为繁琐,常出现涂胶不均匀、脱胶、细胞核悬液浓度不合适、重复性较差等问题。本研究通过多次实验,发现导致涂胶不均匀的原因主要是载玻片不干净或有油脂,采用重铬酸钾洗液和甲醇依次浸泡载玻片后,晾干,再涂层琼脂糖溶液,较好地克服了涂胶不均匀的问题,且可回收利用载玻片,避免了以往一次性使用载玻片造成的浪费。
目前较常用的植物细胞核的提取方法主要是酶解分离法和机械分离法[12],其中酶解分离法成本较高,时间较长,操作复杂;机械分离法通过切片、机械震荡可快速分离得到适宜浓度的细胞核悬液,操作方便。本研究显示,细胞核的提取浓度主要受摇床转速和震荡时间的影响,经改进,选用转速220 r·min-1,震荡10 min,可获得以蚕豆为试材时适宜浓度的细胞核悬浮液。对于其他实验材料,若细胞核浓度较低,可适当增加根尖量;同时,应根据实验材料选择适宜孔径的尼龙布,避免因尼龙布孔径太大,滤液杂质太多,影响观察。
本研究表明,包埋凝胶的脱胶问题主要与低熔点琼脂糖浓度和细胞包埋的方法有关,若采用常规的“三明治”法进行细胞包埋,凝固后需移去盖玻片片[18],极易造成脱胶。经改良后,以0.5%(w/v)涂层琼脂糖作为基层,以1.5%(w/v)包埋凝胶作为叠加层,同时用“推片法”铺展叠加层,这种“双层凝胶法”操作方便,不需移去盖玻片等步骤,较好地解决了脱胶问题。
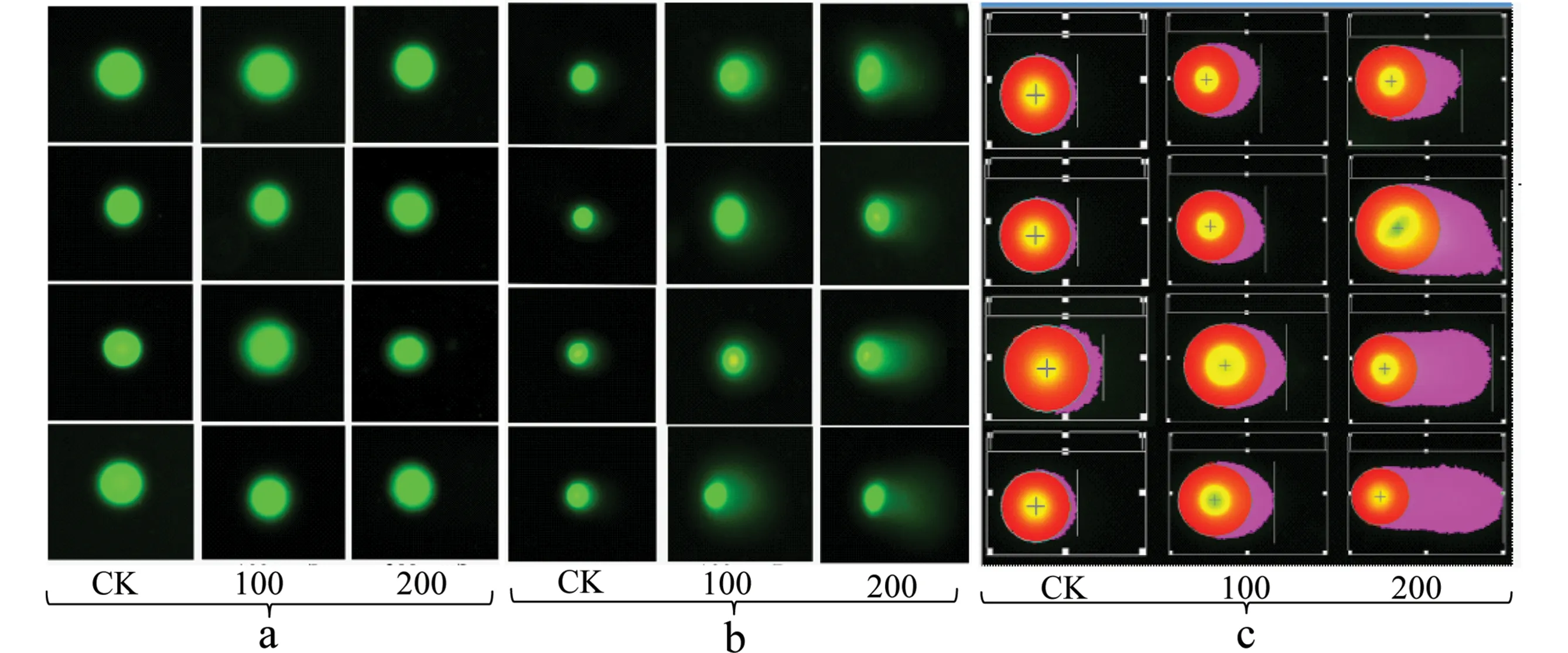
图1 不同浓度Cs+对蚕豆根尖细胞DNA损伤的彗星实验结果及细胞核膜裂解处理对彗星实验结果影响的比较

表1 不同浓度Cs+对蚕豆胚根细胞DNA损伤的彗星评价Table 1 The score analysis of the comet assay for the DNA damage in the radicle cells of Vicia faba treated by Cs+ in different concentrations
注:采用LSD法进行多重比较,同一列不同字母表示差异显著(P<0.05)。
Note: Different letters in a column means significant difference at the 5 % level.
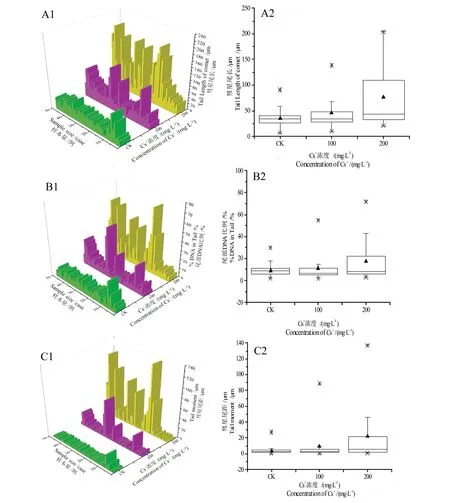
图2 用"3D Bars"图(A1、B1、C1)和"箱图"(A2、B2、C2)描述不同浓度Cs+对蚕豆根尖DNA的损伤程度
本研究显示,细胞核膜的完整性对实验结果有显著的影响,未经细胞核膜的裂解处理过程,细胞核中的DNA断片无法迁移出细胞核,导致“假阴性”结果。因此,核膜裂解步骤不可省略。
由于彗星实验结果受电泳条件(如:电泳缓冲液、电压大小、电泳时间等)的影响,为了避免因电泳条件不同而形成“假阳性”结果,应严格保持电泳条件一致。若采用彗星实验法检测细胞凋亡现象,建议选用低电压(10 V),电泳15 min。
与国家标准方法(GB/T 23748—2009)比较,本研究在实验环节、实验条件及耗时等5个方面进行了较好的改进和优化(表2)。
由于细胞个体存在差异,彗星实验各指标(TL、TD、TM)受极值的影响较大,导致标准偏差较大,若采用均值表示结果会导致量化意义降低[19]。因此,彗星实验的统计分析建议采用SPSS 软件的Explore统计过程和频数分布功能,并使用Origin软件绘制“3D Bars”图和“箱图”,用于显示样本数据的分布情况和样本处理间差异性的比较。
综上所述,通过对彗星实验方法的改进和优化,建立了简单、快速的彗星实验流程(图3)。

表2 彗星实验技术改良前后实验效果比较Table 2 Comparison between the improved comet assay and the standard method

图3 快速检测细胞DNA断裂损伤效应的彗星实验法实验流程
[1] Olive P L,Banath J P.The comet assay: A method to measure DNA damage in individual cells [J].Nature Protocols,2006,1(1): 23-29
[2] 中华人民共和国国家质量监督检验检疫总局.GB/T 23748—2009 辐照食品的鉴定DNA彗星试验法筛选法[S].北京: 中国标准出版社,2009
[3] Ventura L,Giovannini A,Savio M,et al.Single cell gel electrophoresis (comet) assay with plants: research on DNA repair and ecogenotoxicity testing [J].Chemo sphere,2013,92(1): 1-9
[4] Singh N P,McCoy M T,Tice R R,et al.A simple technique for quantitation of low levels of DNA damage in individual cells [J].Experimental Cell Research,1988,175(1): 184-191
[5] Stefan P,Hans U W.Detection of DNA-crosslinking agents with the alkaline comet assay [J].Environmental and Molecular Mutagenesis,1996,27(1): 196-201
[6] 晋艺聪,洪帅,焦玉国.单细胞凝胶电泳检测DNA损伤的方法及应用[J].中央民族大学学报: 自然科学版,2010,19(4): 17-21
Jin Y C,Hong S,Jiao Y G.Study on DNA damages with single cell gel electrophoresis and the application [J].Journal of MUC: Natural Science Edition,2010,19(4): 17-21 (in Chinese)
[7] Jha A N.Ecotoxicological applications and significance of the comet assay [J].Mutagenesis,2008,23(3): 207-221
[8] Dusinska M,Collins A R.The comet assay in human biomonitoring: Gene-environment interactions [J].Mutagenesis,2008,23(3): 191-205
[9] Olive P L.Impact of the comet assay in radiobiology [J].Mutation Research/Reviews in Mutation Research,2009,681(1): 13-23
[10] Wasson G R,McKelvey-Martin V J,Downes C S.The use of the comet assay in the study of human nutrition and cancer [J].Mutagenesis,2008,23(3): 153-162
[11] Le Grandois J,Ruas M,Kalisa P,et al.Detection of cold chain abuse in frozen and chilled salmon using the comet assay [J].LWT - Food Science and Technology,2013,54(1): 242-248
[12] 林爱军,张旭红,张增利,等.利用不同植物进行DNA损伤彗星实验的方法比较[J].生态毒理学报,2006,1(2): 165-171
Lin A J,Zhang X H,Zhang Z L,et al.A comparation study using comet assay to detect DNA damages in different plant spescies [J].Asian Journal of Ecotoxicology,2006,1(2): 165-171 (in Chinese)
[13] 中国环境监测总站.中国土壤元素背景值[M].北京: 中国科学出版社,1990: 87
[14] 赖金龙,陶宗娅,吴国,等.邻苯二甲酸二丁酯对蚕豆胚根细胞微核形成的影响及毒理机制[J].生态毒理学报,2014,9(1): 107-113
Lai J L,Tao Z Y,Wu G,et al.Effect of di-n-butyl phthalate on cell micronucleus formation and the mechanism of toxicity in Vicia faba radicle [J].Asian Journal of Ecotoxicology,2014,9(1): 107-113 (in Chinese)
[15] Ostling O,Johanson K J.Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells [J].Biochemical and Biophysical Research Communications,1984,123(1): 291-298
[16] 曹玉伟,马军,郭长虹,等.植物彗星实验及其在生态毒理监测中的应用[J].生态毒理学报,2009,4(2): 183-189
Cao Y W,Ma J,Guo C H,et al.Plant comet assay and its application on environment pollution monitoring [J].Asian Journal of Ecotoxicology,2009,4(2): 183-189 (in Chinese)
[17] Gyori B M,Venkatachalam G,Thiagarajan P S,et al.Open Comet: An automated tool for comet assay image analysis [J].Redox Biology,2014(2): 457-465
[18] Gichner T,Patkova Z,Szakova J,et al.Toxicity and DNA damage in tobacco and potato plants growing on soil polluted with heavy metals [J].Ecotoxicology and Environmental Safety,2006,65(3): 420-426
[19] 陈颖,王子健.用彗星试验检测土壤污染对蚯蚓活体基因损伤[J].土壤学报,2005,42(2): 576-583
Chen Y,Wang Z J.Detection of genotoxicity of soil pollution to earthworm in vivo exposure by comet assay [J].Acta Pedologica Sinica,2005,42(2): 576-583 (in Chinese)
◆
Improvements of the Comet Assay for Rapid Detecting the Rupture and Damage of DNA in Cells
Lai Jinlong1,Fu Qian1,Ren Sha1,Wu Guo1,Tao Zongya1,*,Zhang Hong1,Luo Xuegang2
1.Life Science College,Sichuan Normal University,Chengdu 610101,China 2.Engineering Research Center of Biomass Materials,Ministry of Education,Southwest University of Science and Technology,Mianyang 621010,China
25 November 2014 accepted 30 December 2014
The comet assay or single cell gel electrophoresis assay (SCGE) provides a simple and effective method for evaluating DNA damage in cells.The method is based on the capability with which the denatured and cleaved DNA fragments migrated out of the nucleoid under the effects of external electric field,whereas undamaged DNA migrated slower and remained mainly in the nucleoid under the same condition.Degree of DNA damage could be assessed by evaluating the tail length of comet (TL),the percent DNA in the tail (TD) and the tail moment (TM) of the DNA “comet” which were built upon the DNA fragments.Although the details and the technique process of the method has been improved recently,there are many problems and difficulties which still remain unresolved,such as the agarose gel debonding,very complex results of the nucleus separation,low repeatability of experimental results and non-standardized technique process of the method,and etc.In view of the above problems,the technical details of the quick process method have been improved in the research.The results showed that it was ensured that the agarose gel was distributed uniformly on the slides through the pretreatment of slide; the nucleus concentration were appropriate which were collected by the improved mechanical separation method; the problem of agarose gel debonding were better solved by the way of double gel layer in which 0.5% (weight in volume,w/v) agarose was used as the basal layer and the low metling agarose of 1.5 % (w/v) used as the overlay,and agarose gel laid slowly with coverslip.It is indicated that the clear picture and fewer impurity could be presented by the improved comet assay and the method is a simple and rapid for analysis degree of DNA damage.
Cs; radicle cells; Vicia faba; genotoxicity; DNA damage; the comet assay; improved
国家核设施退役及放射性废物治理科研重点项目(14ZG6101);四川省教育厅重点课题(14ZA0030);四川省生物质改性材料工程
赖金龙(1991-),男,硕士生,研究方向为生态毒理学,E-mail: 599101592@qq.com;
*通讯作者(Corresponding author),E-mail: t89807596@163.com
10.7524/AJE.1673-5897.20141125001
2014-11-25 录用日期:2014-12-30
1673-5897(2015)4-195-08
Q331
A
陶宗娅(1957-),女,博士,教授,研究方向为植物逆境生物化学与分子生物学。
技术研究中心(西南科技大学)开放课题(12zxbk03);四川师范大学校级青年课题(14qn07);四川师范大学实验技术课题(SYJS2014-14)
赖金龙,付倩,任莎,等.检测细胞DNA断裂损伤效应的彗星实验法的改良[J].生态毒理学报,2015,10(4): 195-202
Lai J L,Fu Q,Ren S,et al.Improvements of the comet assay for rapid detecting the rupture and damage of DNA in cells [J].Asian Journal of Ecotoxicology,2015,10(4): 195-202 (in Chinese)

