孕鼠PFOS暴露对糖皮质激素水平及胎鼠生长发育的影响
韩鹏飞,李洪志,陈志会,张羽飞,袁晓环,初彦辉,赵冰海,*
1.牡丹江医学院红旗医院,牡丹江 157001 2.牡丹江医学院黑龙江省抗纤维化生物治疗重点实验室,牡丹江 157001
孕鼠PFOS暴露对糖皮质激素水平及胎鼠生长发育的影响
韩鹏飞1,李洪志2,陈志会1,张羽飞2,袁晓环2,初彦辉2,赵冰海2,*
1.牡丹江医学院红旗医院,牡丹江 157001 2.牡丹江医学院黑龙江省抗纤维化生物治疗重点实验室,牡丹江 157001
为探究孕期全氟辛烷磺酸(PFOS)暴露与母源糖皮质激素(GC)水平、胎鼠生长发育之间的关系,将孕期为12 d(GD12)的24只SD雌性大鼠,随机分为4组给予不同剂量的PFOS(0,5,10,20 mg·kg-1),连续灌胃7 d,在GD19时对孕鼠和胎鼠的体重、胎鼠肝脏系数和肝脏生化指标、孕鼠血清的生化指标和GC水平、胎盘11β-羟基类固醇脱氢酶2(11β-HSD2)的酶学活性和胰岛素样生长因子-1(IGF-1)的mRNA表达水平分别进行检测。结果表明,与对照组相比:PFOS 20 mg·kg-1组,母鼠体重、胎鼠体重和体长显著下降(P<0.001);PFOS 20 mg·kg-1组,胎鼠肝脏脏器系数低于对照组(P<0.001);PFOS 10 mg·kg-1组,胎鼠肝脏中的酶活性(ALT、AST和ALP等)显著升高(P<0.001);PFOS 20 mg·kg-1组,孕鼠血清GC水平升高(P<0.05);胎盘IGF-1的mRNA表达水平随PFOS剂量升高而降低;胎盘11β-HSD2的活性随PFOS剂量升高而降低。研究表明,孕期暴露PFOS可以导致胎鼠肝脏毒性,降低胎盘11β-HSD2氧化活性导致GC浓度升高,进而影响胎鼠的生长发育。
全氟辛烷磺酸;孕鼠;孕期暴露;胎鼠生长;11β-羟基类固醇脱氢酶2;糖皮质激素
PFOS(全氟辛烷磺酸,perfluorooctanesulfonate)是一类重要的全氟表面活性剂[1],广泛应用于民用产品和工业生产中[2],由于其高度稳定性,已成为新型持久性有机污染物质,在生物体内的蓄积水平也备受关注。PFOS的蓄积率在人体中非常高,清除半衰期为5.4 y[3]。近年来,国内外有愈来愈多的PFOS毒理学方面的研究报道,主要集中在PFOS的肝脏毒性[4]、神经毒性[5-7]、胚胎发育毒性[8]和生殖毒性[9]等。PFOS的主要毒效应靶器官是肝脏,并可通过胎盘屏障,危害子代健康[10-11]。
母源糖皮质激素(GC)对胎儿的生长发育有明显的影响[12-13],11β-母源糖皮质激素羟基类固醇脱氢酶2(11β-HSD2)作为GC代谢主要限速酶调节母胎间经胎盘转运GC的量,它能有效地将母体内有活性的皮质醇在通过胎盘输送给胎儿的过程中快速灭活,转化为无活性的状态,对母体与胎儿间皮质醇的自由转运起到一个限制性屏障作用,保护胎儿免受母体GC的暴露[14]。因此,胎盘11β-HSD2水平的降低会引起胎儿宫内GC过度暴露,对子代今后的生长发育产生长期的影响。
本研究拟将孕鼠在孕期持续暴露于不同剂量的PFOS,检测孕鼠和胎鼠的各项生理生化指标、孕鼠血清GC水平、胎盘11β-HSD2的活性及胰岛素样生长因子(IGF-1)的变化,以了解PFOS染毒对11β-HSD2活性的影响,为探究由PFOS环境污染物所引起的胎儿的生长异常提供研究基础。
1 材料与方法(Materials and methods)
1.1 主要试剂和仪器
PFOS(Fluka公司,纯度>98%),血清糖皮质激素ELISA试剂盒(武汉华美生物技术公司,CSB-E11326r),RNA提取试剂盒(OMEGA R6812),逆转录试剂盒(Roche 04897030001),SYBR Green(Roche 04913914001),Corticosterone (PerkinElmer NEN Radiochemicals,NET399001MC),IVC动物房(苏州净化,MN-LM350P),全自动生化分析仪(OLYMPUS,AU640),酶联免疫分析仪(Molecular Device,SpectraMaxM3),实时定量PCR分析仪(ABI,StepOne),放射性TLC薄层扫描仪(Bioscan,AR2000)。
1.2 实验动物
选取孕期11 d的SPF级SD大鼠24只,购自北京维通利华实验动物技术有限公司,生产许可证:SCXK(京)2006-0009。随即分为4组,每组6只。染毒组:浓度分别为 5、10 和 20 mg·kg-1PFOS,对照组:体积分数为0.5%的Tween20。
1.3 实验方法
1.3.1 动物染毒和取材染毒组和对照组的SD孕鼠
每天经口灌胃PFOS 1次,从GD12 d到GD18 d连续灌胃7 d。在GD19 d用戊巴比妥钠麻醉后剖腹取胎,取出胎鼠和胎盘后,检测胎鼠体重、身长、胎盘重量。解剖孕鼠和胎鼠,获得血液和所需器官,-80 ℃低温保存备用。
1.3.2 胎鼠脏器系数的测定
取出胎鼠后,迅速将胎鼠肝脏用生理盐水漂洗,滤纸吸干准确称取肝脏重量,计算脏器系数:脏器系数(%)=脏器重量(g)/胎鼠体重(g)×100%。
1.3.3 生化指标检测
将母鼠的血液3 000 r·min-1,4 ℃离心30 min后取上清,将胎鼠肝脏匀浆,700 r·min-1,4 ℃离心30 min后离心取上清。使用全自动生化分析仪测定血清和组织匀浆中的相关指标。
1.3.4 血清糖皮质激素ELISA检测
按照说明书操作,用酶标仪450 nm波长依序测量每孔的OD值。
1.3.5 Real time PCR检测
提取SD鼠胎盘的总RNA、逆转录为cDNA(按说明书操作),用Realtime PCR系统检测IGF-1基因,引物序列为:正向:5'-ACTCTGCTTGCTCACCTTTACC-3';反向:5'-TCATCCACAATGCCCGTC-3'。实时定量PCR扩增反应的条件为95 ℃预变性5 min 1个循环后,每个循环变性95 ℃、 30 s,退火60 ℃、 30 s,延伸72 ℃、 30 s,共45个循环,采集循环退火后的荧光信号,结果分析时以Rps16为内参。
1.3.6 酶学活性检测
取胎盘50 mg左右,在含有0.25 mol·L-1蔗糖的0.01 mol·L-1的PBS中匀浆,4 ℃、 700 g离心30 min,检测蛋白浓度。胎盘蛋白50 μg与10 nmol·L-1皮质酮 (CORT,30000 cpm[3H]-CORT)、0.2 mmol·L-1NAD+、5 mmol·L-1DTT 37 ℃孵育1 h,2 mL冰乙醚终止反应,提取类固醇,氮气吹干,每孔75 μL乙醚溶解,点样与TLC板,Bioscan AR2000酶学分析仪检测转化率。
1.3.7 统计学分析
实验数据采用GraphPad Prism 5.0进行分析,计量资料以X±SEM表示,组间采用单因素方差分析比较差异。
2 结果(Results)
2.1 PFOS染毒对孕鼠和胎鼠体重和生长情况的影响
对孕鼠给药前后的体重进行统计发现:随着给药浓度的加大体重有明显的下降趋势,20 mg·kg-1组(P<0.001)最为明显;胎鼠的体重、体长和胎盘的重量在20 mg·kg-1组也出现明显下降(P<0.001),见表1。

图1 PFOS染毒对胎鼠肝脏脏器系数的影响
2.2 PFOS染毒对孕鼠和胎鼠肝脏及生化指标的影响
不同剂量PFOS染毒后,胎鼠的肝脏脏器系数有随着染毒剂量加大而降低的趋势,其中10 mg·kg-1组(P<0.05)和20 mg·kg-1组(P<0.001)较为明显,见图1。
利用全自动生化分析仪对不同剂量染毒组胎鼠的肝脏匀浆进行检测,发现ALT、AST、TP、ALB、GGT、ALP、CHE在10 mg·kg-1组都出现显著的升高(P<0.001),见表2。

表1 PFOS染毒对孕鼠和胎鼠体重和生长情况的影响Table 1 Effect of PFOS on body weight and growth conditions of the pregnant rats and fetal rats
注:与对照组相比,*,P<0.05,**,P<0.01,***,P<0.001。
Note: Compared with control,*,P<0.05,**,P<0.01,***,P<0.001.

表2 PFOS对胎鼠肝脏生化指标的影响Table 2 Effect of PFOS on pup liver biochemical parameters
注:与对照相比,*,P<0.05,**,P<0.01,***,P<0.001。
Note: Compared with control,*,P<0.05,**,P<0.01,***,P<0.001.
不同染毒组孕鼠的血清生化结果见表3,TP在10 mg·kg-1和20 mg·kg-1组出现下降,与对照组比较(P<0.05);ALB在10 mg·kg-1组出现下降与对照组比较(P<0.05);TBA、Hs-CR在20 mg·kg-1组有增高趋势,与对照组比较(P<0.05);AMY、TG、LDL在20 mg·kg-1组出现下降与对照组比较(P<0.05);Cu、CHO、HDL在20 mg·kg-1组出现显著下降与对照组比较(P<0.001)。
2.3 PFOS对孕鼠血清GC及胎盘IGF-1的影响
孕鼠血清GC在高剂量组(20 mg·kg-1)表达显著性升高(图2,P<0.05),IGF-1在低、中、高剂量组胎盘中表达显著性降低(图2,P<0.05,P<0.01,P<0.001)。
2.4 PFOS通过抑制11β-HSD2而影响GC代谢
通过酶学检测发现随着PFOS剂量的升高,11β-HSD2对皮质酮的灭活能力逐渐下降,高剂量组胎盘中11β-HSD2活性显著性降低(图3,P<0.001)。因此我们推断高剂量组GC的显著性升高是由11β-HSD2酶活性降低引起的。

图2 PFOS染毒后孕鼠血清糖皮质激素(GC)及胎盘胰岛素样生长因子1(IGF-1)的变化
3 讨论(Discussion)
孕期PFOS暴露导致子代高死亡率已引起毒理学家的广泛关注[15]。PFOS可以通过胎盘屏障,对子代的生存、生长发育产生一定影响[16-17]。而PFOS暴露是否会使胎盘11β-HSD2的氧化活性降低,使得母源GC高暴露进而导致胎儿生长受限还未见报道。
为验证孕期PFOS对胎鼠及母鼠生长发育的影响,我们对胎鼠和母鼠的体重和肝脏生化指标、肝脏系数进行了检测。肝脏是参与外来化合物代谢的重要器官,也是PFOS毒性作用的主要靶器官,因此肝脏功能的改变可以客观的反应PFOS对母鼠和胎鼠的毒性作用。本研究在对孕鼠血清生化指标检测中发现,血清总蛋白(TP)和白蛋白(ALB)较正常对照组明显降低,孕鼠的体重也有明显的下降趋势(20 mg·kg-1组,P<0.001)。TP和ALB均在肝脏中合成,是反映肝脏功能的重要的指标,它们的降低一般是由于肝功能出现障碍、肝脏合成蛋白减少,是肝炎发生的重要提示,可能是由于污染物影响了肝脏的合成功能。胎鼠的体重、体长、胎盘的重量都随着PFOS给药浓度的加大而显著降低;胎鼠肝脏脏器系数也有随着染毒计量加大而降低的趋势(10 mg·kg-1组,P<0.05;20 mg·kg-1组,P<0.001);生化检测结果中,ALT、AST、ALP在PFOS 10 mg·kg-1组都出现显著升高(P<0.001)。这些肝脏酶类的升高与Yahia等[18]和Yan等[19]实验中得到的结果是一致的。ALT、AST的升高临床主要见于急慢性肝炎、脂肪肝、肝硬化等;而ALP是一组在碱性环境中催化有机机磷酸酯水解的酶,其在胆小管上皮细胞含量较为丰富,所以它是胆管疾患的良好指标。所以ALT、AST、ALP这几个生化指标的升高说明PFOS的暴露可以导致未出生的胎鼠肝脏功能受损。
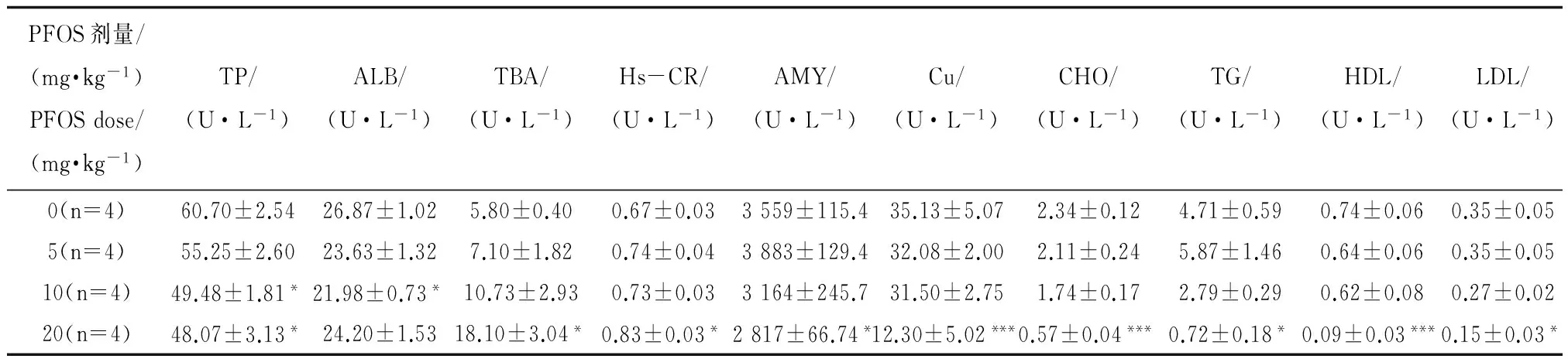
表3 PFOS对孕鼠血清生化指标的影响Table 3 Effects of PFOS on serum biochemical parameters in dams
注:与对照相比,*,P<0.05,**,P<0.01,***,P<0.001。
Note: Compared with control,*,P<0.05,**,P<0.01,***,P<0.001.
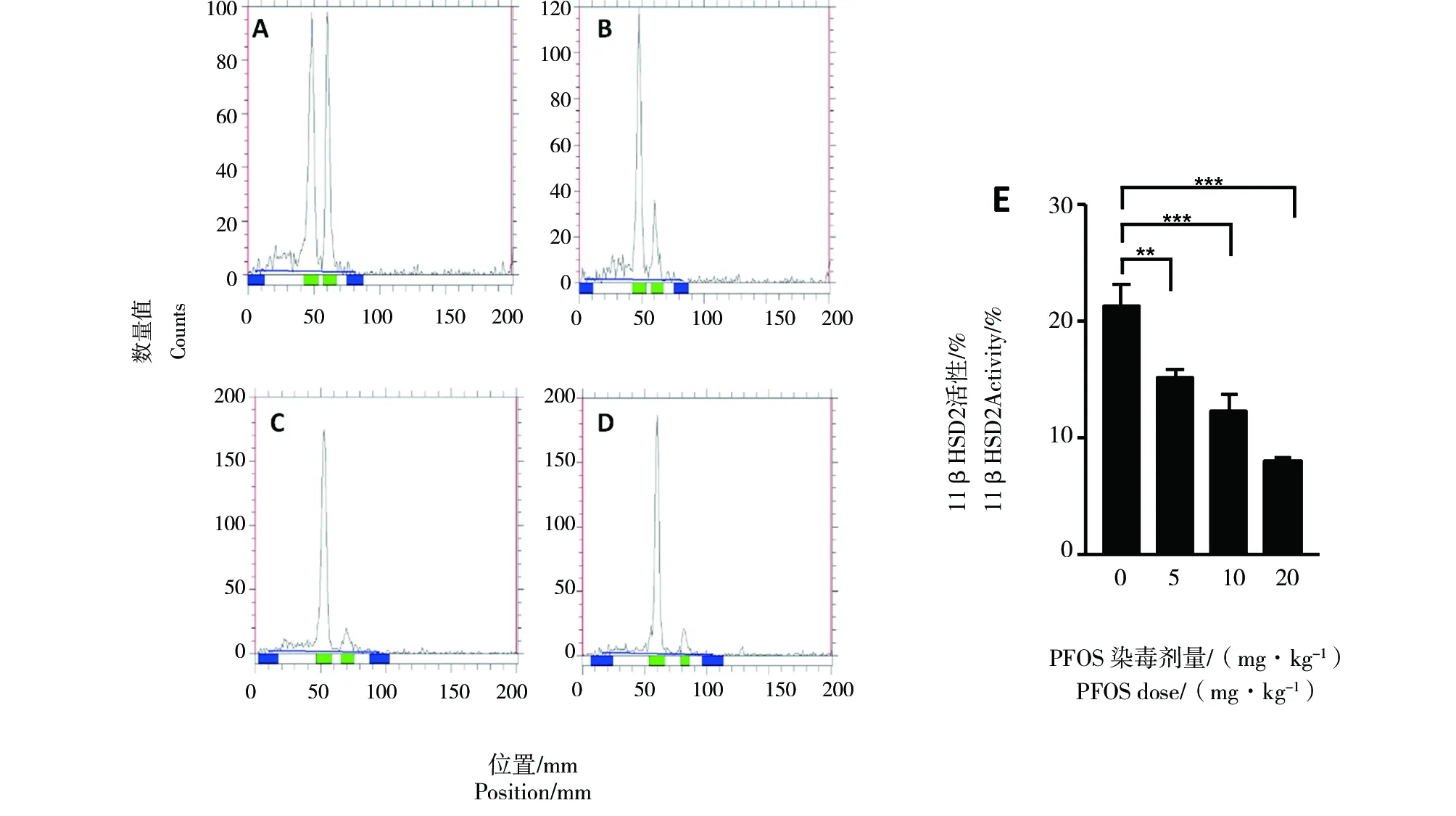
图3 PFOS染毒后胎盘11β-HSD2的酶学活性
GC对胎儿的生长发育有着重要的作用[20]。一方面,它可以促进细胞分化使胎儿器官成熟;另一个方面,它通过抑制细胞增殖来抑制胎儿组织的生长发育。研究发现正常妊娠期间母体血液的GC浓度远远高于胎儿[21],但在妊娠期间胎盘建立了一道有效的GC屏障,可以保证胎儿的正常生张,而这个屏障就依赖于11β-HSD2氧化GC使其失活,以保护高GC对胎儿的影响。如果11β-HSD2氧化活性受到抑制,会使胎儿过暴露于GC[22]。IGF-1是一种与胰岛素结构和功能相似的多肽,与胚胎分化、个体发育密切相关,参与糖、脂肪和蛋白质的代谢[23]。有研究表明,在胎儿生长受限中GC水平过高会抑制胎盘组织的IGF-1表达[24],进而影响胎儿、胎盘的生长发育。在本研究中,酶学检测胎盘中11β-HSD2的活性,发现其活性随PFOS浓度的增加而降低;孕鼠血清中的GC与PFOS暴露的浓度正相关,而胎盘中IGF-1随PFOS浓度的升高而降低。
本研究通过孕期染毒PFOS,证实其对胎鼠和母鼠的生长有一定的影响,对胎鼠的肝脏功能造成损伤,对11β-HSD2、GC和IGF-1的检测结果表明,它们的变化与PFOS暴露浓度有密切的关系,可能由于PFOS的染毒影响了胎盘的11β-HSD2氧化活性,使胎鼠处于母源性GC高暴露环境中,对胎鼠生长造成了一定的影响。
[1] Begley T H,White K,Honigfort P,et al.Perfluorochemicals: Potential sources of and migration from food packaging [J].Food Additives & Contaminants,2005,22(10):1023-1031
[2] D'Hollander W,de Voogt P,De Coen W,et al.Perfluorinated substances in human food and other sources of human exposure [J].Reviews of Environmental Contamination and Toxicology,2010,208:179-215
[3] Olsen G W,Burris J M,Ehresman D J,et al.Half-life of serum elimination of perfluorooctanesulfonate,perfluorohexanesulfonate,and perfluorooctanoate in retired fluorochemical production workers [J].Environmental Health Perspectives,2007,115(9): 1298-1305
[4] Rosen M B,Schmid J E,Das K P,et al.Gene expression profiling in the liver and lung of perfluorooctane sulfonate-exposed mouse fetuses: Comparison to changes induced by exposure to perfluorooctanoic acid [J].Reproductive Toxicology,2009,27(3-4): 278-288
[5] Fuentes S,Colomina M T,Vicens P,et al.Concurrent exposure to perfluorooctane sulfonate and restraint stress during pregnancy in mice: Effects on postnatal development and behavior of the offspring [J].Toxicological Sciences,2007,98(2): 589-598
[6] Tomy G T,Budakowski W,Halldorson T,et al.Fluorinated organic compounds in an eastern arctic marine food web [J].Environmental Science & Technology,2004,38(24): 6475-6481
[7] Chang S C,Thibodeaux J R,Eastvold M L,et al.Thyroid hormone status and pituitary function in adult rats given oral doses of perfluorooctanesulfonate (PFOS) [J].Toxicology,2008,243(3): 330-339
[8] Fei C,McLaughlin J K,Tarone R E,et al.Perfluorinated chemicals and fetal growth: A study within the danishnational birth cohort [J].Environmental Health Perspectives,2007,115(11):1677-1682
[9] Shi Z,Zhang H X,Liu Y,et al.Alterations in gene expression and testosterone synthesis in the testes of male rats exposed to perfluorododecanoic acid [J].Toxicological Sciences,2007,98(1): 206-215
[10] Lau C,Anitole K,Hodes C,et al.Perfluoroalkyl acids: A review of monitoring and toxicological findings [J].Toxicological Sciences,2007,99(2): 366-394
[11] Betts K S.Perfluoroalkyl acids: What is the evidence telling us? [J].Environmental Health Perspectives,2007,115(5):A250-A256
[12] Buckingham J C.Glucocorticoids: Exemplars of multi - tasking [J].British Journal of Pharmacology,2006,147(Z1):S258-S268
[13] Michael A E,Thurston L M,Rae M T.Glucocorticoid metabolism and reproduction: A tale of two enzymes [J].Reproduction (Cambridge,England),2003,126(4): 425-441
[14] Bertram C,Trowern A R,Copin N,et al.The maternal diet during pregnancy programs altered expression of the glucocorticoid receptor and type 2 11beta-hydroxysteroid dehydrogenase: Potential molecular mechanisms underlying the programming of hypertension in utero [J].Endocrinology,2001,142(7): 2841-2853
[15] Naile J E,Khim J S,Hong S,et al.Distributions and bioconcentration characteristics of perfluorinated compounds in environmental samples collected from the west coast of Korea [J].Chemosphere,2013,90(2): 387-394
[16] 王玉,张倩,刘威,等.胚胎期和哺乳期全氟辛烷磺酸(PFOS)暴露致大鼠学习记忆能力下降[J].生态毒理学报,2013,8(5): 671-677
Wang Y,Zhang Q,Liu W,et al.Decline of learning and memory abilities in rats induced by prenatal and lactational exposure to perfluorooctane sulfonate(PFOS) [J].Asian Journal of Ecotoxicology,2013,8(5): 671-677 (in Chinese)
[17] 肖静,连玉龙,马颖,等.孕哺期全氟辛烷磺酸暴露对子代大鼠糖代谢的影响[J].生态毒理学报,2013,8(5): 678-686
Xiao J,Lian Y L,Ma Y,et al.Effect of perinatal PFOS exposure on glucose homeostasis of adult rat offspring [J].Asian Journal of Ecotoxicology,2013,8(5): 678-686 (in Chinese)
[18] Yahia D,El-Nasser M A,Abedel-Latif M,et al.Effects of perfluorooctanoic acid (PFOA) exposure to pregnant mice on reproduction [J].Journal of Toxicological Sciences,2010,35(4): 527-533
[19] Yan S,Wang J,Zhang W,et al.Circulating microRNA profiles altered in mice after 28 d exposure to perfluorooctanoic acid [J].Toxicology Letters,2014,224(1): 24-31
[20] Diaz R,Brown R W,Seckl J R.Distinct ontogeny of glucocorticoid and mineralocorticoid receptor and 11beta-hydroxysteroid dehydrogenase types I and II mRNAs in the fetal rat brain suggest a complex control of glucocorticoid actions [J].Journal of Neuroscience,1998,18(7): 2570-2580
[21] Seckl J R.Glucocorticoids,feto-placental 11 beta-hydroxysteroid dehydrogenase type 2,and the early life origins of adult disease [J].Steroids,1997,62(1): 89-94
[22] Xu D,Wu Y,Liu F,et al.A hypothalamic-pituitary-adrenal axis-associated neuroendocrine metabolic programmed alteration in offspring rats of IUGR induced by prenatal caffeine ingestion [J].Toxicology and Applied Pharmacology,2012,264(3): 395-403
[23] Baumann M U,Schneider H,Malek A,et al.Regulation of human trophoblast GLUT1 glucose transporter by insulin-like growth factor I (IGF-I) [J].PLoS One,2014,9(8):e106037
[24] Agrogiannis G D,Sifakis S,Patsouris E S,et al.Insulin-like growth factors in embryonic and fetal growth and skeletal development[J].Molecular Medicine Reports,2014,10(2):579-584
◆
Effect of PFOS Exposure on the Glucocorticoid Concentration in Pregnant Rats and Fetal Rats Growth and Development
Han Pengfei1,Li Hongzhi2,Chen Zhihui1,Zhang Yufei2,Yuan Xiaohuan2,Chu Yanhui2,Zhao Binghai2,*
1.Hongqi Hospital of Mudanjiang Medical College,Mudanjiang 157001,China 2.Heilongjiang Key Laboratory of Anti-fibrosis Biotherapy,Mudanjiang Medical University,Mudanjiang 157001,China
7 February 2015 accepted 25 March 2015
To explore the effect of PFOS exposure on the maternal glucocorticoid levels and fetal growth and development,the GD12 pregnancy rats were exposed to different doses of PFOS (0,5,10 and 20 mg·kg-1) by gavage for 7 d.At GD19,the body weight of pregnancy and fetal rats,liver biochemical index and liver organ coefficient of fetal rats,serum biochemical index and GC of pregnancy rats,11β-HSD2 activity and IGF-1 mRNA level of placenta were measured.The results showed that the body weight of pregnancy rats and the body weight and length of fetal rats exposed to 20 mg·kg-1of PFOS were significantly lower than the control group (P<0.001); fetal rats liver organ coefficient of 20 mg·kg-1PFOS group markedly decreased (P<0.001); 10 mg·kg-1PFOS treatment increased fetal rats liver enzyme activities (ALT,AST,and ALP) (P<0.001); pregnant rat serum glucocorticoids level in 20 mg·kg-1group increased (P<0.05); IGF-1 mRNA level decreased with PFOS dose increasing in placenta; 11β-HSD2 activity decreased with PFOS increasing in placenta.This study showed that exposure to PFOS during pregnancy can lead to fetal rats liver toxicity,reduce placental 11β-HSD2 oxidative activity,increase GC concentration,thereby affect the growth and development of offspring.
perfluorooctanesulfonate,exposed during pregnancy,11 beta hydroxy steroid dehydrogenase 2,glucocorticoid; fetal growth
国家自然科学资金(81372951,81200430);黑龙江省卫生厅科研课题(2013177);牡丹江市科学技术计划项目(Z2014s017)
韩鹏飞(1980-),男,硕士,研究方向为生物化学与分子生物学,E-mail: hongzhi-li2008@163.com;
*通讯作者(Corresponding author),E-mail: zhaobinghai01@163.com
10.7524/AJE.1673-5897.20150207001
2015-02-07 录用日期:2015-03-25
1673-5897(2015)4-219-07
X171.5
A
赵冰海(1977-),男,博士,副教授,主要研究方向为生殖毒理学,发表相关SCI文章10余篇。
韩鹏飞,李洪志,陈志会,等.孕鼠PFOS暴露对糖皮质激素水平及胎鼠生长发育的影响[J].生态毒理学报,2015,10(4): 219-225
Han P F,Li H Z,Chen Z H,et al.Effect of PFOS exposure on the glucocorticoid concentration in pregnant rats and fetal rats growth and development [J].Asian Journal of Ecotoxicology,2015,10(4): 219-225 (in Chinese)

