人工纳米材料对贝类生态毒理效应的研究进展
葛春梅,黄茜枝,林道辉,王有基,2,*,吕为群,#
1.上海海洋大学水产与生命学院,上海 201306 2.浙江省有机污染过程与控制重点实验室,杭州 310058 3.浙江大学 环境与资源学院,杭州 310058
人工纳米材料对贝类生态毒理效应的研究进展
葛春梅1,黄茜枝1,林道辉2,3,王有基1,2,*,吕为群1,#
1.上海海洋大学水产与生命学院,上海 201306 2.浙江省有机污染过程与控制重点实验室,杭州 310058 3.浙江大学 环境与资源学院,杭州 310058
纳米技术已成为21世纪发展最迅猛的技术领域之一。纳米材料因其具备新异的物理、化学特性而广泛应用于各种领域,包括农业,电子工业,生物医学,制造业,医药品和化妆品等,因此纳米颗粒不可避免会释放到水环境中。贝类由于其具有分布广,处于食物链中的关键位置,滤食食性,对重金属及污染物有较强的生物累积能力,且很多贝类具有养殖和商业价值,因而纳米颗粒对贝类的生态毒性效应备受关注。本文通过对已有相关研究成果进行归纳分析,重点阐述了3方面的内容: 1)人工纳米材料在水环境中的行为;2)贝类作为水生污染监测指示生物的重要意义;3)人工纳米材料对贝类的毒性效应,主要包括贝类对纳米颗粒摄取、积累和转移,并从组织细胞水平,分子和基因水平,胚胎发育和个体生长水平等阐述了纳米材料对贝类的毒性效应。
人工纳米材料;贝类;毒性效应;综述
纳米技术已成为21世纪发展最迅猛的一个技术领域。纳米材料是指平均粒径在100 nm以下的粒子,其中平均粒径20~100 nm的是超细粉,平均粒径小于20 nm的是超微粉。纳米材料具有相当大的比表面积,具有新异的物理和化学特性,如表面效应、体积效应、量子尺寸效应和宏观量子隧道效应等[1-2]。2011年10月,欧盟将纳米材料定义为一种天然的、伴随发生的或人造的材料(颗粒),存在单个颗粒或聚集成块状态,其中有50%或以上以颗粒呈现,尺寸范围为1~100 nm[3]。纳米材料在各种行业应用中呈指数增长,包括工业、农业、商业、医药、服装、化妆品、食品和公共卫生等。这些含有纳米材料的产品和商品被引入到人类的日常生活中[4-5],所以纳米材料在生产和使用过程中必然会释放到环境中[6],且不可避免地进入到水环境,对水生生物的健康可能会产生毒害作用[7]。纳米材料的安全性和毒性已成为生态毒理和公共卫生安全领域关注的热点,但到目前为止,大部分人工制造的纳米材料的细胞毒性和遗传毒性数据对应于它们的使用和机制尚未确立,对纳米材料的毒性理解也不全面。自2002年以来,《Science》、《Nature》、《Environmental Science & Technology》等刊物纷纷发表文章探讨人工纳米颗粒的生物安全性问题。研究表明,人工纳米颗粒通过纳米尺寸效应[8]、自由基氧化损伤以及氧化应激效应[9]、溶解金属离子的毒性效应[10]等致毒途径进入细胞内,导致蛋白质变性、酶活性降低、线粒体和细胞膜损伤,造成基因毒性、DNA突变和功能蛋白表达受损等,在宏观的生物个体、组织器官水平、细胞亚细胞水平、蛋白质及基因水平上对生物体造成毒性损伤[11]。近几年来,国内外均有较多研究报道纳米颗粒对贝类的毒性效应,本文通过对现有最新研究成果进行总结、归纳及分析,重点阐述了不同类型纳米颗粒对贝类的个体、组织、细胞和分子等方面的毒性效应和机制,同时对纳米颗粒在水体环境中的毒理学研究发展方向进行了展望。
1 人工纳米材料在水环境中的行为
水环境是地球上最大的生态系统,极容易受到污染物的侵入和危害。人工纳米材料在生产、运输、处置和消费过程中不可避免会进入水体,并通过摄食、呼吸和皮肤接触等途径进入水生生物体内,影响水生生物的生长和繁殖,甚至可能进一步影响人类健康[12]。纳米材料可促进其同类相关金属物质向环境中释放。Al-Kattan等[13]在人工气候室条件下研究了涂料中钛(含颜料二氧化钛和纳米二氧化钛)的释放,结果表明,涂料中加入纳米二氧化钛对钛的释放有促进作用。纳米材料进入水环境后会发生一系列复杂的水环境行为(悬浮,沉降),并且可能会在生物、物理、化学等作用下发生转化,经过转化或未转化的纳米材料都有可能进入水生生物体内并随着生物链逐级积累,表现出不同的生物化学行为和毒性特征。由于纳米材料间存在不同于常规粒子间的纳米作用能,以及范德华力、布朗运动、表面效应和氢键等影响,在水体介质中纳米材料之间会发生聚集与分散行为,从而影响其与水生生物的相互作用和其在水环境中的归趋[14-15]。因此,纳米材料在水环境中的分散和聚集行为也已成为当前研究的热点。纳米材料在水体中的聚集与分散行为,除了与纳米颗粒自身材料属性密切相关之外,水环境因素也可以明显改变纳米材料的物理化学特性。由于实际水环境条件非常复杂,水体中离子强度、pH值、有机质等水质和水文动力条件,都可能会影响纳米材料的悬浮性能和聚集分散行为。现已有较多研究报道离子强度、pH值等对纳米材料的聚集分散行为和悬浮性能的影响[16-17]。陈金媛等[18]研究纳米二氧化钛在水中的分散沉降行为中表明,水环境条件通过影响颗粒间的势能大小改变纳米二氧化钛在水中的分散沉降行为。在海水中,纳米粒子一般会发生凝聚,易于沉积到泥沙表面。因此,底栖生物如贝类暴露在纳米粒子中的风险较高[19]。
2 贝类生物学特性与纳米颗粒的关系
无脊椎动物种类繁多、数量庞大、分布广泛,在生态系统稳定和环境影响研究中具有重要的意义。贝类作为一类具有世界性分布的软体无脊椎水生动物,由于其具有分布广,移动性较差,滤食食性,对重金属及污染物有较强的生物累积能力等特点,且具有水产养殖和商业价值而备受关注,常用于研究水体的环境质量及底质污染状况评价,也是目前国内外公认的较为理想的水质指示生物[20]。部分贝类如贻贝等已被很多国家作为重金属污染的指示生物[21-22],广泛用于海洋污染的生物监测中[21]。Moore等[23]首次提出了滤食性无脊椎动物,特别是双壳软体动物在纳米毒理学中代表一个独特的目标群体。这些生物在微纳米尺度颗粒的细胞内化、胞吞和吞噬作用中有高度发达的过程,如细胞内消化和细胞免疫,这些是不可或缺的重要生理功能。
贝类的摄食机制目前已知主要有2种,这2种机制与水中纳米颗粒进入贝类体内有密切关系。1)黏液纤毛作用:滤食性贝类主要依靠鳃丝及其上面的着生纤毛的组合运动来摄取食物颗粒。当含有食物(纳米)颗粒的水流经过鳃时,前侧纤毛就会阻挡或以重力作用等方式把颗粒过滤或截取下来,这些被过滤的颗粒被裹以黏液在前纤毛的摆动下送到唇瓣,经唇瓣筛选后,一些大小适宜,有机物含量高的食物颗粒则会被吞食进入消化道,而不适宜的颗粒就会被以假粪的形式排出体外,纳米颗粒这个过程中有可能会通过摄食进入到消化道。2)水动力学作用:即食物(纳米)颗粒随着水流通过鳃丝到达鳃的背部,再沿背部凹槽进入唇瓣[24],最后到达消化腺进行消化过程。消化细胞有非常发达的溶酶体系统,当纳米颗粒被吞入后,影响贝类细胞的首要生理过程就是细胞浆质变化,溶酶体积累和氧自由基产生[23]。
细胞免疫和体液免疫是贝类免疫机制中的2个方面,特别是在抵御异物入侵方面两者密切相关。贝类的免疫细胞和免疫因子相辅相成,共同构成了贝类的免疫系统[25]。体液免疫作为贝类重要免疫防御手段,靠血清中的调节因子和一些非特异性酶来进行调节。目前已确定的体液免疫因子包括溶酶体酶、髓性过氧化物酶、酚氧化酶、抗氧化酶、抗氧化因子、调理素、凝集素、应激蛋白、抗菌肽和细胞因子类似物等[26],其中抗氧化防御系统和溶酶体酶在免疫防御中起着非常重要的作用。多数体液免疫因子由贝类血细胞产生并分泌到血淋巴中发挥防御功能。贝类血细胞参与机体损伤的修复、吞噬异物颗粒和消除有毒有害物质等过程,是贝类免疫功能的主要承担者[27],它们通过吞噬作用、细胞介导免疫和各种细胞毒性反应,如溶酶体酶和抗菌肽的释放和氧自由基的生产来防御和清除纳米颗粒。总之,这些先天免疫机制的研究有利于研究贝类在纳米颗粒环境暴露中常见的生理生化反应。
3 人工纳米材料对贝类的毒性效应
3.1 人工纳米颗粒在贝类中的生物吸收
3.1.1 对生物聚集和积累的影响
目前有较多的证据表明纳米颗粒可以被贝类吸收并产生多种毒性作用(表1)。纳米颗粒在水中可以发生聚集,呈现一定的浓度相关性,而且纳米粒子可以通过不同的途径进入到贝类机体不同组织和细胞中。García-Negrete等[28]将柠檬酸盐金纳米粒子(Au-citrate nanoparticles)投放到人工海水中,颗粒的聚集程度被证明有浓度依赖性。在低浓度时没有聚结或只发现有限的初级粒子聚集物,而且发现柠檬酸盐金纳米颗粒积累在消化腺溶酶体中,离子则积累在鳃中,消化道内腔细胞中有残余的致密颗粒体,可能由于消化吸收过程,导致柠檬酸盐金纳米颗粒聚集成了较大的颗粒物质。Ringwood等[29]在体外培养的美洲牡蛎(Crassostrea virginica)消化腺细胞中也观察到C60富勒烯在细胞中聚集成块。Zuykov等[30]采用超滤和放射性示踪技术确定了蓝贻贝(Mytilus edulis)外套膜外液中银的浓度和形态,纳米银颗粒被运送到贻贝外套膜外液的水平在某种程度上与银离子形式的运送水平相似。外套膜中放射性银的体积活性在整个贻贝只检测到了7%,表明纳米银颗粒比银离子吸收得多,血细胞可能在银迁移中发挥重要作用。
研究显示,纳米颗粒的摄入程度受到水中其他化学物质的干扰。Tedesco等[31]的研究表明,与暴露在混合物中相比,暴露在单一纳米金颗粒(GNP)溶液的蓝贻贝(M.edulis)消化腺中积累的纳米金颗粒较多,而暴露在甲萘醌(menadione)与纳米金颗粒两种混合物中则没有发现纳米金颗粒,可能在摄食时甲萘醌抑制了纳米金颗粒的生物积累。对纳米锌的研究发现,纳米颗粒的首要毒害组织是鳃,进入鳃细胞后,线粒体的结构和功能受到破坏。Trevisan等[32]研究了纳米氧化锌在牡蛎(Crassostrea gigas)中的毒性。暴露6 h后,纳米氧化锌积累在鳃中,通过鳃的超微结构分析显示,纳米颗粒囊泡在细胞膜和线粒体嵴上,24 h后观察到线粒体肿胀和线粒体嵴更明显的损失。48 h后纳米颗粒积累在消化腺中,线粒体膜破坏,电子致密物质中显示有更多的胞质小泡。数据表明,鳃是纳米氧化锌的初始目标,细胞线粒体是牡蛎特别容易受影响的细胞器。Koehler等[33]也得出同样的结论,他们将蓝贻贝(M.Edulis)暴露于纳米二氧化硅,观察到鳃上皮细胞中的纤维团比肝胰脏细胞中的大,表明这些物质是首先被运到鳃中的。
3.1.2 对摄取和外排速率的影响
金属纳米颗粒和金属离子在贝类中的摄取和外排具有差异性,一般来说金属离子的生物利用度更高,纳米颗粒的外排相对较慢。Khan等[34]利用生物动力学模型,推导了紫菜尖顶螺(Peringia ulvae)在纳米银颗粒和硝酸银暴露下银的摄取和外排速率常数。吸收率表明,银离子的生物利用度为纳米银颗粒形式的2倍。双相动力学显示在外排的初始阶段,银离子比纳米银颗粒更快地除去,但外排的速率常数类似。Marie-Noele等[35]研究发现椎实螺(Lymnaea stagnalis)在低暴露浓度范围内,所有形式的银吸收率随着浓度升高而升高,一旦银从饮食中摄入,不管是银离子还是纳米银颗粒,银的排泄非常缓慢并且损害消化能力,不能吸收摄入的食物,严重影响了它们的生长。Ward等[36]表示贝类能捕捉单个粒子(<1 μm)并有小于15%的保留率,因此,贝类无法大量摄入纳米粒子。Gomes等[37]研究也表明,纳米氧化铜与铜离子有不同的反应模式,铜积累在贻贝的鳃中,并且当暴露于纳米氧化铜颗粒时,去除比积累的慢。生物动力学建模提供了一种有效的方法来确定环境中生物可利用的金属浓度,有助于未来人工纳米颗粒的风险评估。Kádár等[38]通过纳米铁颗粒的吸收实验来评估纳米铁在鳃上皮细胞的毒性影响,结果证明:(1) 水溶性铁(95%)和纳米铁(90%)在12 h从水柱内除去;(2) 铁离子和纳米铁颗粒在鳃上皮的吸收遵循不同的路线。Kádár等[39]后来证明纳米铁毒性与纳米铁颗粒的聚集和沉积作用有关。Hull等[75]研究表明生物转化和生物沉积对纳米粒子在水生生态系统中的迁移、转化和沉积等有非常重要的作用。以上研究证实了贝类更容易摄取金属离子,但是相对金属离子,纳米颗粒一旦被摄入,其更容易积累于生物体内,不易排出。

表1 不同纳米材料对贝类的毒性效应Table 1 Toxic effects of different nano-materials on shellfish
续表1
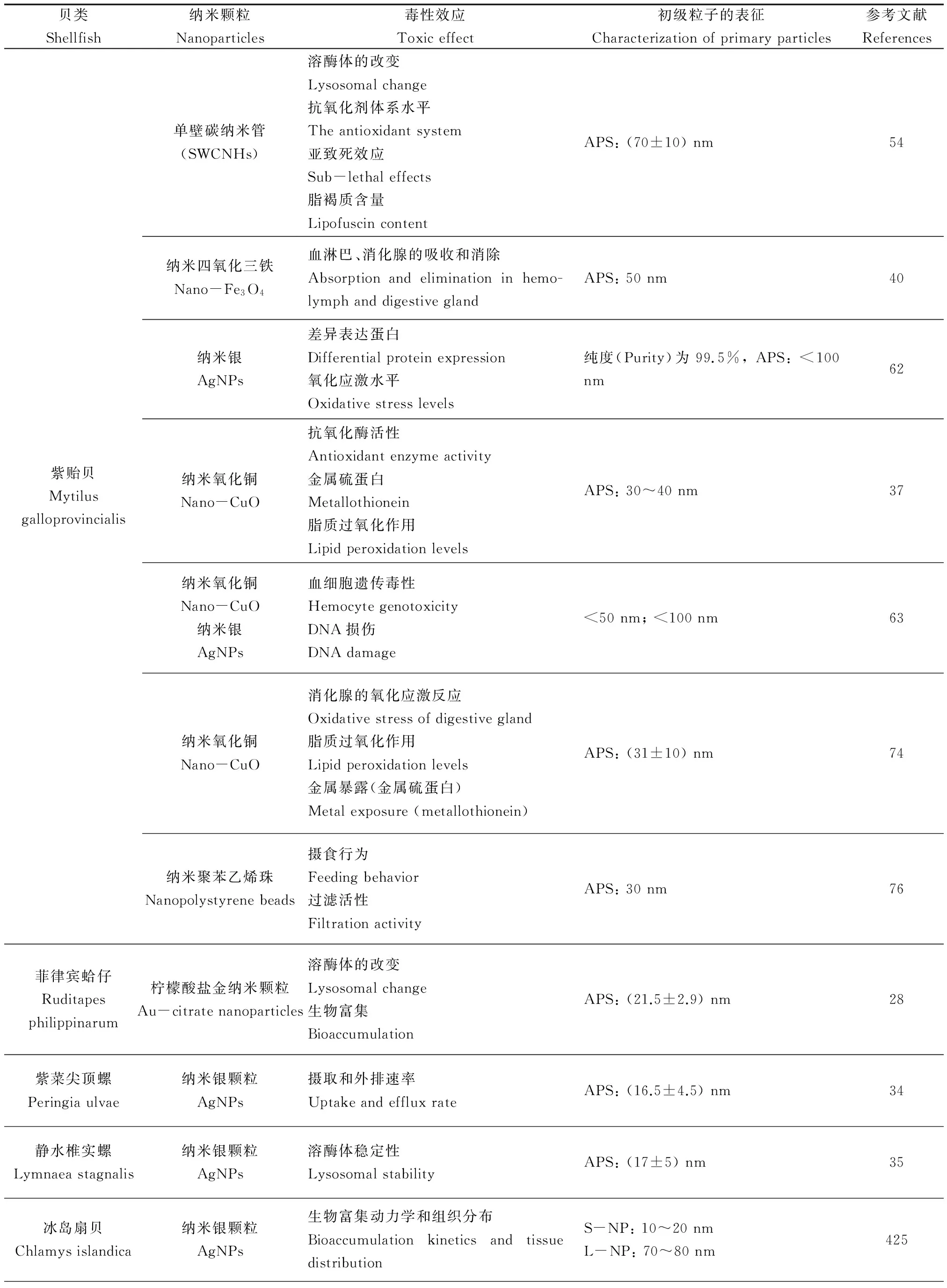
贝类Shellfish纳米颗粒Nanoparticles毒性效应Toxiceffect初级粒子的表征Characterizationofprimaryparticles参考文献References紫贻贝Mytilusgalloprovincialis单壁碳纳米管(SWCNHs)纳米四氧化三铁Nano-Fe3O4纳米银AgNPs纳米氧化铜Nano-CuO纳米氧化铜Nano-CuO纳米银AgNPs纳米氧化铜Nano-CuO纳米聚苯乙烯珠Nanopolystyrenebeads溶酶体的改变Lysosomalchange抗氧化剂体系水平Theantioxidantsystem亚致死效应Sub-lethaleffects脂褐质含量LipofuscincontentAPS:(70±10)nm54血淋巴、消化腺的吸收和消除Absorptionandeliminationinhemo-lymphanddigestiveglandAPS:50nm40差异表达蛋白Differentialproteinexpression氧化应激水平Oxidativestresslevels纯度(Purity)为99.5%,APS:<100nm62抗氧化酶活性Antioxidantenzymeactivity金属硫蛋白Metallothionein脂质过氧化作用LipidperoxidationlevelsAPS:30~40nm37血细胞遗传毒性HemocytegenotoxicityDNA损伤DNAdamage<50nm;<100nm63消化腺的氧化应激反应Oxidativestressofdigestivegland脂质过氧化作用Lipidperoxidationlevels金属暴露(金属硫蛋白)Metalexposure(metallothionein)APS:(31±10)nm74摄食行为Feedingbehavior过滤活性FiltrationactivityAPS:30nm76菲律宾蛤仔Ruditapesphilippinarum柠檬酸盐金纳米颗粒Au-citratenanoparticles溶酶体的改变Lysosomalchange生物富集BioaccumulationAPS:(21.5±2.9)nm28紫菜尖顶螺Peringiaulvae纳米银颗粒AgNPs摄取和外排速率UptakeandeffluxrateAPS:(16.5±4.5)nm34静水椎实螺Lymnaeastagnalis纳米银颗粒AgNPs溶酶体稳定性LysosomalstabilityAPS:(17±5)nm35冰岛扇贝Chlamysislandica纳米银颗粒AgNPs生物富集动力学和组织分布BioaccumulationkineticsandtissuedistributionS-NP:10~20nmL-NP:70~80nm425
续表1

贝类Shellfish纳米颗粒Nanoparticles毒性效应Toxiceffect初级粒子的表征Characterizationofprimaryparticles参考文献References冰岛扇贝Chlamysislandica纳米银颗粒AgNPs纳米金颗粒Goldnanoparticles纳米二氧化硅Nano-SiO2纳米铁Nano-Fe纳米三氧化二铁Nano-Fe2O3蔗糖聚酯SucrosepolyesternanoparticlesC60富勒烯C60fullerene外套膜外液中金属运输MetaltransportinextrapallialfluidAPS:<40nm30内壳层表面形态ThesurfacemorphologyofinnershellAPS:<40nm70消化腺中氧化应激水平Oxidativestressindigestivegland脂质过氧化作用Lipidperoxidationlevels硫氧还蛋白还原酶活性ThioredoxinreductaseactivityAPS:~15nm31氧化应激水平OxidativestresslevelsAPS:~13nm52消化腺中氧化应激水平Oxidativestressindigestivegland脂质过氧化作用Lipidperoxidationlevels溶酶体膜稳定性LysosomalmembranestabilityAPS:(5.3±1)nm59组织摄取Tissueuptake亚细胞定位SubcellularlocalizationN/A33脂质过氧化作用Lipidperoxidationlevels乙酰胆碱酯酶活性AcetylcholinesteraseactivityAPS:50nm38幼虫发育LarvaldevelopmentN/A39消化腺细胞的吸收AbsorptionofdigestivecellsN/A46血细胞溶酶体稳定性HemocytelysosomalstabilityN/A47蓝贻贝Mytilusedulis;美洲牡蛎Crassostreavirginica纳米聚苯乙烯珠Nanopolystyrenebeads纳米颗粒吸收率NanoparticlesabsorptivityAPS:100nm36美洲牡蛎CrassostreavirginicaC60富勒烯C60fullerene纳米银颗粒AgNPs纳米二氧化钛Nano-TiO2消化细胞在体内外的溶酶体膜稳定性Lysosomalmembranestabilityofdi-gestivecellsinvitroandinvivo溶酶体摄取Lysosomaluptake幼体发育LarvaldevelopmentN/A29吞噬作用Phagocytosis(26±1.2)nm(70±3.3)nm45
续表1

贝类Shellfish纳米颗粒Nanoparticles毒性效应Toxiceffect初级粒子的表征Characterizationofprimaryparticles参考文献References美洲牡蛎Crassostreavirginica纳米银颗粒AgNPs胚胎发育Embryodevelopment金属硫蛋白mRNA表达水平MetallothioneinmRNAexpressionlevel溶酶体膜稳定性LysosomalmembranestabilityAPS:(15±6)nm50鳃和肝组织中的毒性Toxicityingillsandlivertissues溶酶体损伤Lysosomaldamage氧化性损伤OxidativedamageAPS:20~30nm67太平洋牡蛎Crassostreagigas纳米氧化锌Nano-ZnO生物积累Bioaccumulation氧化应激水平Oxidativestresslevels线粒体破裂MitochondrialdisruptionAPS:28~88nm32浅沟蛤Scrobiculariaplana纳米氧化铜Nano-CuO纳米金颗粒Goldnanoparticles纳米氧化锌Nano-ZnO纳米银颗粒AgNPs整个组织的生物积累Bioaccumulationofwholetissue行为反应(穴居动力学,摄食率)Behavioralresponses(burrowingdy-namicsandfeedingrate)生化反应(生物标志物)Biochemicalresponse(biomarkers)氧化应激的标志物OxidativestressmarkersAPS:10~100nm55氧化应激水平Oxidativestresslevels行为反应(挖洞和觅食)Behavioralresponses(burrowingandfeeding)APS:5,15,40nm56生物累积Bioaccumulation行为反应(穴居动力学,摄食率)Behavioralresponses(burrowingdy-namicsandfeedingrate)生化反应(生物标志)Biochemicalresponse(biomarkers)APS:20~30nm57氧化应激反应Oxidativestressresponse行为的生物标志物(穴居、摄食行为)Biomarkers(burrowingbehavior,feedingbehavior)APS:40~45nm58细胞损伤和抗氧化的生物标志物Biomarkersofcelldamageandantioxi-dant溶酶体稳定性Lysosomalstability脂质过氧化作用LipidperoxidationlevelsDNA损伤DNAdamage酚氧化酶和溶菌酶活性PhenoloxidaseandlysozymeactivityAPS:40~45nm64
续表1

贝类Shellfish纳米颗粒Nanoparticles毒性效应Toxiceffect初级粒子的表征Characterizationofprimaryparticles参考文献References斑马贻贝Dreissenapolymorpha纳米二氧化钛Nano-TiO2MAPK磷酸化水平Mitogenactivatedproteinkinase(MAPK)phosphorylationlevel吞噬活性PhagocytosisAPS:25nm锐钛矿/金红石(Anatase/Rutile):80/2051九孔鲍Haliotisdiversicolorsupertexta纳米二氧化钛Nano-TiO2氧化应激水平OxidativestresslevelsAPS:≤10nm纯度(Purity)≥99.5%SSA≥150m2·g-153琵琶萝卜螺Lymnaealuteola纳米氧化锌Nano-ZnO纳米银颗粒AgNPs遗传毒性(DNA损伤)Genotoxicity(DNAdamage)氧化应激水平OxidativestresslevelsAPS:50nm,SSA:>10.8m2·g-160急性毒性Acutetoxicity遗传毒性GenotoxicityAPS:≤50nm61囊螺Physaacuta商业纳米二氧化钛CommercialTiO2改良纳米二氧化钛ModifiedTiO2胚胎发育率Embryogrowthrate胚胎孵化率Embryohatchability死亡率MortalityC-TiO2:40~60nm,50.3m2·g-1M-TiO2:7~11nm,301.7m2·g-168淡水贻贝Elliptiocomplanata碲化镉量子点CdTequantumdots纳米氧化锌Nano-ZnO免疫活性Immuneactivity氧化应激(脂质过氧化)Oxidativestress(Lipidperoxidation)遗传毒性(DNA链断裂)Genotoxicity(DNAstrandbreaks)N/A65元素组成关系Elementalcompositionrelationship金属硫蛋白Metallothionein脂质过氧化作用LipidperoxidationlevelsAPS:35nm71河蚬Corbiculafluminea纳米金颗粒Goldnanoparticles纳米颗粒吸收与清除Absorptionandeliminationofnanopar-ticlesAPS:7.8,15,46nm75
纳米粒子在贝类体内的吸收具有时效性,一般暴露初始阶段吸收较快,且沉积的重要靶器官多为消化腺及相关器官。Hull等[40]测量了紫贻贝(Mytilus galloprovincialis)对用聚乙二醇(PEG)修饰的纳米四氧化三铁颗粒(PEG-FeOxNP)和聚乙二醇官能化的硒化镉量子点(PEG-Qdot) 2种类型的金属纳米颗粒的吸收、分布和消除。结果表明,这2种类型中90%以上的纳米颗粒是在暴露初始8 h内吸收的。纳米四氧化三铁颗粒和聚乙二醇官能化的硒化镉量子点几乎都沉积在消化腺。另有研究显示纳米二氧化钛在贝类消化腺中的积累比鳃高10倍以上,表现出比多数纳米颗粒更好的积累特性[41]。另外,纳米颗粒的粒径大小会影响其在贝类体内的分布与富集。Al-Sid-Cheikh等[42]将冰岛扇贝(Chlamys islandica) 暴露在银离子,小纳米银颗粒和大纳米银颗粒3种不同银形式下,利用体内γ计数和全身放射自显影确定生物富集动力学和组织分布。所有形式的银很容易迅速积累,消除过程也很快并呈指数形式,平均生物半衰期从1.4 d到4.3 d是快速阶段,17 d到50 d为慢速阶段,大部分的放射性集中在肝胰脏。银离子和小纳米银颗粒组织分布相似,这2种银形式在该组织的后期快速代谢掉,相反大纳米银颗粒在消化系统中出现持久聚集。评估稳态的生物富集系数(BCF)在2 700~3 800 mL·g-1(溶解和银颗粒形式)之间,表明小纳米银颗粒在短时间可以大量积累,然后进行有效的净化过程。Wegner等[76]研究表明蓝贻贝(M.Edulis)暴露在纳米聚苯乙烯珠(PS)中时,贻贝降低自身过滤活性,但仍造成水中纳米聚苯乙烯珠浓度明显的减少。经生物鉴定证实,纳米聚苯乙烯珠聚集在贻贝足丝附近,并将纳米聚苯乙烯珠从生物体排除到水中。以上研究显示,纳米颗粒在暴露初始阶段容易快速积累,这对贝类容易造成急性毒性效应,另外大纳米颗粒相对于小纳米颗粒更容易积累在消化腺等部位,这对贝类可能会造成长期的慢性毒性效应,在评价纳米材料毒性的时候应该注意此类问题。
3.2 纳米颗粒对组织细胞水平的毒性效应
对于细胞水平上的毒性效应目前研究者利用体内(in vivo)和体外(in vitro)的免疫毒性试验,对不同纳米颗粒在贝类中的毒性效应进行评估,包括测定细胞死亡率,溶酶体膜稳定性,细胞吞噬活性和溶菌酶活性等。不同的纳米颗粒对贝类消化细胞的溶酶体毒性不尽相同。Ward等[36]研究表明纳米颗粒引起消化腺溶酶体膜稳定性下降的能力依次为:NCB(纳米炭黑)> C60 > TiO2> SiO2;引起溶酶体脂褐质堆积和脂质累积能力大小的顺序为:NCB >TiO2和SiO2。Wang等[43]研究发现将翡翠贻贝(Perna viridis)在纳米二氧化钛下暴露216 h,血细胞死亡率随着二氧化钛浓度的增加而升高,吞噬作用减弱,非特异性酯酶和溶酶体随浓度增加而减少,但是血淋巴细胞的体外(in vitro)试验显示,纳米颗粒没有引起相应参数的改变。在牡蛎血细胞中,纳米二氧化钛降低了溶酶体膜的稳定性和细胞吞噬功能[45],并增加了抗菌肽的转录。Moore等[46]发现纳米颗粒对双壳类细胞影响的第一个指示是纳米颗粒在细胞浆质和溶酶体中的积累,并将贻贝血细胞中诱导的细胞毒性作为降低溶酶体膜稳定性的评价标准[47]。以上研究证明了纳米颗粒对贝类的血细胞在不同方面呈现出免疫毒性作用,但是体内和体外试验的结果未必一致。
纳米颗粒对贝类血淋巴细胞的毒性具有浓度依赖性,高浓度下可降低细胞溶酶体和线粒体的功能。Canesi等[48]研究发现贻贝血细胞(M.galloprovincialis)暴露在纳米炭黑(NCB; 1,5,10 μg·mL-1)浓度下30 min,没有引起显著的溶酶体膜不稳定,当血细胞暴露在10 μg·mL-1浓度下60 min后,细胞表面和内部都能发现纳米炭黑,并且血细胞表现出各种形态。通过中性红保留时间试验表明,血细胞对纳米炭黑的摄取具有浓度依赖性,并诱导细胞中溶菌酶和一氧化氮的释放。在高浓度下,经流式细胞仪检测,纳米炭黑可诱导线粒体性能和膜电位降低,表明发生预凋亡过程。纳米炭黑介导的有丝分裂原活化蛋白激酶(MAPKs) p38和JNKs的快速激活效应在免疫和炎症反应中也发挥着关键作用。Kádár等[38]通过纳米铁颗粒的吸收实验评估了纳米铁在血细胞中的毒性效应,结果证明纳米铁和可溶性三氯化铁对循环血细胞的溶酶体稳定性也造成类似的损害,暴露于铁的2种不同形式,鳃脂质过氧化作用都有所增加,而乙酰胆碱酯酶活性则不受影响。Ringwood等[50]在实验中也发现纳米银会使牡蛎的溶酶体损伤。Couleau等[51]研究斑马贻贝(Dreissena polymorpha)暴露在0.1和1 mg·L-1纳米二氧化钛下时发现,贻贝细胞吞噬活性受到抑制。透射电镜显示纳米二氧化钛首次进入贻贝血细胞内。此外,暴露于纳米二氧化钛中的所有试验组都表现出ERK 1/2磷酸化水平的增加。但相比于对照组而言,只有暴露在5和 25 mg·L-1的纳米颗粒浓度下才诱导明显的p38磷酸化水平活化。以上研究显示了贝类的血淋巴细胞是纳米颗粒致毒的重要靶点。
3.3 纳米颗粒对氧化损伤的影响
活性氧(reactive oxygen species,ROS)是引起蛋白质氧化损伤的重要因素,机体内有多种抗氧化酶类可以清除ROS,如超氧化物歧化酶,过氧化氢酶和谷胱甘肽相关酶类,这些酶类的水平可以反映机体的氧化损伤状态。研究显示许多纳米颗粒可增加ROS产生,从而导致相关的抗氧化酶活性改变。Ward等[36]研究表明在几种纳米粒子中,增强过氧化氢酶活性能力的大小顺序为:SiO2>NCB=TiO2>C60。Tedesco等[31]报道在贝类消化腺中,纳米金颗粒可引起氧化型谷胱甘肽(GSSG)的比例减少和适度的氧化应激,从而氧化谷胱甘肽(GSH)和蛋白质中的巯基,因此消化腺中的蛋白巯基减少,但未引起脂质过氧化作用(LPO)或诱导硫氧还原蛋白酶活性。Tedesco[52]等的另一研究结果也显示,纳米金颗粒可诱导氧化应激,并且在鳃、外套膜和消化腺中确定了蛋白的泛素化和羰基化,诱导过氧化氢酶(CAT)活性增加。Canesi等[49]的研究表明C60和TiO2主要积累于牡蛎的消化腺细胞溶酶体中,使一系列的抗氧化酶如过氧化氢酶、谷胱甘肽的活力发生了改变,并造成脂褐质的堆积,以上都是因为氧自由基的大量产生而导致的氧化胁迫。此外,暴露时间的长短也是影响毒性的关键因素,且不同器官对纳米颗粒的生理反应显示差异性。Trevisan等[32]的研究表明,贝类在纳米氧化锌下暴露24 h后,鳃中的谷胱甘肽还原酶(GR)活性降低了29%,而其他生化反应在暴露48 h后才观察到:蛋白巯基水平降低(-21%),脂质过氧化作用(+49%)和谷胱甘肽过氧化物酶(GSH-Px)活性增加(+26%)。纳米氧化锌在消化器官的积累和超微结构变化一致,消化腺呈延迟的生化反应。暴露48 h后,除了谷胱甘肽还原酶活性降低(-47%)之外,其他生化改变在消化腺中没有表现。结果表明,鳃比消化腺更优先吸收锌颗粒,导致线粒体更早破裂和出现氧化应激。Tedesco等[59]研究发现纳米金颗粒集中积累在贻贝的消化腺中,而贻贝的氧化应激发生在24 h内,并表现出显著的脂质过氧化作用,却降低了含巯基的蛋白质含量。Ali等[60]将琵琶萝卜螺(Lymnaea luteola)暴露在纳米氧化锌颗粒(32 μg·mL-1)中24 h和96 h后,引起了消化腺还原谷胱甘肽,谷胱甘肽-S-转移酶和谷胱甘肽过氧化物酶显著减少,并伴随丙二醛水平和过氧化氢酶的增加,Gomes等[74]的研究也呈现类似结果,并引起脂质过氧化水平和金属硫蛋白浓度的增加。以上研究显示了纳米颗粒在暴露初期可以对消化腺造成急性的氧化应激作用,消化腺和鳃是纳米颗粒的主要作用靶点。另外氧化应激的程度与纳米颗粒浓度有密切关系。Zhu等[53]研究显示九孔鲍(Haliotis diversicolor supertexta)在纳米二氧化钛浓度范围为0.1~10 mg·L-1时未发现急性效应。然而,暴露在1.0 mg·L-1的纳米二氧化钛中,九孔鲍的超氧化物歧化酶(SOD)活性显著增加。当浓度≥1.0 mg·L-1时,谷胱甘肽含量显著减少,脂质过氧化水平随着纳米二氧化钛剂量的增加而增加且一氧化氮产生过量。这些结果表明,虽然纳米二氧化钛对九孔鲍没有急性毒性,但对它产生了氧化应激。Moschino等[54]研究发现单壁碳纳米管(SWCNHs)影响贻贝血细胞溶酶体,酶活性显著降低,增加了活性氧分子产生,抗氧化水平增强 ,消化道细胞脂褐素积聚增加。高浓度的单壁碳纳米管可能诱发的亚致死效应与贻贝氧化应激反应以及消化细胞和血细胞中的溶酶体变化有关,纳米颗粒积累在贻贝消化腺中,会导致消化细胞消化功能下降。
纳米颗粒在一定条件下可以诱导抗氧化酶水平增加,从而可以更加有效地清除过多的氧自由基。Buffet等[55]评估了浅沟蛤(Scrobicularia plana)在纳米氧化铜暴露下的氧化应激标志物,结果发现,过氧化氢酶、超氧化物歧化酶和谷胱甘肽-S-转移酶(GST)活性增强,金属硫蛋白也有所增加。Pan等[56]研究结果也显示,纳米金颗粒可诱导金属硫蛋白,且使过氧化氢酶、超氧化物歧化酶和谷胱甘肽S-转移酶的活性都有所增加,Buffet等[57]也证实了这一结果。有研究显示重金属纳米颗粒相比其离子状态下对贝类可引起更大程度的氧化应激。Gomes等[37]的研究表明,相比于铜离子,纳米氧化铜诱导的氧化应激在贻贝鳃中更大,引起显著的脂质过氧化。这与Ringwood等[50]的结果十分相似,并且他们在实验中发现纳米银会使牡蛎的金属硫蛋白mRNA的表达水平上升,但是到目前为止仍不清楚毒性的来源是银离子还是纳米银颗粒,或者是两者皆有。此外,纳米颗粒的暴露途经对贝类氧化应激也有一定影响。Buffet等[58]研究发现纳米乳酸银颗粒在水暴露中的生物积累比饮食暴露中更加严重,氧化应激生物标志物,如谷胱甘肽S-转移酶和超氧化物歧化酶,在饮食暴露下活性明显增加,过氧化氢酶在2种暴露方式中活性都有所增加,对于硫代巴比妥酸反应物质(TBARS),乙酰胆碱酯酶(AChE),乳酸脱氢酶(LDH)和胱天蛋白酶3而言,饮食暴露和水体暴露下没有明显差异。不同种类的纳米颗粒产生的氧化应激的程度有所不同。
3.4 纳米颗粒在分子水平上的效应
纳米颗粒可使贝类DNA结构、免疫相关基因转录水平和相关蛋白质表达改变。Barmo等[44]将紫贻贝(M.galloprovincialis)在纳米二氧化钛下暴露96 h发现,在消化腺中,纳米二氧化钛降低了抗氧化和免疫相关基因的转录。Ali等[60]将淡水螺(Lymnaea luteola)暴露在纳米氧化锌颗粒(32 μg·mL-1)中24 h和96 h后,引起消化腺细胞DNA损伤。Ali等[61]研究纳米银颗粒对L.luteola 的急性毒性和遗传毒性也得到类似结论。Gomes等[62]探讨了暴露在纳米银中紫贻贝鳃和消化腺蛋白表达谱差异,结果表明纳米银改变了与应激反应相关的2种蛋白和参与细胞骨架和细胞结构的1种蛋白的表达。纳米颗粒和相应的溶液金属离子在贝类遗传毒性上具有差异性。Gomes等[63]通过彗星试验检测纳米颗粒和离子对血细胞遗传毒性的影响,结果表明暴露在纳米颗粒和离子形式的铜和银都会诱发血细胞DNA损伤,但离子形式比纳米颗粒形式有较高的遗传毒性。蛋白质鉴定表明纳米银的分子毒性通过氧化应激诱导的细胞信号通路来介导(包括线粒体和细胞核),可导致细胞死亡。然而,Buffet等[64]的研究表明,与可溶性银相比,纳米银颗粒聚集物更容易诱导浅沟蛤(S.plana)细胞凋亡和DNA损伤,并引起炎症和免疫反应增加。Gagnè等[65]在淡水双壳类(Elliptio complanata)的组织和血细胞中观察到CdTe量子点积累,血细胞参数的改变,鳃和消化腺细胞中DNA链的断裂,从而导致DNA完整性破坏,产生分子毒性效应。纳米颗粒对不同器官的分子毒性具有差异性。McCarthy等[67]研究纳米银在美洲牡蛎(C.virginica)鳃和肝组织中的毒性,结果表明,相比于鳃,肝对纳米银更敏感,其总蛋白水平增加,更容易引起肝损伤并导致代谢和生殖障碍。纳米颗粒可以与其他环境污染物在毒性效应上产生交互作用。Canesia等[66]研究了纳米二氧化钛和2,3,7,8-四氯代二苯并二噁英(TCDD)的体外联合暴露实验,结果表明,纳米二氧化钛和TCDD能发挥协同作用,纳米二氧化钛使TCDD积累显著增加,引起血细胞中溶酶体的减少和鳃细胞中DNA损伤的增加,纳米颗粒生物积累主要集中在消化腺,引起消化腺中的基因表达改变。总之,纳米颗粒物主要从鳃,血细胞,消化腺相关细胞引起各种分子毒性,从而造成生理生化指标的变化,氧化应激与各种代谢活动紊乱。
3.5 纳米颗粒对贝类胚胎和幼体发育的毒性效应
目前有证据显示,纳米颗粒对贝类的胚胎和幼体发育产生抑制作用,如发育速率下降,产生畸形个体或致死等。胚胎发育和孵化试验在慢性纳米颗粒毒性试验中是一个确定环境中沉积纳米颗粒毒性阈值的有效手段。Musee等[68]评估了纳米材料γ-alumina、α-alumina、改良的二氧化钛(M-TiO2)和商业二氧化钛(C-TiO2)对淡水囊螺(Physa acuta)的生存、行为和早期生命阶段的影响。研究结果表明,在亚致死浓度水平上增加γ-alumina和α-alumina的浓度会引起胚胎发育率和孵化率显著下降,并诱导胚胎发育畸形。此结果意味着纳米颗粒在贝类孵化期和浮游期具有负面影响作用,可能改变某些生态种群,进而危及整个水生生态功能。Ringwood等[29]发现牡蛎幼体暴露于C60富勒烯下(4 d,10~500 μg·L-1)引起幼虫发育异常。Libralato等[69]评估纳米二氧化钛 (0~64 mg·L-1)对紫贻贝早期幼虫发育阶段的潜在影响,发现其对D型幼体的发育产生延迟性,或者导致畸形个体产生。纳米二氧化钛毒性主要与它的浓度和外周环境有关,纳米二氧化钛对幼虫产生最大不利影响的浓度发生在4~8 mg·L-1。这些浓度下普遍出现畸形的D型幼虫而不是延迟性的D型幼体前阶段幼虫。在暴露的开始阶段,毒性作用就已经发生,纳米颗粒没有损害胚胎发育,但是从担轮幼虫发育到壳顶幼虫阶段的转变时诱导产生了畸形。研究还显示光照可以增强纳米颗粒的幼体发育毒性。纳米二氧化钛浓度在4~8 mg·L-1时,光/暗条件下产生的延迟性幼虫比暗条件下多2倍,非线性回归表明,每个暴露实验出现2个EC50值:EC50在光/暗曝光条件下比暗条件下低,表明光照增加了纳米二氧化钛的毒性效应。
3.6 纳米颗粒对贝类的其他毒性效应
纳米颗粒对贝类的穴居和摄食行为有一定影响。Buffet等[55]评估了浅沟蛤(Scrobicularia plana)在纳米氧化铜颗粒和铜离子暴露下的穴居动力学和摄食行为。结果表明,在2种形式暴露下,浅沟蛤穴居行为受到了损伤,但没有表现出明显的神经毒性作用。Buffet等[58]研究发现,纳米银颗粒对浅沟蛤(S.plana)的穴居行为没有影响,但是在10 d的饮食暴露下,它的摄食行为受到了抑制。纳米颗粒对贝类壳的形态、成分和形成也有一定的影响。Zuykov等[70]将纳米银用放射性同位素标记,用它做短期的暴露实验观察紫贻贝内壳层表面(ISS)的形态,发现贝壳珍珠层在暴露状态下显示出环状结构(DSS),该结构由碳酸钙颗粒构成,覆盖在文石片表面。在野外现场采集双壳类样品时也显示有环状结构。环状结构的形成可以由贝壳钙化机理的干扰来解释。虽然环状结构的发生并不是特定地只与贻贝对金属的生物利用度联系在一起,但是环状结构的形态与金属的吸收利用有一定关系,纳米颗粒对贝壳元素组成会产生一定的变化和诱导。Gagné等[71]研究纳米氧化锌暴露对淡水贻贝(Elliptio complanata)元素组成的影响。与暴露在可溶性锌离子相比,贻贝暴露于纳米氧化锌中增加了贻贝消化腺中总锌、金属硫蛋白和脂质过氧化的水平,还加强了组织中必需元素浓度,特别是Al,As,Cd,Cu,Fe,Ni,Mo和Zn这些元素,而必需元素的增加又可导致更多的氧化性损伤。因此,金属组学是有效理解水生生物中纳米毒性效应和行为模式的有力手段。
4 展 望
形式各异的纳米颗粒通过不同途径进入水体环境,它们与环境产生的相互作用和发生的环境行为十分复杂,现有的研究结果显示不同的纳米颗粒在生态毒理和毒性上不尽相同,纳米颗粒的毒性究竟具体源自哪些方面仍有待于进一步研究,同时对纳米颗粒的毒理研究通常只考虑了颗粒的大小形态和浓度,而对纳米颗粒与实际水体环境中物质或生物大分子材料发生的相互作用和各种迁移、转化和降解等环境行为考虑不多。另外,关于此类研究多集中于单一物质对生物体的影响,而有关多种毒物联合作用对生物体毒性效应知之甚少。因此,未来的纳米颗粒生态毒理学研究应聚焦于实际环境中的纳米颗粒的迁移、转化和降解,纳米颗粒在不同水质和水文条件下的物理化学状态及其毒性,以及纳米颗粒与其他环境因素或异质的联合毒性效应,如缺氧,酸化,温度,持久性有机污染物和微塑料等,这样才能更准确地预知实际环境中纳米颗粒的生态毒理效应。
在水生无脊椎动物中,贝类是调查纳米颗粒潜在毒性影响和作用机制的理想模型生物。在纳米颗粒暴露下,免疫和消化细胞是纳米颗粒致毒的主要靶点。免疫参数评估也是反应生物体健康状况的典型指标。生物标志物方法已被证明是比传统的毒性测试(纳米颗粒是怎样导致生物体的生理变化)更有效和快捷的毒性测试方法。生物标志物可以同时提供应激物的亚致死量影响的指示,以及基本的生化机制和对可能的生殖和种群影响的一个“预警”[72]。生物标志物在生态毒理研究中凸显出其优势,如过氧化氢酶,谷胱甘肽S-转移酶,超氧化物歧化酶,硫代巴比妥酸反应物质,乙酰胆碱酯酶,DNA损伤,胱天蛋白酶3,酚氧化酶,酸性磷酸酶和溶菌酶等,可以用来解释相关毒性机制和不同类型纳米颗粒对水生生物的作用模式。
然而,当研究纳米材料的生态毒理效应时,急性体内试验(in vivo)和体外试验(in vitro)的结果不一定吻合。纳米颗粒生态毒理学中一般采用体内试验研究纳米颗粒对生物的毒性效应,与现实中生物暴露于纳米材料下较为相似,而体外实验是基于离体的器官、组织和细胞来检测其毒性,一般用于解释纳米颗粒的致毒机理,研究中应该根据纳米颗粒的性质和目标生物的特点有针对性的选择适宜的方法。Zhu等[73]指出急性毒性试验不能提供纳米材料与试验物种相互作用的全面信息。在体内和体外的毒理实验中,大多数纳米颗粒毒性效应的研究多采用短期暴露方式,且设置的纳米颗粒浓度均高于其在实际水环境中的含量,有关纳米颗粒低剂量长期暴露的研究尚不多见。近来研究也表明,慢性或长期暴露实验可能会更清晰地显示纳米颗粒的毒性。另外,已有的研究大多关注纳米颗粒对生物个体和种群的毒性影响,且基本都是在实验条件下进行,很少涉及在实际水环境条件下对生物群落水平的影响研究,缺乏环境的真实性,使得现有的研究成果存在一定局限性。并且目前对纳米材料的毒性测试缺乏标准的生理生态方法和统一的实验操作,且纳米颗粒在贝类中的生物利用度、摄取模式、摄食机理和实际体内暴露浓度尚未完全明确,使得试验结果之间可比性不强,此外,纳米颗粒的食物链迁移和生物放大作用也十分重要,特别是对一些水产动物的研究,如食用贝类,这些信息是了解纳米颗粒在人类中潜在转移的关键。因此,基于已有的研究基础,针对现有研究存在的不足,在今后还应加强对低浓度纳米颗粒长期暴露实验的研究,模拟自然环境条件下纳米颗粒的毒理效应及其作用机制研究,完善和标准化纳米材料的毒理学测定和研究方法,揭示生物体吸收和传递纳米颗粒的机制,进一步证明纳米颗粒的食物链迁移和生物放大作用,这样才能更好地研究和预测纳米材料对环境以及人类健康的影响。
[1] 熊道文,李政,方涛.纳米材料的水生态毒理学研究进展[J].环境污染与防治,2009,31(4): 71-77
Xiong D W,Li Z,Fang T.The advancement of aquatic ecotoxicological research of nanomaterials [J].Environmental Pollution & Control,2009,31(4): 71-77 (in Chinese)
[2] Nel A,Xia T,Madler L,et al.Toxic potential of materials at the nanolevel [J].Science,2006,311(5761): 622-627
[3] EU-European Commission Recommendation on the Definition of Nanomaterial [OL].http://osha.europa.eu/ en/ news eu- european commission recommendation on the definition of nanomaterial
[4] Savage N,Diallo M S.Nanomaterials and water purification: Opportunities and challenges [J].Journal of Nanoparticle Research,2005,7(4-5): 331-342
[5] Fu P P.Introduction to the special issue: Nanomaterials-toxicology and medical applications [J].Journal of Food and Drug Analysis,2014,22(1): 1-2
[6] 杨林,许恒毅,杨孟,等.人工纳米材料对水生生物毒性的研究进展[J].中国水产科学,2013,20(4): 902-909
Yang L,Xu H Y,Yang M,et al.Research progress on toxicity of manufactured nanomaterials to aquatic organisms [J].Fishery Sciences of China,2013,20(4): 902-909 (in Chinese)
[7] Scown T M,Van Aerle R,Tyler C R.Review: Do engineered nanoparticles pose a significant threat to the aquatic environment? [J].Critical Reviews in Toxicology,2010,40(7): 653-670
[8] Yuan Y,Ding J Q,Xu J S,et al.TiO2nanoparticles co-doped with silver and nitrogen for antibacterial application [J].Journal of Nanoscience Nanotechnology,2010,10(8): 4868-4874
[9] Montazer M,Seifollahzadeh S.Enhanced self-cleaning,antibacterial and UV protection properties of nano TiO2treated textile through enzymatic pretreatment [J].Photochemistry and Photobiology,2011,87(4): 877-883
[10] Ni M,Leung M K H,Leung D Y C,et al.A review and recent developments in photocatalytic water-splitting using TiO2for hydrogen production [J].Renewable & Sustainable Energy Reviews,2007,11(3): 401-425
[11] Montazer M,Behzadnia A,Pakdel E,et al.Photo induced silver on nanotitanium dioxide as an enhanced antimicrobial agent for wool [J].Photochemistry and Photobiology B,2011,103(3): 207-214
[12] Boxall B A A,Tiede K,Chaudhry Q.Engineered nanomaterials in soils and water: How do they behave and could they pose a risk to human health?[J].Nanomedicine,2007,2(6): 919-927
[13] Al-Kattan A,Wichser A,Vonbank R,et al.Release of TiO2from paints containing pigment-TiO2or nano-TiO2by weathering [J].Environmental Science-Processes & Impacts,2013,15(12): 2186-2193
[14] Li X,Lenhart J J,Walker H W.Aggregation kinetics and dissolution of coated silver nanoparticles [J].Langmuir,2012,28(2): 1095-1104
[15] Gaiser B K,Fernandes T F,Jepson M A,et al.Interspecies comparisons on the uptake and toxicity of silver and cerium dioxide nanoparticles [J].Environmental Toxicology and Chemistry,2012,31(1): 144-154
[16] Lyon D Y,Adams L K,Falkner J C,et al.Antimicrobial activity of fullerene water suspensions: Effects of preparation method and particle size [J].Environmental Science & Technology,2006,40(14): 4360-4366
[17] Lyon D Y,Falkner J C,Sayes C M,et al.Bacterial cell association and antimicrobial activity of a C60 water suspension [J].Environmental Toxicology and Chemistry,2005,24(11): 2757-2762
[18] 陈金媛,方金凤,魏秀珍.nTiO2在水中的分散沉降行为研究[J].环境科学,2013,34(10): 3933-3939
Chen J Y,Fang J F,Wei X Z.Studies on the dispersion and deposition behavior of Nano-TiO2in aquatic system [J].Environmental Science,2013,34(10): 3933-3939 (in Chinese)
[19] Keller A,Wang H,Zhou D,et al.Stability and aggregation of metal oxide nanoparticles in natural aqueous matrices [J].Environmental Science & Technology,2010,44(6): 1962-1967
[20] Tanabe S,Prudente M S,Kan-Atireklap S,et al.Mussel watch: Marine pollution monitoring of butyltins and organo chlorines in coastal waters of Thailand,Philippines and India [J].Ocean & Coastal Management,2000,43(8-9): 819-839
[21] Miller B S.Mussels as biomonitors of point and diffuse sources of trace metals in the Clyde Sea Area,Scotland [J].Water Science and Technology,1999,39(12): 233-240
[22] Rome M,Frasil C,Gnassia-Barelli M,et al.Biomonitoring of trace metals in the Black Sea (Romania) using mussels Mytilus galloprovincialis [J].Water Research,2005,39(4): 596-604
[23] Moore M N,Icarus Allen J,McVeigh A.Environmental prognostics: An integrated model supporting lysosomal stress responses as predictive biomarkers of animal health status [J].Marine Environmental Research,2006,61(3): 278-304
[24] 董波,薛钦昭,李军.滤食性贝类摄食生理的研究进展[J].海洋科学,2000,24(7): 31-34
Dong B,Xue Q Z,Li J.Advances in studies on the feeding physiology of suspension-feeding of luscs [J].Marine Sciences,2000,24(7): 31-34 (in Chinese)
[25] 杜丽,张巍,陆逵,等.贝类免疫机制研究进展[J].动物医学进展,2008,29(3): 77-81
Du L,Zhang W,Lu K,et al.Progress on immunological mechanism in mollusks [J].Progress in Veterinary Medicine,2008,29(3): 77-81 (in Chinese)
[26] 张朝霞,王军,丁少雄,等.贝类免疫学研究新进展[J].厦门大学学报: 自然科学版,2006,45(2): 438-479
Zhang C X,Wang J,Ding S X,et al.Recent progresses of shellfish’s immunology [J].Xiamen University: Natural Science,2006,45(2): 438-479 (in Chinese)
[27] Coteur G,Warnau M,Jangoux M,et al.Reactive oxygen species (ROS) production by amoebocytes of Asterias rubens (Echinodermata) [J].Fish & Shellfish Immunology,2002,12(3): 187-200
[28] García-Negrete C A,Blasco J,Volland M,et al.Behaviour of Au-citrate nanoparticles in seawater and accumulation in bivalves at environmentally relevant concentrations [J].Environmental Pollution,2013,174(1): 134-141
[29] Ringwood A H,Levi Polyachenko N,Carroll D L.Fullerene exposures with oysters: Embryonic,adult,and cellular responses [J].Environmental Science & Technology,2009,43(18): 7136-7141
[30] Zuykov Michael,Pelletier Emilien,Demers Serge.Colloidal complexed silver and silver nanoparticles in extrapallial fluid of Mytilus edulis [J].Marine Environmental Research,2011,71(1): 17-21
[31] Tedesco S,Doyle H,Blasco J,et al.Exposure of the blue mussel,Mytilus edulis,to gold nanoparticles and the prooxidant menadione [J].Comparative Biochemistry and Physiology,2010,151(2): 167-174
[32] Trevisan R,Delapedra G,Mello D F,et al.Gills are an initial target of zinc oxide nanoparticles in oysters Crassostrea gigas,leading to mitochondrial disruption and oxidativestress [J].Aquatic Toxicology,2014,153(1): 27-38
[33] Koehler A,Marx U,Broeg K,et al.Effects of nanoparticles in Mytilus edulis gills and hepatopancreas: A new threat to marine life? [J].Marine Environmental Research,2008,66(1): 12-14
[34] Khan F R,Misra S K,García-Alonso J,et al.Bioaccumulation dynamics and modeling in an estuarine invertebrate following aqueous exposure to nanosized and dissolved silver [J].Environmental Science & Technology,2012,46(14): 7621-7628
[35] Croteau M N,Misra S K,Luoma S N,et al.Silver bioaccumulation dynamics in a freshwater invertebrate after aqueous and dietary exposures to nanosized and ionic Ag [J].Environmental Science & Technology,2011,45(15): 6600-6607
[36] Ward J E,Kach D J.Marine aggregates facilitate ingestion of nanoparticles by suspension-feeding bivalves [J].Marine Environmental Research,2009,68(3): 137-142
[37] Gomes T C,Pinheiro J P S,Cancio I,et al.The effects of copper nanoparticles exposure in the mussel Mytilus galloprovincialis [J].Environmental Science & Technology,2011,45(21): 9356-9362
[38] Kádár E,Lowe D M,Solé M,et al.Uptake and biological responses to nano-Fe versus soluble FeCl3in excised mussel gills [J].Analytical and Bioanalytical Chemistry,2010,396(2): 657-666
[39] Kádár E,Simmance F,Martin O,et al.The influence of engineered Fe2O3nanoparticles and soluble FeCl3iron on the developmental toxicity caused by CO2-induced seawater acidification [J].Environmental Pollution,2010,158(12): 3490-3497
[40] Hull M S,Vikesland P J,Schultz I R.Uptake and retention of metallic nanoparticles in the mediterranean mussel (Mytilus galloprovincialis) [J].Aquatic Toxicology,2013,140-141: 89-97
[41] D'Agata A,Fasulo S,Dallas L J,et al.Enhanced toxicity of 'bulk' titanium dioxide compared to 'fresh' and 'aged' nano-TiO2in marine mussels ( Mytilus galloprovincialis) [J].Nanotoxicology,2014,8(5): 549-558
[42] Al-Sid-Cheikh M,Rouleau C,Pelletier E.Tissue distribution and kinetics of dissolved and nanoparticulate silver iniceland scallop (Chlamys islandica) [J].Marine Environmental Research,2013,86(1): 21-28
[43] Wang Y J,Hu M H,Li Q Z,et al.Immune toxicity of TiO2under hypoxia in the green-lipped mussel Perna viridis based on flow cytometric analysis of hemocyte parameters [J].Science of the Total Environment,2014,470-471: 791-799
[44] Barmo C,Ciacci C,Canonico B,et al.In vivo effects of n-TiO2on digestive gland and immune function of the marine bivalve Mytilus galloprovincialis [J].Aquatic Toxicology,2013,132-133: 9-18
[45] Abbott C T E,Galloway J F,Graczyk T K.Pilot study on effects of nanoparticle exposure on Crassostrea virginica hemocyte phagocytosis [J].Marine Pollution Bulletin,2012,64(10): 2251-2253
[46] Moore M N.Do nanoparticles present ecotoxicological risks for the health of the aquatic environment? [J].Environment International,2006,32(8): 967-976
[47] Moore M N,Readman J A J,Readman J W,et al.Lysosomal cytotoxicity of carbon nanoparticles in cells of the molluscan immune system: An in vitro study [J].Nanotoxicology,2009,3(1): 40-45
[48] Canesi L,Ciacci C,Betti M,et al.Immunotoxicity of carbon black nanoparticles to blue mussel hemocytes [J].Environment International,2008,34(8): 1114-1119
[49] Canesi L,Fabbri R,Gallo G,et al.Biomarkers in Mytilus galloprovincialis exposed to suspensions of selected nanoparticles (Nano carbon black,C60 fullerene,Nano-TiO2,Nano-SiO2) [J].Aquatic Toxicology,2010,100(2): 168-177
[50] Ringwood A H,McCarthy M,Bates T C,et al.The effects of silver nanoparticles on oyster embryos [J].Marine Environ Research,2010,69(S): S49-S51
[51] Couleau N,Techer D,Pagnout C,et al.Hemocyte responses of Dreissena polymorpha following a short-term in vivo exposure to titanium dioxide nanoparticles: Preliminary investigations [J].Science of the Total Environment,2012,438(1): 490-497
[52] Tedesco S,Doyle H,Redmond G,et al.Gold nanoparticles and oxidative stress in Mytilus edulis [J].Marine Environmental Research,2008,66(1): 131-133
[53] Zhu X S,Zhou J,Cai Z H.The toxicity and oxidative stress of TiO2nanoparticles in marine abalone [J].Marine Pollution Bulletin,2011,63(1): 334-338
[54] Moschino V,Nesto N,Barison S,et al.A preliminary investigation on nanohorn toxicity in marine mussels and polychaetes [J].Science of the Total Environment,2014,468-469: 111-119
[55] Buffet P E,Tankoua O F,Pan J F,et al.Behavioural and biochemical responses of two marine invertebrates Scrobicularia plana and Hediste diversicolor to copper oxide nanoparticles [J].Chemosphere,2011,84(1): 166-174
[56] Pan J F,Buffet P E,Poirier L,et al.Size dependent bioaccumulation and ecotoxicity of gold nanoparticles in an endobenthic invertebrate: The tellinid clam Scrobicularia plana [J].Environmental Pollution,2012,168: 37-43
[57] Buffet P E,Amiard-Triquet C,Dybowska A,et al.Fate of isotopically labeled zinc oxide nanoparticles in sediment and effects on two endobenthic species,the clam Scrobicularia plana and the ragworm Hediste diversicolor [J].Ecotoxicology and Environmental Safety,2012,84(1): 191-198
[58] Buffet P E,Pan J F,Poirier L,et al.Biochemical and behavioural responses of the endobenthic bivalve Scrobicularia plana to silver nanoparticles in sea water and microalgal food [J].Ecotoxicology and Environmental Safety,2013,89(1): 117-124
[59] Tedesco S,Doyle H,Blasco J,et al.Oxidative stress and toxicity of gold nanoparticles in Mytilus edulis [J].Aquatic Toxicology,2010,100(1): 178-186
[60] Ali D,Alarifi S,Kumar S,et al.Oxidative stress and genotoxic effect of zinc oxide nanoparticles in freshwater snail Lymnaea luteola L.[J].Aquatic Toxicology,2012,124-125: 83-90
[61] Ali D,Yadav P G,Kumar S,et al.Sensitivity of freshwater pulmonate snail Lymnaea luteola L.,to silver nanoparticles [J].Chemosphere,2014,104(1): 134-140
[62] Gomes T,Pereira C G,Cardoso C,et al.Differential protein expression in mussels Mytilus galloprovincialis exposed to nano and ionic Ag [J].Aquatic Toxicology,2013,136-137: 79-90
[63] Gomes T,Araújo O,Pereira R,et al.Genotoxicity of copper oxide and silver nanoparticles in the mussel Mytilus galloprovincialis [J].Marine Environmental Research,2013,84(1): 51-59
[64] Buffet P E,Aurore Z V,Amélie C,et al.A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: The ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana [J].Science of the Total Environment,2014,470-471: 1151-1159
[65] Gagnè F,Auclair J,Turcotte P,et al.Ecotoxicity of CdTe quantum dots to freshwater mussel:Impacts on immune system,oxidative stress and genotoxicity [J].Aquatic Toxicology,2008,86(3): 333-340
[66] Canesia L,Frenzilli G,Balbi T,et al.Interactive effects of n-TiO2and 2,3,7,8-TCDD on the marine bivalve Mytilus galloprovincialis [J].Aquatic Toxicology,2013,3671: 1-13
[67] McCarthy M P,Carroll D L,Ringwood A H.Tissue specific responses of oysters,Crassostrea virginica,to silver nanoparticles [J].Aquatic Toxicology,2013,138-139: 123-128
[68] Musee N,Oberholster P J,Sikhwivhilu L,et al.The effects of engineered nanoparticles on survival,reproduction,and behaviour of freshwater snail,Physa acuta (Draparnaud,1805) [J].Chemosphere,2010,81(1): 1196-1203
[69] Libralato G,Minetto D,Totaro S,et al.Embryotoxicity of TiO2nanoparticles to Mytilus galloprovincialis (Lmk) [J].Marine Environmental Research,2013,92(1): 71-78
[70] Zuykov M,Pelletier E,Belzile C,et al.Alteration of shell nacre micromorphology in blue mussel Mytilus edulis after exposure to free-ionic silver and silver nanoparticles [J].Chemosphere,2011,84(1): 701-706
[71] Gagné F,Turcotte P,Auclair J,et al.The effects of zinc oxide nanoparticles on the metallome in freshwater mussels [J].Comparative Biochemistry and Physiology C,2013,158(1): 22-28
[72] Canesi L,Ciacci C,Fabbri R,et al.Bivalve molluscs as a unique target group for nanoparticle toxicity [J].Marine Environmental Research,2012,76(1): 16-21
[73] Zhu X,Chang Y,Chen Y.Toxicity and bioaccumulation of TiO2nanoparticle aggregates in Daphnia magna [J].Chemosphere,2010,78(1): 209-221
[74] Gomes T,Pereira C G,Cardoso C,et al.Accumulation and toxicity of copper oxide nanoparticles in the digestive gland of Mytilus galloprovincialis [J].Aquatic Toxicology,2012,118-119: 72-79
[75] Hull M S,Chaurand P,Rose J,et al.Filter-feeding bivalves store and biodeposit colloidally stable gold nanoparticles [J].Environmental Science and Technology,2011,45(15): 6592-6599
[76] Wegner A,Besseling E,Foekema E M,et al.Effects of nanopolystyrene on the feeding behaviour of the Blue Mussel (Mytilus edulis L.) [J].Environmental Toxicology and Chemistry,2012,31(11): 2490-2497;
◆
Research Progress in Ecotoxic Effects of Manufactured Nanomaterials on Shellfish
Ge Chunmei1,Huang Xizhi1,Lin Daohui2,3,Wang Youji1,2,*,Lu Weiqun1,#
1.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China 2.The Key Laboratory of Organic Pollution Process and Control,Zhejiang Province,Hangzhou 310058,China 3.Department of Environmental Science,Zhejiang University,Hangzhou 310058,China
5 August 2014 accepted 20 October 2014
Nanotechnology has become one of the most rapidly developing technologies in the 21st century.Nanomaterials are widely applied to various areas because of the special physical and chemical properties,including agriculture,electronics,biomedicine,manufacturing,pharmaceuticals and cosmetics,thus nanomaterials are inevitably released into the aquatic environment.Shellfish has attracted much attention in nano-toxicology studies due to its wide distribution,key position in food chain,filter feeding habit,strong ability to bioaccumulate heavy metals and contaminants,and aquaculture and commercial value.In this article,we summarized and analyzed the latest scientific research references,through three aspects: 1) the behavior of manufactured nanomaterials in water environment; 2) the significance of shellfish as indicator organisms to monitor marine pollution; 3) the toxic effects of manufactured nanomaterials on shellfish,mainly including nanoparticles uptake,accumulation and depuration of shellfish,and reviews from tissue and cell level,molecule and gene level,embryonic development and individual growth and other physiological toxicity effect.
manufactured nanomaterials; shellfish; toxic effects; review
国家自然科学基金(31302207);上海市自然科学基金(13ZR1455700);上海教委创新项目(13YZ096);上海市大学生创新项目(B-5106-12-0020;B-5106-13-0001);上海高校水产学一流学科建设项目; 浙江省有机污染过程与控制重点实验室开放基金项目(2015-2016)
葛春梅(1992-),女,研究生,研究方向为水产养殖,E-mail: 863596783@qq.com;
*通讯作者(Corresponding author),E-mail: yj_wang@shou.edu.cn
2014-08-05 录用日期:2014-10-20
1673-5897(2015)4-1-16
X171.5
A
王有基(1981—),男,海洋生物与环境科学博士,副教授,主要研究方向为水生动物生态生理学。
吕为群(1967—),男,生理学博士,教授,主要研究方向为水生动物适应生理学。
#共同通讯作者(Co-corresponding author),E-mail: wqlv@shou.edu.cn
10.7524/AJE.1673-5897.20140805001
葛春梅,黄茜枝,王有基,等.人工纳米材料对贝类生态毒理效应的研究进展[J].生态毒理学报,2015,10(4): 1-16
Ge C M,Huang X Z,Wang Y J,et al.Research progress in ecotoxic effects of manufactured nanomaterials on shellfish [J].Asian Journal of Ecotoxicology,2015,10(4): 1-16(in Chinese)

