环草隆与镉复合污染对城市绿地重金属污染土壤有机氮矿化量、基础呼吸和土壤酶活性的影响
谷盼妮,王美娥,陈卫平
1.中国科学院生态环境研究中心 城市与区域生态国家重点实验室,北京 100085 2.中国科学院大学,北京 100039
环草隆与镉复合污染对城市绿地重金属污染土壤有机氮矿化量、基础呼吸和土壤酶活性的影响
谷盼妮1,2,王美娥1,*,陈卫平1
1.中国科学院生态环境研究中心 城市与区域生态国家重点实验室,北京 100085 2.中国科学院大学,北京 100039
环草隆是北方城市应用较为广泛的一种草坪除草剂,重金属镉是土壤中常见的重要污染物,二者在土壤生态系统中存在联合暴露的潜在风险。为了准确评价城市绿地土壤重金属和农药复合污染的生态风险,选择不同重金属污染程度的土壤为研究对象,在室内模拟条件下,探讨了环草隆与镉复合污染对土壤有机氮矿化量、基础呼吸及土壤酶活性的影响。研究发现:环草隆与镉复合污染对各试验指标的影响均达到极显著水平(P<0.01);与镉复合污染能明显改变环草隆的微生物毒性效应,并且Cd对环草隆毒性效应的影响与二者浓度配比有很大关系,Cd浓度由1 mg·kg-1升高到10 mg·kg-1,环草隆浓度与样点G土壤有机氮矿化量变化率的线性关系由正相关变为负相关;复合污染下,根据剂量-效应关系计算的EC50值27.6~848 mg·kg-1,远远高于环草隆草坪建议施用量(3.33 mg·kg-1);土壤中环草隆与镉复合污染的联合毒性效应受土壤理化性质及重金属含量影响较大,另外,二者复合效应也会随污染物浓度及试验指标的不同而不同。以上研究结果能够为城市土壤重金属和除草剂复合污染生态风险评价提供基础数据和技术方法。
环草隆;镉;城市土壤;氮矿化;基础呼吸;土壤酶;剂量-效应关系
城市土壤是城市生态系统的主要组成部分,也是城市化的主要风险受体。随着城市化高度发展,城市土壤重金属污染与绿化农药污染越来越严重[1-4]。城市土壤重金属污染的主要来源有工业生产污染源、交通运输污染源、日常生活污染源、城市堆放的废弃物以及原土壤母质的输入。Chen等[5]对北京市30个公园的土壤重金属含量的调查结果发现市中心公园以及建成历史几百年的公园土壤中Cu与Pb含量较高。
环草隆是北方城市应用较为广泛的一种冷季型草坪播后苗前最优秀的草坪除草剂,制剂为50%可湿性粉剂,对草坪种子的萌发无不良影响,可以有效地控制狗尾草、止血马唐、毛雀麦和稗草。至今为止国内外学者对环草隆的研究大多关注其除草效果,任向辉和王运兵[6]研究了环草隆、甲嘧磺隆和世玛3种草坪除草剂对黑麦草草坪杂草防除的效果,结果表明,环草隆在黑麦草草坪杂草防除中最有应用价值。而Willis等[7]与McElroy和Breeden[8]的研究则表明,环草隆对高羊茅草坪杂草防除效果不理想,不能有效防治阔叶杂草。此外,有关环草隆对水环境的生态风险的研究也有涉及,Kong等[9]对天津市20个地表水样的监测发现,20个水样均含有环草隆。早期的研究结果表明,环草隆淋溶较少,较多累积于表层土壤,生物降解速率中等,对一些土壤细菌如Azotobacter sp.及Chlorella vulgaris的生长具有抑制作用[10-11]。而关于环草隆的其他生态效应和环境行为如对土壤微生物的毒性效应的报道相对较少。
土壤是所有环境污染物的源和汇,是一个多种污染物同时存在的复合污染系统,因此,土壤复合污染联合生态毒性效应研究长期以来备受关注[12-16]。目前,应用模型定量评估复合污染联合毒性效应的研究较多[17],应用最多的2类评估模型分别是浓度加合模型与独立作用模型。此外,还有毒性单元模型及其衍生模型毒性指数模型。关于这些模型的数据基础都是室内微宇宙毒性效应实验结果,这些模型在野外实际场地的适用性很难验证。另一方面,采用野外复合污染场地土壤,即基于基质而非基于化学物质的复合污染联合毒性效应研究也颇受关注[18-20],在他们的研究中,研究土壤为离点源距离不同、土壤重金属浓度呈梯度变化的重金属复合污染土壤,并通过土壤微生物生态功能参数来表征复合污染的生态毒理效应。其中,滕应等[19]通过统计分析对实际污染土壤中4种重金属复合污染对土壤酶动力学的联合生态效应进行了相对定量的评估。由于以上研究都以重金属浓度较高污染场地土壤为研究对象,所获得的样品中重金属浓度梯度变化较为明显,因此,在没有实验室模拟辅助的情况也可以得出较好的定量结果。然而,对于污染物浓度本身比较低而且变化范围相对较小的城市土壤,直接应用野外实际污染土壤进行联合生态效应的评估困难较大。此外,野外实际污染土壤中产生的生态效应会因为干扰因素过多而掩盖了污染物生态效应的产生机制,而实验室模拟试验中由于控制条件,往往较容易对复合效应产生机制进行研究[21]。因此,还需要以实验室研究结果为指导,通过一定的数学方法使实验室结果与野外调查结果相结合,最后达到野外土壤复合污染联合生态效应的评估。
在结果计算中,为更直观表示污染物毒性效应,土壤污染毒性效应研究引入了变化率(处理组相对于对照组的变化情况)这一无量纲变量来表征污染物处理对测试指标造成的影响。目前,这一数据处理方式在土壤污染毒性效应中已有很多应用。律泽等[15]在佳乐麝香与镉复合污染对放线菌数量的影响研究中,用放线菌数量抑制率对实验结果作了直观展示。张慧等[22]对镉与芘复合污染的研究中也用了抑制率来表示二者对土壤酶活与微生物量的影响。傅丽君等[23]对镉、铜、铅复合污染的研究中同样应用了抑制(激活)率来表示土壤微生物受到的影响。此外,将变化率这一变量应用到污染物的剂量-效应关系研究中也会使得EC值的计算更加简便。
有研究发现,土壤中有机污染物与重金属复合污染对生物的联合毒性效应随着污染物浓度的变化以及培养时间的不同而不同[24],从而导致污染物的EC50值也随之发生变化。因此,本文选取污染程度不同的实际土壤,采用土壤微宇宙试验方法,通过添加不同浓度环草隆和重金属Cd,研究两者单一及复合污染对土壤微生物活性及土壤酶活等方面的影响,以确定镉的加入对环草隆毒性效应的影响以及EC50值的变化情况,从而为预测重金属镉对环草隆草坪应用的影响,及准确定量污染物剂量与土壤生态功能效应之间的相关关系,同时也为城市土壤复合污染的生态风险评价提供理论基础和数据支持。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:激光粒度仪 Malvem Master Sizer 2000(Malvem Co.,England),Elementar Vario EL Ⅲ (Hanau Germany),紫外分光光度计(UV-1700),多功能酶标仪(SPECTRA max 190)。
试剂:环草隆,50%可湿性粉剂;重金属含量测定所用试剂为国产优级纯试剂;其他步骤所用试剂为国产分析纯试剂。
1.2 供试土壤
土壤取自北京市南馆公园,采用五点混合采样法采取0~20 cm表层土壤,选取不同重金属污染程度的3个样点N、D、G分别采样。土样去除石块及植物根系后,过2 mm筛,一部分新鲜土壤样品装入无菌自封袋置于4 ℃冰箱保存,用于培养,供各试验指标分析; 一部分土壤样品风干,用于土壤理化性质分析。各样点土壤重金属含量及理化性质见表1。根据Hakanson指数法[25],样点N、D和G土壤重金属综合污染指数分别为8.89、17.2和57.8。
1.3 试验方法
1.3.1 试验设计及土壤处理
本试验采用土壤微宇宙试验,研究了环草隆与镉复合污染对土壤微生物及酶活性的影响。具体操作如下:
称取250 g干土当量的新鲜土壤于500 mL三角瓶中,调节土壤含水量至田间持水量60%,覆盖无菌封口膜,防止水分过量蒸发,置于25 ℃恒温培养箱中避光培养15 d。预培养结束后,采用土壤染毒法对土壤进行染毒。
正式试验之前,为确定环草隆添加浓度,对环草隆的微生物毒性效应随培养时间的变化做了预实验。根据预实验结果,在培养第7天,3~30 mg·kg-1浓度范围内,环草隆与试验指标的剂量-效应关系最明显,因此本实验将培养时间定为7 d,环草隆浓度梯度在0~50 mg·kg-1范围内设定。本试验采用二因素分别为5水平(环草隆浓度分别为0,5,10,20,50 mg·kg-1)和3水平(镉浓度分别为0,1,10 mg·kg-1)的完全组合试验方案设计,共计15个处理。具体添加措施见表2。
环草隆污染土样添加方法:称取适量环草隆溶解于蒸馏水中,配制成1 000 mg·L-1的环草隆溶液。取适量上述溶液添加到供试土壤中混合均匀,使得环草隆浓度分别为5、10、20、50 mg·kg-1,即得5、10、20、50 mg·kg-1环草隆污染土样。
镉污染土样添加方法:将Cd(Ac)2·2H2O配制成500 mg·L-1水溶液,取适量上述溶液添加到供试土壤中混合均匀,使得镉浓度分别为1、10 mg·kg-1,即得1、10mg·kg-1镉污染土样。环草隆与镉复合污染土样采用上述相同方法配制。
添加污染物后,反复搅拌,充分混合,使污染物在土壤中分布均匀。将土壤含水量调至田间持水量60%,覆盖无菌封口膜,防止水分过量蒸发,置于25 ℃恒温培养箱中避光培养。每隔2~3 d用称重法调节土壤含水量,于培养第7天取样测定。将其中一部分土壤风干,用于土壤脲酶、芳基硫酸酯酶、蔗糖酶和碱性磷酸酶活性测定,其余新鲜土壤用于土壤有机氮矿化量、基础呼吸的测定,每处理重复3次。

表1 供试土壤基本理化性质及重金属含量Table 1 Basic physicochemical properties and heavy metal contents of the tested soils

表2 各处理环草隆与Cd2+添加浓度Table 2 Concentrations of siduron and Cd2+ in each treatment
1.3.2 测定方法
土壤理化性质的测定:土壤质地划分为粘粒、粉粒、砂粒,0.5 mol·L-1NaPO3处理后,用激光衍射系统Malvern Master Sizer 2000(Malvern Co.,England)测定。测定pH的土水比为1:5,土样与去离子水充分混匀,静置30 min后测定。土壤有机碳的测定选用盐酸处理法[26],预处理后,使用元素分析仪Elementar Vario ELⅢ(Hanau Germany)测定有机碳含量。
土壤重金属含量的测定:取过100目的土壤样品0.25 g,用土壤环境监测技术规范(HJ/T 166-2004)中的HCL-HNO3-HF-HCLO4法消解土壤,消解产物加1~3滴1:1盐酸,用超纯水定容至50 mL,用石墨炉原子吸收分光光度计测定Cd含量,用ICP-MS测定Cu、Pb和Zn含量。
土壤酶活性测定:脲酶活性测定采用苯酚钠-次氯酸钠比色法[27];芳基硫酸酯酶活性的测定选用氢氧化钠-氯化钙比色法[28];蔗糖酶活性测定采用3,5-二硝基水杨酸比色法[29];碱性磷酸酶活性测定采用磷酸苯二钠比色法[30]。
土壤有机氮矿化量采用厌气培养法测定[31]。
土壤基础呼吸采用密闭碱液吸收法测定[32]。
1.3.3 结果计算
土壤微生物及土壤酶活各指标变化率采用如下公式计算:
R=(b-a)/a×100%
式中:R为变化率(%),正值表示激活作用,负值表示抑制作用;a为对照组测定值;b为T1~T14处理组测定值。
环草隆与镉复合污染联合作用模式计算公式如下:
P(E)=P1+P2
式中:P(E)为理论预测变化率;P1为污染物A引起的变化率;P2为污染物B引起的变化率。若实测值P(T)>理论值P(E),则其联合作用模式为协同作用,若实测值P(T)<理论值P(E),则其联合作用模式为拮抗作用。
1.3.4 实验数据分析
原始数据采用Excel进行初步计算及整理。用DPS 7.05软件多因素方差分析中的Turkey多重比较检验不同处理间结果差异显著性,统计显著性。用SPSS 18.0软件进行回归拟合分析,将变化率与环草隆浓度进行回归分析并计算对应的EC50值。用Sigmaplot 12.5软件作图。
2 结果及分析(Results and analysis)
2.1 环草隆单一及与镉复合污染下各样点土壤试验指标变化率的方差分析
方差分析结果表明(表3),环草隆、镉单一污染及二者复合污染对各试验指标的影响均达到极显著水平(P<0.01),并且变化率在不同样点土壤之间变化也非常明显(P<0.01)。
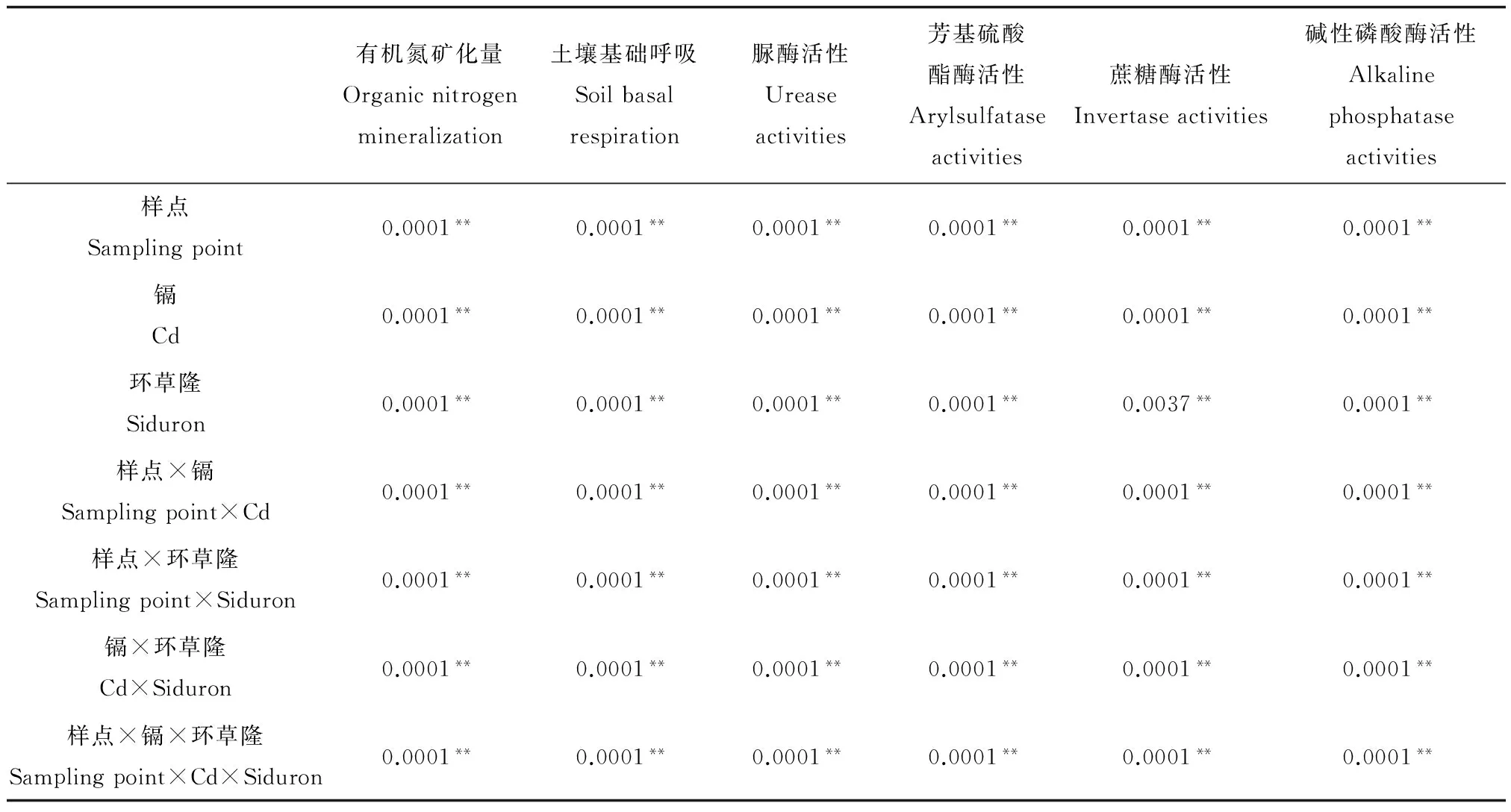
表3 环草隆与镉单一及复合污染下不同样点土壤试验指标变化率方差分析Table 3 Variance analysis of experimental index change rate under single and combined treatment of siduron and cadmium in different soils
注:**P<0.01。
Note: **P<0.01.
2.2 环草隆与镉复合污染对土壤有机氮矿化量的影响
方差分析结果表明(表3),环草隆、镉单一污染及二者复合污染对土壤有机氮矿化量的影响均达到极显著水平(P<0.01),并且有机氮矿化量变化率在不同样点土壤之间变化也非常明显(P<0.01)。
环草隆单一及与镉复合污染下,随环草隆浓度升高,土壤有机氮矿化量变化率的变化情况见图1。由图中可以看出,随环草隆浓度升高,除与10 mg·kg-1Cd复合污染下,样点G土壤有机氮矿化量变化率降低外,环草隆单一及与不同浓度Cd复合污染下,各样点土壤有机氮矿化量变化率整体均有不同程度升高。单一污染下,样点N土壤有机氮矿化量变化率随环草隆浓度升高持续升高,由-38%升高到30%,样点D土壤有机氮矿化量变化率在环草隆浓度20 mg·kg-1降低的基础上增高,由-41%升高到40%,而样点G土壤有机氮矿化量变化率则是在环草隆浓度10 mg·kg-1降低的基础上增高,由3.5%升高到5.8%;与1 mg·kg-1Cd复合污染下,样点N土壤有机氮矿化量变化率随环草隆浓度增高在环草隆浓度20 mg·kg-1降低的基础上升高,由20%升高到40%,样点D土壤有机氮矿化量变化率则是在环草隆浓度10 mg·kg-1降低的基础上增高,由25%升高到100%,样点G土壤有机氮矿化量变化率随环草隆浓度升高持续升高,由3.8%升高到6%;与10 mg·kg-1Cd复合污染下,样点N土壤有机氮矿化量变化率随环草隆浓度升高,在环草隆浓度10 mg·kg-1降低的基础上增高,由30%升高到105%,样点D土壤有机氮矿化量变化率的变化趋势与1 mg·kg-1Cd复合污染时样点D的变化趋势类似,也是在环草隆浓度10 mg·kg-1降低的基础上増高,由18%升高到40%,样点G土壤有机氮矿化量变化率则随环草隆浓度升高持续降低,由12%降低到-3%。
环草隆单一及与镉复合污染下,对土壤有机氮矿化量变化率与环草隆浓度进行回归拟合,将回归系数达到显著水平(P<0.05)且拟合效果最好的方程列出,见表4。由表4可以看出,单一污染下样点N土壤有机氮矿化量变化率、与1 mg·kg-1Cd复合污染下样点D和G土壤有机氮矿化量变化率、与10 mg·kg-1Cd复合污染下样点G土壤有机氮矿化量变化率与环草隆浓度剂量-效应关系呈线性关系,且环草隆单一污染及与1 mg·kg-1Cd 复合污染下呈正相关关系,环草隆起激活作用,与10 mg·kg-1Cd复合污染下呈负相关关系,环草隆起抑制作用。根据剂量-效应关系,计算出环草隆单一及与镉复合污染的土壤有机氮矿化量50%变化率(EC50)值如表4所示。不论是EC50激活值还是抑制值,都远远高于环草隆草坪建议施用量(3.33 mg·kg-1),因此,不论是单一污染还是与镉复合污染,环草隆对相应样点土壤有机氮矿化量的影响均较小。其中,Cd浓度由1 mg·kg-1升高到10 mg·kg-1,环草隆与样点G土壤有机氮矿化量变化率的线性关系由正相关变为负相关,由此可见,Cd对环草隆毒性效应的影响与二者浓度配比有很大关系。

图1 环草隆单一及与镉复合污染对土壤有机氮矿化量的影响
在不同浓度环草隆与镉复合污染下,土壤有机氮矿化量变化率理论值与实测值比较见图2。从图中可以看出,环草隆浓度5~50 mg·kg-1范围内,与1 mg·kg-1Cd复合污染下,环草隆浓度20 mg·kg-1处理的样点N土壤与10 mg·kg-1浓度处理的样点D土壤有机氮矿化量变化率理论值P(E)>实测值P(T),环草隆与镉呈拮抗效应,其他浓度下均呈协同效应,而环草隆浓度5~50 mg·kg-1范围内,样点G土壤有机氮矿化量变化率理论值P(E)<实测值P(T),均表现协同效应;与10 mg·kg-1Cd复合污染下,环草隆浓度10、20 mg·kg-1处理的样点N土壤,10、50 mg·kg-1浓度处理的样点D土壤与50 mg·kg-1浓度处理的样点G土壤有机氮矿化量变化率理论值P(E)>实测值P(T),环草隆与镉呈拮抗效应,其他浓度下均呈协同效应。
由上可知,样点N土壤有机氮矿化量在环草隆浓度10 mg·kg-1,镉浓度由1 mg·kg-1增加到10 mg·kg-1时,联合作用由协同作用变为拮抗作用,可见随镉浓度升高,其对环草隆的毒性效应有一定缓解作用,同样,对环草隆浓度50 mg·kg-1下的样点D和G土壤,镉也有相同效应。
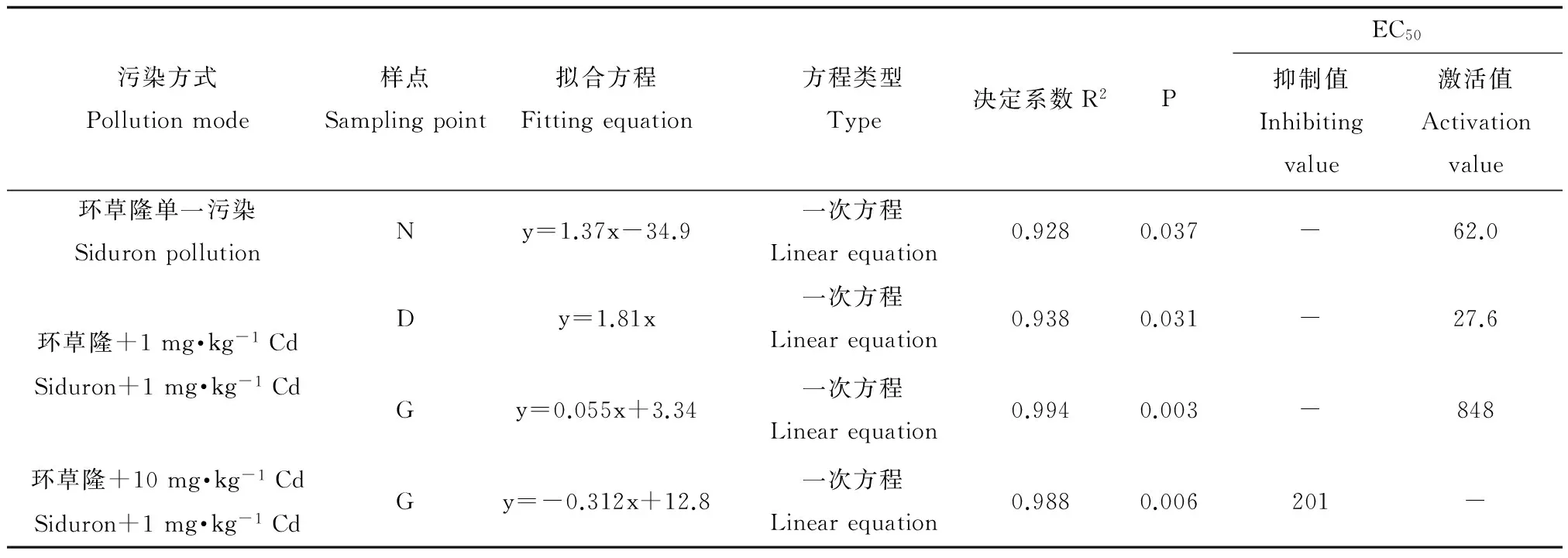
表4 环草隆单一及与镉复合污染下土壤有机氮矿化量变化率与环草隆浓度的剂量-效应关系Table 4 Dose-effect relationship of the change rate of soil organic nitrogen mineralization and siduron concentrations under single and combined treatment of siduron and Cd
2.3 环草隆与镉复合污染对土壤基础呼吸的影响
方差分析结果表明(表3),环草隆、镉单一污染及二者复合污染对土壤基础呼吸的影响均达到极显著水平(P<0.01),并且土壤基础呼吸变化率在不同样点土壤之间变化也非常明显(P<0.01)。
环草隆单一及与镉复合污染下,随环草隆浓度升高,对土壤基础呼吸的影响比较结果见图3。由图中可以看出,在环草隆浓度5~50 mg·kg-1范围内,单一污染下,随环草隆浓度升高,样点N和D土壤基础呼吸变化率在环草隆浓度20 mg·kg-1降低的基础上増高,分别由0%升高到115%、由-45%升高到-40%,而样点G土壤基础呼吸变化率则是在在环草隆浓度10、50 mg·kg-1升高的基础上降低,从90%降低到40%;与1 mg·kg-1Cd复合污染下,样点N土壤基础呼吸变化率在环草隆浓度10、50 mg·kg-1降低的基础上増高,从-10%升高到-5%,而样点D土壤基础呼吸变化率则是在环草隆浓度20 mg·kg-1升高的基础上降低,从30%降低到-5%,样点G土壤基础呼吸变化率随环草隆浓度升高持续降低,从36%降低到-25%;与10 mg·kg-1Cd复合污染下,样点N土壤基础呼吸变化率在环草隆浓度20、50 mg·kg-1升高的基础上降低,从20%降低到-10%,而样点D和G土壤基础呼吸变化率则是在环草隆浓度50 mg·kg-1升高的基础上降低,分别从100%降低到30%、从15%降低到5%。
环草隆单一及与镉复合污染下,对土壤基础呼吸变化率与环草隆浓度进行回归拟合,回归系数未达到显著水平(P<0.05),因此,环草隆与土壤基础呼吸变化率剂量-效应关系不显著。
不同浓度环草隆与镉复合污染下,土壤基础呼吸变化率理论值与实测值比较见图4。从图中可以看出,环草隆浓度5~50 mg·kg-1范围内,与1 mg·kg-1Cd复合污染下,样点N土壤基础呼吸变化率理论值P(E)>实测值P(T),呈拮抗效应,样点D土壤基础呼吸变化率在环草隆浓度10 mg·kg-1时,理论值P(E)>实测值P(T),表现拮抗效应,其他浓度表现协同效应,样点G土壤基础呼吸变化率在环草隆浓度20 mg·kg-1时,理论值P(E)<实测值P(T),表现协同效应,其他浓度表现拮抗效应;与10 mg·kg-1Cd复合污染下,样点N土壤基础呼吸变化率在环草隆浓度5 mg·kg-1时,理论值P(E)<实测值P(T),表现协同效应,其他浓度表现拮抗效应,样点D土壤基础呼吸变化率在环草隆浓度10 mg·kg-1时,理论值P(E)>实测值P(T),表现拮抗效应,其他浓度表现协同效应,样点G土壤基础呼吸变化率在环草隆浓度20 mg·kg-1时,理论值P(E)<实测值P(T),表现协同效应,其他浓度表现拮抗效应。
由上可知,在环草隆浓度5 mg·kg-1,镉浓度由1 mg·kg-1升高到10 mg·kg-1时,联合作用在样点N土壤由拮抗变为协同,即随镉浓度升高,其加强了环草隆对样点N土壤基础呼吸的毒性效应。而环草隆与镉对样点D和G土壤基础呼吸的联合作用没有随镉浓度的升高而发生变化。
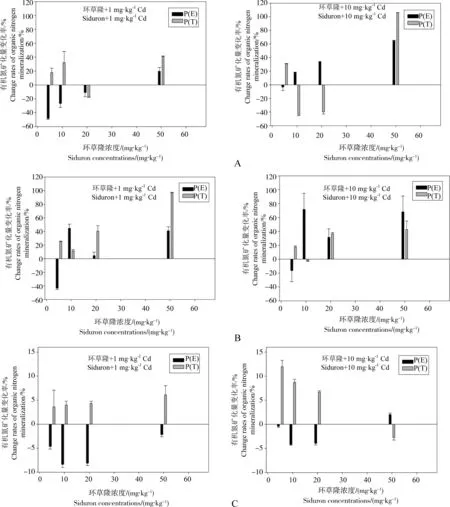
图2 环草隆与Cd复合污染的土壤有机氮矿化量变化率理论值与实测值比较
2.4 环草隆与镉复合污染对土壤脲酶活性的影响
方差分析结果表明(表3),环草隆、镉单一污染及二者复合污染对土壤脲酶活性的影响均达到极显著水平(P<0.01),并且土壤脲酶活性变化率在不同样点土壤之间变化也非常明显(P<0.01)。
环草隆单一及与镉复合污染下,随环草隆浓度升高,对土壤脲酶活性变化率的影响见图5。由图中可以看出,环草隆浓度5~50 mg·kg-1范围内,单一污染下,样点N土壤脲酶活性变化率随环草隆浓度升高持续升高,从-2.5%升高到4%,而样点D和G土壤脲酶活性变化率在环草隆浓度10、20 mg·kg-1波动的基础上,最终恢复到初始变化率;与1 mg·kg-1Cd复合污染下,样点N土壤脲酶活性变化率随环草隆浓度升高持续升高,由-21%升高到11%。样点D土壤脲酶活性变化率在环草隆浓度20 mg·kg-1升高的基础上降低,由-5%降低到-18%,样点G土壤脲酶活性变化率在环草隆浓度10、50 mg·kg-1升高的基础上降低,由2.2%降低到1%;与10 mg·kg-1Cd复合污染下,样点N土壤脲酶活性变化率在环草隆浓度10 mg·kg-1升高的基础上降低,由-8%降低到-25%,而样点G土壤脲酶活性变化率在环草隆浓度50 mg·kg-1降低的基础上升高,由-7%升高到1.5%,样点D土壤脲酶活性变化率随环草隆浓度升高而降低,由-20%降低到-25%。

图3 环草隆单一及与镉复合污染对土壤基础呼吸的影响
环草隆单一及与镉复合污染下,对土壤脲酶活性变化率与环草隆浓度进行回归拟合,将回归系数达到显著水平(P<0.05)且拟合效果最好的方程列出,见表5。由表5可以看出,与1 mg·kg-1Cd复合污染下,样点N土壤脲酶活性变化率与环草隆浓度剂量-效应关系呈线性关系,且呈正相关关系,环草隆起激活作用。根据剂量-效应关系,计算出环草隆与1 mg·kg-1Cd复合污染的土壤脲酶活性50%变化率(EC50)值如表5所示。EC50值335 mg·kg-1远远高于环草隆草坪建议施用量(3.33 mg·kg-1),因此,与1mg·kg-1Cd复合污染下,环草隆对样点N土壤脲酶活性影响较小。
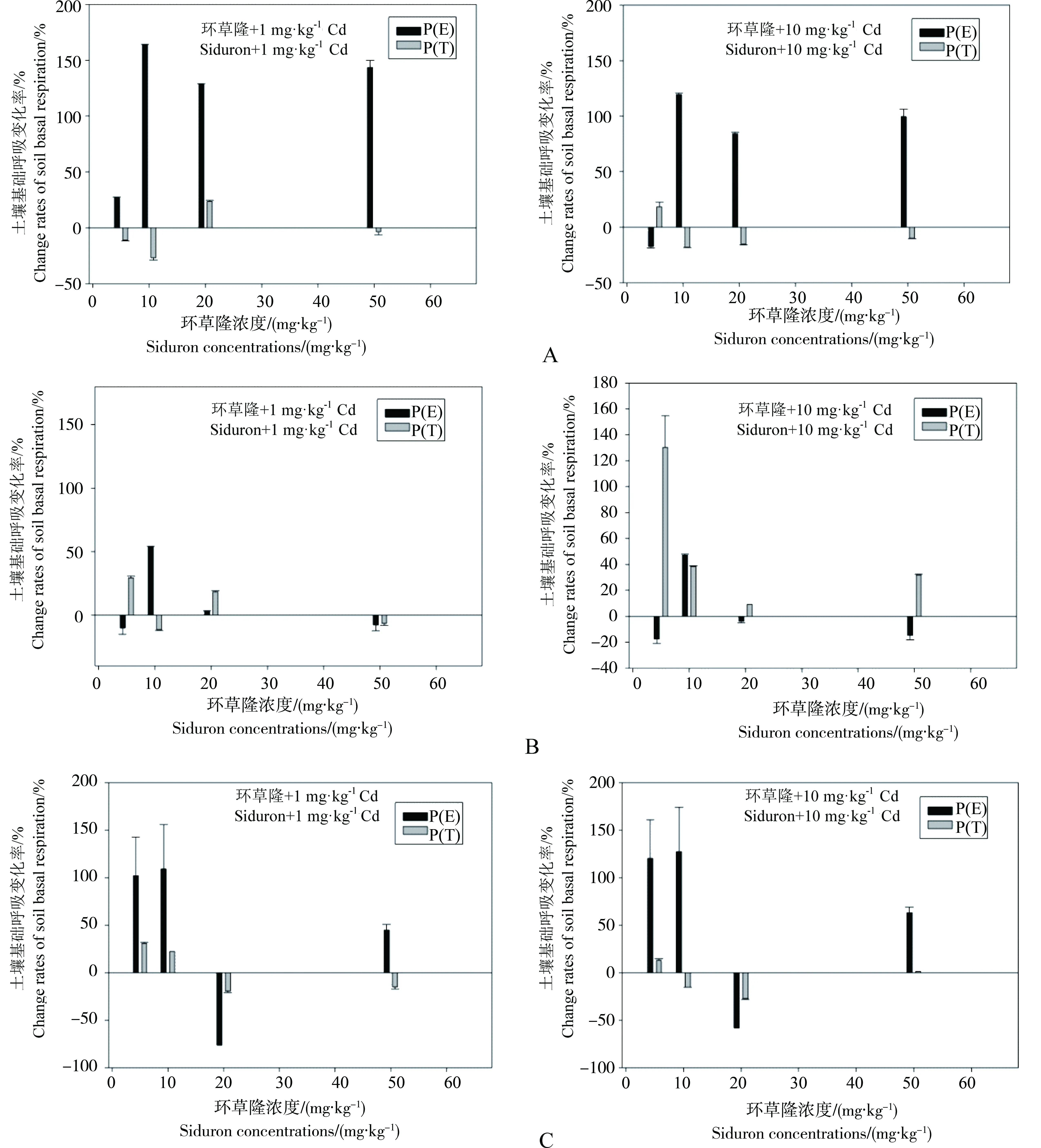
图4 环草隆与Cd复合污染对土壤基础呼吸变化率理论值与实测值比较
不同浓度环草隆与镉复合污染下,土壤脲酶活性变化率理论值与实测值比较见图6。从图中可以看出,环草隆浓度5~50 mg·kg-1范围内,与1 mg·kg-1Cd复合污染下,样点N土壤脲酶活性变化率理论值P(E)>实测值P(T),表现拮抗效应,样点G土壤脲酶活性变化率理论值P(E)<实测值P(T),表现协同效应,样点D土壤脲酶活性变化率在环草隆浓度5 mg·kg-1时,理论值P(E)<实测值P(T),表现协同效应,其他浓度呈拮抗效应;与10 mg·kg-1Cd复合污染下,样点D土壤脲酶活性变化率理论值P(E)>实测值P(T),表现拮抗效应,样点N土壤脲酶活性变化率在环草隆浓度50 mg·kg-1时,理论值P(E)>实测值P(T),呈拮抗效应,其他浓度呈协同效应,样点G土壤脲酶活性变化率在环草隆浓度5、10 mg·kg-1时,理论值P(E)>实测值P(T),呈拮抗效应,在环草隆浓度20、50 mg·kg-1时,理论值P(E)<实测值P(T),呈协同效应。

图5 环草隆单一及与镉复合污染对土壤脲酶活性的影响

表5 环草隆单一及与镉复合污染下土壤脲酶活性变化率与环草隆浓度的剂量-效应关系Table 5 Dose-effect relationship of the change rate of soil urease activities and siduron concentrations under single and combined treatment of siduron and Cd

图6 环草隆与Cd复合污染对土壤脲酶活性变化率理论值与实测值比较
由上可知,环草隆5、10和20 mg·kg-1浓度处理下,随镉浓度由1 mg·kg-1上升到10 mg·kg-1,二者对样点N土壤脲酶活性的联合作用由拮抗变为协同,环草隆毒性效应被增强,而对于5 mg·kg-1浓度处理的样点D土壤和5、10 mg·kg-1浓度处理的样点G土壤,环草隆毒性作用则随镉浓度升高被减弱。
2.5 环草隆与镉复合污染对土壤芳基硫酸酯酶活性的影响
方差分析结果表明(表3),环草隆、镉单一污染及二者复合污染对土壤芳基硫酸酯酶活性的影响均达到极显著水平(P<0.01),并且土壤芳基硫酸酯酶活性变化率在不同样点土壤之间变化也非常明显(P<0.01)。
环草隆单一及与镉复合污染下,随环草隆浓度升高,土壤芳基硫酸酯酶活性变化率的变化情况见图7。由图中可以看出,环草隆浓度5~50 mg·kg-1范围内,单一污染下,样点N和G土壤芳基硫酸酯酶活性变化率在环草隆浓度20mg·kg-1降低的基础上升高,分别从9%升高到11%,从11%升高到15%,而样点D土壤芳基硫酸酯酶活性变化率则是在环草隆浓度50 mg·kg-1降低的基础上増高,从-3%升高到5%;与1 mg·kg-1Cd复合污染下,样点N土壤芳基硫酸酯酶活性变化率在环草隆浓度10 mg·kg-1升高的基础上,从6%回复到6%,样点D土壤芳基硫酸酯酶活性变化率在环草隆浓度10 mg·kg-1升高的基础上降低,从-9%降低到-40%,而样点G土壤芳基硫酸酯酶活性变化率则是在环草隆浓度20 mg·kg-1升高的基础上降低,从120%降低到-60%;与10 mg·kg-1Cd复合污染下,随环草隆浓度升高,样点N土壤芳基硫酸酯酶活性变化率持续降低,从2%降低到-18%。样点D土壤芳基硫酸酯酶活性变化率在环草隆浓度20 mg·kg-1降低的基础上升高,从-30%升高到-20%。样点G土壤芳基硫酸酯酶活性变化率在环草隆浓度20 mg·kg-1升高的基础上降低,从70%降低到5%。
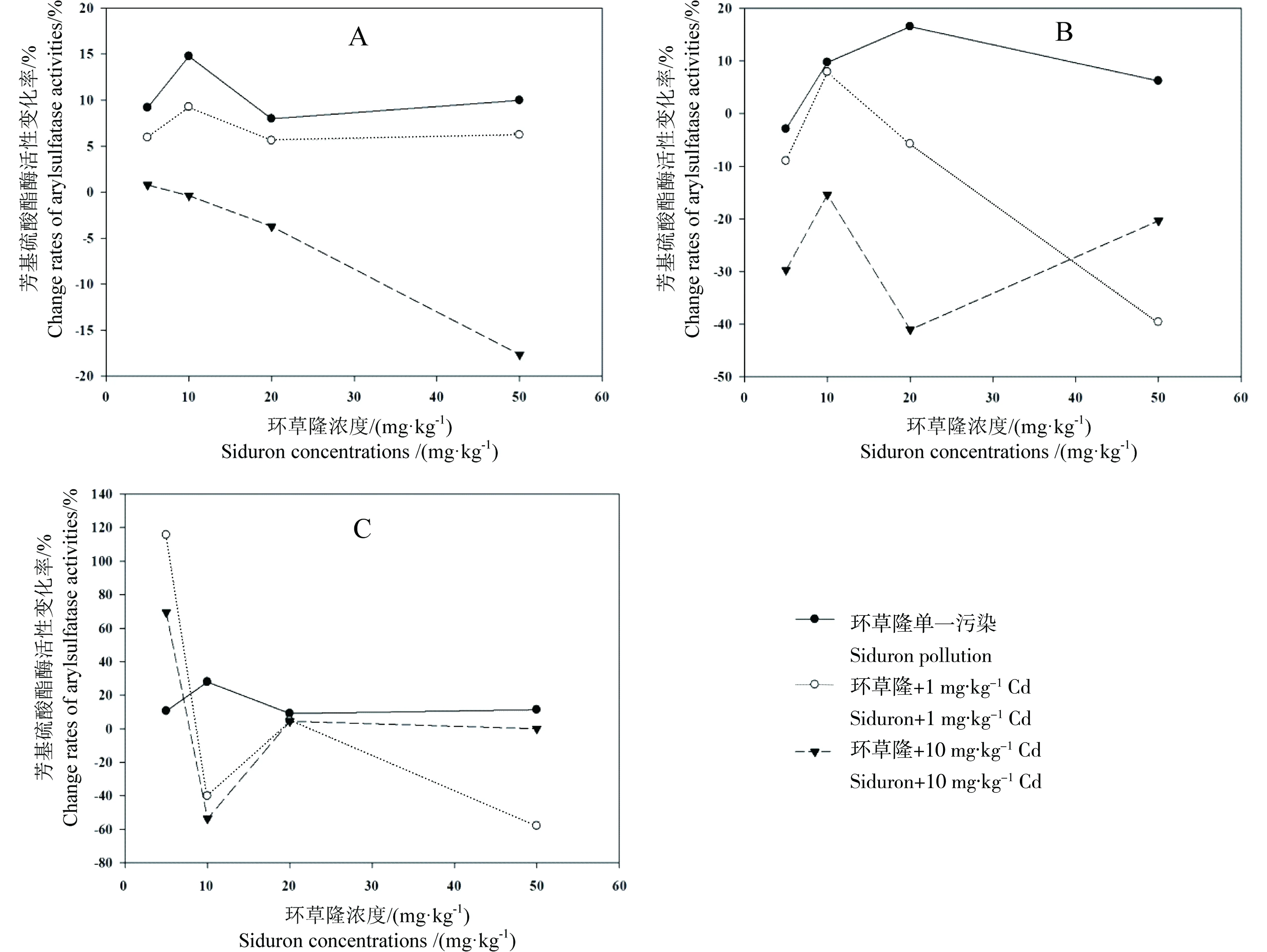
图7 环草隆单一及与镉复合污染对土壤芳基硫酸酯酶活性的影响
环草隆单一及与镉复合污染下,对土壤芳基硫酸酯酶活性变化率与环草隆浓度进行回归拟合,将回归系数达到显著水平(P<0.05)且拟合效果最好的方程列出,见表6。由表6可以看出,与10 mg·kg-1Cd复合污染下,样点N土壤芳基硫酸酯酶活性变化率与环草隆浓度剂量-效应关系呈线性关系,且呈负相关关系,环草隆起抑制作用。根据剂量-效应关系,计算出环草隆与10 mg·kg-1Cd复合污染的土壤芳基硫酸酯酶活性50%变化率(EC50)值如表6所示。EC50值128 mg·kg-1远远高于环草隆草坪建议施用量(3.33 mg·kg-1),因此,与10 mg·kg-1Cd复合污染下,环草隆对样点N土壤芳基硫酸酯酶活性影响较小。
不同浓度环草隆与镉复合污染下,土壤芳基硫酸酯酶活性变化率理论值与实测值比较见图8。从图中可以看出,环草隆浓度5~50 mg·kg-1范围内,与1 mg·kg-1Cd 复合污染下,样点N和D土壤芳基硫酸酯酶活性变化率理论值P(E)>实测值P(T),表现为拮抗效应,样点G土壤芳基硫酸酯酶活性变化率在环草隆浓度5 mg·kg-1时,理论值P(E)<实测值P(T),表现为协同效应,其他浓度呈拮抗效应;与10 mg·kg-1Cd复合污染下,样点N和D土壤芳基硫酸酯酶活性变化率理论值P(E)>实测值P(T),仍表现为拮抗效应,样点G土壤芳基硫酸酯酶活性变化率在环草隆浓度10 mg·kg-1时,理论值P(E)>实测值P(T),表现为拮抗效应,其他浓度呈协同效应。
由上可知,样点G土壤在环草隆浓度20、50 mg·kg-1时,联合作用随镉浓度的升高由拮抗变为协同,环草隆毒性效应也随之增强。
2.6 环草隆与镉复合污染对土壤蔗糖酶活性的影响
方差分析结果表明(表3),环草隆、镉单一污染及二者复合污染对土壤蔗糖酶活性的影响均达到极显著水平(P<0.01),并且土壤蔗糖酶活性变化率在不同样点土壤之间变化也非常明显(P<0.01)。
环草隆单一及与镉复合污染下,随环草隆浓度升高,对土壤蔗糖酶活性变化率的影响结果见图9。由图中可以看出,单一污染下,随环草隆浓度升高,样点N土壤蔗糖酶活性变化率经过5~20 mg·kg-1浓度范围内的短暂升高后,最终降低,由-2.5%降低到-4%,样点D和G土壤蔗糖酶活性变化率在环草隆浓度20 mg·kg-1升高的基础上降低,分别从1%下降到-5%,从3%下降到1%;与1 mg·kg-1Cd复合污染下,随环草隆浓度升高,样点N土壤蔗糖酶活性变化率在环草隆浓度5~20 mg·kg-1范围内降低的基础上有轻微升高,从-3%升高到-2.5%,样点D土壤蔗糖酶活性变化率随环草隆浓度升高持续升高,从-23%升高到13%,而样点G土壤蔗糖酶活性变化率随环草隆浓度升高持续降低,从23%降低到8%;与10 mg·kg-1Cd复合污染下,随环草隆浓度升高,样点N土壤蔗糖酶活性变化率在环草隆浓度5~20 mg·kg-1范围内升高的基础上有轻微降低,从4%降低到2.5%,样点D土壤蔗糖酶活性变化率在环草隆浓度50 mg·kg-1升高的基础上降低,从-2%降低到-6%,样点G土壤蔗糖酶活性变化率随环草隆浓度升高持续升高,从1%升高到18%。
环草隆单一及与镉复合污染下,对土壤蔗糖酶活性变化率与环草隆浓度进行回归拟合,将回归系数达到显著水平(P<0.05)且拟合效果最好的方程列出,见表7。由表7可以看出,与10 mg·kg-1Cd复合污染下,样点G土壤蔗糖酶活性变化率与环草隆浓度剂量-效应关系呈线性关系,且呈正相关关系,环草隆起激活作用。根据剂量-效应关系,计算出环草隆与10 mg·kg-1Cd复合污染的土壤蔗糖酶活性50%变化率(EC50)值如表7所示。EC50值124 mg·kg-1远远高于环草隆草坪建议施用量(3.33 mg·kg-1),因此,与10 mg·kg-1Cd复合污染下,环草隆对样点G土壤蔗糖酶活性的影响较小。
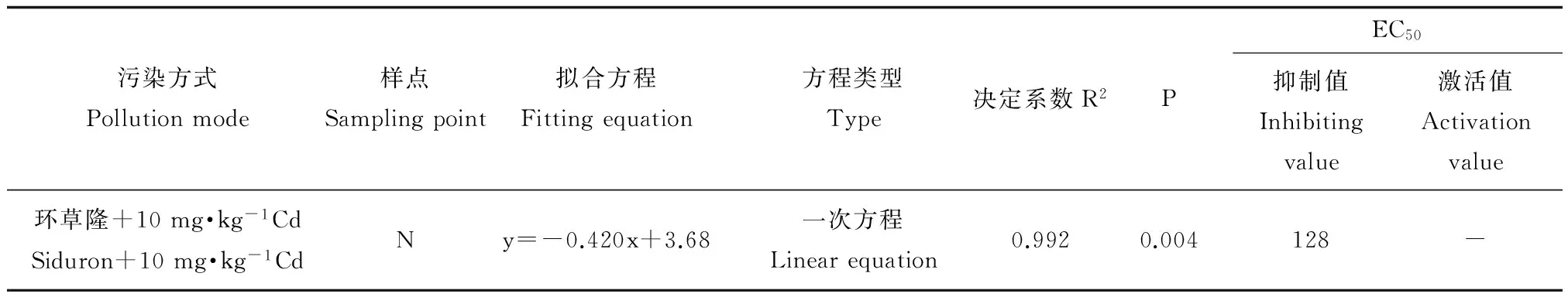
表6 环草隆单一及与镉复合污染下土壤芳基硫酸酯酶活性变化率与环草隆浓度的剂量-效应关系Table 6 Dose-effect relationship of the change rate of soil arylsulfatase activities and siduron concentrations under single and combined treatment of siduron and Cd

图8 环草隆与Cd复合污染对土壤芳基硫酸酯酶活性变化率理论值与实测值比较
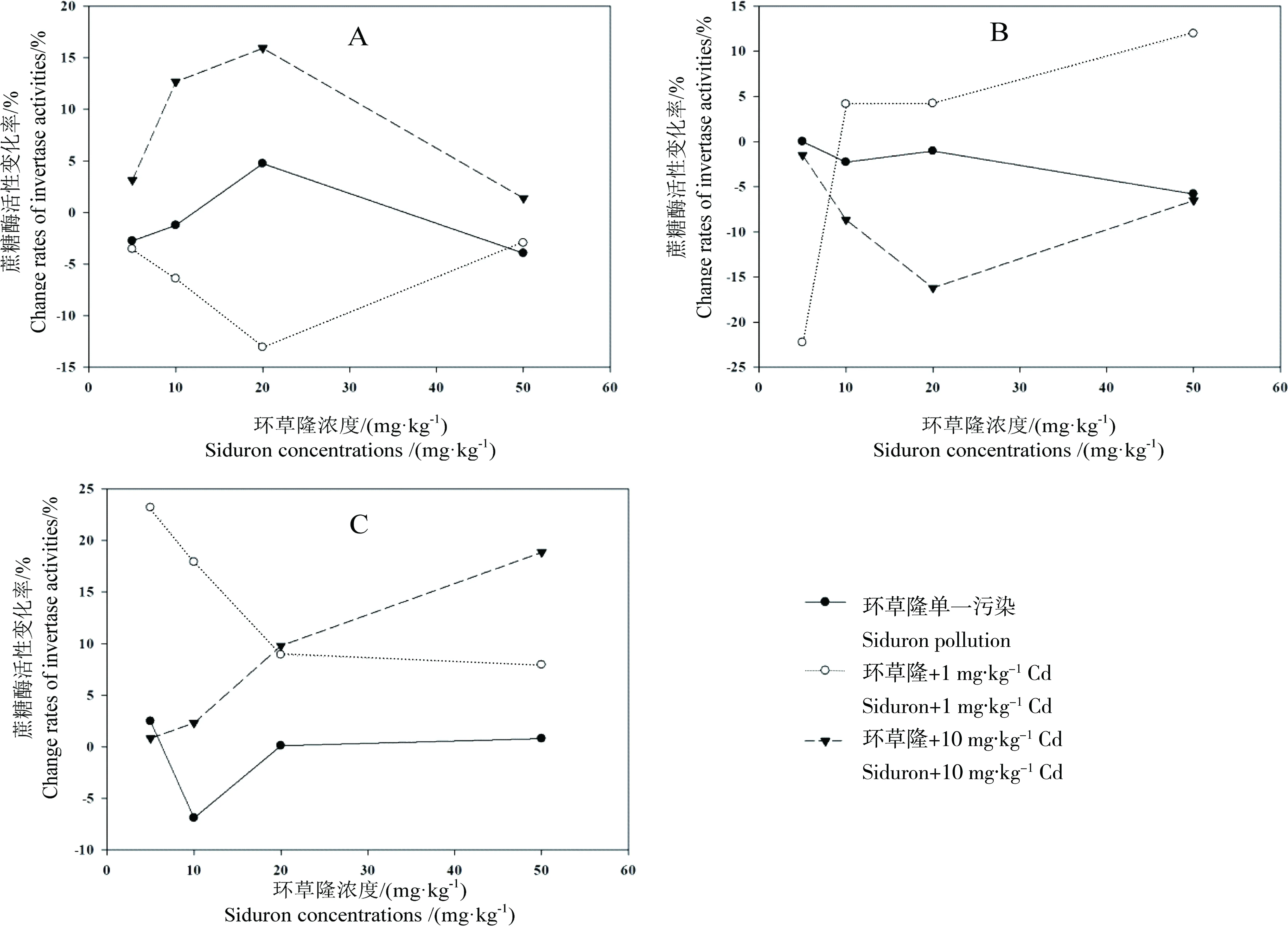
图9 环草隆单一及与镉复合污染对土壤蔗糖酶活性的影响
不同浓度环草隆与镉复合污染下,土壤蔗糖酶活性变化率理论值与实测值比较见图10。从图中可以看出,环草隆浓度5~50 mg·kg-1范围内,与1 mg·kg-1Cd复合污染下,样点N土壤蔗糖酶活性变化率理论值P(E)>实测值P(T),呈拮抗效应,而样点G土壤蔗糖酶活性变化率理论值P(E)<实测值P(T),呈协同效应,样点D土壤蔗糖酶活性变化率在环草隆浓度5 mg·kg-1时,理论值P(E)>实测值P(T),呈拮抗效应,其他浓度表现协同效应;与10 mg·kg-1Cd复合污染下,样点N土壤蔗糖酶活性变化率理论值P(E)<实测值P(T),呈协同效应,而样点G土壤蔗糖酶活性变化率理论值P(E)>实测值P(T),呈拮抗效应,样点D土壤蔗糖酶活性变化率在环草隆浓度5、50 mg·kg-1时,理论值P(E)<实测值P(T),呈协同效应,在环草隆浓度10、20 mg·kg-1时,理论值P(E)>实测值P(T),呈拮抗效应。
由上可知,除在环草隆浓度50 mg·kg-1时,样点D土壤联合作用没有随镉浓度改变发生变化外,其他环草隆浓度处理的3个样点土壤,联合效应均随镉浓度由1 mg·kg-1上升到10 mg·kg-1而被反转,即环草隆对样点N土壤蔗糖酶活性的毒性效应随镉浓度升高被增强,对样点G土壤蔗糖酶活性的毒性效应随镉浓度升高被减弱,对样点D土壤蔗糖酶活性的毒性效应,5 mg·kg-1浓度处理的效应随镉浓度升高被增强,10、20 mg·kg-1浓度处理的效应随镉浓度升高被减弱。
2.7 环草隆与镉复合污染对土壤碱性磷酸酶活性的影响

表7 环草隆单一及与镉复合污染下土壤蔗糖酶活性变化率与环草隆浓度的剂量-效应关系Table 7 Dose-effect relationship of the change rate of soil invertase activities and siduron concentrations under single and combined treatment of siduron and Cd
方差分析结果表明(表3),环草隆、镉单一污染及二者复合污染对土壤碱性磷酸酶活性的影响均达到极显著水平(P<0.01),并且土壤碱性磷酸酶活性变化率在不同样点土壤之间变化也非常明显(P<0.01)。

图10 环草隆与Cd复合污染对土壤蔗糖酶活性变化率理论值与实测值比较

图11 环草隆单一及与镉复合污染对土壤碱性磷酸酶活性的影响
环草隆单一及与镉复合污染下,随环草隆浓度升高,对土壤碱性磷酸酶活性变化率的影响见图11。由图中可以看出,单一污染下,随环草隆浓度升高,样点N土壤碱性磷酸酶活性变化率在环草隆浓度20、50 mg·kg-1的轻微升高后,最终降低,从7%下降到4%,而样点G土壤碱性磷酸酶活性变化率在环草隆浓度10、20 mg·kg-1降低的基础上升高,由35%升高到45%,样点D土壤碱性磷酸酶活性变化率随环草隆浓度升高持续升高,从-20%升高到15%;与1 mg·kg-1Cd复合污染下,随环草隆浓度升高,样点N和G土壤碱性磷酸酶活性变化率在环草隆浓度50 mg·kg-1升高的基础上降低,分别从-9%降低到-16%,从67%降低到17%,而样点D土壤碱性磷酸酶活性变化率在环草隆浓度50 mg·kg-1降低的基础上升高,从-23%升高到-10%;与10 mg·kg-1Cd复合污染下,随环草隆浓度増高,样点N土壤碱性磷酸酶活性变化率在环草隆浓度10 mg·kg-1升高的基础上降低,从2%下降到-23%,而样点D土壤碱性磷酸酶活性变化率在环草隆浓度10 mg·kg-1降低的基础上増高,从-40%升高到-25%,样点G土壤碱性磷酸酶活性变化率在环草隆浓度10、20 mg·kg-1降低的基础上増高,从-3%升高到40%。
环草隆单一及与镉复合污染下,对土壤碱性磷酸酶活性变化率与环草隆浓度进行回归拟合,将回归系数达到显著水平(P<0.05)且拟合效果最好的方程列出,见表8。由表8可以看出,环草隆单一污染下,样点D土壤碱性磷酸酶活性变化率与环草隆浓度剂量-效应关系呈对数关系。根据剂量-效应关系,计算出环草隆单一污染的土壤碱性磷酸酶活性50%变化率(EC50)值如表8所示。EC50抑制值0.26 mg·kg-1,远远低于环草隆草坪建议施用量(3.33 mg·kg-1),而EC50激活值1 686 mg·kg-1在环境中不可能出现,由此可以看出,环草隆的使用会严重抑制样点D土壤碱性磷酸酶活性。
不同浓度环草隆与镉复合污染下,土壤碱性磷酸酶活性变化率理论值与实测值比较见图12。从图中可以看出,环草隆浓度5~50 mg·kg-1范围内,与1 mg·kg-1Cd复合污染下,样点N土壤碱性磷酸酶活性变化率理论值P(E)>实测值P(T),呈拮抗效应,样点D土壤碱性磷酸酶活性变化率在环草隆浓度50 mg·kg-1时,理论值P(E)>实测值P(T),呈拮抗效应,其他浓度理论值P(E)<实测值P(T),表现协同效应,而样点G土壤碱性磷酸酶活性变化率在环草隆浓度5 mg·kg-1时,理论值P(E)<实测值P(T),呈协同效应,其他浓度呈拮抗效应;与10 mg·kg-1Cd复合污染下,样点N土壤碱性磷酸酶活性变化率理论值P(E)<实测值P(T),呈协同效应,而样点G土壤碱性磷酸酶活性变化率理论值P(E)>实测值P(T),呈拮抗效应,样点D土壤碱性磷酸酶活性变化率在环草隆浓度5、50 mg·kg-1时,理论值P(E)<实测值P(T),呈协同效应,在环草隆浓度10、20 mg·kg-1时,P(E)>实测值P(T),呈拮抗效应。
由上可知,在样点N土壤,环草隆浓度5~50 mg·kg-1范围内,随镉浓度由1 mg·kg-1增加到10 mg·kg-1,联合作用由拮抗变为协同,即环草隆对样点N土壤碱性磷酸酶活性毒性效应增强。在样点D土壤,环草隆浓度10、20 mg·kg-1时,对碱性磷酸酶活性的毒性效应随镉浓度升高被减弱,环草隆浓度50mg·kg-1时,对碱性磷酸酶活性的毒性效应随镉浓度升高被增强。环草隆浓度5 mg·kg-1对样点G土壤碱性磷酸酶活性的毒性效应随镉浓度升高被减弱。
3 讨论(Discussions)
周启星等[33]研究发现,复合污染生态毒理效应在微生物数量和分子水平上取决于其浓度水平的组合关系。Wang等[13]对丁草胺与镉复合污染的研究,也发现2种污染物对土壤酶活性的影响决定于土样中2种污染物浓度的配比,丁草胺-镉复合污染显著降低了土壤微生物种群多样性。这与本研究镉的加入能够明显改变环草隆的微生物毒性效应,且随镉浓度不同,影响也不相同的结果一致。研究发现,样点N土壤有机氮矿化量在环草隆浓度10 mg·kg-1,样点D和G土壤在环草隆浓度50 mg·kg-1时,镉浓度由1 mg·kg-1增加到10 mg·kg-1时,联合作用由协同作用变为拮抗作用。另外,在环草隆浓度5 mg·kg-1,镉浓度由1 mg·kg-1升高到10 mg·kg-1时,二者对样点N土壤基础呼吸的联合作用由拮抗变为协同。环草隆对土壤酶活性的影响也随镉浓度变化有不同表现。重金属影响除草剂毒性效应的报道还有很多。Chen等[34]研究发现,Pb在一定浓度时会加速除草剂莠去津的降解,从而改变其对土壤氮硝化的毒性效应。胡著邦等[35]对镉与苄嘧磺隆复合污染的研究表明,随培养时间变化,微生物量氮呈现降低-升高趋势,二者交互作用由协同变为拮抗。陈莹莹等[36]研究了除草剂丁草胺和重金属镉(Cd)复合污染对2种土壤呼吸强度的影响,发现二者对土壤呼吸强度的影响依次表现为:丁草胺>Cd与丁草胺复合污染>Cd,镉降低了丁草胺的毒性效应。Wang等[14]研究也表明,丁草胺与镉对土壤脲酶及磷酸酶活性的影响与二者浓度配比有很大关系。此外,重金属镉还对多种有机物的毒性效应有影响作用。有研究发现,佳乐麝香和Cd单一、复合处理能够明显抑制土壤放线菌数量,且Cd的加入能明显改变佳乐麝香对土壤放线菌的毒性效应,使其EC50值的变化范围更广[15]。沈国清等[37]研究表明,菲和镉复合污染毒性效应的持续时间比单一污染更长。Chen等[38]也发现,镉的存在能明显抑制小麦幼苗对AHTN的吸收。

表8 环草隆单一及与镉复合污染下土壤碱性磷酸酶活性变化率与环草隆浓度的剂量-效应关系Table 8 Dose-effect relationship of the change rate of soil alkaline phosphatase activities and siduron concentrations under single and combined treatment of siduron and Cd

图12 环草隆与Cd复合污染对土壤碱性磷酸酶活性变化率理论值与实测值比较
有机物与重金属复合污染的联合毒性效应产生机理研究有以下几个方面:竞争结合位点、影响微生物及酶活性、干扰生物生理活动及生物大分子的合成等。有研究表明,重金属能对有机物的土壤行为产生影响,如铜离子能降低草甘磷在矿物上的吸附性能,从而增加草甘膦的生物有效性[39]。Moreau等[40]认为,菲对Zn的拮抗作用可能是因为菲改变了溶酶体膜的稳定性及功能,从而影响了溶酶体解除Zn毒害的作用。Teisseire等[41]认为,敌草隆与铜之间的拮抗作用是由于前者可消除由Cu诱导产生的氧化胁迫,同时敌草隆还可促进如谷胱甘肽还原酶、抗过氧化物酶等酶活性,提高了细胞抗氧化能力。此外,重金属镉通过改变土壤微生物的活性也会影响农药在土壤环境中的滞留时间[42]。而对于本研究中环草隆与Cd复合污染对土壤有机氮矿化、基础呼吸及酶活性影响的机理还有待进一步研究。
致谢:感谢中国科学院生态环境研究中心陈卫平研究员及吕斯丹师姐在实验期间和文章写作过程中给予的指导和帮助。
[1] 张甘霖,赵玉国,杨金玲,等.城市土壤环境问题及其研究进展[J].土壤学报,2007,44(5): 925-933
Zhang G L,Zhao Y G,Yang J L,et al.Urban soil environment issues and research progresses [J].Acta Pedologica Sinica,2007,44(5): 925-933 (in Chinese)
[2] Lu Y,Gong Z T,Zhang G L,et al.Concentrations and chemical speciations of Cu,Zn,Pb and Cr of urban soils in Nanjing,China [J].Geoderma,2003,115(1-2): 101-111
[3] 高飞,车少臣.城市绿地化学农药面源污染控制与无公害城市绿地建设[J].北京园林,2009,25(89): 41-43
[4] 裴绍峰,刘海月,叶思源.我国南方主要城市土壤有机氯农药残留及分布特征[J].山东农业大学学报: 自然科学版,2014,45(5): 768-774
Pei S F,Liu H Y,Ye S Y.Residues and distribution character of organochlorine pesticides in soil of main southern cities of China [J].Journal of Shandong Agricultural University: Natural Science Edition,2014,45(5): 768-774(in Chinese)
[5] Chen T B,Zheng Y M,Lei M,et al.Assessment of heavy metal pollution in surface soils of urban parks in Beijing,China [J].Chemosphere,2005,60(4): 542-551
[6] 任向辉,王运兵.黑麦草草坪杂草防除的药剂实验[J].山西农业科学,2008,36(12): 72-73
Ren X H,Wang Y B.Drug-efficiency experiment on weeds control of ryegrass lawn [J].Journal of Shanxi Agricultural Sciences,2008,36(12): 72-73 (in Chinese)
[7] Willis J B,Beam J B,Barker W L,et al.Weed control options in spring-seeded tall fescue(Festuca arundinacea) [J].Weed Technology,2006,20(4): 1040-1046
[8] McElroy J S,Breeden G K.Tall fescue seedling tolerance to carfentrazone,bromoxynil,quinclorac,and siduron [J].HortScience,2006,41(1): 252-254
[9] Kong L X,Kadokami K,Wang S P,et al.Monitoring of 1300 organic micro-pollutants in surface waters from Tianjin,North China [J].Chemosphere,2015,122: 125-130
[10] Fields M L,Hemphill D D.Influence of siduron and its degradation products on soil microflora [J].Weed Science,1968,16(4): 417-419
[11] Belasco I J,Langsdorf W P.Synthesis of C14-labeled siduron and its fate in soil [J].Journal of Agricultural and Food Chemistry,1969,17(5): 1004-1007
[12] 熊严军.我国土壤污染现状及治理措施[J].现代农业科技,2010(8): 294-296
[13] Wang J H,Lu Y T,Shen G Q.Combined effects of cadmium and butachlor on soil enzyme activities and microbial community structure [J].Environmental Geology,2007,51(7): 1221-1228
[14] Wang J H,Ding H,Lu Y T,et al.Combined effects of cadmium and butachlor on microbial activities and community DNA in a paddy soil [J].Pedosphere,2009,19(5): 623-630
[15] 律泽,胡筱敏,安婧,等.佳乐麝香和镉复合污染对土壤中放线菌数量的影响[J].生态学杂志,2014,33(6): 1501-1507
Lv Z,Hu X M,An J,et al.Joint effects of galaxolide and cadmium on actinomycetes quantities in soils [J].Chinese Journal of Ecology,2014,33(6): 1501-1507 (in Chinese)
[16] Zhao Y P,Tan Y Y,Guo Y,et al.Interactions of tetracycline with Cd(Ⅱ),Cu(Ⅱ) and Pb(Ⅱ) and their cosorption behavior in soils [J].Environmental Pollution,2013,180: 206-213
[17] Perrodin Y,Boillot C,Angerville R,et al.Ecological risk assessment of urban and industrial systems: A review [J].Science of the Total Environment,2011,409(24): 5162-5176
[18] 赵祥伟,骆永明,滕应,等.重金属复合污染农田土壤的微生物群落遗传多样性研究[J].环境科学学报,2005,25(2): 186-191
Zhao X W,Luo Y M,Teng Y,et al.Genetic diversity of microbial communities in farmland soils contaminated with mixed heavy metals [J].Acta Scientiae Circumstantiae,2005,25(2): 186-191 (in Chinese)
[19] 滕应,骆永明,李振高.土壤重金属复合污染对脲酶、磷酸酶及脱氢酶的影响[J].中国环境科学,2008,28(2): 147-152
Teng Y,Luo Y M,Li Z G.Kinetics characters of soil urease,acid phosphotase and dehydrogenase activities in soil contaminated with mixed heavy metals [J].China Environmental Science,2008,28(2): 147-152 (in Chinese)
[20] 曹靖,贾红磊,徐海燕,等.干旱区污灌农田土壤Cu、Ni、复合污染与土壤酶活性的关系[J].农业环境科学学报,2008,27(5): 1809-1814
Cao J,Jia H L,Xu H Y,et al.Relationships between soil enzymatic activities and Cu-Ni compounds pollution in the waste water irrigated farmland in arid region [J].Journal of Agro-Environment Science,2008,27(5): 1809-1814 (in Chinese)
[21] 周启星.复合污染生态学[M].北京: 中国环境科学出版社,1995: 35-78
[22] 张慧,党志,姚丽贤,等.镉芘单一污染和复合污染对土壤微生物生态效应的影响[J].农业环境科学学报,2007,26(6): 2225-2230
Zhang H,Dang Z,Yao L X,et al.Eco-toxicological effect of cadmium and pyrene combined and simplex pollution on soil microbe [J].Journal of Agro-Environment Science,2007,26(6): 2225-2230 (in Chinese)
[23] 傅丽君,刘智任,杨磊.镉、铜、铅复合污染对枇杷园土壤微生物的生态毒理效应[J].生态毒理学报,2009,4(6): 881-888
Fu L J,Liu Z R,Yang L.Ecotoxicological effect of Cd-Cu-Pb compound pollution on loquat soil microbe [J].Asian Journal of Ecotoxicology,2009,4(6): 881-888 (in Chinese)
[24] Wang M E,Zhou Q X.Joint stress of chlorimuron-ethyl and cadmium on wheat Triticum aestivum at biochemical levels [J].Environmental Pollution,2006,144(2): 572-580
[25] 李章平,陈玉成,杨学春,等.重庆市主城区土壤重金属的潜在生态危害评价[J].西南农业大学学报: 自然科学版,2006,28(2): 227-230
Li Z P,Chen Y C,Yang X C,et al.Assessment of potential ecological hazard of heavy metals in urban soils in Chongqing city [J].Journal of Southwest Agricultural University: Natural Science,2006,28(2): 227-230 (in Chinese)
[26] Nam J J,Thomas G O,Jaward F M,et al.PAHs in background soils from Western Europe: Influence of atmospheric deposition and soil organic matter [J].Chemosphere,2008,70(9): 1596-1602
[27] Gosewinkel U,Broadbent F.Conductimetric determination of soil urease activity [J].Communications in Soil Science & Plant Analysis,1984,15(11): 1377-1389
[28] Tabatabai M,Bremner J.Arylsulfatase activity of soils [J].Soil Science Society of America Journal,1970,34(2): 225-229
[29] Frankeberger W,Johanson J.Method of measuring invertase activity in soils [J].Plant and Soil,1983,74(3): 301-311
[30] Kramer M,Yerdei G.Application of the method of phosphatase activity determination in agricultural chemistry [J].Soviet Soil Science,1959,9: 1100-1103
[31] 鲍士旦.土壤农化分析(第三版)[M].北京: 中国农业出版社: 2008,58-59
[32] 许光辉,郑元洪.土壤微生物分析方法手册[M].北京: 中国农业出版社,1986: 226-227,274-279
[33] 周启星,孔繁翔,朱琳.生态毒理学[M].北京: 科学出版社,2004: 178-280
[34] Chen Q L,Yang B S,Wang H,et al.Soil microbial community toxic response to atrazine and its residues under atrazine and lead contamination [J].Environmental Science and Pollution Research,2015,22(2): 996-1007
[35] 胡著邦,汪海珍,吴建军,等.镉与苄嘧磺隆除草剂单一污染和复合污染土壤的微生物生态效应[J].浙江大学学报: 农业与生命科学版,2005,31(2): 151-156
Hu B Z,Wang H Z,Wu J J,et al.Ecological effects of both single and combined pollution of Cd and bensulfuron-methyl on soil microorganisms [J].Journal of Zhejiang University: Agriculture & Life Sciences,2005,31(2): 151-156 (in Chinese)
[36] 陈莹莹,王金花,陆贻通.丁草胺与镉复合污染对土壤呼吸强度的影响[J].环境污染与防治,2006,28(10): 723-730
Chen Y Y,Wang J H,Lu Y T.Effects of butachlor and Cd on microbial respiration in top soil [J].Environmental Pollution & Control,2006,28(10): 723-730 (in Chinese)
[37] 沈国清,陆贻通,洪静波.重金属和多环芳烃复合污染对土壤酶活性的影响及定量表征[J].应用与环境生物学报,2005,11(4): 479-482
Shen G Q,Lu Y T,Hong J B.Quantitative expression and effect of combined pollution of heavy metals and polycyclic acromatic hydrocarbons on soil enzyme [J].Chinese Journal of Applied and Environmental Biology,2005,11(4): 479-482 (in Chinese)
[38] Chen C H,Zhou Q X,Cai Z,et al.Effects of soil polycyclic musk and cadmium on pollutant uptake and biochemical responses of wheat (Triticum aestivum) [J].Archives of Environmental Contamination and Toxicology,2010,59(4): 564-573
[39] 王果.Cu2+对3种农药在Ca-蒙脱石和δ-Al2O3上吸附的影响[J].环境科学学报,1996,16(1): 23-29
Wang G.Adsorption of three pesticides on Ca-montmorillonite and δ-Al2O3in presence or absence of copper [J].Acta Scientiae Circumstantiae,1996,16(1): 23-29 (in Chinese)
[40] Moreau C J,Klerks P L,Haas C N.Interaction between phenanthrene and zinc in their toxicity to the sheepshead minnow (Cyprinodon variegates) [J].Archives of Environmental Contamination and Toxicology,1999,37(2): 251-257
[41] Teisseire H,Couderchet M,Vernet G.Toxic responses and catalase activity of Lemna minor L.exposed to folpet,copper,and their combination [J].Ecotoxicology and Environment Safety,1998,40(3): 194-200
[42] 黄欣,陆贻通.镉对土壤丁草胺降解作用的影响[J].环境污染与防治,1991,13(1): 13-15
Hang X,Lu Y T.The effects of Cd on the degradation of butachlor in soil [J].Environmental Pollution & Control,1991,13(1): 13-15 (in Chinese)
◆
Combined Effects of Siduron and Cadmium on Organic Nitrogen Mineralization,Basal Respiration and Enzyme Activities in Heavy Metal Polluted Urban Soil
Gu Panni1,2,Wang Meie1,*,Chen Weiping1
1.State Key Laboratory of Urban and Regional Ecology,Research Center for Eco-Environmental Sciences,Chinese Academy of Sciences,Beijing 100085,China 2.University of Chinese Academy of Sciences,Beijing 100039,China
10 March 2015 accepted 13 May 2015
In northern cities,siduron is widely used in lawn management,and soil contamination of heavy metal like Cd commonly exists in urban green land.Thus,combined exposure of siduron and Cd is very likely in the urban green land soil ecosystem.In this research,three urban soils polluted by different level of heavy metals (marked as N,D,G) were selected to evaluate the ecological risk of combined pollution of heavy metals and herbicide.Combined effects of siduron and Cd on soil organic nitrogen mineralization,basal respiration and soil enzyme activities were studied.It was suggested that: the single and combined effects of siduron and Cd on experimental indexes were markedly significant (P<0.01).Presence of Cd obviously changed the toxic effect of siduron on microorganisms and the effect of Cd was dependent on concentration of siduron and Cd.When Cd concentrations increased from 1 mg·kg-1to10 mg·kg-1,the linear relationship between siduron concentrations and the change rate of organic nitrogen mineralization in soil G changed from positively to negatively.Under combined pollution,the values of EC50(27.6~848 mg·kg-1) obtained based on the dose- effect relationship were well above the suggested dosage of siduron (3.33 mg·kg-1).The combined effects of siduron and Cd on these selected indexes were greatly influenced by soil physical and chemical properties and heavy metal contents.In addition,the combined effects both varied with their concentrations and experimental indexes.The above results can provide basic data and technical methods for the ecological risk assessment of combined pollution of heavy metals and herbicide in urban soil.
siduron;cadmium; urban soil; nitrogen mineralization; basal respiration; soil enzyme; dose-effect relationship
国家自然科学基金面上项目(41271503)
谷盼妮(1989-),女,硕士生,研究方向为土壤污染生态风险评价,E-mail:gupanniyue@126.com;
*通讯作者(Corresponding author),E-mail: mewang@rcees.ac.cn
10.7524/AJE.1673-5897.20150310003
2015-03-10 录用日期:2015-05-13
1673-5897(2015)4-065-23
X171.5
A
王美娥(1975-),女,博士,副研究员,长期以来从事土壤重金属、农药单一复合污染过程与生态效应研究,已发表SCI论文十余篇,其中第一作者8篇,中文核心数篇。
谷盼妮,王美娥,陈卫平.环草隆与镉复合污染对城市绿地重金属污染土壤有机氮矿化量、基础呼吸和土壤酶活性的影响[J].生态毒理学报,2015,10(4): 65-87
Gu P N,Wang M E,Chen W P.Combined effects of siduron and cadmium on organic nitrogen mineralization,basal respiration and enzyme activities in heavy metal polluted urban soil [J].Asian Journal of Ecotoxicology,2015,10(4): 65-87 (in Chinese)

