深海细菌及其活性物质防控植物病原真菌的研究进展
孙晓磊, 闫培生, 王 凯, 王文威, 李梦瀛
哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209
深海细菌及其活性物质防控植物病原真菌的研究进展
孙晓磊, 闫培生*, 王 凯, 王文威, 李梦瀛
哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209
近年来,从天然产物中开发生物农药成为了研究者关注的热点,海洋微生物因其独特的生存环境,产生了许多从陆地微生物中未曾发现的生物活性物质,为新型生物农药开发带来了佳音。从微生物多样性、抑菌物质的种类与结构和抑菌机理3个方面阐述深海细菌防控植物病原真菌的研究进展,并对其发展前景进行了展望,以期为抗植物病原真菌的海洋微生物的开发利用提供参考。
深海细菌;植物病原真菌;产毒真菌;抑菌机理
海洋是微生物资源的一大宝库,其独特的生态系统造就了具有独特功能的海洋微生物,海洋微生物种类约100多万种,其多样性远远超过陆地微生物。随着人们对海洋研究的深入,发现海洋微生物中蕴藏许多结构新颖、生物活性强的代谢产物,这些天然产物成为新药开发的重要来源。其中,由海洋微生物天然产物制成的农用抗生素(agricultural antibiotics)在植物耐药真菌的防治方面取得了很多进展[1~4]。植物真菌性病害难于防治、造成的损失严重,是多种重要粮食作物的主要病害,在水稻的240多种病害中,90%为真菌性病害[5]。海洋微生物在对抗植物病原真菌方面具有独特的优势,其天然产物结构独特,与病原真菌没有交叉反应,不易产生抗药性;具有丰富的抗菌机制,既可制备各种生物农药,又可利用微生物制备拮抗菌剂。本文从产抗真菌活性物质的海洋微生物种类、活性物质及活性物质结构特征以及抑菌机理等方面对目前取得的研究进展进行了总结,以期为抗植物病原真菌和产毒真菌的海洋微生物的进一步开发与利用提供参考。
1 防控植物病原真菌的深海细菌的物种多样性
作为海洋微生物天然产物的重要来源,已发现的海洋可培养细菌主要包括假单胞菌属(Pesudomonas)、假交替单胞菌属(Pseudoalteomonas)、交替单胞菌属(Alteromonas)、肠杆菌属(Enterobacterium)、芽胞杆菌属(Bucillus)、黄杆菌属(Flavobacterium)、微球菌属(Micrococcus)、钦氏菌属(Chainia)以及着色菌属(Chromtium)等属[6]。
海洋细菌由于其具有分布范围广泛、代谢产物结构新颖、抑菌作用强和抑菌谱广的优势[7],一些海洋细菌已用于植物病害的生物防治[8~12],表1汇总了部分国内外已研究的具有抑制植物病原真菌活性的海洋细菌及其产生的活性物质、靶标和分离来源等信息,从表中可以看出,这些拮抗细菌的物种主要包括假单胞菌(Pseudomonas)、粘细菌(Haliangium)、芽胞杆菌(Bacillus)、海洋单胞菌(Marinomonas)、产碱杆菌(Alcaligenes)和类芽胞杆菌(Paenibacillus)等,其生存的生态环境包括海洋生物体内(如海藻、珊瑚等)、不同海域与不同深度的沉积物和极地等。

表1 海洋细菌拮抗植物病原真菌的国内外研究概况Table 1 Foreign and domestic researches on agricultural antifungal antibiotics from marine microorganisms.
注:“-”表示该项未知。
2 活性物质的种类与结构特征
科学家利用结晶分析和其他测试技术对从深海细菌分离到的化合物进行鉴定,发现其中许多物质结构新颖且罕见,如芬荠素(fengycins)家族的宁康霉素(nincomycin),对丝状植物病原真菌有很好的抑制效果[13]。国内外报道的海洋细菌产生的活性物质的类型主要有肽类、蛋白类、酯类、糖苷类、醌类、苯丙素类、黄酮类和生物碱等[30]。
2.1 肽类
2.1.1 脂肽类 脂肽是由亲水的肽链和亲油的脂肪烃链两部分组成,很多芽胞杆菌能够产生具有抗真菌[31]、诱导植物产生系统抗性[32]、促进芽胞杆菌在植物根际生态系统中定殖[33]的脂肽类活性物质。目前已报道的具抗真菌活性的包括伊枯草菌素(iturins)、fengycins、表面活性素(surfactins)家族的脂肽类物质[34],其中iturins和fengycins抗真菌效果相对显著。目前已报道的iturins主要有bacillomycin D、F、L、Lc、S,iturin A、Al、C,mycosubtilin,mixirin。从海洋细菌中发现的iturins包括bacillomycin Lc、iturin A[18],以及近几年新发现的maribasins[35]、subtulene[36]、mojavensin[37]和bacillopeptin A(图1)[16]等。Iturin家族的脂肪酸碳链长度在14~17个碳原子不等,分子量在1 000 Da左右。作为一种常见的伊枯草菌素,iturin A的抑菌活性甚至能与一些化学农药相比,在植物病害的生物防治方面前景广阔[18]。Fengycins是芽胞杆菌产生的另一类脂肽,fengycins家族典型有fengycin A、B两种结构,脂肪酸碳链长度为14~18个碳原子,分子量在1 500 Da左右,fengycins区别于其他环脂肽的是,除4种D-氨基酸和鸟氨酸,其余氨基酸均为L-氨基酸,后8位氨基酸形成肽环,对丝状真菌具有明显抑制效果,且溶血活性较伊枯草菌素类低[38],从海洋细菌中发现的fengycins有nincomycin[13]、6-abufengycin[39](图2)等。相比化学农药和传统抗生素,脂肽具有对动植物无害、可生物降解以及不易使病原真菌产生交叉抗性等优点,随着海洋资源的进一步开发,将会发现更多新型抗植物病原真菌脂肽[40]。
2.1.2 缩肽类 2006年Iizuka等[41]从海洋中分离出一株弱好盐细菌SMH-27-4,其发酵产物中含有一种新抗生素miuraenamides A和B(图3),它们为缩合肽类化合物,miuraenamides A具有较强的抑制植物病原菌(如Phytophthorasp.)的活性[42]。并且,与多烯类化合物myxalamid对真菌的抑制作用[43]类似,此种缩肽类化合物也可作用于真菌呼吸链电子传递系统,抑制NADH氧化。
2.2 抗菌蛋白
海洋细菌L1-9可产生对植物病原真菌具抑制作用的蛋白酶、葡聚糖酶、纤维素酶和几丁质酶[44]。海洋细菌TC-1产生的抗菌蛋白对香蕉枯萎病有明显的抑制作用,推测其为耐高温的碱性蛋白酶和中性蛋白酶[45]。Osawa等[46]在海洋细菌V.fluvialis、V.pacohaemolyticus、V.mimicus、V.algionlyticus、Idstoaellaangudlanun及Aeromonashudrophila中发现了几丁质酶。几丁质酶、葡聚糖酶和纤维素酶是对真菌产生抑制作用的主要酶类[47~51]。
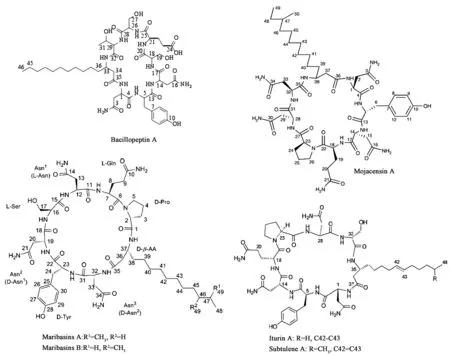
图1 Iturins家族化合物结构式[16,22,35~37]Fig.1 Structures of iturins family compounds[16,22,35~37].
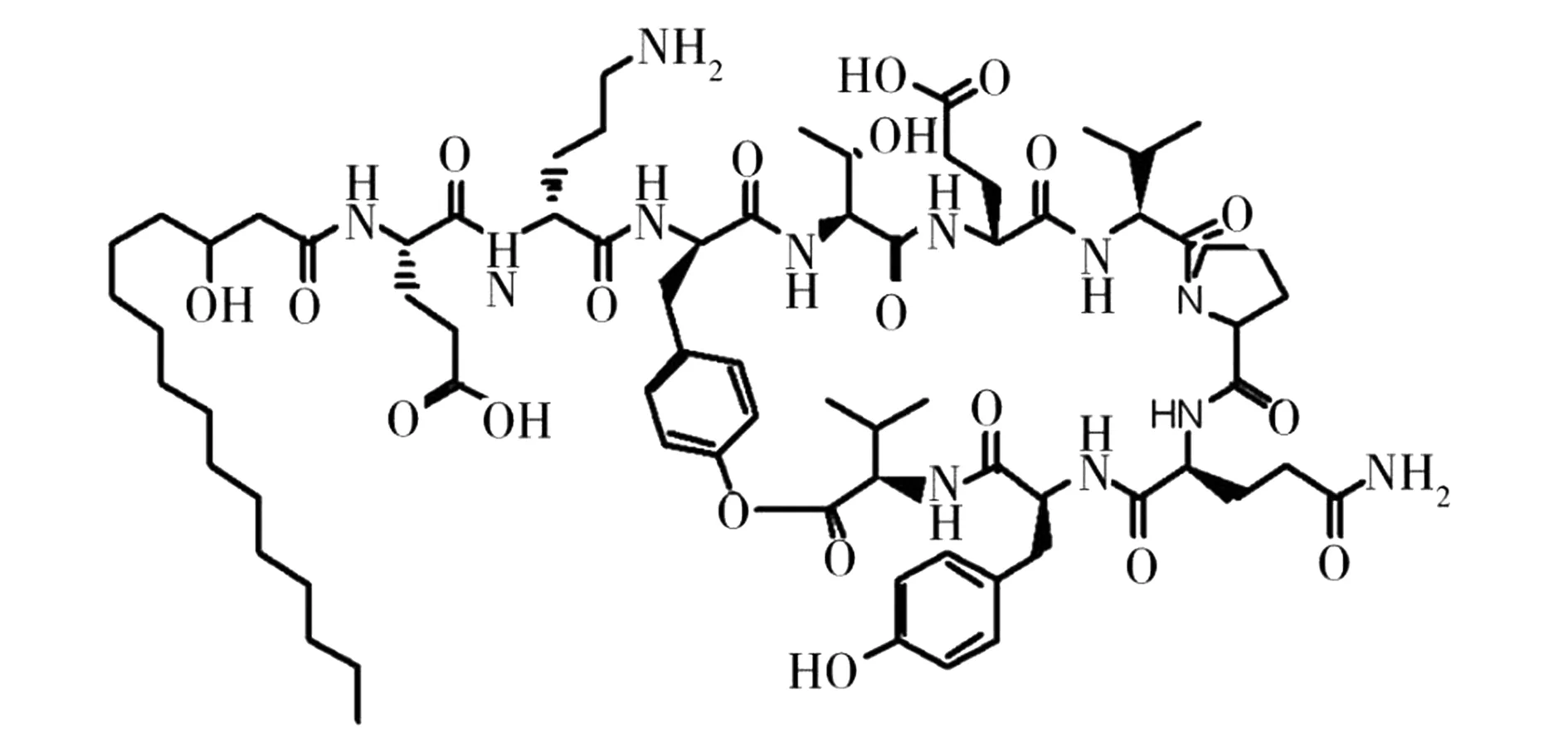
图2 Fengycins家族化合物6-abufengycin结构式[39]Fig.2 The structure of 6-abufengycin from fengycins family[39].

图3 缩肽类化合物miuraenumides A、B结构式[43]Fig.3 The structure of miuraenumides A,B[43].
2.2.1 几丁质酶 几丁质(chitin)又名甲壳素,是N-乙酰-D-葡萄糖胺以β-1,4糖苷键连接的直链多聚物,广泛存在于自然界,特别是海洋中。几丁质作为真菌细胞壁的主要成分可被几丁质酶酶解为N-乙酰氨基葡萄单糖。几丁质酶属糖苷水解酶18、19家族,其定义有广义、狭义之分,广义的几丁质酶是指所有与几丁质降解有关的酶,包含脱乙酰酶、壳聚酶、几丁寡糖酶和几丁二糖酶等,狭义的几丁质酶是指催化水解至少含有一个N-乙酰葡萄胺基团糖苷键的酶,包括几丁内切酶和几丁外切酶[52]。几丁质酶的分子结构主要包括信号肽序列、催化区、特异性结合区域和C端区域。其中催化区具2个高度保守区,Glu和Asp残基高度保守。来源于同一菌株的酶的几丁质结合区域具有相似性,而不同来源的几丁质酶结合区域也不同[53~55]。
2.2.2 葡聚糖酶 β-1,3-葡聚糖酶是植物抗真菌病的重要抗性物质之一,具破坏真菌细胞壁并将其杀死的能力。有关β-1,3-葡聚糖酶的结构研究比较晚。现已知其是一种混合酶系包含内切β-1,3-葡聚糖酶和外切β-1,3-葡聚糖酶,其中内切β-1,3-葡聚糖酶更易降解真菌细胞壁,最终导致菌体自溶[56]。已知的β-1,3-葡聚糖酶均属于糖基水解酶第十七家族[57],其成员具有共同的序列结构:(LIVM)X(LIVMFYM)3(STAG)E(ST)GWP(ST)XG[50]。
2.2.3 纤维素酶 纤维素酶是由多种水解酶组成的复杂酶系,通常人们从习惯上将纤维素酶分成3类:葡聚糖外切酶(C1)、葡聚糖内切酶(Cx)酶和β葡萄糖苷酶(CB)。C1酶是对纤维素最初起作用的酶,破坏纤维素链的结晶结构,生成纤维二糖。Cx酶是作用于经C1酶活化的纤维素、分解β-1,4-糖苷键的纤维素酶。β-葡萄糖苷酶可以将纤维二糖、纤维三糖及其他低分子纤维糊精分解为葡萄糖[58~60]。马炳田等[51]通过实验证实,供试菌株纤维素酶活力可能与其生物防治潜能有一定关系,纤维素酶活力越高,生防潜能越大。大多数纤维素酶都由一个或多个催化结构域(catalytic domain,CD)和纤维素结合区(cellulose binding domain,CBD)组成,中间由一段可辨认的连接肽(linker peptide)所连接[61]。
2.3 酯类
Fudou等[27]从海洋粘细菌中发现了能抑制多种植物病原真菌的含β-甲氧基丙烯酸酯基团的多不饱和酯。到目前为止已报道的此类抗生素有40多个,结构简单的有15个,其中strobilurin类的有16个、oudemansin系列4个、cymenin系列3个、myxothiazole系列17个[48]。基于具有杀菌活性的天然β-甲氧基丙烯酸酯衍生物研发出了一系列天然抗生素,结构中含有甲氧基和丙烯酸酯或酰胺的基团,其他基团在β位取代,具有广谱、高效、安全的特点[62]。
Strobilurin A是strobilurin天然抗生素家族中最早被确定的,也是种类最多的一类,按照结构特点一般划分为两类:一是苯基取代三烯类,包括strobilurin A-C,H、strobilurin F-1、strobilurin F-2、9-methoxystrobilurin A和hydroxystrobilurin A 8个化合物(图4A);二是苯并二氧杂环取代三烯类,包括strobilurin E、9-methoxystrobilurin E、strobilurin M、strobilurin D (G)、strobilurin O、strobilurin P、hydroxytrobilurin (G)和9-methoxystrobilurin K 8个化合物(图4B)[62~66]。
3 活性物质抗植物病原真菌的作用机制
3.1 肽类抗植物病原真菌机制
真菌具有细胞壁这一特殊结构,其主要组分为几丁质、葡聚糖和甘露聚糖等。抗真菌肽对真菌的作用机理有如下几种:①对真菌细胞膜作用,抗真菌肽与膜作用,破坏脂膜使细胞质发生泄漏。且抗真菌肽增加细胞膜的电导率和通透性,影响细胞膜的表面张力,抑制病原菌孢子的形成,如magainins、cecropins和dermaseptins等[67]。Iturin是一类生物表面活性剂,在体内和体外实验中,iturin家族脂肽都表现出很强的抗真菌活性。Iturin的抗真菌活性主要源自于膜通透效应,但它不会破坏细胞膜,却可以干扰细胞膜上的离子通道。Surfactins是比iturins更强的生物表面活性剂,由于具有两亲型结构,surfactin类脂肽可以紧密锚定于脂膜中,破坏细胞膜的完整性;②对真菌细胞壁的作用,抗真菌肽通过抑制细胞壁的重要组分葡聚糖和几丁质的合成,破坏病原菌细胞壁的合成,从而达到杀菌的作用,抑制病原物的侵入和扩展,调节提高植物防御能力,如nikkomycin Z、echinocandins[67];③抗真菌肽对真菌内细胞器(如线粒体)的作用,如buforins、Ib-AMP1和histatins[68~72]。
Fengycins类脂肽有很强的抗丝状真菌活性,但这类脂肽的抑菌机理尚不明确,其作用机理也可能与改变脂膜结构和通透性有关。此外,还发现其家族成员宁康霉素可阻遏真菌代谢系统,导致菌丝生长缓慢[13]。

图4 化合物strobilurin结构式[62]Fig.4 The structures of strobilurin[62].A.苯基取代三烯类;B.苯并二氧杂环取代三烯类。
3.2 抗菌蛋白与酶类抑菌机理
生防菌可以通过产生生物活性物质抵抗植物病原真菌,其中抗菌蛋白作为主要的抗菌成分已受到到国内外专家的关注。关于抗菌蛋白的作用机理,到目前为止主要涉及两方面:一是造成细胞畸变,出现小泡、肿胀,然后裂解;二是破坏细胞壁,菌丝原生质从细胞壁溶解处泄漏,菌丝体断裂成段,继而消融,但因抗菌蛋白结构不同其作用机理可能也不一样,也有许多学者对抗菌蛋白的作用机制提出了不同观点[45]。
海洋天然产物几丁质酶对真菌新生细胞如芽管和菌丝顶端细胞壁具有破坏作用。丝状真菌延伸菌丝的过程中生长顶端会不断新合成几丁质、葡聚糖或其他多糖,菌丝顶端暴露的几丁质链会被几丁质酶所水解,进而使顶端细胞壁变薄,形成球状突起,最后降解细胞壁,原生质体破裂,进而使真菌孢子萌发、芽管伸长和菌丝生长受抑制,芽管和附着胞解体。几丁质酶解的产物是几丁寡糖,具有抗菌、抑菌性能,可以直接杀死病原真菌,还可以作为植物功能调节剂,促进植物生长发育[73]。在植物的细胞次生壁与中胶层中有蛋白质存在,可被蛋白酶降解。细胞壁降解酶如几丁质酶、蛋白酶和纤维素酶等均能引起真菌细胞壁通透性变化抵抗植物病原真菌。
3.3 酯类杀菌机制
以天然产物Strobilurin A作为先导化合物开发的新型杀菌剂——甲 氧 基 丙 烯 酸 酯 类 杀 菌 剂,是线粒体呼吸抑制剂。它的作用机理是在植物病原真菌线粒体合成能量的过程中键合在位于真菌线粒体内膜的细胞色素b(Cytb,细胞色素bc1复合物的一部分)的还原型辅酶Q的氧化位点(Qo位点) ,阻止细胞色素b和c1之间的电子传递,抑制线粒体的呼吸作用,破坏三磷酸腺苷(ATP) 的产生,从而阻断了菌体内部的能量循环[74,75]。
4 深海细菌防控产毒植物病原真菌的研究现状
深海环境存在着丰富的微生物资源,具有巨大的研究空间与开发潜力[4,76],目前国内外研究主要集中在利用深海细菌对非产毒真菌的生物防治,对产毒真菌的生物防治研究开展的很少,而产毒真菌的危害比非产毒真菌更加严重,不仅影响作物生长,降低产量,更重要的是产生能严重危害人类和动物健康的真菌毒素,如黄曲霉毒素、镰刀菌毒素和赭曲毒素等,具有强毒性、致癌性、致畸性及免疫抑制性,因此,产毒真菌的防治是一个亟待解决的重大课题。本文作者已开展了大西洋深海细菌抗黄曲霉毒素和镰刀菌毒素产生的研究[77,78],筛选出一些菌株,其发酵无细胞上清液对黄曲霉毒素产生菌和镰刀菌毒素产生菌的孢子萌发和真菌毒素产生的抑制率达100%,有些菌株的15倍稀释液仍能完全抑制黄曲霉毒素的产生,这些高效菌株的获得为有效防控产毒真菌提供了新的可能。
5 展望
化学合成农药的使用遍及世界,过多的使用会使植物病原真菌产生抗药性,同时,还会带来大量农药残留,污染环境,危害人类健康。利用次生代谢物防治不仅可更好的防控耐药性作物病害,还有利于环境保护。并且,海洋微生物来源的天然产物新颖结构、具有较强的活性和多种作用机制,是开发抗植物真菌病生物农药的重要资源,也是植物真菌病害防治的发展方向之一。尽管目前海洋微生物在植物病害防治中主要研究利用的是近海、浅海及海岸带等来源的微生物,但随着人们对深海微生物研究的不断深入,越来越多的能高效抑制植物病原真菌特别是产毒真菌的深海微生物将会被筛选出来,并在生物防治领域发挥重要的作用。
[1] Joint I,Muhling M,Querellou J.Culturing marine bacteria — an essential prerequisite for biodiscovery [J].Microb.Biotechnol.,2010,3(5):564-575.
[2] Das S,Lyla P S,Khan S A.Marine microbial diversity and ecology:Importance and future perspectives [J].Curr.Sci.,2006,90(10):1325-1335.
[3] Molinski T F,Dalisay D S,Lievens S L,etal..Drug development from marine natural products [J].Nat.Rev.Drug Discov.,2009,8(1):69-85.
[4] 谭仁祥.海洋微生物:新天然药物的重要源泉 [J].中国天然药物,2006,4(1):1-3.
[5] 余凤玉,李振华,曾会才.抗真菌农用抗生素的研究进展 [J].热带农业科学,2005,25(1):61-66.
[6] 孙丕喜,陈颖稚,王宗兴,等.原核生物概况及海洋原核生物组成 [J].广西科学院学报,2010,2(6):140-142.
[7] 尹宏权,田 黎,付红伟,等.海洋细菌Bacillusmarinus化学成分分离和结构鉴定 [J].北京理工大学学报,2007,27(5):460-462.
[8] 田 黎,顾振芳,陈 杰,等.海洋细菌B-9987菌株产生的抑菌物质及对几种植物病原真菌的作用 [J].植物病理学报,2003,33(1):77-80.
[9] 马桂珍,孔德平,王增池,等.抗植物病原真菌海洋细菌的抗菌作用研究 [J].吉林农业大学学报,2009,31(1):8-12.
[10] 马桂珍,暴增海,王淑芳.海洋细菌L19菌株对小麦的促生防病作用研究 [J].中国生物防治学报,2011,27(2):228-232.
[11] 郭春艳.海洋细菌BacillusvelezensisDM09在油菜中的定殖及对油菜菌核病的防治研究[D].武汉:华中农业大学,硕士学位论文,2010.
[12] 柳 凤,欧雄常,何 红,等.红树内生细菌AmS2菌株对芒果炭疽病菌的抑制作用 [J].植物保护学报,2010,35(5):44-45.
[13] 刘 丽,胡江春,李晓荣,等.宁康霉素对植物病原真菌的抑制作用 [J].沈阳农业大学学报,2006,37(2):182-185.
[14] 李 伟,胡江春,王书锦.海洋细菌3512A对黄瓜枯萎病的防治及促进植株生长的效应 [J].沈阳农业大学学报,2008,39(2):182-185.
[15] 岳蕾娜.海洋细菌TC-1抗菌活性物质对香蕉枯萎病菌(Foc4)抑制作用的初步研究 [D].广东湛江:广东海洋大学,硕士学位论文,2010.
[16] 牛力轩,王 楠,王雪梅,等.一株产脂肽类抗生素bacil-lopeptin A深海芽胞杆菌的筛选与鉴定 [J].中国抗生素杂志,2011,36(10):738-744,750.
[17] 陈丽丽,王 楠,王雪梅,等.深海来源Bacillusanmylo-liquefacinesSH-B10产生抗真菌脂肽的分离纯化及结构鉴定 [A].见:中国腐植酸工业协会.第八届全国绿色环保肥料(农药)新技术、新产品交流会论文集 [C].北京:中国腐植酸工业协会,2009,5.
[18] 吕 倩,胡江春,王 楠,等.南海深海甲基营养型芽胞杆菌SHB114抗真菌脂肽活性产物的研究 [J].中国生物防治学报,2014,1:113-120.
[19] 丁存宝,刘海燕,李 明,等.短芽胞杆菌属菌株几丁质酶分离纯化及其抗真菌活性的初步测定 [J].中国抗生素杂志,2009,4:263.
[20] Tareq F S,Lee M A,Lee H S,etal..Non-cytotoxic antifungal agents:Isolation and structures of gageopeptides A-D from aBacillusstrain 109GGC020 [J].J.Agric.Food Chem.,2014,62(24):5565-5572.
[21] 龙 彬,高程海,潘丽霞,等.南海深海细菌BacillusamyloliquefaciensGAS 00152抗菌代谢产物研究 [J].天然产物研究与开发,2014,6:807-812.
[22] Ken H,Satoshi E,Shingo M,etal..Transgenic tobacco plants expressing endo-β-mannanase gene from deep-seaBacillussp.JAMB-602 strain confer enhanced resistance against fungal pathogen (Fusariumoxysporum) [J].J.Plant Biotechnol.Rep.,2012,6:243-250.
[23] 何 红,欧雄常,王立才,等.红树内生海洋细菌CⅢ-1菌株对辣椒青枯病的防病效果 [J].植物保护学报,2008,6:497-500.
[24] Kong Q,Shan S,Liu Q,etal..Biocontrol ofAspergillusflavuson peanut kernels by use of a strain of marineBacillusmegaterium[J].Int.J.Food Microbiol.,2010,139(1):31-35.
[25] 任雪芸,王 伟,郭少华,等.南极海单胞菌BSw10005代谢活性物质及对植物病原菌抑制作用 [J].植物病理学报,2007,37(6):654-659.
[26] Peng J L,Bao Z L,Li P,etal..Harpinxoo and its functional domains activate pathogen-inducible plant promoters inArabidopsis[J].Acta Bot.Sin.,2004,46:1083-1090.
[27] Fudou R.Haliangicin,a novel antifungal metabolite produced by a marine myxobacterium [J].J.Antibiot.,2001,9:149-152.
[28] 林建朋.拮抗植物病原真菌的海洋细菌筛选及其活性物质研究 [D].武汉:华中农业大学,硕士学位论文,2011.
[29] 王淑芳,暴增海,马桂珍,等.海洋假单胞菌GY-1菌株的抗菌作用及其胞外抗菌蛋白的分离纯化[J].食品科学,2012,21:221-225.
[30] 高程海,龙 彬,孙海燕.海洋细菌中活性次生代谢产物研究进展 [J].广西科学院学报,2014,2:69-73.
[31] Chen L,Wang N,Hu J,etal..Characterization of two anti-fungal lipopeptides produced byBacillusamyloliquefaciensSH-B10 [J].Bioresour.Technol.,2010,101(22):8822-8827.
[32] Ongena M,Jourdan E,Adam A,etal..Surfactin and fengycin lipopeptides ofBacillussubtilisaselicitors of induced systemic resistance in plants[J].Environ.Microbiol.,2007,9(4):1084-1090.
[33] Raaijmakers J M,Paulitz T C,Steinberg C,etal..The rhizosphere:A phayground and battlefield for soilborne pathogens and beneficial microorganisms [J].Plant Soil,2009,321(1-2):341-361.
[34] Ongena M,Jacques P.Bacilluslipopeptides:Versatile weapons for plant disease biocontrol [J].Trends Microbiol.,2008,16(3):115-125.
[35] Zhang D J,Liu R F,Li Y G,etal..Two new antifungal cyclic lipopeptides fromBacillusmarinusB-9987 [J].Chem.Pharm.Bull.,2010,58(12):1630-1634.
[36] Thasana N,Prapagdee B,Rangkadilok N,etal..BacillussubtilisSSE4 produces subtulene A,a new lipopeptide antibiotic possessing an unusual C15 unsaturated beta-amino acid [J].FEBS Lett.,2010,584(14):3209-3214.
[37] Ma Z,Wang N,Hu J,etal..Isolation and characterization of a new iturinic lipopeptide,mojavensin A produced by a marine-derived bacteriumBacillusmojavensisB0621A [J].J.Antibiot.(Tokyo),2012,65(6):317-322.
[38] 龚谷迪,周广田,郭 阳,等.脂肽surfactin、iturin、fengycin性质鉴定的研究与展望 [J].中国食品添加剂,2013,3:211-215.
[39] 胡江春,王 楠,潘华奇,等.海洋微生物抗菌脂肽及新生物农药研发 [J].微生物学杂志,2013,6:1-5.
[40] 徐 杨,王 楠,李 伟,等.海洋枯草芽胞杆菌3512A抗真菌脂肽的分离纯化及结构特性鉴定 [J].中国生物防治,2009,4:328-333.
[41] Iizuka T,Fudou R,Jojima Y,etal..Miuraenamides A and B,novel antimicrobial cyclic depsipeptides from a new slightly halophilic myxobacterium:Taxonomy,production,and biological properties [J].J.Antibiot.,2006,59:385-391.
[42] 刘新利,李越中.粘细菌次级代谢产物及其在农业上的应用价值 [J].中国农业科技导报,2007,3:44-51.
[43] 刘新利,鞠培殿,娄红祥.黏球菌产生的活性天然产物 [J].国际药学研究杂志,2010, 2:98-104.
[44] 夏振强,暴增海,周 超.抗真菌海洋细菌L1-9菌株的几种胞外酶活性测定 [J].河南农业科学,2009,7:74-77.
[45] 齐希猛.海洋细菌TC-1防治香蕉枯萎病及抗菌蛋白抑菌的机理初步研究 [D].广东湛江:广东海洋大学,硕士学位论文,2012.
[46] Osawa R,Koga T.An investigation of aquatic bacteria capable of utilizing chitin as the sole scource of nutrients [J].Lett.Appl.Microbiol.,1995,21(5):288-291.
[47] 许梦秋,钟增明,龚 琰,等.几丁质酶在植物病害生物防治中的应用 [J].现代农业科技,2010,5:122-123.
[48] 张福丽,王占斌,王志英.几丁质酶在植物抗真菌病害中的作用 [J].林业科技,2006,3:24-27.
[49] 蒋选利,李振岐,康振生,等.几丁质酶与植物的抗病性 [J].西北农业学报,2002,3:71-75.
[50] 万平平.β-1,3-葡聚糖酶的纯化、特性及其抗菌活性 [D].山东泰安:山东农业大学,硕士学位论文,2004.
[51] 马炳田,文成敬.几种核盘菌菌核重寄生真菌生物防治潜能的研究 [J].中国农学通报,2002,6:58-63.
[52] 苗灵凤.病原诱导启动子驱动几丁质酶基因遗传转化甘蔗的研究 [D].海口:华南热带农业大学,硕士学位论文,2005.
[53] 陈少波,吴根福.几丁质酶研究进展 [J].科技通报,2004,3:258-262.
[54] 钟万芳,丁少军.细菌几丁质酶的结构与功能研究进展 [J].江苏农业科学,2012,4:1-3.
[55] 郑爱萍,李 平.细菌几丁质酶研究进展 [J].中国生物工程杂志,2002,4:75-79.
[56] 李 珊,詹晓北,郑志永,等.哈茨木霉产β-1,3-葡聚糖内切酶的发酵工艺条件研究 [J].工业微生物,2015,2:39-46.
[57] 刘 琼.Thermotoganeapolitanaβ-1,3-葡聚糖酶基因的克隆与表达 [D].长春:吉林农业大学,硕士学位论文,2013.
[58] 任恒星,冷云伟,李 浩,等.纤维素酶生产研究进展 [J].安徽农学通报:上半月刊,2010,15:63-64,79.
[59] 张晓勇,高向阳,陈秀霞,等.纤维素酶半纤维素酶的应用及分子相关性 [J].纤维素科学与技术,2006,1:47-51.
[60] 杨永彬,黄谚谚,林跃鑫.纤维素酶的结构及分子多样性 [J].生命的化学,2004,3:211-213.
[61] 杨永彬,黄谚谚,林跃鑫.纤维素酶的结构及分子多样性 [J].生命的化学,2004,3:211-213.
[62] 刘祖明.新型甲氧基丙烯酸酯类衍生物的合成及杀菌活性研究 [D].武汉:华中师范大学,博士学位论文,2008.
[63] 林 龙.Sclerotiorin衍生物的合成及杀菌活性研究 [D].武汉:华中师范大学,博士学位论文,2012.
[64] 李 淼,刘若霖,李志念,等.新型含嘧啶环的甲氧基丙烯酸酯类化合物的设计、合成及杀菌活性 [J].农药,2009,6:405-408.
[65] 周 凯.新型strobilurin类化合物以及丙烯酰胺类化合物的合成,表征与生物活性研究 [D].山东青岛:青岛科技大学,硕士学位论文,2007.
[66] 王文琴.新型strobilurins类杀菌剂的设计、合成及生物活性研究 [D].武汉:华中师范大学,博士学位论文,2009.
[67] 张 杰,张双全.抗真菌肽对真菌作用机制研究进展 [J].生物化学与生物物理进展,2005,1:13-17.
[68] 郭丽清.苏云金芽胞杆菌中脂肽类抗生素Iturins的研究 [D].福州:福建农林大学,硕士学位论文,2010.
[69] 陈 华,郑之明,余增亮.枯草芽胞杆菌JA脂肽类及挥发性物质抑菌效应的研究 [J].微生物学通报,2008,35(1):1-4.
[70] 张 杰,张双全.抗真菌肽对真菌作用机制研究进展 [J].生物化学与生物物理进展, 2005,32(1):13-17.
[71] Wiederhold N P,Lewis R E.The echinocandin antifungals:An overview of the pharmacology,spectrum and clinical efficacy [J].Expert Opin.,2003,12 (8):1313-1333.
[72] Helmerhorst E J,Troxler R F,Oppenheim F G.The human salivary peptide histatin 5 exerts its antifungal activity through the form ation ofreactive oxygen species [J].Proc.Natl.Sci.USA,2001,98(25):l4637-14642.
[73] 许梦秋,钟增明,龚 琰,等.几丁质酶在植物病害生物防治中的应用 [J].现代农业科技,2010,5:122-123.
[74] 王 丽,石延霞,李宝聚,等.甲氧基丙烯酸酯类杀菌剂研究进展 [J].农药科学与管理,2008,9:24-27.
[75] 赵 平,严秋旭,李 新,等.甲氧基丙烯酸酯类杀菌剂的开发及抗性发展现状 [J].农药,2011,8:547-551,572.
[76] 晏仁义,陈若芸.天然产物中先导化合物的发展和优化 [J].中国天然药物,2005,3(6):322-324.
[77] Yan P S,Li P,Ma R,etal..Inhibiyion of Aflatoxin Production by Marine Microorganisms [A].In:Book of the Abstracts of International Mycotoxin Conference [C].Beijing:International Society for Mycotoxicology,2014,123.
[78] 王 凯,徐静静,马 瑞,等.南大西洋深海水体中可培养微生物的多样性及应用潜力评估 [A].见:第六届全国微生物资源学术暨国家微生物资源平台运行服务研讨会论文集 [C].北京:中国微生物学会微生物资源专业委员会,2014,37.
Progress of Deep-sea Bacteria and its Bioactive Compounds on Prevention of Plant Pathogenic Fungi
SUN Xiao-lei,YAN Pei-sheng*,WANG Kai,WANG Wen-wei,LI Meng-ying
SchoolofMarineScienceandTechnology,HarbinInstituteofTechnologyatWeihai,ShandongWeihai264209,China
In recent years,the development of biopesticides from natural products has been concerned by scholars.For the unique living environment,marine microorganisms producing many novel bioactive compounds that never been found in the terrestrial microorganisms,which provide bright prospects for developing novel biopesticides.The research progress of deep-sea bacteria against phytopathogenic fungi was briefly summarized from three aspects of species diversity,kinds and structures of antifungal substances and antifungal mechanisms.Developing biological pesticide from marine microorganisms was prospected in this paper.This review might provide some insight for development and utilization of marine microorganisms in anti-phytopathogenic fungi.
deep-sea bacteria; phytopathogenic fungi; mycotoxin-producing fungi; antifungal mechanisms
2015-04-22; 接受日期:2015-05-12
国际海域资源调查与开发“十二五”重大项目(DY125-15-R-01);哈尔滨工业大学优秀团队支持计划资助。
孙晓磊,硕士研究生,主要从事海洋微生物研究。E-mail:sunrabbit@yeah.net。*通信作者:闫培生,教授,博士生导师,研究方向为海洋微生物资源与利用、海洋生物质及其加工废物的高值资源化、有害微生物的生物防治与生物农药、微生物发酵工程与生物制药等。E-mail:yps6@163.com
10.3969/j.issn.2095-2341.2015.03.05

