利用污泥提取液制备微生物絮凝剂
王 爽, 李 昂, 李 琳, 李维国*, 马 放*
1.哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨 150090
利用污泥提取液制备微生物絮凝剂
王 爽1, 李 昂2, 李 琳2, 李维国1*, 马 放2*
1.哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨 150090
以污水厂剩余污泥作为培养基原料,经过一系列处理,探索微生物絮凝剂产生菌的最适发酵培养基配方,结果表明,污泥预处理条件以pH 12碱解条件最优,碳氮源产出量最大,补加8 g/L葡萄糖后灭菌,微生物絮凝剂产生菌LLin6可正常产絮,絮凝率达91.55%。该结果为降低微生物絮凝剂的制备成本,并实现污泥的减量化和污泥资源化利用提供了基础。
剩余污泥;微生物絮凝剂;絮凝率
微生物絮凝剂(microbial flocculants,MBF)是微生物代谢过程中产生的次级代谢物,主要通过微生物发酵获得,通过分离、提取与精炼获得的特殊大分子物质,有絮凝悬浮粒固体、细胞和胶体颗粒等功能[1]。生物絮凝剂是一种环境友好型的水处理材料,因其具有极高的安全度、高度的有效性、无毒及容易生物降解等特性,非常符合可持续发展的要求[2]。
针对絮凝剂生产成本高的问题,各国学者开展了较多研究[3~5],以期获得廉价替代培养基。污泥中有机物含量较高,具有很高的再利用价值[6]。利用污水厂排出的剩余污泥作为廉价底物用于微生物絮凝剂的制备,既可显著降低微生物絮凝剂的生产成本,又可对剩余污泥加以利用,实现了剩余污泥的资源化利用。
本文对污泥提取液的制备方法与产絮菌污泥培养条件进行研究,以期为利用污泥提取液制备微生物絮凝剂的应用提供基础。
1 材料和方法
1.1 材料
1.1.1 原料污泥 采用取自哈尔滨市某污水厂的剩余污泥。
1.1.2 微生物絮凝剂产生菌 菌种为城市水资源与水环境国家重点实验室(哈尔滨工业大学)开发的高效絮凝菌LLin6,保藏编号CGMCC:10180,属于不动杆菌属(Acinetobactersp.)。
1.1.3 主要试剂与仪器 高岭土购自济宁高新区泰丰化轻技术装备研究所;酵母膏购自北京奥博星生物技术有限公司;BSA试剂盒为SIGMA公司产品;化学试剂均为国产分析纯。六联混凝搅拌仪(ZR4-6型,深圳中润水工业技术发展公司);分光光度计(T6新世纪型,北京普析通用仪器有限公司);TOC测定仪(TOC-VCPN型,日本岛津);总氮测定仪(TNM-1,日本岛津)。
1.1.4 培养基 种子培养基:葡萄糖10 g/L,K2HPO45 g/L,KH2PO42 g/L,尿素0.5 g/L,酵母膏0.5 g/L,MgSO4·7H2O 0.2 g/L,NaCl 0.1 g/L,pH 7.0。
污泥提取液培养基:将20~30 g/L的污泥进行碱解(pH 12)处理3 h后,将处理液在8 000 r/min下离心5 min,上清液112℃下灭菌30 min后即为污泥提取液培养基。
1.2 方法
1.2.1 正交试验设计 设计正交试验考察温度、pH、处理时间对污泥破碎释放有机物的影响程度,从而确定污泥预处理的方法。实验设置如表1。
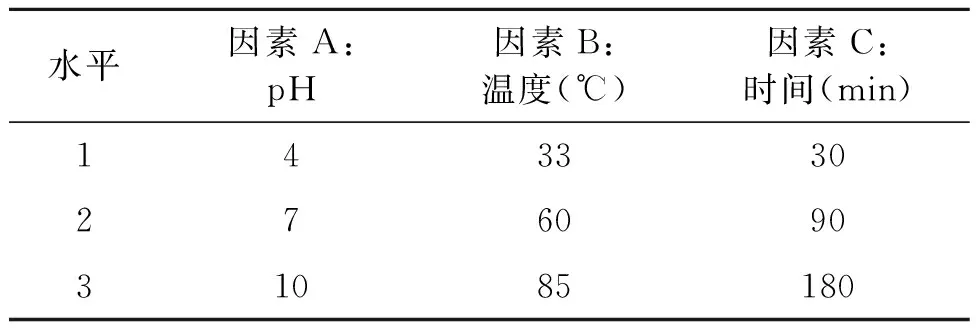
表1 正交试验的因素水平Table 1 Factors and levels in orthogonal experiment design.
1.2.2 污泥处理液分析 分析污泥处理液的各项水质指标:总有机碳量(total organic carbon,TOC)采用TOC测定仪测定,总氮(total nitrogen,TN)用TNM-1总氮测定仪测定,总磷(total phosphorus,TP)含量采用钼锑抗分光光度法测定[7],氨氮浓度采用纳氏试剂比色法测定[7]。对污泥处理液进行多糖、蛋白质含量的测定,确定最佳预处理条件。多糖浓度测定采用苯酚硫酸法[8];蛋白质含量采用BSA试剂盒进行测定。
1.2.3 发酵 将1.1.2中的菌种活化后接种到种子培养基,摇床培养(50 mL/250 mL)24 h,培养温度30℃,摇床转速140 r/min。以污泥提取液为发酵培养基培养产絮菌:按5%的接种量将种子培养液接入污泥培养液,发酵温度30℃,摇床转速为140 r/min,初始pH 为7。
1.2.4 絮凝率的测定 采用自来水配制的高岭土悬浊液(5 g/L)作为试验水样,取发酵24 h的产絮菌发酵液10 mL,按顺序投加发酵液和1.5 mL 10%的CaCl2溶液,调节pH至7左右,以不添加发酵液的水样作为空白对照。在六联混凝搅拌仪上完成搅拌之后静沉20 min,其中水力条件为二段式搅拌(第一段搅拌速度为160 r/min,搅拌时间为40 s;第二段搅拌速度为40 r/min,搅拌时间为280 s)。测定样品上清液在550 nm处的吸光度,以吸光度值计算絮凝率,公式如下:
絮凝率=(A-B)/A×100%
式中,A:对照上清液吸光度值;B:样品上清液吸光度值。
1.2.5 MBF产量的测定 取发酵24 h的产絮菌发酵液50 mL,于10 000 r/min离心10 min,向其上清液中加入2倍体积的无水乙醇(4℃下预冷24 h),充分搅拌,收集出现的絮体,对获得的上清液进行多次乙醇提取后,将收集到的絮体于105℃干燥至质量恒定,得到絮凝剂粗品,称重。
1.2.6 污泥提取液培养基的优化 污泥提取液分别补加2 g/L、4 g/L、6 g/L和8 g/L葡萄糖,112℃下灭菌30 min后作为产絮菌的发酵培养基,发酵条件同1.2.3,测定发酵培养后絮凝率和MBF产量。
2 结果与分析
2.1 污泥提取液处理方法的确定
2.1.1 预处理方法的正交试验结果 按正交实验设计考察各因素对污泥预处理的影响。分析处理液中污泥破碎程度,以污泥释放有机物(TOC、TN)的浓度表征,并考察处理后污泥的减少率情况,结果如表2~4所示。

表2 正交试验中污泥处理液的TOC浓度Table 2 TOC concentration of sludge treatment solution in orthogonal experiment.

表3 正交试验中污泥处理液的TN浓度Table 3 TN concentration of sludge treatment solution in orthogonal experiment.
对污泥进行预处理一方面是要得到可以生产生物絮凝剂的培养基,因此污泥预处理要尽量使处理液中的营养物质含量保持较高水平。在表2、表3中,极差RA>RB>RC,污泥处理各因素对TOC和TN的影响程度为pH>温度>时间,pH偏碱性和高温条件效果最佳,并且在最佳pH和温度组合条件下,处理时间不宜过长。
另一方面可以减少污泥,达到污泥资源化、减量化。本实验利用污泥减少率表征污泥资源化程度。污泥减少率极差RA>RB>RC(表4),表明pH和温度对其影响较大。

表4 正交试验中污泥处理后的污泥减少率Table 4 Sludge reduction rate after sludge treated in orthogonal experiment.
2.1.2 不同酸碱度、温度条件下的预处理效果 进一步考察对污泥酸解、碱解和不同温度的预处理方法。在30℃,在不同pH条件下处理污泥3 h,离心后得到的提取液水质分析结果如图1所示,酸解、碱解处理污泥释放的总碳、总氮浓度在pH 12条件下最高,此条件下碳氮源较多。虽然总磷和氨氮浓度在此条件下均不高,但对产絮菌的影响不大。
pH 7条件下,以不同温度处理污泥3 h得到处理液的水质分析结果如图2。100℃条件下,污泥释放的总碳、总氮浓度最高,总磷和氨氮浓度均不高。
2.1.3 碱解与高温预处理方法的比较 对碱解、高温预处理效果进一步考察,于pH 12和100℃分别处理污泥后,对污泥处理液的蛋白、多糖浓度进行测定,结果见表5,碱解(pH 12)污泥处理液的多糖和蛋白浓度最大,接近培养要求,所以最终采取碱解的方法处理污泥。

图1 不同pH条件下处理污泥所得提取液水质分析Fig.1 Water quality analysis of the sludge extract under different treatment pH conditions.

图2 不同温度下处理污泥所得提取液水质分析Fig.2 Water quality analysis of the sludge extract under different temperature conditions.
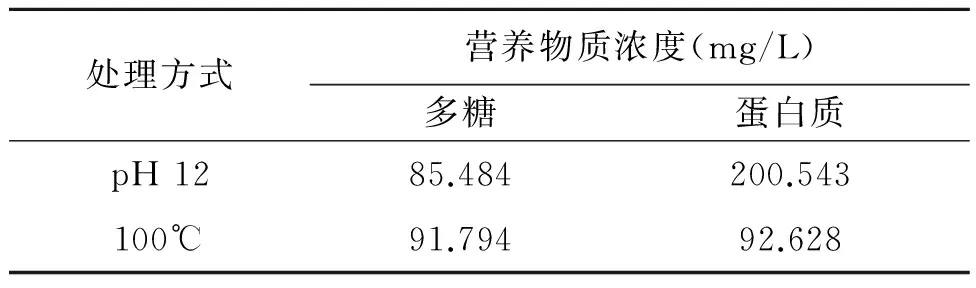
表5 pH 12和100℃条件下分别处理污泥所得提取液的蛋白、多糖浓度Table 5 Concentration of protein and polysaccharide in sludge extract after treatment in pH 12 and 100℃ respectively.
2.2 污泥提取液培养基的配置
污泥提取液中碳源浓度较低,不能给产絮菌提供足够可利用碳源,因此考虑外加碳源,研究表明絮凝剂产生菌的最适碳源主要为葡萄糖[9],因此选择外加葡萄糖以提供碳源,考察葡萄糖添加量对产絮菌LLin6产絮的影响,结果如图3。
未添加葡萄糖的污泥提取液培养基无絮凝效果,葡萄糖的加入大大提升了絮凝率,在补加量为8 g/L时絮凝效果最好,絮凝率可达到91.55%,产絮量2.5 g/L。但并非补加的葡萄糖越多越好,随着葡萄糖浓度的增加,絮凝效果反而有所降低。结果表明,对于处理后的污泥提取液补加8 g/L葡萄糖,灭菌后作为产絮菌LLin6的发酵培养基是可行的,且絮凝率、产絮量均较高。

图3 葡萄糖投加量对产絮菌产絮的影响Fig.3 Effects of glucose dosage on floc bacteria producing flocculant.
3 讨论
污水处理厂污泥含有重金属及病原菌等有害物质,直接排放不仅对环境造成污染,同时也是资源的浪费。目前污泥回收再利用主要用于建筑材料、农业用肥等,而将污泥预处理作为生物絮凝剂产生菌廉价发酵培养基还是先例。将污泥进行预处理,目的是使污泥的碳氮源最大量释放,接近产絮菌培养条件。另一方面使污泥减少,本研究中污泥减少率达到30%~40%,说明利用污泥提取液作为产絮菌发酵培养基对污泥减量化和资源化是有效的。
微生物絮凝剂产生菌可以利用培养基中碳氮源合成胞外物质,这些物质可以对污水中颗粒物、细胞和胶质吸附、聚集成大的颗粒物后沉降。而培养基价格昂贵一直是研究瓶颈。目前如李大鹏等[10]利用谷氨酸废液作为氮源制备生物絮凝剂。李静等[11]利用沼液作为廉价培养液。本研究利用污泥提取液作为产絮菌发酵培养基可获得产絮菌生长所需的部分营养条件,但有机碳源不足。考察碱解和高温预处理对污泥释放碳氮源的影响,确定pH 12碱解条件下污泥提取液氮源释放达200.54 mg/L,较其他条件高,可选取此条件处理污泥。预处理后的污泥提取液经离心处理后添加8 g/L葡萄糖,配置后灭菌可以替代传统产絮培养基为产絮菌提供营养物质使其生长产絮。
本研究立足于污泥减量化和资源化利用,通过构建低成本培养基的可行性配置方案,充分发挥生物絮凝剂产生菌资源的优势,为生物絮凝剂的低成本规模化制备提供一定的技术支持和保障。
[1] 李和平.微生物絮凝剂 [J].重庆环境科学,2000,2(22):18-21.
[2] 朱艳彬,马 放,李大鹏.水处理生物絮凝剂菌种资源研究进展 [A].见:中国环境科学学会.中国环境科学学会学术年会论文集2009[C].北京:北京航空航天大学出版社,2009.
[3] 裴瑞林,信 欣,张雪乔,等.养猪废水培养微生物絮凝剂产生菌群B-737及发酵特性[J].环境科学,2013,34(5):1951-1957.
[4] 颜东方,贠建民.马铃薯淀粉废水生产微生物絮凝剂菌株筛选及其营养条件优化 [J].农业工程学报,2013,29(3):198-206.
[5] 董双石,王爱杰,任南琪,等.利用生物制氢废液制取絮凝剂及除污效能 [J].中国给水排水,2006,22(1):18-21.
[6] 姚舜华.消化脱水污泥处置与利用的探讨 [J].中国市政工程,1994,4:46-50.
[7] 国家环保局.水和废水监测分析方法 (第4版)[M].北京:中国环境科学出版社,2002.
[8] 张 杰,李春燕,李劲平,等.蒽酮硫酸法与苯酚硫酸法测定竹节参多糖含量的比较研究 [J].中南药学,2012,10(6):421-424.
[9] Kurane R,Toeda K,Takeda K,etal..Culture conditions for production of microbial flocculant byRhodococcuserythropolis[J].Agric.Biol.Chem.,1986,9(50):2309-2313.
[10] 李大鹏.以秸秆和谷氨酸废液制取生物絮凝剂及其净水效能研究[D].哈尔滨:哈尔滨工业大学,博士学位论文,2010.
[11] 李 静.利用沼液制取生物絮凝剂及其去除重金属效能研究[D].哈尔滨:哈尔滨工业大学,硕士学位论文,2014.
Production of Microbial Flocculants from Sludge Extract
WANG Shuang1,LI Ang2,LI Lin2,LI Wei-guo1*,MA Fang2*
1.SchoolofMarineScienceandTechnology,HarbinInstituteofTechnologyatWeihai,ShandongWeihai264209,China;2.StateKeyLaboratoryofUrbanWaterResourceandEnvironment,HarbinInstituteofTechnology,Harbin150090,China
Use sewage sludge as media materials,process the sewage sludge through a series of conditions aiming to use the treated sewage sludge as the fermentation medium of microbial flocculant producing bacteria.The results showed that alkaline hydrolysis of the sludge at pH 12 was the optimal pretreatment conditions,with maximum output of carbon and nitrogen.Sterilizing the sludge extract after adding 8 g/L glucose,the microbial flocculant producing bacteria LLin6 could normally produce flocculants,the flocculation rate could reach 91.55%.The present study would provide basis for reducing the expected cost of bioflocculant preparation and realizing sludge reduction and resources reutilization.
sludge; microbial flocculants; flocculation rate
2015-04-22; 接受日期:2015-05-04
国家重点实验室开放基金项目(QA201016)资助。
王爽,硕士研究生,主要从事环境微生物研究。E-mail:1173828732@qq.com。*通信作者:李维国,副教授,博士,主要从事高盐废水处理与环境微生物研究。E-mail:lwghm@tom.com;马放,教授,博士,主要从事环境生物技术研究。E-mail:mafang@hit.edu.cn
10.3969/j.issn.2095-2341.2015.03.12

