蛋清蛋白、大豆分离蛋白及其美拉德反应产物膜包裹对核桃仁脂质过氧化作用的比较研究
强婉丽,景 浩
(中国农业大学食品科学与营养工程学院,北京 100083)
蛋清蛋白、大豆分离蛋白及其美拉德反应产物膜包裹对核桃仁脂质过氧化作用的比较研究
强婉丽,景 浩*
(中国农业大学食品科学与营养工程学院,北京 100083)
本文通过测定核桃油酸价、过氧化值、丙二醛含量、碘值和DPPH自由基清除率五个指标的变化研究比较蛋清蛋白膜、大豆分离蛋白膜及其与木糖美拉德反应产物膜包裹对核桃仁脂质过氧化的影响。结果表明,随着反应时间(0~8d)的增加,核桃仁酸价、过氧化值和丙二醛含量均呈现上升趋势,DPPH自由基清除率均呈现下降趋势,而碘值则变化不明显。加热第8d时,四种膜包裹核桃仁的酸价、过氧化值和丙二醛含量均小于未包膜的核桃仁,DPPH自由基清除率高于未包膜的核桃仁。四种膜包裹核桃仁的酸价无显著性差异(p>0.05);而过氧化值中以蛋清蛋白膜组较高,且其余三组的无显著性差异(p>0.05);四种膜包裹核桃仁的丙二醛含量均明显低于未包膜组,延缓丙二醛含量上升的效果依次为:大豆分离蛋白-木糖膜>蛋清蛋白-木糖膜>大豆分离蛋白膜>蛋清蛋白膜;大豆分离蛋白-木糖膜包裹核桃仁保留的DPPH自由基清除率明显高于其它三种膜。综上所述,两种蛋白及其美拉德反应产物膜包裹均可延缓核桃仁脂质过氧化,综合各项指标其效果依次为:大豆分离蛋白-木糖膜>蛋清蛋白-木糖膜>大豆分离蛋白膜>蛋清蛋白膜。
蛋清蛋白膜,大豆分离蛋白膜,美拉德反应产物膜,核桃仁
核桃仁营养丰富,含有65%左右的油脂[1],其中不饱和脂肪酸含量在73%左右[2],核桃仁容易发生脂质过氧化反应,从而对其品质产生不良影响,降低营养价值,因此研究延缓核桃仁脂质过氧化反应的方法具有一定实际意义。可食用蛋白膜是以动植物蛋白为材料制备生成的可食性膜,以其可生物降解、营养可食、良好的阻水性、隔氧性、机械特性等特性,相对于脂质膜和多糖膜具有一定优势,近年来得到了广泛的研究[3-4]。
有研究表明蛋清蛋白及蛋清蛋白-木糖美拉德反应产物膜包裹核桃仁,可以抑制核桃仁酸价的上升,但两种膜之间没有显著性差异[5];大豆分离蛋白膜包裹核桃仁可以抑制核桃仁过氧化值和TBA值的上升[6];乳清蛋白和乳清蛋白-海藻酸钠复合膜对核桃仁的酸败无明显抑制作用,乳清蛋白-木糖膜可以延缓核桃仁酸败[7];另有研究将蛋清蛋白、大豆分离蛋白和乳清蛋白膜包裹核桃仁,对比三种膜对核桃仁脂质过氧化反应的抑制作用,结果表明膜包裹延缓核桃脂质过氧化效果为:大豆分离蛋白膜>蛋清蛋白膜>乳清蛋白膜[8];虽然对于蛋清蛋白膜和大豆分离蛋白膜包裹核桃仁的研究已有一些报道,但对于蛋清蛋白、大豆分离蛋白及其美拉德反应产物膜包裹核桃仁对其脂质过氧化作用的分析比较未见报道,本实验用蛋清蛋白膜、大豆分离蛋白膜、蛋清蛋白-木糖膜和大豆分离蛋白-木糖膜包裹核桃仁,测定核桃仁在50°C、8d期间内酸价、过氧化值、丙二醛含量、碘值和DPPH自由基清除率的变化,分析比较四种膜包裹对核桃仁脂质过氧化的抑制作用。
1 材料与方法
1.1 材料与仪器
核桃 购自北京市清河农贸市场,手工去壳,选取大小均一的核桃仁包膜用;蛋清蛋白粉(Egg white protein,EWP) 蛋白质含量为84.3%,河北同和生物制品有限公司;大豆分离蛋白粉(Soy protein isolate,SPI) 用豆粕提取大豆分离蛋白,大豆分离蛋白含量大于90%,豆粕由中粮集团有限公司惠赠;木糖(Xylose,Xyl) 含量98.5%;北京嘉康源科技发展有限公司。
无水乙醇(Ethanol,EtOH)、乙醚(Diethyl ether,Et2O)、氢氧化钾(Potassium hydroxide)、硫代巴比妥酸(Thiobarbituric acid,TBA)、三氯乙酸(Trichloroacetic acid,TCA)、碘化钾(Potassium iodide)、硫代硫酸钠(Sodium thiosulfate)、环己烷(Cyclohexane)、无水碳酸钠(Natrium carbonicum calcinatum)、邻苯二甲酸氢钾(potassium acid phthalate)、甘油(Glycerol,Gly)、氢氧化钠(Sodium hydroxide)、盐酸(Hydrochloric acid) 均购于北京化工厂,均为分析纯;三氯甲烷(Trichloromethane)、一氯化碘(Iodine monochloride)、石油醚(Petroleum ether,PE) 均购于国药集团化学试剂有限公司,均为分析纯;冰乙酸(Acetic acid glacial,AC,纯度≥99.8%)、淀粉指示剂(Starch indicator,0.5%) 均购自天津市光复科技发展有限公司;重铬酸钾(Potassium dichromate,基准级)、酚酞(Phenolphthalein) 购自天津市津科精细化工研究所;1,1,3,3-四甲氧基丙烷(1,1,3,3-Tetramethoxy propane,TEP,纯度为99%)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 购于美国Sigma 公司。
1.2.1 核桃仁蛋白成膜溶液的处理 根据预实验确定的、优化的蛋白成膜溶液成分和浓度,准确称量12g蛋清蛋白或大豆分离蛋白于干净烧杯中,向蛋白成膜溶液中加入5mL甘油溶液,蛋白-木糖成膜溶液中加入12g木糖、0.25mL甘油溶液,加入去离子水100mL,于磁力搅拌器上搅拌溶解后,用去离子水定容至200mL,用浓度为1mol/L的NaOH溶液将成膜溶液pH调节至11,于80℃加热60min后取出,于室温下冷却至约50℃时用于包裹核桃仁。其中蛋白成膜溶液中蛋白与甘油比例为6∶2.5(g∶mL),蛋白-木糖成膜溶液中蛋白、木糖与甘油比例为6∶6∶0.125(g∶g∶mL)。
核桃仁的包膜参照李琦等[5]的方法并稍作修改,对核桃仁进行包膜处理。简述如下,将270g核桃仁置于200mL成膜溶液中浸泡5min,同时用玻璃棒进行搅拌,使核桃仁与成膜溶液充分接触。然后用油篦子将核桃仁小心捞出并沥干溶液后,将核桃仁均匀的铺在硫酸纸上,室温下晾干(20°C,12 h),将核桃仁置于干净的烧杯中保存。
1.2.2 核桃仁的加速氧化条件 取大小均一的核桃仁分成六组,每组270g。第一组将未包膜核桃仁,置于室温处理,标记为“未包膜(20℃)”;第二组将未包膜核桃仁,置于50℃电热恒温培养箱内处理,标记为“未包膜(50℃)”;第三组将核桃仁用蛋清蛋白膜包裹,标记为“包膜(EWP)”;第四组将核桃仁用大豆分离蛋白膜包裹,标记为“包膜(SPI)”;第五组将核桃仁用蛋清蛋白-木糖膜包裹,标记为“包膜(EWP-Xyl)”;第六组用大豆分离蛋白-木糖膜包裹,标记为“包膜(SPI-Xyl)”。第三、四、五、六组均置于50℃电热恒温培养箱内处理。根据预实验确定的加速氧化条件,实验前1d将盛有饱和KBr溶液的托盘放入温度为50℃的电热恒温培养箱中平衡24 h。将第一组核桃仁置于室温,将第二、三、四、五、六组核桃仁置于50℃平衡24 h后的电热恒温培养箱内,每隔两天取出样品提油后冷冻待测,直至8d。
1.2.3 核桃油的提取 参照李琦等[5]的方法并稍作修改,简述如下,取出45g核桃仁,在研钵中磨碎成糜糊状,将其置于180mL石油醚中搅拌1min,浸泡12h,于2810×g(4000r/min)离心10min,将上清液在40℃条件下真空旋转蒸发,实际得到核桃油在21~23mL之间(质量在19~21g之间),将核桃油放在-20℃的冰箱中贮存待测,测定前将核桃油取出后于50℃水浴中放置30min,方便吸取。
1.2.4 核桃油脂质过氧化指标的测定
1.2.4.1 酸价测定 根据GB/T5530-2005《动植物油脂酸价和酸度测定》[5]所提供的方法稍作修改,测定酸价:称取2 g核桃油于250mL锥形瓶中,加入40mL乙醇和乙醚(体积比为1∶1)溶液混匀,以酚酞为指示剂,用0.1mol/L的KOH滴定至溶液呈浅粉色,记录所消耗的KOH溶液体积,每个样品重复测定三次。根据下述公式计算酸价:酸价=56.11CKOHVKOH/Moil,式中:CKOH为KOH的摩尔浓度,mol/L;VKOH为滴定所用KOH体积,mL;Moil为油脂质量,g;56.1为KOH的摩尔质量,g/moL。
1.2.4.2 过氧化值测定 根据GB/T5009.37-2003《食用植物油卫生标准的分析方法》[6]所提供的方法测定,称取2g核桃油置于250mL碘量瓶中,加入30mL氯仿-冰乙酸混合液(2∶3,v/v)溶解,加入1.00mL饱和KI溶液后加塞振摇30s,暗处放置3min后,加入100mL去离子水;摇匀后用浓度为0.002mol/L的Na2S2O3溶液滴定至淡黄色,加入浓度为0.5g/100mL的淀粉溶液1.00mL,继续用浓度为0.002mol/L的Na2S2O3溶液滴定至蓝色消失。每个样品重复测定三次,同时作空白实验。计算公式为:POV=(V2-V1)×C×0.1269×78.8×100/M,式中:POV为试样的过氧化值,meq/kg;V1为空白溶液滴定时所消耗的Na2S2O3标准溶液体积,mL;V2为样品溶液滴定时所消耗的Na2S2O3标准溶液体积,mL;m为油样的质量,g;C为Na2S2O3标准溶液的浓度,mol/L;0.1269为与1.00mL Na2S2O3标准溶液相当的碘的质量,g;78.8为换算因子。
对系统的优化设计,省去外部芯片,节省PCB布板空间,减少信号线之间的相互干扰问题,将并行数据的传输速率由原来的35 MHz提升到50 MHz,对相同的原始图像,在相同的压缩倍数下进行压缩后,由上位机显示的原始图像和压缩图像的对比结果图分别如图8和图9所示。
1.2.4.3 丙二醛含量测定 参照姚惠芳[7]的方法并稍作修改,测定核桃油脂中丙二醛含量。简述如下,称取1.8g核桃油于15mL的离心管中,加入混合显色液(0.02mol/L的TBA与7.5%的TCA等体积混合)5mL,混匀于100℃的水浴中加热30min,取出冷却,用去离子水定容至10mL,加入2mL三氯甲烷,密塞上下倒置10次,使油充分溶入三氯甲烷层,静置10min,使油沉入管底,取上清液于530nm处测定其吸光值,同一样品重复测定三次吸光值。同时做标准曲线。标准曲线的制作:准确吸取浓度为10μg/mL的丙二醛标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2mL置于15mL离心管中,然后按样品测定的方法测定其吸光值。根据丙二醛含量与吸光值关系绘制标准曲线。
1.2.4.4 碘值测定 根据GB/T5532-2008《动植物油碘价的测定》[8]所提供的方法稍作修改,准确称取0.65g核桃油,置于500mL碘量瓶中,加入10mL环己烷-冰乙酸混合液(1∶1,v/v),13mL韦氏试剂(将25g一氯化碘溶于1500mL冰乙酸中),盖好塞子,摇匀后将锥形瓶置于暗处1h后,加入浓度为10g/100mL的碘化钾溶液10mL和去离子水80mL。用标定过的浓度为0.1mol/L硫代硫酸钠标准溶液滴定至碘的黄色接近消失。加几滴淀粉溶液继续滴定,一边滴定一边用力摇动锥形瓶,直到蓝色刚好消失。每个样品重复测定三次,同时作空白实验。计算公式为:W1=0.1269×C×(V1-V2)×100/m,式中:W1为试样的碘值,每100g样品吸取碘值的克数,g/100g;V1为空白溶液滴定时所消耗的Na2S2O3标准溶液体积,mL;V2为样品溶液滴定时所消耗的Na2S2O3标准溶液体积,mL;m为油样的质量,g;C为Na2S2O3标准溶液的浓度,mol/L;0.1269为与1.00mL Na2S2O3标准溶液相当的碘的质量,g。
1.2.4.5 DPPH自由基清除率测定 参照李琦[3]的方法并稍作修改,测定核桃油DPPH自由基清除率。简述如下,称取9.8mg DPPH(1,1-Diphenyl-2-picrylhydrazyl,1,1-二苯基-2-三硝基苯胫)溶于10mL无水乙醇中,配制成浓度为2.5mmol/L的DPPH储备液,使用前用无水乙醇稀释储备液至浓度为1.56mmol/L 的工作液。在96孔板中进行DPPH自由基清除实验。吸取100μL核桃油于1.5mL离心管中,加入100μL无水乙醇,于涡旋震荡仪上混匀,配制成浓度为50%的核桃油样品,测定时在样品孔中加入30μL浓度为50%的核桃油和150μL DPPH工作液,在颜色对照孔中加入30μL浓度为50%的核桃油和150μL无水乙醇,在空白对照孔中加入30μL无水乙醇和150μL DPPH工作液。在黑暗室温环境下放置30min,在520nm波长下读取吸光值,带入下式计算:DPPH自由基清除率(%)=[Abs空白-(Abs样品-Abs对照)]×100/Abs空白,式中:Abs空白为空白对照孔在520nm处吸光值;Abs样品为样品孔在520nm处吸光值;Abs对照为颜色对照孔在520nm处吸光值。
1.2.5 数据处理方法 数据的显著性差异由Minitab软件进行分析。对均数进行单因素方差分析(One way analysis of variance,One way ANOVA),进一步以Tukey多重比较进行检验,得到各组均数间的显著性差异(p<0.05)。
2 结果与分析
2.1 核桃油酸价的变化
如表1所示,在8d贮藏过程中,六组核桃油酸价随着加热时间的延长均呈现上升趋势,其中50℃未包膜组核桃油的酸价上升最多,在第8d时显著高于其余五组,经膜包裹的核桃油酸价和20℃未包膜组无显著性差异。
酸价是用来表示核桃仁油水解酸败程度的指标,核桃仁贮藏过程中会发生脂质过氧化,产生游离脂肪酸,而酸价是指中和1g油脂中游离脂肪酸所用的KOH的毫克数,因此酸价越高则表示游离脂肪酸含量越高,脂质过氧化程度越深[12]。Cho等人[13]测定植物油酸价得出:新鲜精炼和压榨植物油酸价分别为0.2、0.7mg KOH/g oil,压榨未精炼植物油酸价为3.0mg KOH/g oil。姚惠芳和李琦[5,8]测定核桃油酸价时,得出未包膜核桃油酸价上升幅度大于包膜组,且姚惠芳得出包裹SPI膜的核桃油酸价上升幅度小于包裹EWP膜核桃油酸价,这与本实验结果一致。本实验中,加热8d后,50℃未包膜组核桃仁酸价上升幅度大于20℃未包膜组,其酸价变化率相比20℃未包膜组升高了77.81%,说明在50℃和相对湿度80%的条件下,核桃仁酸价已有明显升高。加热8d后,包膜组核桃仁酸价上升幅度均小于50°C未包膜组,EWP、SPI、EWP-Xyl和SPI-Xyl包膜组的核桃仁酸价变化率与50°C未包膜组相比分别降低了56.09%、62.99%、51.24%和58.65%,因此膜包裹均延缓核桃仁酸价上升,但四组包膜组的核桃仁酸价无显著性差异(p>0.05)。这是由于蛋白膜具有阻水性、隔氧性和耐热性,将蛋白膜包裹在核桃仁表面,使得核桃仁中不饱和脂肪酸的氧化过程减弱[14]。
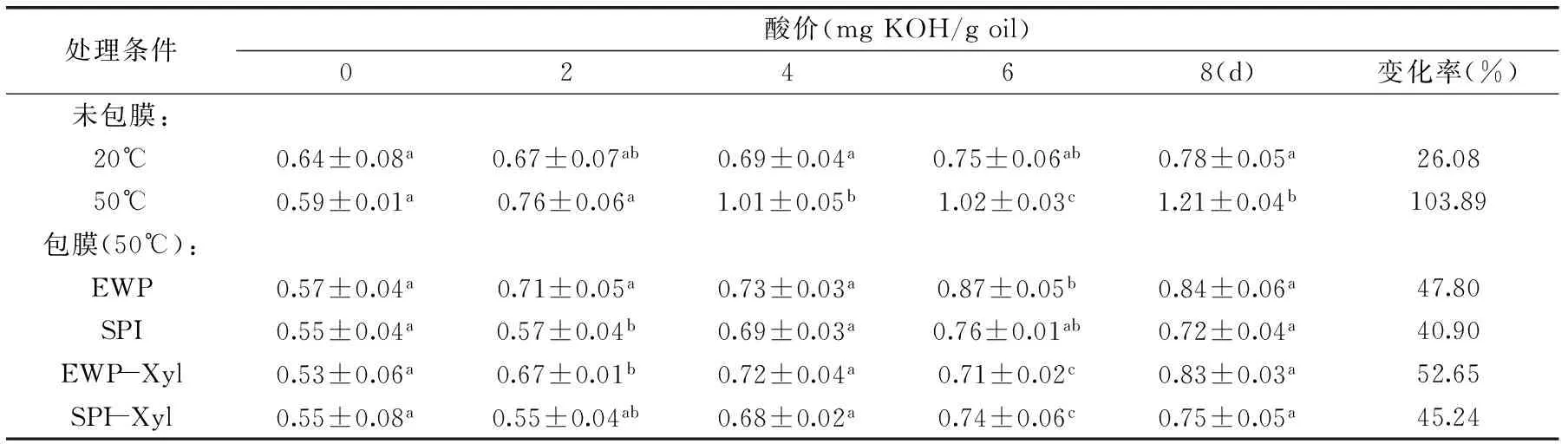
表1 4种不同蛋白膜包裹的核桃油酸价的变化Table 1 Acid values of the walnuts coated with four different protein films
注:同一列中标不同字母的组别表示有显著性差异(p<0.05),表2~表5同。酸价变化率(%)=(酸价8d-酸价0d)/酸价0d×100。

表2 4种不同蛋白膜包裹的核桃油过氧化值的变化Table 2 Peroxide values of the walnuts coated with four different protein films
注:POV变化率(%)=(POV8d-POV0d)/POV0d×100。
2.2 核桃油过氧化值的变化
如表2所示,在8d贮藏过程中,六组核桃油过氧化值均呈现上升趋势。50℃未包膜组核桃油过氧化值上升幅度高于其余组,过氧化值上升幅度为:50℃未包膜组>20℃未包膜组>EWP包膜组>SPI-Xyl包膜组>SPI包膜组>EWP-Xyl包膜组。
过氧化值是油脂氧化酸败的第一个中间指标,它是衡量油脂氧化变质的重要指标之一,油脂的过氧化值越高,说明在储藏过程中产生的氢过氧化物越多,油脂哈败程度越高[14-15]。过氧化值的测定原理是:油脂中的过氧化物与碘化钾作用产生碘单质,用硫代硫酸钠滴定生成的碘单质,通过测定碘的含量间接求出过氧化物的含量[16]。新鲜核桃油的过氧化值非常低,在1.2meq O2/kg oil左右[17-18]。Gamli等人[19]研究不同贮藏条件下开心果油品质变化得出开心果油过氧化值随着加热时间延长呈现上升趋势,Vanhanen等人[1]测定不同贮藏温度下核桃仁过氧化值变化时得出:各组核桃油的过氧化值上升不显著,Kang等人[4]研究大豆分离蛋白膜包裹核桃仁对其脂质过氧化的抑制作用,结果表明:35℃贮藏21d后,包裹SPI膜核桃油过氧化值上升幅度小于未包膜组。本实验中,加热8d后,50℃未包膜组核桃仁过氧化值上升幅度大于20℃未包膜组,其过氧化值变化率相比20℃未包膜组升高了26.25%,说明在50℃和相对湿度80%的条件下,核桃仁过氧化值已有明显升高,这与姚惠芳报告的结果一致[8]。加热8d后,包膜组核桃仁过氧化值上升幅度均小于50℃未包膜组,EWP、SPI、EWP-Xyl和SPI-Xyl包膜组核桃仁过氧化值变化率与50℃未包膜组相比分别降低了29.90%、53.00%、49.77%和41.17%。这说明膜包裹减少核桃仁加热过程中氢过氧化物的产生,从而抑制核桃仁脂质过氧化反应。
2.3 核桃油丙二醛含量的变化
如表3所示,在8d贮藏过程中,50℃未包膜组核桃油丙二醛含量随着加热时间的延长呈现先上升后下降的趋势,在第6d达到最大值;其余五组核桃仁丙二醛含量随着加热时间的延长呈现上升趋势,50℃未包膜组核桃油丙二醛含量最大值显著高于其余五组(p<0.05)。
油脂中的不饱和脂肪酸在加热时易被空气中的氧气氧化而产生氢过氧化物,氢过氧化物进一步氧化生成醛、酮、酸等物质,丙二醛含量油脂变质的中间产物,随着更深度的氧化酸败,油脂丙二醛含量也会呈现下降趋势[16]。本实验用TBA法测定油脂中丙二醛含量,测定原理是:丙二醛与硫代巴比妥酸(TBA试剂)反应生成TBA红色化合物,该化合物在532nm处有最大吸收,因此通过测定其在532nm处的吸光值,并根据丙二醛标准曲线,计算出油脂中丙二醛含量,来反映油脂氧化程度[5]。Kang等人[4]研究大豆分离蛋白膜包裹核桃仁对其脂质过氧化的影响得出包裹SPI膜的核桃油丙二醛含量上升幅度明显小于未包膜核桃油,这与本实验结果一致。李琦等人[3]研究蛋清蛋白膜及其美拉德反应产物膜包裹核桃仁对其脂质过氧化反应的影响,结果表明50℃未包膜组核桃油丙二醛含量在加热2d时达到最大值,然后呈现下降趋势,徐永霞等人[20]研究猪脂肪氧化时得出:丙二醛含量随着氧化时间的延长呈现先上升后下降的趋势,由于丙二醛是油脂氧化变质过程中的中间产物,会进一步氧化成酸类物质,则丙二醛含量会下降,因此丙二醛含量下降并不表示油脂氧化程度降低,本实验中50℃未包膜组核桃油丙二醛含量在第6d达到最大值,随后呈现下降趋势,这与徐永霞报告的结果一致。本实验中,加热8d后,50℃未包膜组核桃仁丙二醛含量上升幅度大于20℃未包膜组,其丙二醛含量变化率相比20℃未包膜组升高了61.83%,说明在50℃和相对湿度80%的条件下,核桃仁丙二醛含量已有明显升高。加热8d后,包膜组核桃仁丙二醛含量上升幅度均小于50℃未包膜组,EWP、SPI、EWP-Xyl和SPI-Xyl包膜组核桃仁丙二醛含量变化率与50℃未包膜组相比分别降低了26.38%、38.78%、52.08%和79.72%。因此,四种膜包裹抑制核桃油丙二醛含量上升效果为:SPI-Xyl>EWP-Xyl>SPI>EWP。美拉德反应产物包膜组核桃仁丙二醛含量上升幅度小于蛋白包膜组,这是由于蛋白质与糖美拉德反应可以改变蛋白质的交联情况,从而改变膜的结构,提高蛋白膜阻隔性能[7],另有研究报道,蛋白和糖随着美拉德反应程度的加深,会产生具有抗氧化性能的美拉德反应产物[21],因此美拉德反应产物膜对核桃仁脂质过氧化反应的抑制效果更好。

表3 4种不同蛋白膜包裹的核桃油丙二醛含量的变化Table 3 MDA contents of the walnuts coated with four different protein films
注:丙二醛含量变化率(%)=(丙二醛含量8d-丙二醛含量0d)/丙二醛含量0d×100。

表4 4种不同蛋白膜包裹的核桃油碘值的变化Table 4 Iodine values of the walnuts coated with four different protein films
注:碘值变化率(%)=(碘值8d-碘值0d)/碘值0d×100。
2.4 核桃油碘值的变化
碘值是指100g油脂所能吸收碘的克数,是油脂不饱和程度的指标,动植物油脂酸败导致碘值下降,因此油脂中碘值多少直接影响油脂本身内在质量,是一个非常重要的指标[22-24]。碘值的测定原理是:油脂的不饱和脂肪酸与部分一氯化碘起加成反应,剩余的一氯化碘与碘化钾作用放出碘,用硫代硫酸钠标准溶液滴定,通过公示计算碘值[24]。如表4所示,在50℃、8d贮藏过程中,六组核桃油碘值变化均不明显,且无显著性差异(p>0.05)。狄建兵等人[25]进行涂膜抑制核桃哈敗的研究,结果表明:未包膜和包裹SPI膜的核桃油碘价均呈现下降趋势,但无显著性差异。赵悦平等人[26]研究不同品种核桃的贮藏期,测定核桃在室温贮藏期间碘价的变化时得出:核桃贮藏一年后,碘价从130下降到127g/100g,并无显著性变化。宋丽丽等人[27]研究包装对香榧坚果贮藏期间油脂酸败的影响,结果表明:贮藏8个月后香榧坚果酸价和过氧化值变化明显,碘值变化不明显,这与本实验结果一致。
2.5 核桃油DPPH自由基清除率的变化
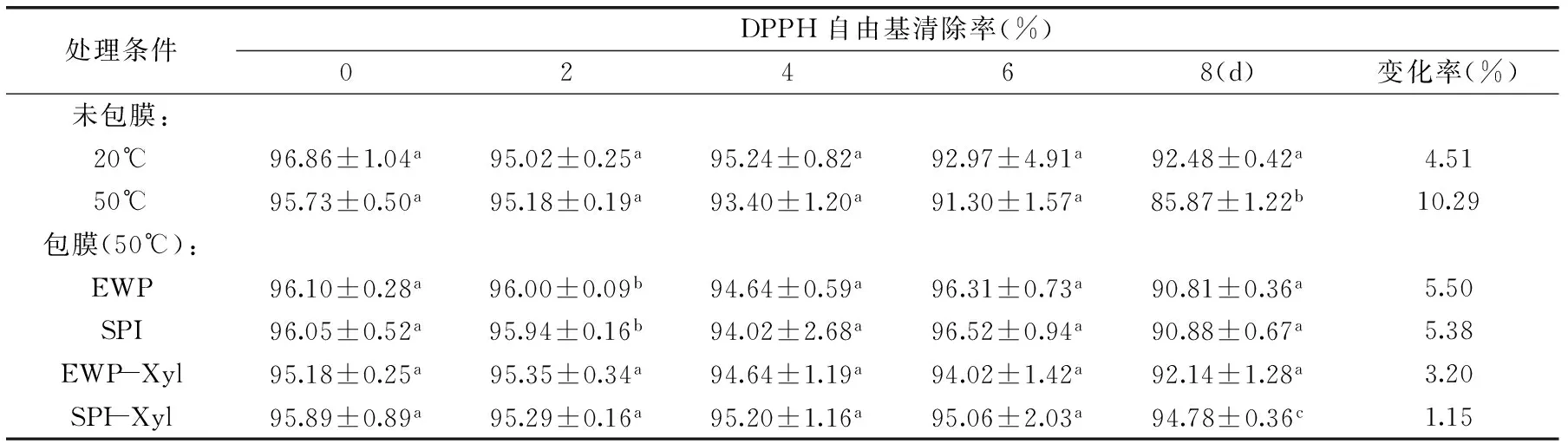
表5 4种不同蛋白膜包裹的核桃油DPPH自由基清除率的变化Table 5 DPPH free radical scavenging rates of the walnuts coated with four different protein films
注:DPPH自由基清除率变化率(%)=(DPPH自由基清除率8d-DPPH自由基清除率0d)/DPPH自由基清除率0d×100。
如表5所示,在8d贮藏过程中,五组核桃仁的DPPH自由基清除率随着加热时间的延长呈现下降趋势,下降幅度为:50℃未包膜组>EWP包膜组>SPI包膜组>EWP-Xyl包膜组>20℃未包膜组>SPI-Xyl包膜组。加热8d后,50℃未包膜核桃油DPPH自由基清除率显著低于包膜组,且包膜组核桃仁DPPH自由基清除率无显著性差异(p>0.05)。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)分析法是体外抗氧化活性测定的主要方法之一,实验原理是依据DPPH自由基具有孤对电子而在515nm附近有强吸收,当DPPH自由基遇到质子供体时,自由基就会被清除,颜色由紫色变为黄色[28-29]。若受试物能清除DPPH自由基,则表示受试物具有降低烷自由基、氢自由基或过氧自由基等稳定性不如DPPH自由基的能力,从而起到抗氧化作用。因此利用核桃油脂与DPPH自由基的反应,就可以检测其清除自由基的能力,能力的大小用抑制率表示,抑制率越大,抗氧化性越强[8]。沈军卫等人[29]在研究美拉德反应产物抗氧化性与反应进程的关系中得出美拉德反应产物具有清除DPPH自由基清除率的作用,DPPH清除能力随着反应时间的延长呈现先上升后下降趋势。Martínez等人[14]研究不同贮藏条件对核桃仁脂质过氧化作用的影响时得出不同贮藏条件下核桃油DPPH自由基清除率均变化不明显。本实验中,加热8d后,50℃未包膜组核桃仁DPPH自由基清除率下降幅度大于20℃未包膜组,其DPPH自由基清除率变化率比20℃未包膜组升高了5.78%,说明在50℃和相对湿度80%的条件下,核桃仁DPPH自由基清除率有所下降。加热8d后,包膜组核桃仁DPPH自由基清除率下降幅度均小于50℃未包膜组,EWP、SPI、EWP-Xyl和SPI-Xyl包膜组核桃仁保留的DPPH自由基清除率的变化率与50℃未包膜组相比分别降低了4.79%、4.91%、7.09%和9.14%。
3 结论
本研究通过测定核桃仁在50℃、8d贮藏期间脂质过氧化指标和DPPH自由基清除率的变化,证实了蛋白膜及其美拉德反应产物膜包裹可以抑制核桃仁脂质过氧化反应。在50℃、8d条件下,核桃仁的酸价、过氧化值、丙二醛含量和DPPH自由基清除率变化较为显著,而碘值变化不明显。其中核桃仁脂质过氧化指标和DPPH自由基清除率变化在20℃未包膜组均小于50℃未包膜组。包膜组核桃仁酸价、过氧化值和丙二醛含量均低于未包膜组,且DPPH自由基清除率高于未包膜组。综合各项指标包膜组的核桃仁脂质过氧化抑制效果依次为:大豆分离蛋白-木糖膜>蛋清蛋白-木糖膜>大豆分离蛋白膜>蛋清蛋白膜。
[1]Vanhanen LP,Savage GP. The use of peroxide values as a measure of quality for walnuts flour stored at five different temperature using three different types of packaging[J]. Food Chemistry,2006,99:64-69.
[2]Crews C,Hough P,Godward J,etal. Study of the main constituents of some authentic walnut oils[J]. Journal of Agricultural and Food Chemistry,2005,53:4853-4860.
[3]Callegarin F. Lipids and biopackaging[J]. Review,1997,74:1183-1192.
[4]杨坤,陈树兴,赵胜娟,等. 可食性蛋白膜研究进展[J]. 食品研究与开发,2009,30(7):174-178.
[5]李琦. 蛋清蛋白-木糖美拉德反应产物膜特性及其膜包裹对核桃仁脂质过氧化影响的研究[D]. 北京:中国农业大学,2011.
[6]Kang HJ,Kim SJ. Inhibitory effect of soy protein coating formulations on walnut(JuglansregiaL.)kernels against lipid oxidation[J]. Food Science and Technology,2013,51:393-396.
[7]张曦. 乳清蛋白糖基化及其成膜特性的研究[D]. 北京:中国农业大学,2010.
[8]姚惠芳,武爽,李琦,等. 3种蛋白膜包裹对核桃仁脂质过氧化作用的比较研究[J]. 食品科技,2012,37(7):58-70.
[9]GB/T 5530-2005,动植物油脂酸价和酸度测定[S].
[10]GB/T 5009.37-2003,食用植物油卫生标准的分析方法[S].
[11]GB/T 5532-2008,动植物油碘价的测定[S].
[12]李助乐. 山核桃种仁油脂提取及其抗氧化作用的研究[D]. 合肥:安徽农业大学,2008.
[13]Cho YJ,Kim TE,Gil B. Correlation between refractive indexof vegetable oils measured with surface plasmon resonance and acid values determined with the AOCS official method[J]. Food Science and Technology,2013,53:517-521.
[14]周柏玲,李蕾,孙秋雁,等. 玉米醇溶蛋白复合膜包衣对核桃仁酸败抑制效果的研究[J]. 农业工程学报,2004,20(3):180-183.
[15]Crowe TD,Crowe TW,Johnson LA,etal. Impact of extractio method on yield of lipid oxidation products from oxidized and unoxidized walnuts[J]. Journal of the American Oil Chemists’ Society,2002,79(5):453-456.
[16]王新芳. 油脂氧化及氧化稳定性的测定方法[J]. 德州学院学报,2004,20(6):46-49.
[17]Gecgel U,Gumus T,Daglioglu O,etal. Determination of fatty acid composition of γ-irradiated hazelnuts,walnuts,almonds,and pistachios[J]. Radiation Physics and Chemistry,2011,80(4):578-581.
[18]Martínez ML,Penci MC,Ixtaina V,etal. Effect of natural and synthetic antioxidants on the oxidative stability of walnut oil under different storage conditions[J]. Food Science and Technology,2013,51:44-50.
[19]Gamli OF,Hayoglu I. The effect of the different packaging and storage conditions on the quality of pistachio nut paste[J]. Journal of Food Engineering,2007,78:443-448.
[20]徐永霞,张若洁,徐竞一,等. 猪脂肪控制氧化及挥发性氧化产物研究[J]. 食品科学,2010,31(21):76-80.
[21]龚平,阚建全. 美拉德反应产物性质的研究进展[J]. 食品与发酵工业,2009,35(4):141-147.
[21]肖仁显. 山核桃油的提取工艺及其氧化稳定性研究[D]. 江苏:江南大学,2012.
[22]Tubino M,Aricetti JA. A green potentiometric method for the determination of the iodine number of biodiese[J]. Fuel,2012:1158-1163.
[23]赖宜萍,张惠黄,彬红,等. 影响杏仁油中碘值测定因素分析[J]. 食品工程,2009(4):56-58.
[24]狄建兵. 涂膜抑制核桃哈败的研究[D]. 太古:山西农业大学,2005.
[25]赵悦平. 核桃硬壳结构与坚果品质相关性的研究[D]. 保定:河北农业大学,2004.
[26]宋丽丽,郜海燕,葛林梅,等. 包装对香榧坚果贮藏中的油脂酸败和抗氧化能力的影响[J]. 林业科学,2009,45(3):49-53.
[27]王丽,张英华. 大豆分离蛋白的凝胶性及其应用的研究进展[J]. 中国粮油学报,2010,25(4):96-99.
[28]孙丽萍,王大仟,张智武. 11种天然植物提取物对DPPH自由基的清除作用[J]. 食品科学,2009,30(1):45-47.
[29]沈军卫,樊金玲,朱文学,等. 模式美拉德反应产物的抗氧化性与反应进程的关系研究[J]. 食品科技,2010,35(3):253-257.
Comparison of egg white protein,soy protein isolate and associated Maillard reaction products as coating-films on walnuts lipid peroxidation
QIANG Wan-li,JING Hao*
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
The egg white protein,soy protein isolate and associated Maillard reaction products were compared as coating-films on the walnut lipid peroxidation,which was analyzed using walnuts’ acid values,peroxide values,MDA contents and iodine values,DPPH radical scavenging rates. The results showed that walnuts’ acid values,peroxide values and MDA contents were increased with the extension of heating time(0~8d),while DPPH radical scavenging rates were decreased during heating process,but the iodine values had no obvious change. When heated at 50℃ for 8d,the acid values,peroxide values and MDA contents were higher for the uncoated walnuts than the coated walnuts,while DPPH radical scavenging rates were lower for the uncoated walnuts than the coated walnuts. There was no significant difference in acid values among four film-coated walnuts;the peroxide value of the walnuts coated by EWP film was the highest among four film-coated walnuts,while there was no significant difference among other three films;the MDA contents were lower in four film-coated walnuts than in uncoated walnuts,and inhibitive effects of MDA production were in a descending order of SPI-Xyl film>EWP-Xyl film>SPI film>EWP film. The DPPH radical scavenging rate of the walnuts coated by SPI-Xyl film was the highest,and there was no significant difference among other three films. In conclusion,the walnuts’ lipid peroxidation was inhibited by four different protein films with a descending order of SPI-Xyl film>EWP-Xyl film>SPI film>EWP film.
egg white protein film;soy protein isolate film;Maillard reaction products film;walnut
2014-04-18
强婉丽(1990-),女,硕士研究生,研究方向:蛋白膜制备与应用。
*通讯作者:景浩(1957-),男,博士,教授,主要从事分子营养与食品安全方面的研究。
TS254.1
A
1002-0306(2015)01-0124-07
10.13386/j.issn1002-0306.2015.01.018

