萌芽黑豆中蛋白质组分分子量分布及其抗氧化活性研究
来吉祥,何聪芬,方 云,赵 亚,魏少敏,,*
(1.江南大学,化学与材料工程学院,江苏无锡 214122;2.北京工商大学理学院,北京 100048;3.上海家化联合股份有限公司,上海 200082)
萌芽黑豆中蛋白质组分分子量分布及其抗氧化活性研究
来吉祥1,何聪芬2,方 云1,赵 亚3,魏少敏1,3,*
(1.江南大学,化学与材料工程学院,江苏无锡 214122;2.北京工商大学理学院,北京 100048;3.上海家化联合股份有限公司,上海 200082)
本文目的是研究萌芽黑豆中不同蛋白质组分的分子量分布,以及各组分的抗氧化活性。采用碱提酸沉法获得萌芽黑豆中的蛋白质,通过硫酸铵盐析法逐级分离各蛋白质组分,SDS-PAGE法测定各蛋白质组分分子量分布,并从清除自由基和抗人皮肤成纤维细胞氧化损伤两个方面研究了各蛋白质组分的抗氧化活性。萌芽黑豆中蛋白质组分可以集中分离为三个部分,其分子量分布为140.0~166.0、45.0~72.0、17.0~23.0ku;清除自由基和抗人皮肤成纤维细胞氧化损伤的实验结果均表明分子量在17.0~23.0ku的蛋白质组分具有最优的抗氧化活性,说明低分子量的萌芽黑豆蛋白质具有更强的抗氧化活性。
萌芽黑豆,蛋白质,分子量分布,抗氧化活性
黑豆,又名黑大豆、橹豆、乌豆,味甘性平,具有高蛋白、低热量的特性。在常见的食用豆中,黑豆具有最为显著的抗氧化生物活性[1]。研究发现,黑豆在萌发的过程中,由于酶的作用,其中的蛋白质、多糖和矿物质元素等营养成分会被释放出来,增加人体吸收利用率[2];黄酮类物质也发生了有益的转化[3],皂苷和非糖基化的黄酮醇含量显著增加[4-5];同时,萌发过程能够促进蛋白质分解为氨基酸,有利于提高黑豆的营养价值[6]。黑豆提取物具有强抗氧化功效[7],已有研究发现,黑豆中的抗氧化活性成分主要是多酚类物质[8]、花色苷[9]、酚酸、花青素、异黄酮[10]、肽[11-12]等,目前关于黑豆功效的研究也都是围绕这些活性成分展开的。作者前期研究发现:黑豆经过萌发后,其蛋白质含量和抗氧化活性均发生显著变化,且两者呈正相关变化,其中萌芽初期黑豆(芽长0.5cm)的蛋白质含量最高,这一阶段黑豆萌芽的抗氧化活性也最优异[13],推测是由于萌芽过程促使黑豆中的蛋白质发生了有益的转化,生成小分子量的蛋白质,其生物活性也发生了变化,但目前关于黑豆蛋白质抗氧化活性的研究还鲜见报道。因此,本研究采用硫酸铵盐析法分级分离萌芽黑豆(芽长0.5cm)中的蛋白质,并通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳技术(SDS-PAGE)分析各蛋白质组分的分子量分布,采用清除自由基实验和抗人皮肤成纤维细胞氧化损伤实验对各蛋白质组分的抗氧化活性进行评价,验证萌芽黑豆中蛋白质的抗氧化活性,并研究其中抗氧化活性最强的蛋白质组分及其分子量分布,为黑豆及其萌芽中蛋白质资源的开发利用提供依据。
1 材料与方法
1.1 材料与仪器
黑豆(Soybean(Glycinemaxvar)) 产地河北石家庄,青仁黑豆,当年新豆;1,1-二苯基-2-三硝基苯肼(DPPH),水杨酸,H2O2(3%),噻唑蓝(MTT),二甲基亚砜(DMSO) Sigma公司;DMEM培养基,小牛血清 美国Gibco公司;维生素C,丙酮,苯酚,无水硫酸铵 国药集团化学试剂有限公司。
Spectra Max Plus 384连续光谱扫描式酶标仪 美国Molecular Devices公司;UV2300紫外可见分光光度计 日本岛津公司;4K15高速冷冻离心机 Sigma公司;KQ-400KDB型超声波仪 昆山市超声仪器有限公司;JHBE-50T型闪式提取器 西安太康生物科技有限公司;巧夫人智能型家用豆芽机 瑞安市威鹏家用电器有限公司。
1.2 实验方法
1.2.1 黑豆萌芽过程 选取优质的青仁黑豆,籽粒饱满,色泽乌黑,无虫蛀,无破损,豆长9~10mm,直径约7mm,百粒重约30g左右。称取10g黑豆干种子,用去离子水清洗表面灰尘及细菌,加入去离子水200mL,放置于30℃下浸泡16h,期间每4h换水1次。将泡发的黑豆种子用去离子水清洗干净,均匀摆放在家用豆芽机中,置于黑暗处进行萌发,保持温度在30℃左右。豆芽机可自动喷淋,每60min喷淋一次,每次60s。每24h为豆芽机更换一次去离子水,并对豆芽机和豆芽进行清洗。约36h后黑豆开始萌芽,48h后芽长达0.5cm,采收备用。
1.2.2 蛋白质提取及分离纯化 参考文献方法[14],采用超声辅助水提法提取萌芽黑豆中的蛋白质,按照1∶30的料液比加入去离子水,采用闪式提取器,于40V电压下粉粹3min,室温在40kHz功率下超声提取30min;参考文献,采用碱提酸沉法[15]分离蛋白质:取超声后的萌芽黑豆提取液500mL,用2mol/L的NaOH调整混合物的pH至8.0,匀速搅拌15min,增加蛋白质在碱性溶液中的溶解度,200目纱布过滤,5000r/min离心15min,取上清液,加入稀盐酸调整上清液的pH至4.5,静置20min,待蛋白质充分沉淀后,5000r/min离心15min,用等体积丙酮洗涤沉淀,沉淀在室温下自然干燥,即获得萌芽黑豆蛋白质干粉,备用。
1.2.3 硫酸铵盐析法分级分离蛋白组分 参考文献方法[16-18],取上述萌芽黑豆酸沉蛋白沉淀0.5g,加入25mL蒸馏水制成萌芽黑豆蛋白溶液,分6级调节硫酸铵的饱和度,分别为30%、45%、60%、75%、90%和100%,每一级分离过程中,边搅拌边缓慢加入硫酸铵,直到达到相应的饱和度,充分搅拌后,在4℃冰箱中静置4h,然后在10000r/min条件下离心20min,沉淀即为分级分离的蛋白。将上清液重复上述操作,补加硫酸铵达到相应的下一个饱和度,再次搅拌、静置、离心得沉淀。以此类推,按级不断增大硫酸铵的饱和度,直到100%,对萌芽黑豆水提液中的蛋白质进行分级分离。各分级分离的蛋白质分别溶于5mL去离子水中,采用3500分子量的透析袋透析24h,去除硫酸铵,冷冻干燥获得萌芽黑豆分级蛋白质。每个样品平行测定3次,取平均值作为各蛋白质组分的含量。
1.2.4 蛋白质组分分子量分布测定 参考文献方法[19],利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定蛋白质分子量分布:配制含10%丙烯酰胺的分离胶,凝固后加入含5%丙烯酰胺的浓缩胶,将萌芽黑豆各分级蛋白质组分加入样品缓冲液中,煮沸5min,冷却后各取20μL加入至十二烷基硫酸纳-聚丙烯酰胺凝胶中进行电泳。初始电流8mA,当染料进入分离胶后将电流提高至11mA。电泳结束后将凝胶加入含有考马斯亮蓝R-250的染色液中60℃染色5min,转移至脱色液中脱色。
1.2.5 各组分清除自由基抗氧化活性
1.2.5.1 清除羟基自由基(OH·)活性 采用水杨酸法[20]检测萌芽黑豆蛋白质组分清除OH·的活性。在10mL比色管中加入2mmol/L FeSO4溶液3mL、6mmol/L水杨酸溶液3mL、5mg/mL萌芽黑豆蛋白质水溶液1mL,摇匀;接着加入1mmol/L H2O2溶液3mL,摇匀,启动反应;于37℃水浴保温60min后取出,在510nm处测其吸光度;以维生素C作为阳性对照,样品对OH·清除率的计算公式如下:
Y(%)=(A0-A1+A2)/A0×100
式(1)
式中:Y为样品对OH·清除率;A0为空白组吸光度值;A1为样品组吸光度值;A2为样品本底吸光度值。每个样品平行测定3次,结果以平均值±标准差表示。
Y(%)=(1-V1/V0)×100
式(2)
1.2.5.3 清除DPPH自由基(DPPH·)活性 1,1-二苯基-2-三硝基苯肼(DPPH·)是一种稳定的有机自由基,可用来评价样品清除自由基的能力。以维生素C作为阳性对照,参考文献[22-23]的方法,取3mL的5mg/mL萌芽黑豆蛋白质水溶液于10mL试管中,加入3mL体积的2×10-4mol/L的DPPH溶液,快速混匀;向3mL DPPH 溶液中加入3mL无水乙醇,记录吸光值为A0,即空白对照;室温避光放置30min;用分光光度计测量其在517nm处的吸光值,记录为A1,样品对DPPH·清除率的计算公式如下:
Y(%)=(A0-A1+A2)/A0×100
式(3)
式中:Y为样品对DPPH·清除率,A0为空白组吸光度值,A1为样品组吸光度值,A2为样品本底吸光度值。每个样品平行测定3次,结果以平均值±标准差表示。
1.2.6 抗H2O2诱导的人皮肤成纤维细胞氧化损伤实验 通过MTT法检测萌芽黑豆蛋白质组分抗H2O2诱导的人皮肤成纤维细胞氧化损伤的活性。参考任德成等人[24]的实验方法,采用第3代人皮肤成纤维细胞,运用紫外分光光度法,在570nm波长下检测细胞的存活率。细胞分为三组:(1)H2O2预先作用组——将人皮肤成纤维细胞预先与浓度为800μmol/L的H2O2孵育4h,然后再与萌芽黑豆蛋白质(1mg/mL)孵育12h;(2)同时作用组——将萌芽黑豆各蛋白质组分(1mg/mL)与浓度为800μmol/L的H2O2同时作用于人皮肤成纤维细胞,孵育12h;(3)蛋白质预先孵育组——将人皮肤成纤维细胞预先与萌芽黑豆蛋白质(1mg/mL)孵育12h,然后再与浓度为800μmol/L的H2O2作用4h。
MTT法检测细胞存活率 人皮肤成纤维细胞,在37℃,5% CO2条件下培养于含10%小牛血清的DMEM培养基中,采用第3代的细胞进行实验,接种密度为5×104cells/mL,培养24h,细胞融合达到70%。用含有萌芽黑豆蛋白质组分的成纤维细胞生长培养基制成细胞悬液,培养基为空白对照,细胞密度为5×104cells/mL,接种在96孔细胞培养板上,每孔200μL(1×104cells/孔)。在37℃,5% CO2的恒温培养箱中培养。实验结束前4h,每孔加入MTT 20μL,培养4h后弃上清,然后每孔加入150μL二甲基亚砜(DMSO)震荡15min,使结晶充分溶解。置于酶联免疫检测仪上,以波长570nm测定各孔吸光度值。细胞存活率的计算公式如下:
Y(%)=(A1-A0)/(A2-A0)×100
式(4)
式中:Y为细胞存活率,A0为培养基体系本底吸光度值,A1为样品组吸光度值,A2为非氧化损伤组吸光度值。每1种蛋白质组分设6个复孔,重复2次实验,结果以平均值±标准差表示。
1.2.7 数据分析 应用统计学软件SPSS v19.0分析处理实验数据,采用组间单因素方差分析进行数据处理,当p<0.05时,认为在统计学上有显著性差异。
2 结果与讨论
2.1 蛋白质组分分子量分布
萌芽黑豆蛋白质组分的分子量分布如表1所示:
表1结果表明:萌芽黑豆中各蛋白质组分的分子量主要集中分布在140.0~166.0、45.0~72.0、17.0~23.0ku三个范围内。随着硫酸铵饱和度的升高,大分子量的蛋白质首先沉淀出来,主要集中在140.0~166.0ku,含量约占总蛋白的9.8%;然后是分子量45.0~72.0ku的蛋白质,含量最多,约占总蛋白的35.4%;最后沉淀的是小分子量的蛋白质,17.0~23.0ku,含量约占总蛋白的27.7%。
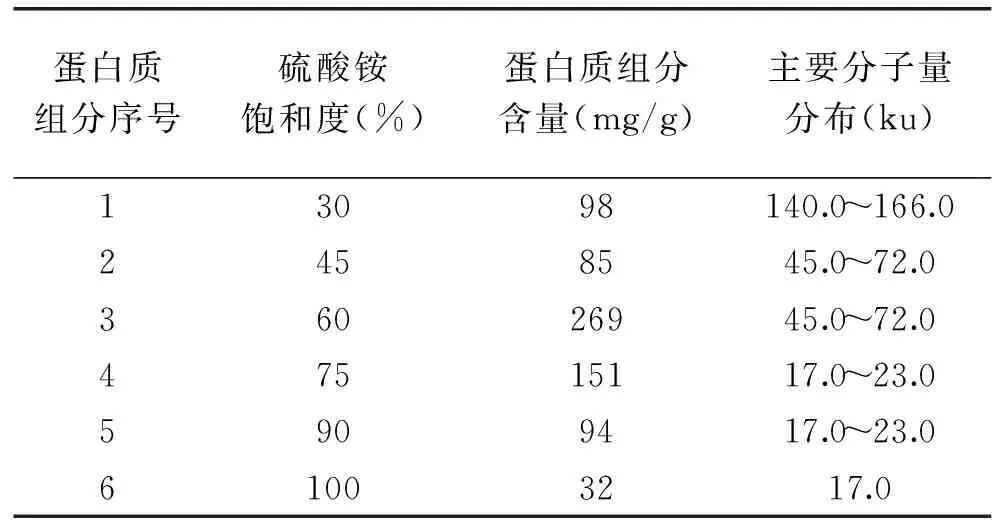
表1 萌芽黑豆分级分离蛋白质的分子量分布Table 1 Molecular weight distribution of proteins in germinal black soybeans
2.2 蛋白质组分清除自由基活性
2.2.1 清除羟基自由基活性 萌芽黑豆中蛋白质对羟基自由基的清除活性如图1所示:萌芽黑豆中的蛋白质对羟基自由基具有清除活性,但不同分子量范围蛋白质的清除活性有显著差异,其中小分子量的蛋白质(17.0~23.0ku)对羟基自由基具有最优异的清除活性,显著高于其他分子量的蛋白质(p<0.05)。

图1 萌芽黑豆中蛋白质组分清除羟基自由基活性Fig.1 OH· scavenging activities of proteins in germinal black soybeans
2.2.2 清除超氧阴离子自由基活性 萌芽黑豆中蛋白质对超氧阴离子自由基的清除活性如图2所示:萌芽黑豆蛋白质对超氧阴离子自由基具有清除活性,其中小分子量蛋白质(17.0~23.0ku)的清除活性最佳,清除率可达70%以上,与其他分子量的蛋白质相比具有显著性差异(p<0.05)。

图2 萌芽黑豆中蛋白质组分清除超氧阴离子自由基活性Fig.· scavenging activities of proteins in germinal black soybeans
2.2.3 清除DPPH自由基活性 萌芽黑豆中蛋白质对DPPH自由基的清除活性如图3所示:萌芽黑豆蛋白质可以清除DPPH自由基,其中小分子量蛋白质(17.0~23.0ku)的清除活性最佳,显著高于其他分子量的蛋白质(p<0.05)。

图3 萌芽黑豆中蛋白质组分清除DPPH自由基活性Fig.3 DPPH· scavenging activities of proteins in germinal black soybeans
综合考察萌芽黑豆中蛋白质对羟基自由基,超氧阴离子自由基和DPPH自由基的清除活性研究结果,发现萌芽黑豆蛋白质具有清除自由基活性,低分子量的黑豆蛋白质(17.0~23.0ku)具有更强的抗氧化活性。推测可能是由于小分子量的蛋白质空间结构简单,具有更多的活性基团,易于与自由基接触,发挥抗氧化活性。已有研究发现,与大分子量多肽相比,小分子量的黑豆肽和大豆肽也具有更优的清除自由基活性[25-26];相关研究发现,随着分子量减小,大豆肽对DPPH自由基的清除效果明显增高,其中分子量小于5000u的小肽具有最显著的抗氧化活性[27];低分子量的大豆肽(5000~10000u)较其他分子量段的多肽具有更强的抗癌活性[28]。综合分析可能有两方面的原因:一方面与蛋白质或多肽中特定的氨基酸组成有关,特定的氨基酸残基具有更好的电子供体;另一方面蛋白质或多肽中特定的氨基酸序列也与抗氧化活性有密切关系[29]。
2.3 抵御H2O2诱导的人皮肤成纤维细胞氧化损伤的作用
通过MTT法检测萌芽黑豆蛋白质对H2O2诱导的人皮肤成纤维细胞损伤的作用结果如图4所示:

图4 萌芽黑豆蛋白质对H2O2引起的 人皮肤成纤维细胞损伤的作用Fig.4 Effect of proteins of black soybean on the human skin fibroblast damnified by H2O2注:a.H2O2预先作用组,b.同时作用组,c.蛋白质预先孵育组。
与空白对照相比,H2O2预先作用组中的细胞活力无显著增加,但也没有显著下降。人皮肤成纤维细胞与H2O2预先孵育时,已经受到了氧化损伤,细胞存活率下降,再加入萌芽黑豆蛋白质,无法在短时间内消除H2O2引起的氧化损伤。在同时作用组中1~6各组萌芽黑豆蛋白质孵育的人皮肤成纤维细胞,细胞存活率与阴性对照接近,无显著变化。这说明萌芽黑豆蛋白质和H2O2一起作用于人皮肤成纤维细胞时,细胞仍然遭受了H2O2的氧化损伤,萌芽黑豆蛋白质清除了一部分自由基,但保护细胞的作用不强。在蛋白质预先孵育组中细胞存活率显著提高(p<0.05),说明使用萌芽黑豆蛋白质预先孵育细胞能够显著抵抗H2O2引起的氧化损伤。分析原因,可能是因为萌芽黑豆蛋白质在孵育的过程中,促进了人皮肤成纤维细胞的增殖,增强了细胞活力;然后再与H2O2作用时,萌芽黑豆蛋白质清除了H2O2产生的自由基,抵御了氧化损伤,使得整体细胞活力增强,细胞存活率增高。
综合分析H2O2预先作用组,同时作用组,蛋白质预先孵育组的实验结果,参考肖健等人[30]的报道,对三组数据进行比较研究,结果表明:H2O2预先作用组和同时作用组中,细胞存活率与空白对照均无显著差异,但是,同时作用组略优于H2O2预先作用组;蛋白质预先孵育组中细胞的存活率达到50%以上,其中,当萌芽黑豆蛋白质的分子量在17.0~23.0ku时,细胞的存活率最高,可达68.5%±5.26%,超出空白对照组(53.5%),明显优于其他分子量范围的蛋白质(p<0.05)。实验结果表明,萌芽黑豆蛋白质抵抗H2O2引起的人皮肤成纤维细胞损伤的作用包括两个方面:一是直接的化学反应,通过直接清除自由基来进行;二是萌芽黑豆蛋白质促进了人皮肤成纤维细胞的增殖,增加了细胞活力。萌芽黑豆蛋白质为人皮肤成纤维细胞的生长与增殖提供了营养和物质基础,增强了细胞活力。如果增加萌芽黑豆蛋白质的添加量,延长孵育时间,将可能会促进人皮肤成纤维细胞的增殖,提高细胞存活率。
3 结论
本研究以萌芽黑豆(芽长0.5cm)中的蛋白质为研究对象,通过清除自由基和抵御细胞氧化损伤实验证实萌芽黑豆中的蛋白质具有抗氧化活性;通过SDS-PAGE分析发现萌芽黑豆中各蛋白质组分的分子量主要集中分布在140.0~166.0、45.0~72.0、17.0~23.0ku三个范围内,其中17.0~23.0ku范围内的蛋白质组分具有最优的清除自由基活性和抵御H2O2诱导的人皮肤成纤维细胞氧化损伤的作用。研究发现,萌芽黑豆蛋白质抵御H2O2诱导的人皮肤成纤维细胞氧化损伤的作用主要包括两个方面:一是直接清除自由基,二是促进细胞增殖,增加细胞活力。通过对萌芽黑豆蛋白质分子量分布及其各组分抗氧化活性的研究,为黑豆及其萌芽中蛋白质资源的开发利用提供了依据。
[1]Xu B J,Chang K C. Comparative study on antiproliferation properties and cellular antioxidant activities of commonly consumed food legumes against nine human cancer cell lines[J]. Food Chemistry,2012,134(3):1287-1296.
[2]王莘,王艳梅,苏玉春,等. 黑大豆萌发期功能性营养成分测定与分析[J]. 食品工业科技,2004,25(4):132-133,88.
[3]孙肖青,孙筱林. 黑豆萌发期游离异黄酮苷元成分的测定[J]. 山东农业科学,2008(8):110-111.
[4]Guajardo-Flores D,Garcia-Patino M,Serna-Guerrero D,etal. Characterization and quantification of saponins and flavonoids in sprouts,seed coats and cotyledons of germinated black beans[J]. Food Chemistry,2012,134(3):1312-1319.
[5]翟玮玮. 黑豆发芽条件及其异黄酮提取物特性研究[J].食品科学,2008,29(9):186-189.
[6]翟玮玮,焦宇知. 黑豆发芽过程中蛋白质及γ-氨基丁酸的变化及发芽条件的优化[J]. 食品科学,2009,30(19):51-54.
[7]王萌,阮美娟. 黑豆提取物抗氧化性的研究[J]. 食品科技,2007(3):123-125.
[8]张瑞芬,黄昉,徐志宏,等. 黑豆皮提取物抗氧化和延缓衰老作用研究[J]. 营养学报,2007,29(2):160-162.
[9]王玉丽,任海伟,李志忠,等. 用清除DPPH自由基法评价药黑豆色素的抗氧化能力[J]. 食品工业科技,2009,30(8):102-105.
[10]Xu B J,Chang K C. Antioxidant capacity of seed coat,dehulled bean,and whole black soybeans in relation to their distributions of total phenolics,phenolic acids,anthocyanins,and isoflavones[J]. Journal of Agricultural and Food Chemistry,2008,56(18):8365-8373.
[11]任海伟,王常青,宋育璇. 黑豆多肽分离及其抗氧化活性的研究[J]. 天然产物研究与开发,2009(21):136-139.
[12]任海伟,王常青. 黑豆低聚肽的抗氧化活性评价及其氨基酸组成分析[J]. 食品与发酵工业,2009,35(9):46-50.
[13]Lai J X,Xin C,Zhao Y,etal. Study of Active Ingredients in Black Soybean Sprouts and Their Safety in Cosmetic Use[J]. Molecules,2012(17):11669-11679.
[14]李大婧,宋江峰,刘春泉,等. 超声波辅助提取黑豆皮色素工艺优化[J]. 农业工程学报,2009,25(2):273-279.
[15]李校堃,袁辉. 药物蛋白质分离纯化技术[M]. 北京:化学工业出版社,2005:42-48.
[16]郭福旺,阮美娟,王朝臣,等. 大豆蛋白小分子肽的制备及其分离纯化[J]. 食品工业,2008(1):4-5.
[17]殷涌光,刘静波. 大豆食品工艺学[M]. 北京:化学工业出版社,2006.
[18]Agric J. Aggregation of Peptides during Hydrolysis as a Cause of Reduced Enzymatic Extractability of soybean Meal proteins[J].Food Chemistry,2002(50):4512-4519.
[19]张煜,王建英,王晶妍. 硫酸铵盐析法分级分离大豆酸沉蛋白[J]. 河南师范大学学报:自然科学版,2011,39(6):99-100.
[20]刘骏. 结晶紫分光光度法测定Fenton反应产生的羟自由基[J]. 武汉工业学院学报,2001,24(2):53-55.
[21]王勇,庆伟霞,杨玉霞,等. 分光光度法测定二氢黄酮化合物对超氧阴离子自由基的清除作用[J]. 化学研究,2013,24(5):441-443.
[22]Yildirim A,Mavi A,Kara A A. Determination of antioxidant and antimicrobial activities of Rumex crispus L. extracts[J]. Journal of Agricultural and Food Chemistry,2001,49(8):4083-4089.
[23]赵进,来吉祥,何聪芬,等. 红景天活性成分的提取工艺及其美容功效研究[J]. 日用化学工业,2009,12(6):402-404.
[24]任德成,杜冠华,张均田. 总丹酚酸对过氧化氢诱导内皮细胞损伤的抑制作用[J]. 中国药理学与毒理学杂志,2003,17(5):333-337.
[25]刘恩岐,李华,巫永华,等. 黑豆肽的抗氧化活性与缓解体力疲劳作用[J]. 食品科学,2013,34(11):273-277.
[26]张莉莉,严群芳,王恬. 大豆生物活性肽的分离及其抗氧化活性研究[J]. 食品科学,2007,28(5):208-210.
[27]邓成萍,薛文通,孙晓琳,等. 不同分子量段大豆多肽功能特性的研究[J]. 食品科学,2006,27(5):109-112.
[28]葛锡娟,赵城彬,杨丽丽,等. 大豆抗癌肽的分离纯化及分子量分布[J]. 食品工业科技,2012,33(3):99-101,105.
[29]陈敏,敖静,李博. 分子量对酪蛋白多肽抗氧化活性的影响[J]. 食品工业科技,2012,33(9):95-99.
[30]肖健,李校堃,郭建红,等. 姜黄素对过氧化氢诱导的血管内皮细胞损伤的双重作用[J]. 中国临床药理学与治疗学,2005,10(12):1376-1379.
Study on molecular weight distribution and antioxidant activity of protein components in germinal black soybean
LAI Ji-xiang1,HE Cong-fen2,FANG Yun1,ZHAO Ya3,WEI Shao-min1,3,*
(1. School of Chemical and Material Engineering,Jiangnan University,Wuxi 214122,China;2. School of Science,Beijing Technology and Business University,Beijing 100048,China;3. Shanghai Jahwa United Co. Ltd.,Shanghai 200082,China)
Molecular weight distribution and antioxidant activities of each protein composition in germinal black soybean were studied. Protein components in germinal black soybean were extracted and separated by ammonium sulfate method. Molecular weight distribution of each protein component was measured using SDS-PAGE method,and antioxidant activity were studied by free radicals scavenging test and anti-H2O2-induced damaged skin fibroblast test. Molecular weight of proteins in germinal black soybean was concentrated in 140.0~166.0,45.0~72.0,17.0~23.0ku. Results of antioxidant activity tests showed that the protein component of 17.0~23.0ku molecular weight had the best antioxidant activity indicating that low molecular weight germinal black soybean protein had stronger antioxidant activity.
germinal black soybean;protein;molecular weight distribution;antioxidant activity
2014-02-18
来吉祥(1983-),男,博士研究生,研究方向:植物源化妆品功效添加剂研究。
*通讯作者:魏少敏(1952-),男,博士,教授,主要从事精细化学品科学研究。
国家自然科学基金(21276113);国家科技支撑计划项目(2011BAD23B03)。
TS214.9
A
1002-0306(2015)01-0049-05
10.13386/j.issn1002-0306.2015.01.001

