异氟烷通过激活Calpain影响大鼠海马神经干细胞的增殖与分化*
张建芳, 陈 欣, 王 伟, 方 茜, 罗爱林, 周碧云
异氟烷通过激活Calpain影响大鼠海马神经干细胞的增殖与分化*
张建芳, 陈 欣, 王 伟, 方 茜, 罗爱林, 周碧云△
华中科技大学同济医学院附属同济医院麻醉科,武汉 430030
目的 探讨异氟烷影响神经干细胞(NSCs)增殖与分化的机制。方法 原代培养SD新生大鼠(出生1d内)海马NSCs,取传至第2代细胞,将其随机分为4组(n=5):空白对照组(CON),给予含有21%O2和5%CO2的混合气体;异氟烷组(ISO),给予3.4%异氟烷,干预6h;Calpeptin组(CP),给予10μmol/L Calpeptin和含有21%O2和5%CO2的混合气体,干预6h;异氟烷+Calpeptin组(ISO+CP),给予10μmol/L Calpeptin和3.4%异氟烷,干预6h。BrdU检测NSCs增殖,Western blot检测GFAP、Tuj-1、αⅡ-spectrin及其裂解产物SBDP145的蛋白水平。结果 与CON组相比,ISO组在干预后0、12、24h时BrdU+细胞数目明显减少,说明异氟烷抑制了NSCs增殖并有后遗效应;ISO组SBDP145表达明显上调,说明异氟烷可上调Calpain活性。掺入Calpain抑制剂Calpeptin后,与ISO组相比,ISO+CP组SBDP145表达量明显下降,表明Calpeptin可拮抗异氟烷致Calpain活性增强的作用;ISO+CP组BrdU+细胞数目增多,Calpeptin减弱了异氟烷抑制NSCs增殖的作用。与CON组相比,ISO组GFAP表达水平上调,Tuj-1水平无明显改变;CP组GFAP水平无明显改变,而Tuj-1表达上调。与ISO组相比,ISO+CP组GFAP水平降低,Tuj-1水平无明显改变,表明异氟烷促进NSCs分化为胶质细胞,而Calpeptin可拮抗异氟烷的这种作用。结论 异氟烷通过激活Calpain信号通路抑制NSCs的自我更新并促进NSCs分化为胶质细胞。
Calpain; 异氟烷; 神经干细胞; 细胞增殖; 细胞分化
吸入麻醉药广泛应用于小儿麻醉。然而近年临床及基础研究表明,全身麻醉可导致婴幼儿学习记忆功能障碍[1]。在大脑发育及学习记忆功能正常形成中,神经干细胞(neural stem cells,NSCs)的增殖与分化起着至关重要的作用[2]。已有研究证实,异氟烷导致NSCs细胞内钙超载,影响NSCs的增殖与分化,可能是导致婴幼儿学习记忆功能障碍的重要原因[3]。Calpain是细胞内普遍存在的一类Ca2+依赖的半胱氨酸蛋白酶,可通过调节NSCs自我更新及分化能力[4],在神经退行性疾病病理生理过程及学习记忆功能形成中发挥重要作用。因此本研究旨在探讨异氟烷影响NSCs增殖与分化是否与Calpain信号通路有关。
1 材料与方法
1.1 主要材料
SD大鼠由华中科技大学同济医学院实验动物学部提供。DMEM/F12(1∶1)、成纤维细胞生长因子(bFGF)、表皮细胞生长因子(EGF)、B27、Accutase、层粘连蛋白购自Gibco公司,多聚鸟氨酸、Calpeptin、BrdU购自Sigma公司,抗BrdU抗体购自Cell Signaling Technology公司,抗巢蛋白(nestin)抗体、抗神经Ⅲβ-微管蛋白(Tuj-1)抗体购自Abcam公司,抗神经胶质原纤维酸性蛋白(GFAP)抗体购自Invitrogen公司,抗αⅡ-spectrin抗体购自上海Abclonal公司,抗β-actin抗体购自武汉博士德生物工程有限公司,异氟烷购自Baxter公司。
1.2 NSCs分离及培养
参照文献[5]方法,75%乙醇消毒新生SD大鼠(出生1d内)后,取其海马组织,放入DMEM/F12(1∶1),仔细剥离海马组织,剪碎,用1mL枪头吹打成细胞悬液,400目滤网过滤,1 000r/min离心5 min,加入增殖培养液[DMEM/F12(1∶1)、2%B27、20ng/mL bFGF、20ng/mL EGF]重悬细胞,锥虫蓝染色,细胞计数,调整密度为5×105/mL,转入25 cm2培养瓶中培养。观察神经球形成大小,当NSCs形成的神经球直径达100μm时,轻轻振荡培养瓶,收集神经球至离心管,1 000r/min离心5min。弃去培养液,加入Accutase消化液,轻轻吹打均匀,37℃孵育5min,用1mL枪头反复轻轻吹打至单细胞悬液,加入新鲜培养液,1 000r/min离心5min。锥虫蓝染色计数,调整细胞密度为5×104/mL进行传代培养。后续实验均使用第2代NSCs。
1.3 NSCs诱导分化培养
用10μg/mL多聚鸟氨酸和10μg/mL层粘连蛋白相继包被24孔板或6孔板。将NSCs接种至培养板,加入NSCs分化培养液[DMEM/F12(1∶1)、2%B27、1%FBS、1%青链霉素],约7~9d完成分化培养,收集并裂解细胞提取总蛋白,用Western blot检测神经元标志物Tuj-1和胶质细胞标志物GFAP蛋白,鉴定分化细胞。
1.4 实验分组及药物处理
实验随机分为4组(n=5),包括对照组(CON)、异氟烷组(ISO)、Calpeptin组(CP)、异氟烷+Calpeptin组(ISO+CP)。CON组:用含有21% O2和5%CO2的混合气体处理6h;ISO组:用3.4%异氟烷处理6h;CP组:于麻醉前30min向培养液中加入10μmol/L Calpeptin,用含有21%O2和5% CO2的混合气体处理6h;ISO+CP组:于麻醉前30min向培养液中加入10μmol/L Calpeptin,用3.4%异氟烷处理6h。药物干预完成后,立即更换新鲜增殖培养液。
1.5 NSCs增殖能力检测
5-溴脱氧尿嘧啶核苷(BrdU)在DNA合成期可代替胸腺嘧啶合成DNA,而后利用抗BrdU单克隆抗体进行免疫荧光染色,可显示增殖细胞。将神经球消化为单个NSCs悬液后,接种至包被过的含盖玻片的24孔板,待NSCs完全贴壁后,于麻醉开始前30min,各组细胞培养液中掺入10μmol/L BrdU。待异氟烷麻醉完成后,立即更换新鲜增殖培养液。每个样本随机观察5个视野。记录BrdU+细胞数和细胞总数(DAPI+),以BrdU+细胞数/细胞总数(DAPI+)反映NSCs增殖能力。
1.6 免疫荧光化学检测
取出盖玻片,4%多聚甲醛固定20min,PBS洗3×5min,封闭液(10%山羊血清+0.3%Triton-100)室温封闭1h,加入一抗(抗BrdU,抗nestin),4℃过夜。次日,弃一抗,PBS漂洗3×5min,加FITC标记的荧光二抗,室温孵育2h,加DAPI染色5min,(PBS+0.1%Twen-20)洗3×10min。50%甘油封片,荧光显微镜下观察。
1.7 Western blot检测
各组在实验药物干预完成后,加入RIPA裂解液裂解细胞,提取总蛋白。采用聚丙烯酰胺凝胶电泳法分离并检测GFAP、Tuj-1、αⅡ-spectrin及裂解片段SBDP145蛋白水平。采用Image Lab 3.0软件进行灰度分析。以GFAP、Tuj-1、αⅡ-spectrin、SBDP145与β-actin灰度值的比值反映其表达水平。
1.8 统计学分析
计量资料以均数±标准差(¯x±s)表示,采用SPSS 16.0软件进行数据分析。组间均数比较采用单因素方差分析。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 原代NSCs培养及鉴定
取新生SD大鼠(出生1d内)海马组织,分离培养NSCs。NSCs呈悬浮生长,约3d左右形成神经球,传代后行免疫荧光化学染色检测NSCs标志物nestin,红色为阳性,第2代NSCs阳性率为(94.24 ±3.99)%。见图1。

图1 悬浮生长的NSCs球(A,×100)及NSCs标志物nestin染色(B,×200)Fig.1 NSCs in suspension(A,×100)and staining of NSCs marker nestin(B,×200)
2.2 异氟烷抑制NSCs的增殖
行免疫荧光化学染色检测BrdU,结果发现ISO组BrdU标记的NSCs的数目相对于CON组明显减少,并且持续至24h(P<0.05),如图2所示。
2.3 异氟烷上调NSCs内Calpain的活性
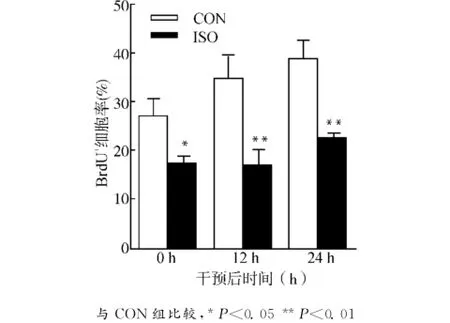
图2 异氟烷抑制NSCs的增殖并具时间依赖性Fig.2 Time-dependent inhibition of isoflurane on NSCs proliferation
收集各组NSCs裂解提取总蛋白后行Western blot检测αⅡ-spectrin及其裂解物145kD片段(SBDP145)蛋白水平。αⅡ-spectrin是普遍存在的细胞骨架蛋白,被Calpain特异裂解为150/145kD片段,150kD随后又继续被Calpain裂解为145kD片段,SBDP145水平的高低用来反映Calpain的活性强度[6]。与CON组相比,ISO组在干预后0h和12h,SBDP145水平明显升高(P<0.01),24h时无明显改变(P>0.05),表明异氟烷作用于NSCs后,其胞内Calpain活性明显增强并且持续至少12h。见图3。
2.4 Calpeptin减弱异氟烷致Calpain活性增强的作用
Calpeptin(CP)是Calpain的有效抑制剂,可抑制Calpain活性[7]。与CON组相比,CP组SBPD145水平降低(P<0.01);与ISO组相比,ISO+CP组SBDP145水平明显下降(P<0.01)。见图4。

图3 异氟烷干预后增强Calpian活性。Fig.3 Increased calpain activities after intervention with isoflurane

图4 Calpeptin减弱异氟烷致Calpain活性增强的作用Fig.4 Calpeptin inhibited isoflurane-induced enhanced activities of Calpain
2.5 Calpeptin可减弱异氟烷抑制NSCs增殖的作用
掺入Calpeptin后,再检测NSCs增殖发现:与CON组相比,ISO组BrdU+细胞数目显著减少(P<0.01),而CP组无明显差异;与ISO组相比,ISO+CP组BrdU+细胞数目增加(P<0.05)。见图5。
2.6 异氟烷促进NSCs向胶质细胞分化
待NSCs分化完成后,检测胶质细胞标志物GFAP和神经元标志物Tuj-1的表达变化。与CON组相比,ISO组GFAP水平升高(P<0.05),Tuj-1水平无明显改变(P>0.05);CP组GFAP水平无明显改变(P>0.05),而Tuj-1水平升高(P<0.05)。与ISO组相比,ISO+CP组GFAP水平降低(P<0.01),Tuj-1水平无明显改变(P>0.05)。见图6。
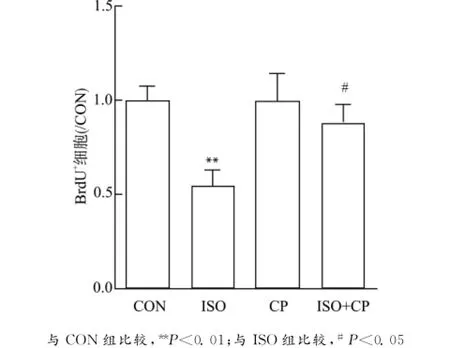
图5 Calpeptin减弱异氟烷抑制NSCs增殖的作用Fig.5 Calpeptin attenuated the antiproliferative effects of isoflurane
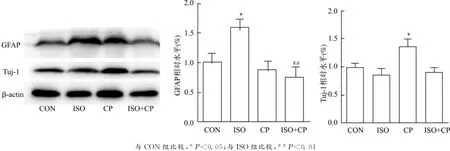
图6 异氟烷促进NSCs向胶质细胞分化Fig.6 Isoflurane significantly promoted the differentiation of NSCs to gliacytes
3 讨论
NSCs是中枢神经系统中具有自我更新和分化能力的细胞,可最终分化形成星形胶质细胞、少突神经胶质细胞和神经元[2]。NSCs在大脑的发育和学习记忆功能等生理过程中发挥着至关重要的作用。麻醉药物引起的认知功能障碍和行为改变可能是通过影响NSCs功能或形态而实现的。而目前体内外实验研究证实异氟烷可抑制NSCs的自我更新能力,改变NSCs的分化潜能[8]。参照文献[9-10],本研究选用3.4%异氟烷处理NSCs 6h,探讨Calpain在异氟烷对NSCs增殖与分化影响中的作用。
我们研究发现3.4%异氟烷作用于NSCs 6h后,BrdU+细胞数目减少,并持续24h之久,表明异氟烷可有效抑制NSCs的增殖能力,这与先前研究结果一致。与此同时,我们的研究结果发现,异氟烷处理可显著升高NSCs中Calpain的活性且持续12 h。而Calpain抑制剂Calpeptin不仅可拮抗异氟烷所致的Calpain活性增强,亦可显著减弱异氟烷所致的增殖功能抑制。这就说明异氟烷可能通过增加NSCs中Calpain的活性导致NSCs增殖功能抑制。
诱导NSCs分化完成后,我们发现异氟烷可显著增加GFAP的表达,而不影响Tuj-1的表达,说明异氟烷可促进NSCs更多地向星形胶质细胞分化。而Calpeptin可显著拮抗异氟烷所致星形胶质细胞分化增加,说明异氟烷可能通过增加NSCs中Calpain的活性导致了NSCs更多地向星形胶质细胞分化。
研究表明,成年大鼠学习记忆能力与海马NSCs数量和功能密切相关[11]。而发育期NSCs自我更新能力下降或过度的分化均能导致成年海马NSCs数量减少[12-13]。本研究与前期研究结果一致,表明了异氟烷可通过诱导发育期海马NSCs增殖能力减弱和分化增加,最终导致海马NSCs数量减少。而Calpain可通过调节NSCs细胞周期[4],发挥抑制NSCs增殖和促进分化的作用。本实验结果表明,异氟烷可能通过诱发细胞内钙超载,激活细胞内的Calpain相关信号通路,从而抑制NSCs增殖和促进分化。抑制Calpain信号通路可能是保护异氟烷致发育期NSCs毒性的重要手段。
[1] Zhang B,Tian M,Zhen Y,et al.The effects of isoflurane and desflurane on cognitive function in humans[J].Anesth Analg,2012,114(2):410-415.
[2] Gage F H.Mammalian neural stem cells[J].Science,2000,287(5457):1433-1438.
[3] Zhao X,Yang Z,Liang G,et al.Dual effects of isoflurane on proliferation,differentiation,and survival in human neuroprogenitor cells[J].Anesthesiology,2013,118(3):537-549.
[4] Santos D M,Xavier J M,Morgado A L,et al.Distinct regulatory functions of Calpain 1and 2during neural stem cell selfrenewal and differentiation[J].PLoS One,2012,7(3): e33468.
[5] Guo W,Patzlaff N E,Jobe E M,et al.Isolation of multipotent neural stem or progenitor cells from both the dentate gyrus and subventricular zone of a single adult mouse[J].Nat Protoc,2012,7(11):2005-2012.
[6] Wang K K.Calpain and caspase:can you tell the difference?,by kevin K.W.WangVol.23,pp.20-26[J].Trends Neurosci,2000,23(2):59.
[7] Nozaki K,Das A,Ray S K,et al.Calpeptin attenuated apoptosis and intracellular inflammatory changes in muscle cells[J].J Neurosci Res,2011,89(4):536-543.
[8] Culley D J,Boyd J D,Palanisamy A,et al.Isoflurane decreases self-renewal capacity of rat cultured neural stem cells[J].Anesthesiology,2011,115(4):754-763.
[9] Stratmann G,Sall J W,May L D,et al.Isoflurane differentially affects neurogenesis and long-term neurocognitive function in 60-day-old and 7-day-old rats[J].Anesthesiology,2009,110(4):834-848.
[10] Sall J W,Stratmann G,Leong J,et al.Isoflurane inhibits growth but does not cause cell death in hippocampal neural precursor cells grown in culture[J].Anesthesiology,2009,110(4):826-833.
[11] Bonaguidi M A,Song J,Ming G L,et al.A unifying hypothesis on mammalian neural stem cell properties in the adult hippocampus[J].Curr Opin Neurobiol,2012,22(5):754-761.
[12] Bonaguidi M A,Wheeler M A,Shapiro J S,et al.In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics[J].Cell,2011,145(7):1142-1155.
[13] 张运康,陶连方.电针对脑缺血再灌注大鼠学习记忆能力及血管内皮生长因子表达的影响[J].华中科技大学学报:医学版,2013,42(1):70-73.
(2015-01-16 收稿)
Isoflurane Affects Proliferation and Differentiation of Neural Stem Cells by Activating Calpain
Zhang Jianfang,Chen Xin,Wang Wei et al
Department of Anesthesiology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To investigate the mechanism by which isoflurane(ISO)affects the proliferation and differentiation of neural stem cells(NSCs).Methods NSCs were isolated from neonatal Sprague Dawley rats(postnatal day 1)and cultured.NSCs of passage 2were used and divided into 4groups(n=5):control group,in which NSCs were treated with 5%CO2and 21%O2for 6h;ISO group,in which 3.4%ISO was given for intervention for 6h;calpeptin(CP)group,in which NSCs were treated with 10μmol/L CP and 5%CO2,21%O2for 6h;ISO+CP group,in which 10μmol/L CP and 3.4%ISO were given for 6h.The proliferation of NSCs was detected by using 5-bromodeoxyuridine(BrdU).The expression levels of GFAP,Tuj-1,αⅡ-spectrin and SBDP145were determined by Western blot.Results The number of BrdU+cells was significantly decreased at 0,12,24h in ISO group when compared with control group,suggesting that ISO can inhibit the proliferation of NSCs.The expression of SBDP145was conspicuously upregulated in ISO group,indicating that ISO can increase the activity of calpain.After treatment with CP,the expression of SBDP145was markedly decreased in ISO+CP group when compared with ISO group,suggesting that CP can suppress the ISO-induced increase of calpain activity.The number of BrdU+cells was increased in ISO+CP group,suggesting that CP could block antiproliferative effect of ISO on NSCs.The expression levels of GFAP were significantly increased in ISO group when compared with control group and there was no significant difference in Tuj-1expression between the two groups.Be contrast,cells in CP group experienced no significant change of GFAP but significant upregulation of Tuj-1.The expression level of GFAP was reduced while Tuj-1had no significant change in ISO+CP group when compared with ISO group,which suggested that ISO can promote the differentiation of NSCs to gliocytes and such ISO-induced effect could be blocked by CP.Conclusion ISO inhibits the self-renewal capacity of NSCs and promotes the differentiation of NSCs to gliocytes by activating calpain signaling pathways.
calpain; isoflurane; neural stem cells; proliferation; differentiation
R329.54
10.3870/j.issn.1672-0741.2015.03.004
*国家自然科学基金资助项目(No.81200880)
张建芳,女,1987年生,硕士研究生,E-mail:zhangjianfang815@126.com
△通讯作者,Corresponding author,E-mail:biyun.zz@gmail.com

