2-APB体内干预对压力超负荷大鼠左心室心肌肥厚的影响*
王方超, 陈 明, 郝德雄
2-APB体内干预对压力超负荷大鼠左心室心肌肥厚的影响*
王方超, 陈 明△, 郝德雄
重庆医科大学附属第一医院心内科,重庆 400016
目的 探讨瞬时受体通道C亚族1型(TRPC1)阻滞剂2-APB体内干预对压力超负荷诱导的大鼠左心室心肌肥厚的影响。方法 成年雄性SD大鼠18只,体重200~250g,随机分为假手术组、AAC组和AAC+2-APB组(各6只),通过腹主动脉缩窄术(AAC)建立压力超负荷模型。术后AAC+2-APB组大鼠每2天给予2-APB腹腔注射(2.5 mg/kg),共4周。4周后检测各组大鼠血压、左心室质量指数(LVMI)、左心室心肌细胞横径(LVTDM);采用免疫组化、Western blot和RT-PCR检测TRPC1的mRNA和蛋白表达水平。结果 假手术组大鼠的LVMI为(1.82±0.09)mg/g,LVTDM为(13.98±0.16)μm。与假手术组相比,AAC组大鼠LVMI[(2.93±0.23)mg/g]、LVTDM[(20.89±0.79)μm]及TRPC1的mRNA和蛋白表达均显著增加(均P<0.05);AAC+2-APB组大鼠LVTDM[(16.12±0.50)μm]、TRPC1的mRNA和蛋白表达显著增加(P<0.05),LVMI[(1.99±0.09)mg/g]差异无统计学意义。与AAC组相比,AAC+2-APB组大鼠LVMI、LVTDM及TRPC1的mRNA和蛋白表达均显著减少(均P<0.05)。结论 TRPC1在压力超负荷诱导的SD大鼠左心室心肌肥厚中表达上调,体内2-APB干预可降低TRPC1表达,一定程度上延缓左心室心肌肥厚的进展。
瞬时受体通道C亚族1型; 心肌肥厚; 腹主动脉缩窄术; 2-APB
心力衰竭是导致心血管病患者死亡的重要因素,心肌肥厚是心力衰竭发生发展的病理基础,阻止和逆转左室心肌肥厚是防治心力衰竭的关键。瞬时受体通道C亚族(transient receptor potential channel,TRPC)近年来因其参与心肌肥厚发生发展的调控过程而广受关注[1-2],瞬时受体通道C亚族1型(TRPC1)被认为是钙库操纵性钙离子通道(storeoperated Ca2+channels,SOC)的重要组成部分[3],但目前通过体内药物干预TRPC1通道对心肌肥厚影响的研究尚少。本研究拟构建压力超负荷大鼠模型,检测TRPC1在心肌肥厚过程中的表达水平,观察体内药物干预下调TRPC1表达对心肌肥厚进展的影响。
1 材料与方法
1.1 主要试剂和仪器
2-APB(美国Sigma公司),TRPC1一抗、二抗(英国Abcam公司),SDS-PAGE凝胶配置试剂、BCA试剂盒、ECL试剂盒(碧云天公司),PVDF膜(Millipor公司),总RNA提取试剂、RNA逆转录试剂盒[宝生物工程(大连)有限公司],凝胶成像系统和PCR仪(美国BIO-RAD公司),大鼠尾动脉无创血压计(RBP-1型,淮北正华生物仪器有限公司)。
1.2 实验方法
1.2.1 动物分组及模型制备 成年雄性SD大鼠18只,体重200~250g,购自重庆医科大学动物实验中心,随机分为假手术组、AAC组和AAC+2-APB组(每组6只)。以腹主动脉缩窄术(abdominal aorta constriction,AAC)建立压力超负荷模型。术前禁食12h,测尾动脉压力。用10%的水合氯醛0.3mL/100g腹腔注射麻醉,剑突下正中切口切开腹部,分离腹主动脉,在右肾动脉上方约0.3cm处用4号缝线将7号针头和腹主动脉一起结扎,拔出针头,腹腔滴入青霉素(40U),逐层关腹缝合。假手术组不结扎腹主动脉,余同手术组。AAC+2-APB组术后即给予2-APB腹腔注射(2.5mg/kg),每2天1次,持续4周,假手术组和AAC组腹腔注射等体积的2%二甲基亚砜作为对照。术后第2、第4周末测量大鼠尾动脉压力。
1.2.2 左心室质量指数(left ventricular mass index,LVMI)的测量 术后第4周末,禁食12h,测量大鼠尾动脉压力并称取体质量。3组大鼠全身麻醉后打开胸腔,迅速剪取完整心脏,放入预冷PBS液中,冰上低温迅速分离出左心室及室间隔称重。取左心室和室间隔质量之和与大鼠体质量之比得到LVMI。
1.2.3 左心室心肌细胞横径(left ventricular transdiameter,LVTDM)的测量 取大鼠左心室中部石蜡包埋连续切片,苏木精-伊红染色。随机选取20个形状较规则细胞,测量其细胞横径,取平均值作为LVTDM。
1.2.4 TRPC1的免疫组化检测 各组切片常规脱蜡、水化、抗原修复、H2O2溶液孵育、封闭,TRPC1一抗(1∶200)4℃过夜,滴加生物素化兔二抗,DAB显色、苏木精复染、烘干、封片。高倍镜下采集图像,Image Pro-Plus6.0软件测定阳性表达的平均吸光度值。
1.2.5 RT-PCR检测心肌细胞TRPC1的表达使用总RNA提取试剂盒提取心肌细胞总RNA,RNA逆转录试剂盒逆转录合成cDNA。以其为模板,β-actin为内参,引物序列如下:TRPC1上游5′-TATGGGGAAGAACTGCAGTCC-3′,下游5′-CAGATCTTGGCGCAGTTCATT-3′。β-actin上游5′-CAACTGGGACGAATGGAGAA-3′,下游5′-CAGCCTGGATGGCTACGTACA-3′。PCR条件为: 94℃预变性5min,94℃变性45s,63℃退火45s,72℃延伸1min,PCR扩增30个循环,72℃延伸5 min。β-actin基因的退火温度为60℃,扩增25个循环,余同TRPC1基因的扩增。扩增之后行琼脂糖凝胶电泳,Bio-Rad凝胶成像系统采集图像,运用Quantity One软件进行灰度分析。
1.2.6 Western blot检测TRPC1的蛋白表达 从各组标本提取心肌细胞膜蛋白,SDS-PAGE电泳、转膜、封闭,加入一抗(稀释倍数TRPC1为1∶ 2 000,β-actin为1∶1 000),4℃孵育过夜,TBST溶液洗膜3次,二抗(稀释倍数1∶1 000)37℃孵育2 h,洗膜3次,显影。凝胶成像系统采集图像,Quantity One软件行灰度值分析。
1.3 统计学处理
所有数据采用SPSS 19.0统计软件进行统计分析,符合正态分布的计量资料以均数±标准差(¯x± s)表示,多组间均数的比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体质量和尾动脉收缩压
与假手术组相比,AAC组、AAC+2-APB组大鼠术后4周末体质量显著降低(均P<0.05),大鼠尾动脉收缩压显著升高(均P<0.05)。与AAC组相比AAC+2-APB组大鼠体质量及尾动脉收缩压差异无统计学意义。详见表1。

表1 各组大鼠术后4周末的体质量和尾动脉收缩压(¯x±s)Table1 Body mass and systolic blood pressure(SBP)of the caudal artery in each group at the end of 4weeks after surgery(¯x±s)
2.2 各组大鼠LVMI和LVTDM
各组标本苏木精-伊红染色如图1所示,假手术组心肌细胞排列整齐,间隙均匀;AAC组心肌细胞明显肥大,单位面积内细胞数量减少;AAC+2-APB组细胞体积较AAC组小,排列较为整齐。各组LV-MI和LVTDM结果如表2所示,与假手术组相比,AAC组LVMI、LVTDM显著增加(均P<0.05);AAC+2-APB组较假手术组LVTDM明显增加(P<0.05),但LVMI无显著差异;与AAC组比较,AAC+2-APB组LVMI和LVTDM均显著降低(均P<0.05)。

图1 各组大鼠术后4周末左心室心肌组织苏木精-伊红染色(×400)Fig.1 HE staining of left ventricular myocardial tissues in each group at the end of 4weeks after surgery(×400)

表2 各组大鼠术后4周末的LVMI和LVTDM(¯x±s)Table2 LVMI and LVTDM in each group at the end of 4weeks after surgery(¯x±s)
2.3 TRPC1的免疫组织化学检测
各组TRPC1免疫组化检测结果如图2所示,其中棕黄色颗粒为TRPC1蛋白表达。Image Pro-Plus6.0软件对各组TRPC1蛋白表达的吸光度值分析显示:与假手术组相比,AAC组和AAC+2-APB组TRPC1蛋白表达明显增加(均P<0.05);AAC+2-APB组TRPC1表达较AAC组显著降低(P<0.05)。见表3。
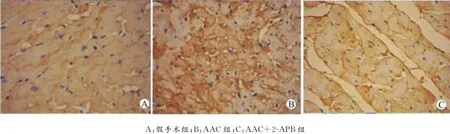
图2 各组大鼠术后4周末左心室心肌组织TRPC1蛋白免疫组化染色(×400)Fig.2 Immunohistochemical analysis of the expression of TRPC1protein in left ventricular myocardial tissues in each group at the end of 4weeks after surgery(×400)

表3 各组大鼠术后4周末左心室心肌组织TRPC1蛋白免疫组化染色吸光度值(¯x±s)Table3 Immunohistochemical analysis of absorbance value of TRPC1protein in left ventricular myocardial tissue in each group at the end of 4weeks after surgery(¯x±s)
2.4 TRPC1的mRNA表达
如图3示,与假手术组比较,AAC组和AAC+2-APB组TRPC1的mRNA表达显著增高(均P<0.05);与AAC组比较,AAC+2-APB组TRPC1的mRNA表达显著降低(P<0.05)。
2.5 TRPC1的免疫印迹检测
如图4示,与假手术组比较,AAC组和AAC+2-APB组大鼠TRPC1蛋白表达显著增加(均P<0.05);与AAC组比较,AAC+2-APB组大鼠TR-PC1蛋白表达显著降低(P<0.05)。

图3 各组大鼠术后4周末左心室心肌组织TRPC1mRNA的表达Fig.3 Expression of TRPC1mRNA in left ventricular myocardial tissues in each group at the end of 4weeks after surgery

图4 各组大鼠术后4周末左心室心肌组织TRPC1蛋白的表达Fig.4 Expression of TRPC1protein in left ventricular myocardial tissues at the end of 4weeks after surgery in each group
3 讨论
左心室肥厚是心肌对压力负荷增加的一种适应,是多种病理刺激的最终反应,心肌细胞内钙离子浓度增加是导致心肌细胞肥大的基本信号。瞬时受体通道是位于细胞膜上的一类重要的钙离子内流通道,TRPC是其中的一个亚家族,包括TRPC1~7七个亚型,其中TRPC2在人类细胞上暂未被发现[4]。近来大量研究表明,TRPC作为一种非电压依赖的钙离子通道,通过调节细胞内钙离子变化,参与并调节心肌肥厚的发生发展过程[1-2,5]。
TRPC通道的激活受渗透压、pH值、机械刺激等多种因素的综合调节,目前大多数认为磷脂酶C(PLC)途径的激活是其主要机制。激动剂如内皮素、血管紧张素Ⅱ和儿茶酚胺等物质和G蛋白耦联受体或酪氨酸受体结合后,激活PLC,使4,5-二磷酸磷脂酰肌醇水解,产生1,4,5-三磷酸肌醇(inositol trisphosphate,IP3)和二酰基甘油(diacylglycerol,DAG)。之后根据激活通道刺激物的不同,TR-PC分为受体操纵性钙离子通道(receptor-operated Ca2+channels,ROC)和钙库操纵性钙离子通道(SOC)。IP3作用于IP3受体,使肌浆网钙库大量释放Ca2+,细胞内钙库耗竭进而激活SOC引起Ca2+内流[6-7]。TRPC1是TRPC的一个亚型,目前被认为是SOC非常重要的组成部分。
目前许多实验已证实TRPC1通道的表达和活性上调可导致病理性心肌肥厚。2007年,Ohba等[3]发现在腹主动脉缩窄的Wistar大鼠心脏中,TRPC1表达显著增加;以小干扰RNA(siRNA)下调TRPC1基因表达,结果显示内皮素-1、血管紧张素Ⅱ和去甲肾上腺素诱导的心肌肥厚并不明显。2009年,Seth等[8]研究证实TRPC1基因缺失的WT大鼠在受到压力负荷或神经激素刺激的作用下,心肌肥厚并不显著。2010年,Vindis等[9]发现5-羟色胺处理大鼠心肌细胞可使TRPC1表达明显上调,使用siRNA下调TRPC1基因表达,同样有效抑制了心肌肥厚进展。
当前有关TRPC1的研究多为体外研究,通过药物抑制TRPC1表达进而观察心肌肥厚进展的研究更少。本实验选用TRPC1阻滞剂2-APB,采用腹腔注射的方式进行体内干预,通过观察比较心肌肥厚指标的变化,进一步探讨TRPC1在心肌肥厚发生发展中的重要作用。本实验中,AAC术后,AAC组和AAC+2-APB组大鼠与假手术组比较,尾动脉压力明显升高,提示AAC模型构建成功。术后4周,与假手术组比较,AAC组大鼠LVMI和LVTMD均显著增加,TRPC1mRNA和蛋白表达均显著上调,提示压力超负荷诱导的大鼠肥厚心肌细胞中TRPC1的表达上调。与AAC组比较,AAC+2-APB组大鼠LVMI、LVTDM均显著减小,TRPC1蛋白和mRNA表达下调,提示通过体内药物干预下调TRPC1的表达可抑制心肌肥厚的进展。另外,在本实验中观察到,与假手术组比较,AAC+2-APB组除LVMI无显著差异外,LVTDM、TRPC1 mRNA和蛋白表达均显著升高,提示2-APB使用4周在分子和细胞水平抑制作用已非常显著。加大2-APB剂量或延长使用时间是否可进一步显著降低LVMI,尚需进一步实验明确。
本实验亦有不足之处,2-APB(2-Aminoethoxydiphenyl borate)是一种膜通透性的IP3受体(IP3R)拮抗剂,可抑制钙库诱导的钙库调控性离子通道(SOC)活化[10]。但2-APB并非TRPC1的特异性阻滞剂,在抑制TRPC1的同时可能也抑制了其他心肌肥厚发生相关通道的激活。另外,由于使用2-APB进行动物体内干预的实验尚少,目前并无明确的剂量选择标准,本研究剂量的选择参考国内李燕等[11]的研究,其相关的毒副作用尚缺乏参考资料。再者,由于实验条件的限制,本实验并未采用心脏多普勒超声或心腔内血流动力学检测进一步评估心肌肥厚进展程度。总之,TRPC1作为TRPC通道的一个亚型,作为SOC的重要组成部分,在压力超负荷大鼠左室心肌肥厚的进展中具有重要作用,未来是否可选用TRPC1特异性阻滞剂来延缓甚至逆转心肌肥厚的进展,尚需更深入的研究。
[1] Wu X,Eder P,Chang B,et al.TRPC channels are necessary mediators of pathologic cardiac hypertrophy[J].Proc Natl Acad Sci,2010,107(15):7000-7005.
[2] Bush E W,Hood D B,Papst P J,et al.Canonical transient receptor potential channels promote cardiomyocyte hypertrophy through activation of calcineurin signaling[J].J Biol Chem,2006,281(44):33487-33496.
[3] Ohba T,Watanabe H,Murakami M,et al.Upregulation of TRPC1in the development of cardiac hypertrophy[J].J Mol Cell Cardiol,2007,42(3):481-483.
[4] 张静,武智晓,易欣,等.经典型瞬时受体电位通道与心肌肥厚[J].中国心脏起搏与心电生理杂志,2012,26(2):165-167.
[5] Nakayama H,Wilkin B J,Bodi I,et al.Calcineurin-dependent cardiomyopathy is activated by TRPC in the adult mouse heart[J].FASEB J,2006,20(10):1660-1670.
[6] Nishida M,Kurose H.Roles of TRP channels in the development of cardiac hypertrophy[J].Naunyn Schmiedebergs Arch Pharmacol,2008,378(4):395-406.
[7] 田小芍,陈明.瞬时受体电位通道C亚族参与高血压心室肥厚机制研究的新进展[J].中国分子心脏病学杂志,2012,12(5):308-312.
[8] Seth M,Zhang Z S,Mao L,et al.TRPC1channels are critical for hypertrophic signaling in the heart[J].Circ Res,2009,105(10):1023-1030.
[9] Vindis C,D′Angelo R,Mucher E,et al.Essential role of TRPC1channels in cardiomyopathy hypertrophy mediated by 5-HT2Aserotonin receptors[J].Biochem Biophys Res Commun,2010,391(1):979-983.
[10] Peppiatt C M,Collins T J,Mackenzie L,et al.2-Aminoethoxydiphenyl borate(2-APB)antagonises inositol 1,4,5-trisphosphate-induced calcium release,inhibits calcium pumps and has a use-dependent and slowly reversible action on storeoperated calcium entry channels[J].Cell Calcium,2003,34(1):97-108.
[11] 李燕,江慧,阮承超,等.TRPM7抑制剂对压力超负荷大鼠心肌肥厚的影响[J].中国分子心脏病学杂志,2013,13(2):501-504.
(2014-06-05 收稿)
Effect of In Vivo 2-APB Intervention on Left Ventricular Hypertrophy Induced by Pressure Overload
Wang Fangchao,Chen Ming△,Hao Dexiong
Department of Cardiology,First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
Objective To investigate the effect of in vivo intervention with the transient receptor potential channel 1(TRPC1)inhibitor 2-APB on left ventricular hypertrophy induced by pressure overload in SD rats.Methods Eighteen adult male SD rats,weighing 200-250g,were randomly divided in sham-operated group,abdominal aorta constriction(AAC)group and AAC+2-APB group(n=6in each group).Pressure overload model was created by AAC.Rats in AAC+2-APB group were given 2-APB(2.5mg/kg)by intraperitoneal injection once every 2days.After administration for 4weeks,blood pressure,left ventricular mass index(LVMI)and transverse diameter of left ventricular myocytes(LVTDM)were measured.The expression levels of TRPC1mRNA and protein were detected by immunohistochemistry,RT-PCR and Western blot,respectively.Results The LVMI[(2.93±0.23)mg/g vs.(1.82±0.09)mg/g],LVTDM[(20.89±0.79)μmvs.(13.98±0.16)μm],expression levels of TRPC1mRNA and protein were significantly higher in AAC group than in sham-operated group(P<0.05for all).Compared with sham-operated group,the LVTDM[(16.12±0.50)μm],and expression levels of TRPC1mRNA and protein were profoundly increased in AAC+2-APB group(P<0.05),while LVMI[(1.99±0.09)mg/g]was not significantly different between the two groups.These indexes were significantly decreased in AAC+2-APB group when compared with AAC group(P<0.05).Conclusion TRPC1was upregulated in rats with left ventricular hypertrophy induced by pressure overload.In vivo 2-APB intervention could downregulate the expression of TRPC1and delay the progress of left ventricular myocardial hypertrophy.
transient receptor potential channel 1; ventricular hypertrophy; abdominal aorta constriction; 2-aminoethoxydiphenyl borate(2-APB)
R364.31
10.3870/j.issn.1672-0741.2015.03.007
*国家临床重点专科建设资助项目(No.财社[2011]170号)
王方超,男,1988年生,硕士研究生,E-mail:fangchao.07@163.com△通讯作者,Corresponding author,E-mail:chenmingcq@126.com

