硫化氢活化ERK抵抗内质网应激诱导的心肌细胞凋亡*
祝晓莹, 王桂美, 胡 敏, 陆 欢, 邓 晶, 严晓红△
硫化氢活化ERK抵抗内质网应激诱导的心肌细胞凋亡*
祝晓莹1,2#, 王桂美1#, 胡 敏1, 陆 欢1, 邓 晶1, 严晓红1△
1武汉大学基础医学院生理学系,武汉 430071
2河南科技大学医学院病原生物学教研室,洛阳 471003
目的 探讨硫化氢(H2S)对心肌的保护作用是否通过激活细胞外信号调节激酶(ERK)通路来抵抗心肌缺血诱导的内质网应激所致的心肌细胞凋亡。方法 60只雄性SD大鼠随机分为对照组、ISO模型组、NaHS+ISO组及PD98059阻断组,每组各15只。对照组大鼠注射等体积生理盐水;ISO模型组大鼠第1、2天腹腔注射生理盐水,第3、4天注射完生理盐水30min后背部皮下分别注射10mg/kg和5mg/kg的ISO;NaHS+ISO组大鼠腹腔注射NaHS 14 μmol/kg,1次/d,连续2d后,改为2次/d,连续2d,并在后2d的第1次注射30min后,于背部皮下分别注射10mg/kg和5mg/kg的ISO,1次/d;PD98059阻断组大鼠在上述NaHS+ISO组大鼠处理基础上,于注射ISO之前经尾静脉注射MEK/ERK抑制剂PD98059(4mg/kg),1次/d,连续2d。每组最后一次注射ISO并禁食12h后,检测心电图、心功能指标;测定血浆中H2S浓度变化;TTC染色测定心肌梗死面积;TUNEL法检测心肌细胞凋亡指数(AI);免疫组织化学方法检测心肌中GRP78、CHOP及ERK磷酸化(p-ERK)蛋白的表达。结果 ISO模型组大鼠血浆的H2S含量明显低于对照组(P<0.01);14μmol/kg NaHS可以显著改善心肌缺血引起的心功能改变,而PD98059阻断组可以逆转NaHS的心肌保护作用;与ISO模型组相比,NaHS+ISO组大鼠心肌组织中GRP78、CHOP的表达明显减少(均P<0.05),p-ERK表达明显增多(P<0.01),AI、心肌梗死面积明显减小(均P<0.05);与NaHS+ISO组相比,PD98059阻断组大鼠心肌组织中GRP78、CHOP的表达、AI、梗死面积均显著增加(均P<0.05),心功能明显降低(P<0.05),而p-ERK无表达。相关分析显示大鼠心肌细胞CHOP表达、AI与p-ERK的表达呈负相关(P<0.01)。结论 内源性H2S浓度的降低及内质网应激可能参与急性缺血心肌损伤的发生与发展,H2S对缺血损伤的心肌保护作用机制可能与其激活ERK进而抑制内质网应激诱导的心肌细胞凋亡有关。
硫化氢; 心肌缺血; 内质网应激; 细胞外信号调节激酶; GRP78; CHOP
硫化氢(hydrogen sulfide,H2S),是继NO和CO之后新发现的第3种气体信号分子。在心血管系统中,内源性H2S主要由胱硫醚-γ-裂解酶(Cystathionine-γ-lyase,CSE)裂解L-半胱氨酸产生,体内1/3以H2S形式存在,2/3以硫氢化钠(NaHS)形式存在,且能维持动态平衡。因H2S气体具有挥发性,故一般采用NaHS作为外源性H2S的供体。目前对H2S的心肌保护作用及其机制的研究已成为心血管研究领域的新热点[1-4]。研究表明,异丙肾上腺素(isoproterenol,ISO)诱导的心肌缺血损伤大鼠心肌内源性CSE/H2S生成减少,给予外源性H2S对心脏具有明显的保护作用,其机制可能涉及H2S清除氧自由基和降低脂质过氧化水平[5]。H2S还可以通过激活细胞外信号调节激酶(extracellular signal regulation kinase,ERK)而发挥心肌保护作用[6]。近年,又有研究表明心肌缺血可诱导内质网应激(endoplasmic reticulum stress,ERS)[7],而过强或持续时间过长的ERS可激活凋亡信号分子,如CHOP、JNK等,启动由ERS介导的凋亡信号通路,引起细胞凋亡,促进心肌疾病的发生[810]。H2S能否通过活化ERK抑制心肌缺血诱导的ERS所致心肌细胞凋亡而发挥心肌保护作用?本实验采用ISO制造心肌缺血模型,应用ERK抑制剂PD98059,通过检测心功能、心肌梗死面积、心肌凋亡指数及内质网标志蛋白GRP78、CHOP与ERK磷酸化(p-ERK)蛋白的表达水平等指标,探讨H2S对心肌的保护作用是否通过激活ERK通路来拮抗心肌缺血诱导的ERS所致的心肌细胞凋亡。
1 材料与方法
1.1 主要试剂及仪器
NaHS、TUNEL检测试剂盒(美国Sigma公司);TTC(红四氮唑,北京纵横洋洲医药生物技术有限公司);PD98059[2-氨基-3-甲氧黄酮,普洛麦格(北京)生物技术有限公司];兔抗大鼠GRP78多克隆抗体、兔抗大鼠CHOP多克隆抗体、兔抗大鼠p-ERK多克隆抗体(北京博奥森生物技术有限公司);羊抗兔IgG-HRP(Santa Cruz公司)。BL-420生物机能实验系统(成都泰盟科技有限公司);DW-2000动物人工呼吸机(上海嘉鹏科技有限公司);UV-2100分光光度计[尤尼柯(上海)仪器有限公司]。
1.2 实验方法
1.2.1 急性心肌缺血模型的制作 健康SD大鼠适应性喂养2d后,于第1、2天腹腔注射生理盐水,第3、4天腹腔注射生理盐水0.5h后皮下分别注射ISO 10 mg/kg、5mg/kg复制大鼠心肌缺血模型[11]。心电图监测,出现ST段抬高即表示模型复制成功。
1.2.2 动物分组 模型制作稳定后将60只SD大鼠随机分为4组:对照组、ISO模型组、NaHS+ISO组及PD98059阻断组,每组15只。对照组注射等体积生理盐水;NaHS+ISO组腹腔注射NaHS 14 μmol/kg,每日1次,连续2d后,改用每日2次,连续2d,并在后2天的第1次注射30min后,于背部皮下分别注射10mg/kg和5mg/kg的ISO,每日1次;PD98059阻断组大鼠在上述NaHS+ISO组大鼠处理基础上,于注射ISO前经尾静脉注射MEK/ERK抑制剂PD98059(4mg/kg),每日1次,连续2 d。
1.2.3 大鼠心功能指标检测及标本制备 通过BL-420生物机能实验系统连续记录左心室收缩压(LVSP)、左室舒张末期压(LVEDP)及左室压最大变化速率(±dp/dtmax);分离左颈外静脉,静脉插管取血1mL,取血后室温静置30min,离心30min收集血清,-20℃冻存备用,用于测H2S浓度;开胸取心脏组织,4%多聚甲醛固定,用于免疫组化检测。
1.2.4 血清H2S浓度的测定 血清H2S浓度的测定采用去蛋白法[12],在预先准备好的5mL Ep管中先加入0.5mL 10g/L醋酸锌,再加入0.1mL血清标本,振荡摇匀,依次加入0.5mL 20mmol/L对苯二胺盐酸盐和0.5mL 30mmol/L三氯化铁,室温孵育,使之显色充分,再加入1mL 10%的三氯醋酸,最后加入蒸馏水补足体积至5mL,充分混匀。离心6 000r/min,5min,然后吸出上清液,用紫外分光光度计测上清液在670nm处的吸光度值。根据H2S标准曲线计算出血清中H2S的含量。
1.2.5 心肌梗死范围的测定 采用TTC染色法[13]。开胸后迅速取出心脏,保留左心室,用4℃生理盐水冲洗残血,-20℃冷冻保存。1h后取出,平行房室沟将左室切成1~2mm厚,置37℃1% TTC磷酸缓冲液中避光染色15min,然后用磷酸盐缓冲液(pH7.4)洗去多余染料,再放于10%甲醛中固定24h,以增强染色的对比。梗死区心肌呈苍白色,未梗死心肌呈砖红色。取不同颜色心肌组织分别称重,按质量百分比法计算梗死心肌占整个左心室心肌的百分比,判断模型稳定性。
1.2.6 心肌细胞凋亡的检测 心肌石蜡切片常规脱蜡、水化后,PBS漂洗3×5min;按照TUNEL检测试剂盒说明书进行操作。用DNA酶处理切片作阳性对照,用标记液代替TdT酶反应液作阴性对照。在光学显微镜下观察并记录实验结果。每张切片心肌细胞凋亡原位标记标本随机取10个高倍视野(×200),用计算机图像分析软件分析凋亡心肌细胞,计算凋亡心肌细胞数占心肌细胞总数的百分比即凋亡指数(apoptotic index,AI)。
1.2.7 大鼠心肌组织GRP78、CHOP、p-ERK表达的测定 取固定后的心脏组织,常规石蜡包埋,4 μm切片,捞片后,放入烤箱中烘烤4h,放置于标本盒中用于免疫组化检测。主要步骤:将石蜡切片常规脱蜡,梯度乙醇水化,PBS漂洗3×5min;微波炉修复抗原;室温冷却后,PBS漂洗3×5min;滴加50 μL过氧化物酶阻断液,37℃温箱中孵育10min;PBS漂洗3×5min;滴加山羊血清封闭液,37℃温箱孵育10min;甩去多余血清,分别滴加GRP78、CHOP、p-ERK抗体,4℃过夜,PBS漂洗3×5min;分别滴加生物素标记的二抗,37℃孵育1h,PBS漂洗3×5min;滴加辣根过氧化物酶标记的链抗生物素蛋白,37℃温箱中孵育1h,PBS漂洗3×5min;每片滴加DAB显色,再依次滴加苏木精轻度复染、脱水、透明、封片,在显微镜下观察结果。阴性对照采用PBS取代一抗,其余步骤相同。阳性表达细胞膜或胞质呈棕褐色或黄褐色,正常细胞呈均匀的淡紫色。各组照片都用Quantimet-520图像分析仪对免疫组化染色的阳性反应产物进行定量分析,随机选12个位点测量阳性反应产物的灰度值,然后取其平均值。阳性产物强度用灰度值表示,灰度值愈大则阳性反应物的阳性强度愈小。
1.3 统计学处理
计量资料以均数±标准差(¯x±s)表示,统计处理采用SPSS 13.0统计分析软件,多组间比较采用单因素方差分析(one-way ANOVA),若差异显著则进一步用least-significant-difference法进行两两比较,相关分析采用Pearson法,以P<0.05为差异有统计学意义。
2 结果
2.1 H2S对心肌缺血损伤大鼠心功能的影响
为观察H2S对大鼠心功能的影响,我们分别记录了各组大鼠心脏的LVSP、LVEDP及±dp/dtmax(表1)。与对照组比较,ISO模型组大鼠LVSP和±dp/dtmax值明显降低,分别下降27%和50%(P<0.05和P<0.01),LVEDP上升了321.5%(P<0.01),差异显著;与ISO模型组比较,NaHS+ISO组的LVSP和±dp/dtmax均明显增加(均P<0.05),而LVEDP则明显降低(P<0.01);与NaHS+ISO组比较,PD98059阻断组LVSP和±dp/dtmax均明显减小(均P<0.05),而LVEDP则明显增加(P<0.01);但是PD98059阻断组与ISO模型组相比差异无统计学意义。
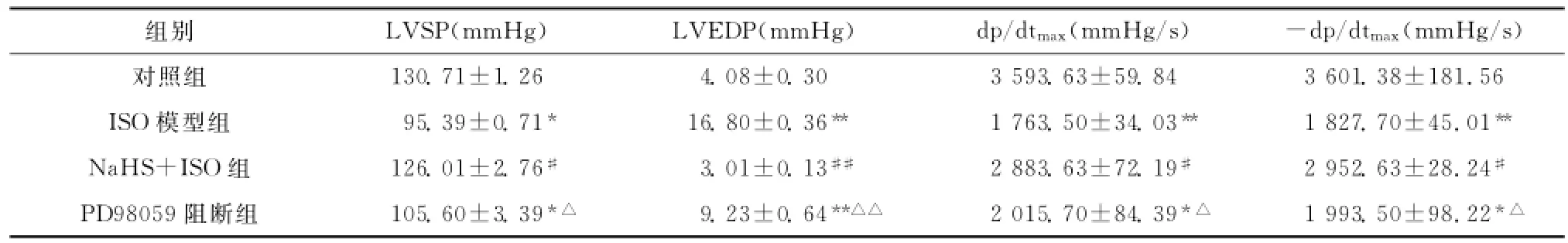
表1 各组大鼠血流动力学指标(¯x±s,n=15)Table1 Hemodynamics in different groups of rats(¯x±s,n=15)
2.2 H2S在心肌缺血损伤大鼠血清中含量的变化
各组大鼠血清H2S的浓度如图1所示。与对照组相比,ISO模型组大鼠血清中H2S浓度明显降低[(26.64±0.84)vs.(39.01±0.50)μmol/L,P<0.01];与ISO模型组比较,NaHS+ISO组大鼠血清H2S的浓度明显增加[(35.48±1.18)μmol/L vs.(26.64±0.84)μmol/L,P<0.01],PD98059阻断组亦明显增加[(35.65±0.72)μmol/Lvs.(26.64±0.84)μmol/L,P<0.01];与NaHS+ISO组比较,PD98059阻断组大鼠血清H2S浓度变化没有统计学意义。
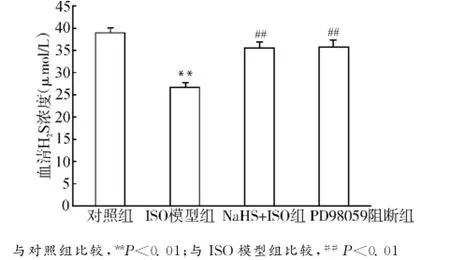
图1 各组大鼠血清H2S浓度Fig.1 H2S concentration in different groups of rats
2.3 H2S对心肌缺血损伤大鼠心肌梗死面积的影响
TTC染色结果显示:梗死区心肌呈苍白色,未梗死心肌呈砖红色。按质量百分比法计算各组大鼠的心肌梗死面积。各组间梗死面积比较如图2所示。设定对照组梗死面积为0,与对照组比较,ISO模型组梗死面积明显增加[(37.45±5.20)%,P<0.01];与ISO模型组比较,NaHS+ISO组梗死面积明显减小[(23.87±4.51)%vs.(37.45± 5.20)%,P<0.05];与NaHS+ISO组比较,PD98059阻断组梗死面积显著增加[(33.25± 2.41)vs.(23.87±4.51)%,P<0.05],而与ISO模型组相比则差异无统计学意义(P>0.05)。
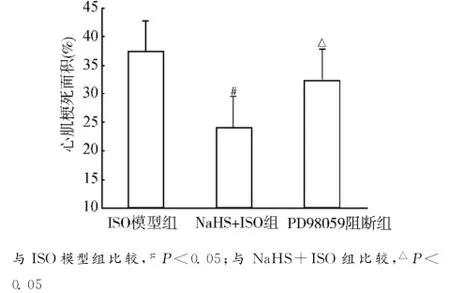
图2 各组大鼠心肌梗死面积Fig.2 Myocardial infarct size in different groups of rats
2.4 H2S对心肌缺血损伤大鼠心肌细胞凋亡的影响
图3显示:对照组心肌的凋亡指数(AI)极低,与对照组比较,ISO模型组心肌细胞凋亡明显增加[(42.5±7.9)%vs.(2.7±0.7)%,P<0.01];与ISO模型组比较,NaHS+ISO组凋亡指数显著减小[(11.6±2.4)%vs.(42.5±7.9)%,P<0.01];与NaHS+ISO组比较,PD98059阻断组凋亡指数明显增加[(28.9±6.1)%vs.(11.6±2.4)%,P<0.05],而与ISO模型组差异无统计学意义,提示ERK磷酸化可能抑制缺血心肌组织中的细胞凋亡。
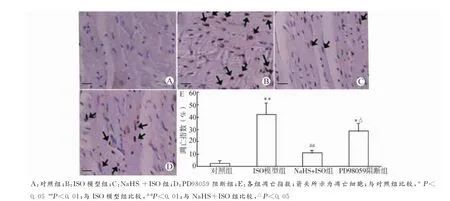
图3 各组大鼠心肌细胞TUNEL染色(标尺=0.4μm)Fig.3 TUNEL staining of cardiomyocytes in different groups of rats(bar=0.4μm)
2.5 H2S对大鼠缺血损伤心肌中GRP78和CHOP表达的影响
GRP78是ERS的标志蛋白,在胞质中表达,免疫组化染色呈棕黄色;CHOP是内质网启动的凋亡信号中最多的分子之一,主要位于坏死区,阳性表达呈深浅不一的棕黄色(图4)。半定量灰度值分析显示,与对照组比较,ISO模型组GRP78的灰度值[(98.6±3.4)vs.(180.2±4.8),P<0.01]和CHOP的灰度值[(100.3±5.4)vs.(199.8±3.6),P<0.01]均显著降低;与ISO模型组比较,NaHS+ISO组GRP78的灰度值[(152.6±3.3)vs.(98.6 ±3.4),P<0.01]和CHOP的灰度值[(162.5± 3.2)vs.(100.3±5.4),P<0.01]均明显增加;与NaHS+ISO组比较,PD98059阻断组GRP78的灰度值[(124.7±2.5)vs.(152.6±3.3),P<0.05]和CHOP的灰度值[(119.9±3.6)vs.(162.5±3.2),P<0.05]均显著减小,但与ISO模型组相比二者差异均无统计学意义。

图4 各组大鼠心肌GRP78和CHOP的表达(标尺=0.4μm)Fig.4 The expression of GRP78and CHOP in myocardial tissues of rats in each group(bar=0.4μm)
2.6 H2S对缺血损伤大鼠心肌中p-ERK表达的影响
p-ERK免疫组化检测结果如图5所示:与对照组相比,ISO模型组p-ERK表达的灰度值明显降低[(141.7±2.5)vs.(239.4±2.0),P<0.05],提示当心肌缺血时,会有少量ERK磷酸化发挥作用;与ISO模型组相比,NaHS+ISO组p-ERK灰度值明显降低[(90.3±3.1)vs.(141.7±2.5),P<0.05],说明加入NaHS后,大量ERK被激活;而PD98059组因加入ERK抑制剂,几乎没有p-ERK的表达。
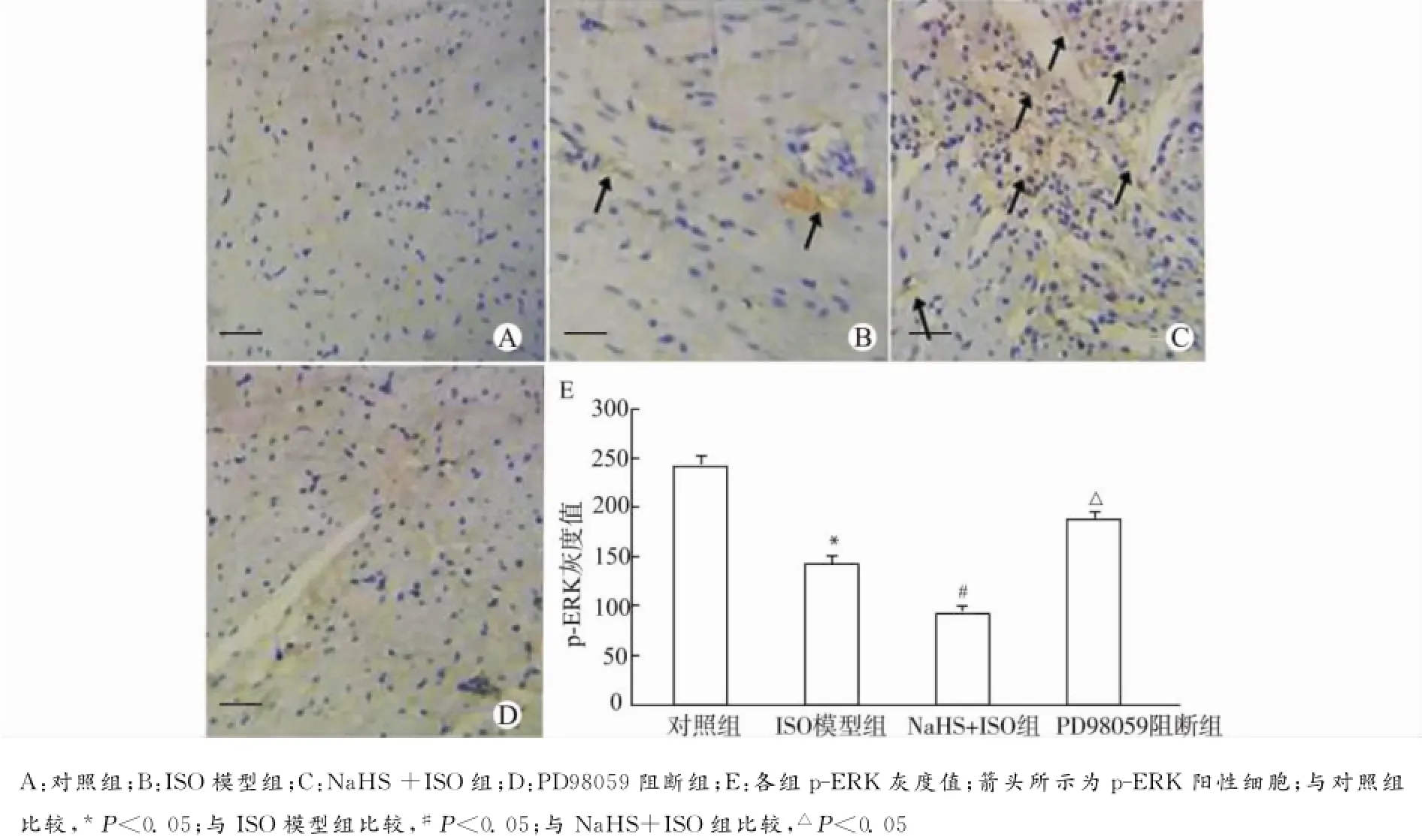
图5 各组大鼠心肌p-ERK的表达(标尺=0.4μm)Fig.5 The expression of p-ERK in myocardial tissues of rats in each group(bar=0.4μm)
2.7 p-ERK与CHOP、凋亡指数之间的相关分析
相关分析显示,缺血心肌中CHOP灰度值、凋亡指数(AI)与p-ERK灰度值间的相关系数分别为r=-0.762及r=0.638。由于灰度值越大,阳性表达产物越少,因此缺血心肌中CHOP表达、凋亡指数(AI)与p-ERK的表达均呈负相关。见图6。
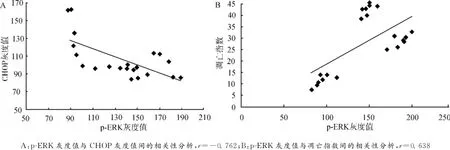
图6 p-ERK与CHOP、凋亡指数之间的相关分析Fig.6 Correlation analysis of the relationship between p-ERK and CHOP or apoptotic index
3 讨论
作为继NO和CO之后的第3类气体信号分子,H2S已经被证实对心血管有保护作用[4,14]。H2S可以活化KATP通道引起血管舒张,还可通过促进肌浆网重拾胞内游离钙及依赖PKC的Na+/Ca2+交换机制缓解缺血心肌细胞内钙超载;Geng等[4-5,15]从CSE/H2S途径出发分析了在ISO诱导的心肌缺血模型中H2S的心脏保护作用,并指出H2S是通过清除氧自由基和降低脂质过氧化水平而起作用的。
本实验ISO模型组大鼠血清中H2S浓度明显低于对照组(P<0.01),这表明H2S浓度的降低参与了心肌缺血损伤。心肌发生缺血损伤后,心功能会发生改变。通常评价左心室收缩和舒张功能的指标主要是LVSP、LVEDP、±dp/dtmax。本实验结果显示,ISO组LVSP、±dp/dtmax与对照组相比分别下降27%和50%(P<0.05和P<0.01),LVEDP上升了321.5%(P<0.01),说明缺血可造成心肌损伤导致心室舒缩功能下降;给予14μmol/mL NaHS后,LVSP和±dp/dtmax与ISO组相比均明显增加(P<0.05),而LVEDP则明显降低(P<0.01),同时心肌梗死面积明显减少,提示H2S可改善心肌缺血损伤导致的心功能下降[5,14]。
ISO是β受体激动剂,注射一定剂量ISO后,β受体兴奋,腺苷酸环化酶活性增加,细胞内cAMP浓度提高,通过cAMP依赖性蛋白激酶系统,促进钙内流,加重细胞内钙超载,而内质网是真核细胞中细胞内钙离子的储存场所,细胞内钙超载会造成内质网内钙离子平衡紊乱,进而诱导内质网应激(ERS)[16]。ERS参与了诸多心血管系统疾病的病理发展过程[17-18]。葡萄糖调节蛋白GRP78是一种对细胞起保护作用的内质网分子伴侣,在ERS时可以帮助内质网对蓄积的错误折叠和未折叠蛋白质进行处理以增强内质网应激能力,促进内质网功能恢复,因而被认为是ERS的一种标志蛋白。伴侣蛋白GRP78过度表达可作为一种ERS的指示剂,而过强或过长时间的ERS将通过激活下游的凋亡信号分子CHOP/GADD153等,启动由ERS所介导的凋亡信号通路,诱导细胞凋亡[1922]。为验证ISO所致的急性心肌缺血是否诱导ERS及H2S是否通过抑制ERS保护心肌,本实验用免疫组化检测各组大鼠心肌中GRP78和CHOP的表达,结果显示:ISO模型组GRP78和CHOP表达比对照组显著增加(P<0.01);而NaHS+ISO组GRP78和CHOP的表达明显低于ISO模型组(P<0.01),提示ISO所致的心肌缺血可诱导心肌细胞ERS,并激活下游ERS凋亡分子CHOP的凋亡通路引起大鼠心肌细胞的凋亡。这与Szegezdi等[23]在模拟缺血的乳鼠心肌细胞上发现缺血能诱导ERS,促凋亡的分子CHOP表达明显上调是一致的。给予外源性H2S可使GRP78和CHOP的表达下调,提示H2S可能通过拮抗心肌缺血诱导的ERS而实现心肌保护的。
细胞外信号调节激酶(ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的一员,它的信号传递途径是调节细胞生长、发育及分裂信号网络的核心。ERK信号通路的激活在细胞生命活动中有重要意义,如在细胞增殖、分化和抗凋亡中发挥作用[2425]。本研究应用ERK阻断剂,并通过免疫组化检测ERK磷酸化蛋白(p-ERK)的表达以进一步探讨H2S抵抗心肌缺血诱导的ERS是否通过激活ERK通路。结果显示:与ISO模型组比较,NaHS+ISO组p-ERK表达明显增加(P<0.05),GRP78、CHOP表达明显降低(P<0.01),AI明显减少(P<0.01);给予ERK阻断剂PD98059,p-ERK表达抑制,而GRP78、CHOP表达及AI等明显增加(P<0.05)。进一步相关分析显示,心肌细胞CHOP表达及凋亡指数(AI)与p-ERK的表达呈负相关(P<0.05)。提示H2S可能通过ERK通路调控心肌缺血诱导的ERS所引起的心肌细胞凋亡。
总之,本研究表明内源性H2S浓度的降低及ERS可能参与心肌缺血的发生与发展。补充外源性H2S可保护心肌,其机制可能与H2S可激活ERK从而抑制ERS诱导的细胞凋亡有关,其确切机制仍需进一步阐明。
[1] Bolli R.Cardioprotective function of inducible nitric oxide synthase and role of nitric oxide in myocardial ischemia and preconditioning: an overview of a decade of research[J].J Mol Cell Cardiol,2001,33(11):1897-1918.
[2] Clark J E,Naughton P,Shurey S,et al.Cardioprotective actions by a water-soluble carbon monoxide-releasing molecule[J].Circ Res,2003,93(2):e2-e8.
[3] Wang R.Two’s company,three’s a crowd:can H2S be the third endogenous gaseous transmitter?[J].FASEB J,2002,16(13):1792-1798.
[4] Wang R.Physiological implications of hydrogen sulfide:a whiff exploration that blossomed[J].Physiol Rev,2012,92(2):791-896.
[5] Geng B,Chang L,Pan C,et al.Endogenous hydrogen sulfide regulation of myocardial injury induced by isoproterenol[J].Biochem Biophys Res Commun,2004,318(3):756-763.
[6] Hu Y,Chen X,Pan T T,et al.Cardioprotection induced by hydrogen sulfide preconditioning involves activation of ERK and PI3K/Akt pathways[J].Pflugers Arch,2008,455(4): 607-616.
[7] Minamino T,Komuro I,Kitakaze M.Endoplasmic reticulum stress as a therapeutic target in cardiovascular disease[J].Circ Res,2010,107(9):1071-1082.
[8] Han S W,Li C,Ahn K O,et al.Prolonged endoplasmic reticulum stress induces apoptotic cell death in an experimental model of chronic cyclosporine nephropathy[J].Am J Nephrol,2008,28(5):707-714.
[9] Shore G C,Papa F R,Oakes S A.Signaling cell death from the endoplasmic reticulum stress response[J].Curr Opin Cell Biol,2011,23(2):143-149.
[10] Okada K,Minamino T,Tsukamoto Y,et al.Prolonged endoplasmic reticulum stress in hypertrophic and failing heart after aortic constriction:Possible contribution of endoplasmic reticulum stress to cardiac myocyte apoptosis[J].Circulation,2004,110(6):705-712.
[11] Rona G,Chappel C I,Balazs T,et al.An infarct-like myocardial lesion and other toxic manifestations produced by isoproterenol in the rat[J].AMA Arch Pathol,1959,67(4):443-455.
[12] Chunyu Z,Junbao D,Dingfang B,et al.The regulatory effect of hydrogen sulfide on hypoxic pulmonary hypertension in rats[J].Biochem Biophys Res Commun,2003,302(4):810-816.
[13] Rao P R,Kumar V K,Viswanath R K,et al.Cardioprotective activity of alcoholic extract of Tinosporacordifolia in ischemiareperfusion induced myocardial infarction in rats[J].Biol Pharm Bull,2005,28(12):2319-2322.
[14] SzabóC.Hydrogen sulphide and its therapeutic potential[J].Nat Rev Drug Discov,2007,6(11):917-935.
[15] Johansen D,Ytrehus K,Baxter G F.Exogenous hydrogen sulfide(H2S)protects against regional myocardial ischemiareperfusion injury—Evidence for a role of KATPchannels[J].Basic Res Cardiol,2006,101(1):53-60.
[16] Ono Y,Shimazawa M,Ishisaka M,et al.Imipramine protects mouse hippocampus against tunicamycin-induced cell death[J].Eur J Pharmacol,2012,696(1-3):83-88.
[17] Xu J,Wang G,Wang Y,et al.Diabetes and angiotensin II-induced cardiac endoplasmic reticulum stress and cell death: Metallothionein protection[J].J Cell Mol Med,2009,13(8 A):1499-1512.
[18] Dou G,Sreekumar P G,Spee C,et al.Deficiency of alphaB crystallin augments ER stress-induced apoptosis by enhancing mitochondrial dysfunction[J].Free Radic Biol Med,2012,53(5):1111-1122.
[19] Shore G C,Papa F R,Oakes S A.Signaling cell death from the endoplasmic reticulum stress response[J].Curr Opin Cell Biol,2011,23(2):143-149.
[20] Okada K,Minamino T,Tsukamoto Y,et al.Prolonged endoplasmic reticulum stress in hypertrophic and failing heart after aortic constriction:Possible contribution of endoplasmic reticulum stress to cardiac myocyte apoptosis[J].Circulation,2004,110(6):705-712.
[21] Zhao H,Liao Y,Minamino T,et al.Inhibition of cardiac remodeling by pravastatin is associated with amelioration of endoplasmic reticulum stress[J].Hypertens Res,2008,31(10): 1977-1987.
[22] Marciniak S J,Yun C Y,Oyadomari S,et al.CHOP induces death by promoting protein synthesis and oxidation in the stressed endoplasmic reticulum[J].Genes Dev,2004,18(24): 3066-3077.
[23] Szegedi E,Duffy A,O’Mahoney M E.ER stress contributes to ischemia-induced cardiomyocyte apoptosis[J].Biochem Biophys Res Commun,2006,349(4):1406-1411.
[24] Chang L,Karin M.Mammalian MAP kinase signalling cascades[J].Nature,2001,410(6824):37-40.
[25] Johnson G L,Lapadat R.Mitogen-activated protein kinase pathways mediated by ERK,JNK,and p38protein kinases[J].Science,2002,298(5600):1911-1912.
(2015-03-02 收稿)
Hydrogen Sulfide Inhibits Endoplasmic Reticulum Stress-induced Myocardial Cell Apoptosis by Activating ERK
Zhu Xiaoying1,2#,Wang Guimei1#,Hu Min1et al
1Department of Physiology,School of Basic Medicine,Wuhan University,Wuhan 430071,China
2Department of Pathogen Biology,Medical College of Henan University of Science and Technology,Luoyang 471003,China
Objective To investigate whether hydrogen sulfide(H2S)protects cardiomyocytes from endoplasmic reticulum stress-induced apoptosis by activating the extracellular signal regulation kinase(ERK).Methods A total of 60SD rats were randomly divided into control group,ISO group,NaHS+ISO group and PD98059group(n=15in each group).Animals in control group was injected with saline;those in ISO group was intraperitoneally injected with saline at the same volume as control group for 4days,and subcutaneously injected with ISO at 10mg/kg and 5mg/kg,respectively,on the back,30min after the intraperitoneal injection with saline at the later 2days;those in NaHS+ISO group was intraperitoneally injected with 14μmol/kg NaHS once a day for 2days,twice a day for 2days,and then subcutaneously injected with ISO 10mg/kg and 5mg/kg,respectively,on the back,30min after NaHS injection at the later 2days;those in PD98059group was given the same treatment as NaHS+ISO group except intravenous injection with 4mg/kg PD98059(ERK inhibitor)via the caudal vein before ISO injection.Animals were fasted for 12hafter last injection with ISO.The heart function was monitored with physiologic signal analysis system and the electrocardiogram was recorded.The H2S concentration in plasma was biochemically determined.The myo-cardial infarction size and the apoptosis index(AI)of cardiomyocytes was measured by TTC staining and TUNEL assay,respectively.And the expression of GRP78,CHOP and p-ERK were detected in the myocardial tissue by using immunohistochemistry.Results The H2S concentration was much lower in ISO group than in control group(P<0.01for all).NaHS(14μmol/kg)could significantly improve the impaired heart function caused by myocardial ischemia,which could be reversed by PD98059.The expression of GRP78and CHOP was significantly decreased,that of p-ERK was significantly increased and the AI and the myocardial infarction size were profoundly reduced in NaHS+ISO group when compared with ISO group(P<0.05).However,the myocardial infarction size,the AI,the expression of GRP78and CHOP were obviously increased,while the heart function was significantly attenuated in PD98059group when compared with NaHS+ISO group(all P<0.05).There was no statistical difference in p-ERK expression between the two groups.Moreover,the correlation analysis showed that the expression of CHOP and AI had a negative correlation with the expression of p-ERK in myocardial tissues(P<0.01).Conclusion The decrease of endogenous H2S and the endoplasmic reticulum stress may be involved in the occurrence and development of acute ischemic myocardial injury.The protective effect of H2S on ischemic myocardia may be associated with the activation of ERK and thereby inhibit the apoptosis induced by the endoplasmic reticulum stress.
hydrogen sulfide; myocardial ischemia; endoplasmic reticulum stress; extracellular signal regulation kinase; GRP78; CHOP
R363.1
10.3870/j.issn.1672-0741.2015.03.002
*国家自然科学基金资助项目(No.31071005)
#同为第一作者
祝晓莹,女,1982年生,硕士研究生,E-mail:luofan3904@sina.com;王桂美,女,1986年生,硕士研究生,E-mail:yuhan-zp@163.com△通讯作者,Corresponding author,E-mail:yanxiaohong461@126.com

