贝伐单抗联合替莫唑胺同步放疗治疗新诊断的胶质母细胞瘤的有效性和安全性
张堃莫立根邓腾陈海南张东伟王琳李小阳
作者单位:530021 南宁1广西医科大学附属肿瘤医院神经外科;264000 烟台2青岛大学医学院附属烟台毓璜顶医院乳腺外科;530021 南宁3广西医科大学研究生学院
循证医学
贝伐单抗联合替莫唑胺同步放疗治疗新诊断的胶质母细胞瘤的有效性和安全性
张堃1,2莫立根1邓腾1陈海南1张东伟3王琳3李小阳3
作者单位:530021 南宁1广西医科大学附属肿瘤医院神经外科;264000 烟台2青岛大学医学院附属烟台毓璜顶医院乳腺外科;530021 南宁3广西医科大学研究生学院
目的系统评价贝伐单抗联合替莫唑胺同步放疗治疗新诊断的多形性胶质母细胞瘤(glioblastomamultiforme,GBM)的有效性和安全性。方法 以计算机检索PubMed、Cochrane图书馆、EMBASE和万方数据库并收集所有相关临床研究资料。由两名研究者分别独立检索相关数据库,筛选相关文献并提取相关数据。采用RevMan 5.3统计学软件进行Meta分析。随机对照研究质量评价参考Cochrane系统评价手册推荐的方法。结果 纳入4个前瞻性临床研究,共计1 773例患者,其中试验组891例,对照组882例。Meta分析结果显示:与单纯替莫唑胺联合放疗相比,贝伐单抗联合替莫唑胺同步放疗治疗新诊断的GBM可以提高患者6个月(RR=0.44,95%CI:0.37~0.52,P<0.001)和12个月(RR=0.78,95%CI:0.73~0.84,P<0.001)的无疾病进展生存时间,同时也显著提高患者12个月(RR=0.86,95%CI:0.74~0.99,P=0.03)的总生存率,但增加了高血压病(RR=3.11,95%CI:2.39~4.06,P<0.001)、出血(RR=1.85,95%CI:1.50~2.27,P<0.001)不良反应的发生率,而血管栓塞性疾病、伤口愈合并发症、内脏穿孔等不良反应发生率比较的差异无统计学意义(P>0.05)。不良反应经治疗后均得以缓解。结论 贝伐单抗联合替莫唑胺同步放疗治疗新诊断的GBM可延长患者的无疾病进展生存时间和总生存率,但增加不良反应的发生。
脑肿瘤;新诊断胶质母细胞瘤;贝伐单抗;替莫唑胺;同步放疗;有效性;安全性;系统评价
多形性胶质母细胞瘤(glioblastomamultiforme,GBM)又称胶质母细胞瘤,是起源于中枢神经系统最致命的原发性恶性肿瘤[1],手术后复发率高,预后较差。手术后联合替莫唑胺同步放疗是目前治疗新诊断的GBM的标准方案。虽然该治疗方案使新诊断GBM患者生存获益,但其中位生存期仅为14.6个月,5年生存率仅为9.8%[2,3],疗效不尽如人意。相关研究表明[4],GBM可分泌大量血管内皮生长因子(vascular endothelial growth factor,VEGF),VEGF与GBM血管的发生、发展有关,因此,VEGF成为治疗GBM的重要靶点。贝伐单抗作为一种抗血管生成的药物,2009年已被美国FDA批准用于治疗复发性脑胶质瘤[5],但治疗新诊断的GBM是否同样获益尚处于探索阶段。本文拟采用系统评价的方法评价贝伐单抗联合替莫唑胺同步放疗治疗新诊断的GBM的疗效及安全性,为新诊断的GBM的临床治疗提供循证医学证据。
1 资料与方法
1.1 文献纳入标准
1.1.1 研究类型 前瞻性临床研究,发表语种不限。对于重复发表的研究,保留病例数最大、数据最全的文献。
1.1.2 研究对象 ⑴年龄大于18岁;⑵接受手术治疗;⑶术后病理组织学明确诊断为原发性GBM患者,诊断标准符合WHO关于脑胶质瘤分级的诊断要求;⑷生活质量Karnofsky功能状态(KPS)评分≥60分。1.1.3 干预措施 贝伐单抗联合替莫唑胺同步放疗。1.1.4 观察指标 总生存率(OS)、无疾病进展生存时间(PFS)、不良反应。
1.2 排除标准
⑴影像学资料提示近期有颅内出血征象者、有严重的心肺功能障碍者、严重肝肾功能损害者、严重血液系统及消化系统疾病者、严重感染及营养不良者、妊娠及哺乳期妇女、严重精神及神经疾病者;⑵未提供生存数据或生存数据无法提取的文献。
1.3 文献检索策略
计算机检索PubMed、Cochrane图书馆、EMBASE和万方数据库。检索时间均为建库至2015年2月。中文检索词为“脑胶质瘤”、“脑胶质母细胞瘤”、“贝伐单抗”。英文检索词为“glioma”、“glioblastoma”、“spongioblastoma”、“spongiocytoma”、“Malignant glioma”、“bevacizumab”。同时结合各数据库的主题词和自由词进行检索。
1.4 资料提取
由2名研究者分别阅读所检索文献的题目和摘要,并排除明显不符合纳入标准的文献,尔后阅读全文,以确定是否符合纳入标准。2位研究者交叉核对纳入试验的结果,对有分歧难以确定的试验通过第3位研究者决定是否纳入。
1.5 文献质量评价
由2名评价员独立进行,如遇不同意见则讨论解决或咨询第3位评价者。对于偏倚风险评估,依据Cochrane系统评价员手册(5.1.0版)中随机对照研究(RCT)的偏倚风险评价标准评价纳入研究的方法学质量,具体内容为:⑴随机分配方法;⑵分配隐藏;⑶是否采用盲法;⑷结果数据的完整性;⑸无选择性报告研究结果;⑹无其他偏倚来源。根据以上6条采用“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)进行评价。
1.6 统计学方法
采用Cochrane协作网提供的RevMan 5.3统计学软件进行Meta分析。计数资料采用相对危险度(RR)为疗效分析统计量,各效应量均以95%CI表示。各研究的异质性检验采用χ2检验和I2检验。如I2≤50%,则各研究间统计学异质性较小,可采用固定效应模型分析;若I2>50%,则认为研究间存在异质性,可采用随机效应模型合并效应量。若异质性过大无法合并则放弃Meta分析,只做一般的统计描述。
2 结果
2.1 文献检索结果
根据文献的纳入和排除标准,最终纳入4篇英文文献[6~9],其中2篇RCT[7,8],1篇前瞻性队列研究[6]和1篇无对照组的观察性研究[9]。共计1 773例患者,其中试验组891例,对照组882例。各纳入研究的试验组治疗方案为贝伐单抗联合替莫唑胺同步放疗,对照组的治疗方案为安慰剂联合替莫唑胺同步放疗。纳入研究的基本特征见表1、表2。
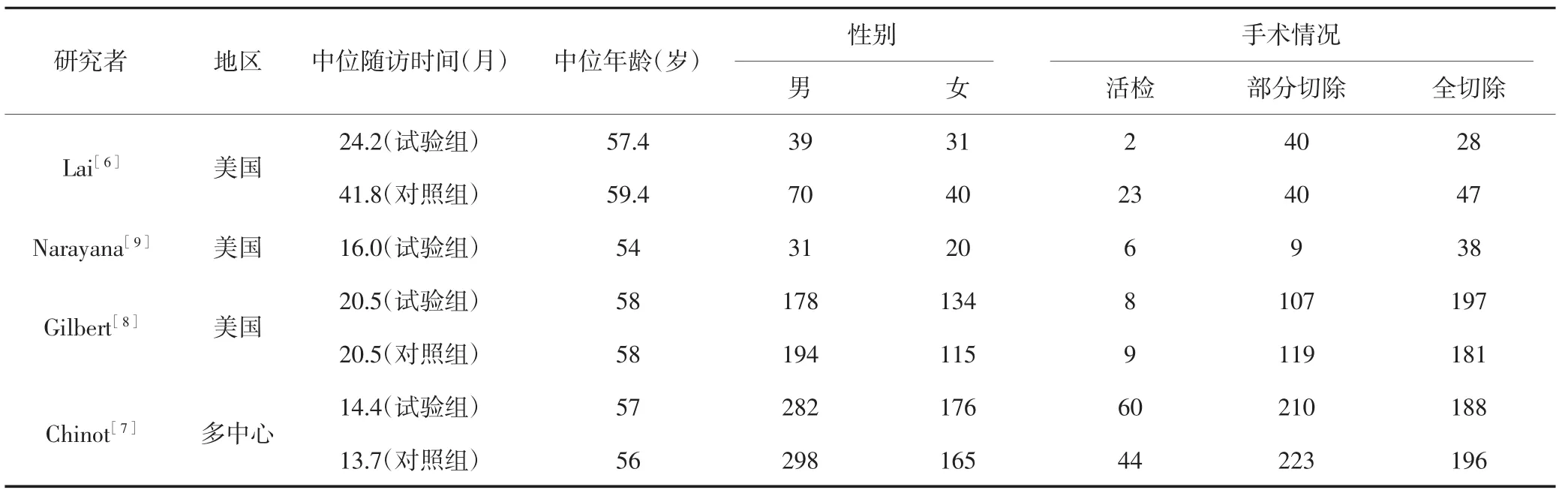
表1 纳入研究的基本特征(n)

表2 纳入研究的具体干预措施
2.2 纳入研究的方法学质量评价
根据Cochrane推荐的文献质量评价条目,纳入的2篇随机对照研究偏倚风险低。见表3。
2.3 Meta分析结果
2.3.1 总生存率 1篇前瞻性队列研究[8]和2个RCT[9,10]比较了贝伐单抗联合替莫唑胺同步放疗与替莫唑胺同步放疗6个月、12个月和24个月的OS。试验组840例,对照组882例,共计1 722例。结果显示,两组患者6个月(RR=0.69,95%CI:0.42~1.13,P=0.14)、24个月(RR=1.01,95%CI:0.91~1.13,P=0.81)OS比较的差异均无统计学意义。但两组患者12个月(I2=6%,RR=0.86,95%CI:0.74~0.99,P=0.03)OS比较的差异有统计学意义。提示贝伐单抗可以有效提高新诊断的GBM患者12个月的OS。见图1。
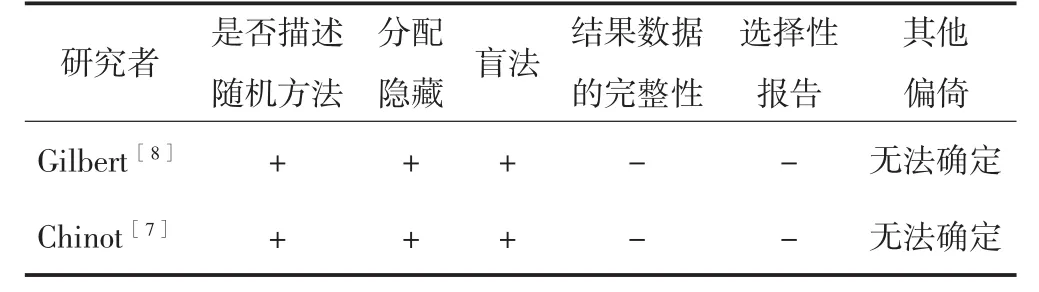
表3 纳入随机对照试验的质量评估
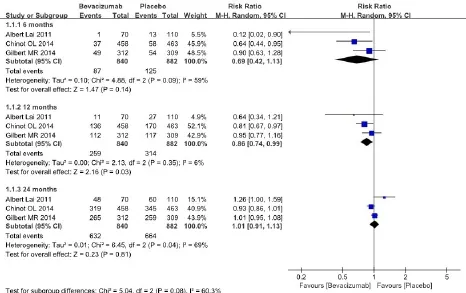
图1 两组患者总生存率的M eta分析结果
2.3.2 无疾病进展生存期 1篇前瞻性队列研究[6]和2个RCT[7,8]比较了贝伐单抗联合替莫唑胺同步放疗与替莫唑胺同步放疗6个月、12个月和24个月的PFS。试验组839例,对照组882例,共计1 721例患者。结果显示,两组患者6个月(RR=0.44,95%CI:0.37~0.52,P<0.001)、12个月(RR=0.78,95%CI:0.73~0.84,P<0.001)PFS比较的差异均有统计学意义。提示试验组治疗方案可以有效提高新诊断的GBM患者6个月、12个月的PFS。但两组患者24个月(RR=1.01,95%CI:0.96~1.07,P=0.60)PFS比较的差异无统计学意义。
2.3.3 不良反应 2个RCT[7,8]比较了贝伐单抗联合替莫唑胺同步放疗与替莫唑胺同步放疗引起的高血压病、血管栓塞性疾病、术后伤口愈合并发症、出血、内脏穿孔和蛋白尿、疲劳、恶心呕吐及免疫力低下等其他不良反应,试验组764例,对照组750例,共1514例患者。结果显示,两组患者高血压病发生率(RR=3.11,95%CI:2.39~4.06,P<0.001)、出血发生率(RR=1.85,95%CI:1.50~2.27,P<0.001)比较的差异均有统计学意义,试验组患者高血压病、出血的发生率明显高于对照组。贝伐单抗联合替莫唑胺同步放疗组患者的蛋白尿、疲劳、恶心呕吐及免疫力低下等其他不良反应的发生率亦显著增高(RR=1.74,95%CI:1.46~2.08,P<0.001)。而两组患者血管栓塞性疾病(RR=1.25,95%CI:0.91~1.71,P=0.17)、伤口愈合并发症(RR=1.55,95%CI:0.92~2.61,P=0.10)、内脏穿孔(RR=2.94,95%CI:0.80~10.82,P=0.11)发生率比较的差异均无统计学意义。
3 讨论
GBM具有发病率高、复发率高、病死率高、治愈率低的特点,目前仍以手术治疗为主,术后辅以放疗和化疗。尽管近年来影像学和显微外科设备不断更新,显微外科手术配合神经导航、术中B超、术中MRI、术中荧光实时导航等技术广泛应用于GBM切除术,但肿瘤全切除率仍然不理想,术后患者5年生存率小于5%。其原因与GBM呈侵袭性生长、缺乏包膜、与正常脑组织分界不清密切相关。Stupp等[2,3]发现,与GBM术后单纯放射治疗相比,术后替莫唑胺同步放化疗加辅助化疗的GBM患者5年生存率从1.4%提高到9.8%。该方案也是目前新诊断的GBM治疗的标准方案。然而患者经标准方案治疗后5年生存率仍然小于10%,预后依然较差。因此如何对GBM手术、放疗和化疗等治疗模式进行挖掘和优化,进一步提高患者生存率、改善其预后仍是广大医务工作者积极探索的重大课题。
随着GBM治疗研究的不断深入,分子靶向生物治疗成为当前肿瘤治疗研究的热点。GBM和大部分神经系统肿瘤一样,其生长、浸润依赖于血管自身的不断生成和血管所提供的营养物质。GBM可分泌大量VEGF,这些生长因子结合血管内皮细胞上的血管内皮生长因子受体,促进新血管的生成,是治疗GBM的重要靶点。
近年,国外已开展贝伐单抗治疗复发性GBM的临床研究[11,12]。研究表明贝伐单抗治疗复发性GBM不仅延长患者OS及PFS,同时还提高了患者的生活质量。基于以上临床研究结果,美国FDA于2009年5月9日首次批准贝伐单抗治疗复发性GBM。但对于新诊断的GBM的治疗贝伐单抗是否同样有效?2011年Lai等[6]开展了一项多中心、开放、前瞻性Ⅱ期临床研究,评估贝伐单抗联合替莫唑胺同步放疗治疗70例初诊为脑GBM患者的疗效,对照组为110例使用替莫唑胺同步放疗的初诊患者,结果显示贝伐单抗联合替莫唑胺同步放疗治疗新诊断的GBM,中位生存期为19.6个月,PFS为13.6个月,对照组的中位生存期和PFS分别为21.2个月和7.6个月。提示虽然贝伐单抗能够延长患者的PFS,但并不能改善患者的总生存期,其不良反应也增多。Narayana等[9]以贝伐单抗治疗新诊断的GBM,结果显示中位生存期为23个月,PFS为13个月,同样提示贝伐单抗可有效延长GBM患者的PFS,而对生存期的延长无明显作用。上述研究结果均提示贝伐单抗治疗新诊断的GBM仍然存在争议。本研究结果表明,与单纯替莫唑胺联合放疗治疗新诊断的GBM相比,贝伐单抗联合替莫唑胺同步放疗治疗可以有效提高新诊断的GBM患者6个月、12个月的PFS和12个月的OS,而对6个月、24个月的OS则无明显延长作用。
贝伐单抗作为一种分子靶向药物,有严重的不良反应。常见不良反应包括疲劳无力(45%)、高血压病(12%~34%)、蛋白尿(4%~36%)、鼻出血(19%~35%)、高凝状态或静脉血栓栓塞症(8%~21%)以及脑溢血、肾病综合征、胃肠穿孔、动脉血栓栓塞、脑缺血等少见的严重不良反应[13]。但这些不良反应可以通过减少剂量或停药缓解或消除。本研究纳入的4项研究[6~9]表明,应用贝伐单抗的严重不良反应(Grade≥3)主要表现为高血压病和出血,但经治疗后均得以缓解。2个随机试验[7,8]表明应用贝伐单抗发生严重不良反应的概率均大于对照组,其中一项研究[8]表明在贝伐单抗同步放疗期间,中性粒细胞减少是最常见的不良反应,但均未出现感染。而在贝伐单抗化疗维持阶段,血管栓塞性疾病和高血压病的发生率最高,分别为4.2%和7.7%。其他不良反应包括疲劳、皮肤黏膜及内脏出血、血小板减少、蛋白尿、伤口愈合不良和胃肠穿孔等,但均经治疗后得到改善。
综上,贝伐单抗联合替莫唑胺同步放疗治疗新诊断的GBM可延长患者6个月、12个月的无疾病进展生存时间及12个月的总生存率。高血压病、出血等不良反应增加,但可耐受,在使用贝伐单抗的过程中需要密切监测不良反应。由于本研究存在纳入文献数量及质量方面的局限性,贝伐单抗是否同样能使新诊断的GBM患者生存获益,尚需在今后的研究中进行多中心、大样本的前瞻性Ⅲ期临床研究,以得出更为可靠的结论指导临床。
[1] Zhan g W,Q i u X G,C h e n B S,et a l.A n t i an gi o g e n i c t h e r a py w i t h bev a c i zu m a b i n r ec u rr e n tm a l ig nan t g l i om a s:ana lys i s of t h e r espo n se an d co r e p a t h w a y a be rr a t i o n s[J].C h i n M ed J(E n g l),2009,122(11):1250-1254.
[2] S t u pp R,Ma so n W P,v an de n B e n t M J,et a l.Ra d i ot h e r a py pl u s co ncom i t an t an d a dj u v an t temo z olom i de fo r g l i obl a stom a[J].N E n g l J M ed,2005,352(10):987-996.
[3] S t u pp R,H e gi M E,Ma so n W P,et a l.E ffects of r a d i ot h e r a py w i t h co n com i t an t an d a dj u v an t temo z olom i de ve r s u s r a d i ot h e r a py a lo n e o n s u r v i v a l i n g l i obl a stom a i n a r an dom i sed p ha seⅢ st u dy:5-ye a r ana lys i s of t h e EO R TC-N CIC t ri a l[J].L an cet O n coly,2009,10(5):459-466.
[4] L i u Y,Zh o u Y,Zhan g X S,et a l.E xp r ess i o n of VEGF an d MMP-9 an d MR I i m a gi n g c han g es i n ce r eb r a l g l i om a[J].O n col Lett,2011,2(6):1171-1175.
[5] C o h e n MH,S h e n YL,K ee g an P,et a l.F D A d r u g a pp r ov a l s u mm a r y:bev a c i zu m a b(A v a st i n)a s t r e a tme n t of r ec u rr e n t g l i obl a stom a m u lt ifo r me[J].T h e O n colo gi st,2009,14(11):1131-1138.
[6] L a i A,T r an A,Ng h i emp hu P L,et a l.Pha seⅡst u dy of bev a c i zu m a b pl u s temo z olom i de d u ri n g an d a fte r r a d i a t i o n t h e r a py fo r p a t i e n ts w i t h n ew ly d i a g n osed g l i obl a stom a m u lt i fo r me[J].J C l i n O n col,2011,29(2):142-148.
[7] C h i n ot O L,W i ck W,Ma so n W,et a l.B ev a c i zu m a b pl u s r a d i ot h e r a pytemo z olom i de fo r n ewly d i a g n osed g l i obl a stom a[J].N E n g l J M ed,2014,370(8):709-722.
[8] Gi lbe r t MR,D ig na m JJ,Ar mst r o n g T S,et a l.A r an dom i z ed t ri a l of bev a c i zu m a b fo r n ewly d i a g n osed g l i obl a stom a[J].N E n g l J M ed,2014,370(8):699-708.
[9] N a r a y ana A,Gr u be r D,K unna kk a t S,et a l.A cl i n i c a l t ri a l of bev ac i zu m a b,temo z olom i de,an d r a d i a t i o n fo r n ewly d i a g n osed g l i obl a s-tom a[J].J N e u r os u rg,2012,116(2):341-345.
[10] Hu r w i t z H,F e h r e n b a c h e r L,N ovot n y W,et a l.B ev a c i zu m a b pl u s iri n otec an,fl u o r o u r a c i l,an d le u covo ri n fo r met a st a t i c colo r ect a l c ance r[J].N E n g l J M ed,2004,350(23):2335-2342.
[11]Fri edm an H S,P r a dos M D,We n P Y,et a l.B ev a c i zu m a b a lo n e an d i n comb i na t i o n w i t h iri n otec an i n r ec u rr e n t g l i obl a stom a[J].J C l i n O n col,2009,27(28):4733-4740.
[12]K r e i sl T N,K i m L,M oo r e K,et a l.Pha se II t ri a l of s i n g le-a g e n t bev ac i zu m a b followed by bev a c i zu m a b pl u s iri n otec an a t t u mo r p r o gr ess i o n i n r ec u rr e n t g l i obl a stom a[J].J C l i n O n col,2009;27(5):740-745.
[13]Ar mst r o n g T S,We n P Y,Gi lbe r t MR,et a l.Mana g eme n t of t r e a tme n ta ssoc i a ted tox i c i tes of an t i-an gi o g e n i c t h e r a py i n p a t i e n ts w i t h b r a i n t u mo r s[J].N e u r o O n col,2012,14(10):1203-1214.
[2015-05-25收稿][2015-07-25修回][编辑 阮萃才]
Efficacy and safety of Bevacizumab combined w ith radiotherapy-temozolom ide to treat new ly diagnosed glioblastom a
ZHANG Kun1,2,MO Ligen1,DENG Teng1,CHEN Hainan1,ZHENG Dongwei3,WANG Lin3,LIXiaoyang3(1Department of Neurosurgery,Affiliated Tumor Hospitalof GuangxiMedical University,Nanning 530021,P.R.China;2Yantai Yuhuangding Hospital,Affiliated Medical CollegeofQindaoUniversity,Yantai264000,P.R.China;3Graduate schoolofGuangxiMedical University,Nanning 530021,P.R.China)Corresponding author:MO Ligen.E-mail:ligenmo@163.com
Objective To assess the efficacy and safety of Bevacizumab combined with Radiotherapy-Temozolomide to treat newly diagnosed glioblastoma.M ethods PubMed,The Cochrane Library,EMBASE,and theWanfang Databasewere systematically searched for relevant clinical studies.Two researchers assessed trial quality according to the Cochrane Manual and extracted data independently. Datawere analyzed using RevMan 5.3.Result Four prospective clinical trials,including two randomized controlled trials,were included in the review;these trials involved 891 patientswho received Bevacizumab combined with radiotherapy-temozolomide and 882 control patients who received radiotherapy-temozolomide.Meta-analysis indicated that combination therapy was associated with significantly higher 6-month progression-free survival(PFS;RR 0.44,95%CI 0.37-0.52,P<0.001),12-month PFS(RR 0.78,95%CI 0.73-0.84,P<0.001)and 12-month overall survival(RR 0.86,95%CI 0.74-0.99,P=0.03).At the same time,combination therapy was associatedwith significantly higher incidence of hypertension(RR 3.11,95%CI 2.39-4.06,P<0.001)and bleeding(RR 1.85,95%CI 1.50-2.27,P<0.001).Incidence of vascular thrombus diseases,wound-healing complications and internal organ perforation was similar for the two therapies.All treatment-related adverseeventswereeasily resolved.Conclusions Bevacizumab combinedwith radiotherapy-temozolomide can prolong progression-free and overall survival in patients with newly diagnosed glioblastoma,but it increases the risk of some adverse reactions.
Brain neoplasms;Newly diagnosed glioblastoma;Bevacizumab;Temozolomide;Concurrent radiotherapy;Efficacy;Safety;Systematic Review
R739.41
A
1674-5671(2015)04-06
10.3969/j.issn.1674-5671.2015.04.10
广西科学研究与技术开发计划资助项目(桂科攻14124004-2-16)
莫立根。E-mail:ligenmo@163.com

