白藜芦醇对大鼠肾脏缺血-再灌注损伤保护作用研究
宋先兵,张 宝,黄焱平,安 梅,方安宁,陈晓宇
◇药学研究◇
白藜芦醇对大鼠肾脏缺血-再灌注损伤保护作用研究
宋先兵1,张 宝2,黄焱平1,安 梅1,方安宁1,陈晓宇3
目的观察白藜芦醇(RES)对大鼠肾脏缺血-再灌注(I/R)保护作用并初步探讨其相关机制。方法SD大鼠随机分为4组:空白对照组、I/R模型组、白藜芦醇(RES)处理组、RES+IR模型组;检测各组大鼠血清肌酐(Cr)、尿素氮(BUN)及肾脏病理学改变,使用超氧化物歧化酶(SOD)活力、丙二醛(MDA)和谷胱甘肽过氧化物酶(GSH-PX)试剂盒检测肾脏组织SOD、MDA、GSH-PX产生;Western blot法检测肾脏组织p-AKT蛋白水平。结果与空白对照组相比,I/R模型组Cr、BUN含量均有升高,与I/R模型组相比,RES+I/R模型组Cr、BUN含量均有明显下降;病理学检测显示RES+I/R模型组肾脏损伤较I/R模型组明显减轻,肾小球结构基本正常,细胞间质有少量炎性细胞浸润,基底膜稍有增厚;与空白对照组相比,I/R模型组SOD、MDA、GSH-PX含量均有升高,与I/R模型组相比,RES+I/R模型组SOD、GSH-PX含量均有明显下降;Western blot检测显示,与空白对照组相比,I/R模型组p-AKT表达水平有所降低,但RES可提高p-AKT表达水平,差异有统计学意义。结论RES通过氧化应激保护I/R肾脏损伤,其作用机制可能与PI3K/AKT信号通路活化有关。
白藜芦醇;缺血-再灌注;氧化应激;AKT
白藜芦醇(resveratol,RES)是植物体内一种天然的二苯乙烯类多环基酚化物质,化学名为3,4,5-三羟基酚,研究[1-2]表明,RES可对肿瘤、缺血、动脉粥样硬化等多种疾病具有良好的治疗作用。其保护及治疗机制可能由于RES是一种抗自由基抗氧化剂,但其具体的作用机制尚不清楚[3]。肾脏缺血-再灌注(ischemia-reperfusion,I/R)损伤是临床上导致缺血性急性肾衰竭的主要原因之一,病死率高,且存活的患者也会伴有不同程度的慢性肾功能损害[4]。脂质过氧化是I/R导致肾脏组织损伤的重要机制,因此寻找积极有效的脂质过氧化治疗药物,保护肾脏细胞免受过度氧化应激的损伤,对保护I/R过程产生的肾脏损害具有重要意义[5]。该研究观察RES治疗后肾脏I/R的保护作用及其可能的分子生物学机制。
1 材料与方法
1.1 实验动物健康雄性SD大鼠40只,250~300 g,SPF级,购自安徽省实验动物中心。
1.2 主要试剂与仪器RES、戊巴比妥钠(中国医药上海化学试剂公司);超氧化物歧化酶(superoxide dismutase,SOD)活力、丙二醛(malondialdehyde,MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)试剂盒(南京建成生物工程研究所);兔抗大鼠p-AKT抗体(美国CST公司)。Universal 320/320R型低温高速离心机(德国Hettich公司);μQuant酶标仪(美国Bio-Tek公司);AUW 220D电子分析天平(日本岛津公司)。
1.3 实验方法
1.3.1 实验动物分组 将SD大鼠适应性饲养1周后,随机分为空白对照组(10只)、I/R模型组(10只)、RES预处理组(10只)、RES+I/R模型组(10只)。
1.3.2 大鼠I/R模型制备 模型组动物以2%戊巴比妥纳(0.25 ml/100 g)腹腔注射麻醉,腹部正中切口暴露腹腔,小心分离双侧肾蒂,以无创动脉夹关闭左侧肾动脉1 h,然后开放动脉血流,同时切除右侧肾脏。开放血流后肾脏由暗红变为鲜红,表明再灌注成功,缝合腹腔。并于缺血24 h处死动物,股动脉取血,留取肾脏标本[6-7]。RES治疗组于建模前1 h腹腔注射RES(3 mg/kg)进行预处理[8];空白对照组不做任何处理;RES预处理组与RES治疗组处理相同,但不建立I/R模型。于造模24 h后麻醉处死各组大鼠。
1.4 病理学检测及评分各组大鼠处死后,取左侧肾脏组织,将少量组织固定于10%甲醛中,固定48
2015-04-08接收
基金项目:国家自然科学基金(编号:81373421)
作者单位:1安徽医学高等专科学校人体解剖与组织胚胎教研室,合肥 230601
2安徽医科大学第一附属医院临床营养科,合肥 230022
3安徽医科大学组胚教研室,合肥 230032
作者简介:宋先兵,男,讲师,硕士;
陈晓宇,男,博士,教授,责任作者,E-mail:cxyayd@163. com
h后制作蜡块,制成5μm切片,采用苏木精-伊红(HE)染色法观察小鼠肾脏的病理变化。病理评分方法参照文献
[9]
,镜下随机选择10个视野,观察肾小管上皮细胞肿胀、空泡形成和脱化等,评分等级分为0~5分,分别为:0分(无);1分(≤10%);2分(11%~25%);3分(26%~45%);4分(46%~75%);5分(≥76%)。
1.5 肾功能及脏器系数检测各实验组大鼠处死后,腹主动脉取血,4 000 r/min离心10 min,离心半径为87 mm,取血清,脲酶法检测肌酐(creatinine,Cr)和尿素氮(blood urea nitrogen,BUN)水平。各实验组大鼠处死后,取血后颈椎脱臼处死动物,迅速摘取左侧肾脏,冷生理盐水冲洗后用滤纸吸干,称重,计算脏器系数。计算方法:脏器系数(%)=脏器重量/体重×100%。
1.6 生化指标测定大鼠再灌注24 h后将大鼠处死,取部分肾脏组织制备匀浆,分别按照试剂盒操作方法测定肾脏组织SOD、MDA、GSH-PX含量。
1.7 W estern blot法测定p-Ak t蛋白表达称取冻存肾脏样品0.1 mg,冰浴,加入500μl组织裂解液,冰浴匀浆,4℃、12 000 r/min离心10 min,收集上清液50 m l,应用BCA蛋白定量试剂盒进行蛋白定量,加入4×Loading buffer与上清液混匀变性10 min,每个样品的总蛋白为20μg上样,进行SDSPAGE凝胶电泳(浓缩胶为5%,分离胶为12.5%),后转至PVDF膜,5%脱脂奶粉封闭2 h,一抗封闭4℃过夜,PBST(PBS+吐温-20),洗膜3次,每次10 min;二抗(1∶20 000)室温孵育12 h(羊抗兔),PBST漂洗后,用ECL增强化学发光法检测蛋白表达,使用IPP 6.0软件进行灰度值分析。
1.8 统计学处理用SPSS 11.0统计软件ANOVA法进行显著性检验,实验数据均用±s表示,组间比较采用最小显著性差数法(LSD法)。
2 结果
2.1 肾功能及脏器系数检测结果 空白对照组与RES预处理组相比差异无统计学意义(P>0.05),与空白对照组相比,I/R模型组Cr、BUN含量及脏器系数均有升高,差异有统计学意义(P<0.05),与IR模型组相比,RES+IR模型组Cr、BUN含量及脏器系数均有明显下降,差异有统计学意义(P<0.05)。见表1。
2.2 病理学检测结果各组大鼠肾脏组织病理图片见图1,空白对照组与RES预处理组可见清晰的肾小球结构,基底膜未见明显增厚和融解,无粘连变性现象,细胞间质未见炎性细胞浸润,I/R模型组大鼠肾脏均出现不同程度的损伤现象,镜下可见肾皮质内肾小囊消失,肾小管上皮细胞空泡样变性改变,细胞间质出现大量的炎性细胞浸润和球旁器增生等病理改变,RES+IR模型组肾脏损伤较I/R模型组明显减轻,肾小球结构基本正常,细胞间质有少量炎性细胞浸润,基底膜稍有增厚。
2.3 各组大鼠肾脏SOD、MDA及GSH-PX含量
空白对照组与RES预处理组相比,各指标无明显差异(P>0.05),与空白对照组相比,I/R模型组SOD、MDA、GSH-PX含量均有升高,差异有统计学意义(P<0.05),与IR模型组相比,RES+I/R模型组SOD、GSH-PX含量均明显下降,差异有统计学意义(P<0.05)。见表2。
2.4 各组大鼠肾脏组织p-AKT蛋白表达情况与空白对照组相比,I/R模型组p-AKT表达水平有所降低,但RES提高p-AKT表达水平,差异有统计学意义(F=1 863.872,P<0.05)。见图2。
3 讨论
RES是一种天然的蒽醌萜类化合物,是近年来研究较多的一种植物抗毒素,可从虎杖等根茎中提取,具有较强的抗肿瘤、抗炎、调节免疫及保护心血管等作用,其作用机制涉及抑制脂质过氧化、抑制血小板聚集合组织因子的表达、促进血管舒张等[10]。
肾脏I/R在临床疾病及治疗中有时难以避免,如肾动脉手术、肾移植、心跳骤停、高血压和休克等。I/R引起的肾脏损伤最主要的是发生在缺血后再灌注阶段。其机制可能是再灌注过程中产生的活性氧自由基产物诱导氧化应激炎性损伤和脏器功能障碍[11]。抗氧化治疗已被证实对肾脏I/R损伤具有保护作用,机体发生氧化应激时,体内的抗氧化能力减弱,具有清除活性氧(reactive oxygen species,ROS)的抗氧化酶如SOD、GSH-PX,从而导致ROS的过度积聚[12]。SOD是体内唯一能够直接清除氧自由基的酶,对肾组织抵御自由基的损伤发挥着重要作用,同时GSH-PX的降低提示组织氧化应激的过度激活和抗氧化能力下降。体内大量的ROS能攻击生物膜中的多不饱和脂肪酸,引发其脂质过氧化,从而形成大量的脂质过氧化产物,如MDA等。研究[13]显示MDA能直接反映体内氧化应激水平,并可反映组织细胞氧化损伤的程度。本研究显示,使用RES治疗肾脏I/R后,大鼠肾脏组织SOD和GSH-PX含量相对增多,MDA生产明显降低,表明RES具有较好地清除细胞内氧化毒性物质的能力,且具有促进SOD产生的作用。
表1 各组大鼠肾脏功能及脏器系数检测结果=10)

表1 各组大鼠肾脏功能及脏器系数检测结果=10)
与空白对照组比较:*P<0.05;与RES+IR模型组比较:#P<0.05
项目空白对照组I/R模型组RES预处理组RES+IR模型组F值Cr(μmol/L)93.20±13.74 252.50±31.88*#98.39±12.45 116.33±18.32*81.096 BUN(mmol/L)8.86±0.75 11.55±1.76*#8.48±0.85 9.58±0.91 2.461脏器系数(%)0.74±0.08 0.99±0.12*#0.80±0.11 0.82±0.05*11.613
表2 各组大鼠肾脏SOD、MDA及GSH-PX含量比较,n=10)
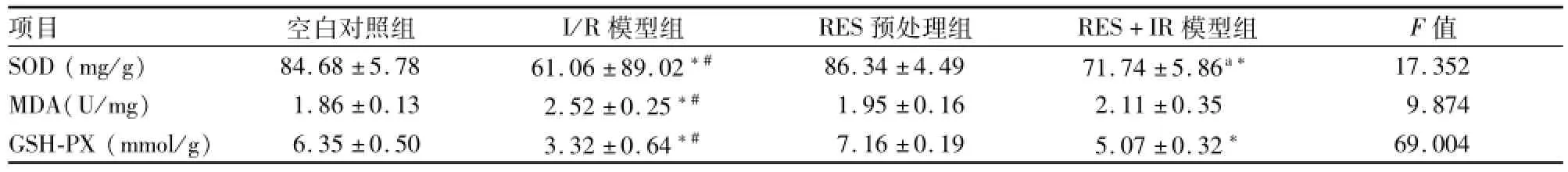
表2 各组大鼠肾脏SOD、MDA及GSH-PX含量比较,n=10)
与空白对照组比较:*P<0.05;与RES+IR模型组比较:#P<0.05
项目空白对照组I/R模型组RES预处理组RES+IR模型组F值SOD(mg/g)84.68±5.78 61.06±89.02*#86.34±4.49 71.74±5.86a*17.352 MDA(U/mg)1.86±0.13 2.52±0.25*#1.95±0.16 2.11±0.35 9.874 GSH-PX(mmol/g)6.35±0.50 3.32±0.64*#7.16±0.19 5.07±0.32*69.004
PI3K/AKT是一条经典的存活信号通路,在细胞凋亡和肿瘤发生中发挥着重要作用。PI3K可以使其下游分子Akt磷酸化。研究[14]显示RES可以通过降低受氧化应激刺激的HUVEC细胞内ROS、MDA产生、提高SOD生成、促进Nrf2蛋白表达来发挥氧化应激能力,且这一作用的机制可能与活化PI3K/AKT通路有关;同时,PI3K/AKT信号通路及氧化应激在大鼠脑I/R损伤中发挥重要作用[15]。本研究显示RES能够减轻I/R过程中的肾脏损伤,同时RES可提高p-AKT水平。
综上所述,推测RES可保护I/R肾脏损伤,主要是由于其SOD和GSH-PX含量相对增多,MDA产生明显降低来发挥其抗氧化应激能力,且这一作用机制可能与PI3K/AKT活化有关。
[1] Nakata R,Takahashi S,Inoue H.Recent advances in the studyon resveratrol[J].Biol Pharm Bull,2012,35(3):273-9.
[2] Dhar S,Kumar A,Li K,et al.Resveratrol regulates PTEN/Akt pathway through inhibition of MTA1/HDAC unit of the NuRD complex in prostate cancer[J].Biochim Biophys Acta,2014,1853(2):265-75.
[3] LiC,Xu X,Tao Z,etal.Resveratrol dimers,nutritional components in grape wine,are selective ROS scavengers and weak Nrf2 activators[J].Food Chem,2015,173:218-23.
[4] Danobeitia JS,Djamali A,Fernandez L A.The role of complement in the pathogenesis of renal ischemia-reperfusion injury and fibrosis[J].Fibrogenesis Tissue Repair,2014,7:16.
[5] Senbel A M,AbdelMoneim L,Omar A G.Celecoxib modulates nitric oxide and reactive oxygen species in kidney ischemia/reperfusion injury and rat aorta model of hypoxia/reoxygenation[J]. Vascul Pharmacol,2014,62(1):24-31.
[6] Wang Z,Liu Y,Han Y,et al.Protective effects of aliskiren on ischemia-reperfusion-induced renal injury in rats[J].Eur JPharmacol,2013,718(1-3):160-6.
[7] Chen Y T,Tsai TH,Yang CC,et al.Exendin-4 and sitagliptin protect kidney from ischemia-reperfusion injury through suppressing oxidative stress and inflammatory reaction[J].J Transl Med,2013,11:270.
[8] Khader A,YangW L,Kuncewitch M,et al.Novel resveratrol analogues attenuate renal ischemic injury in rats[J].J Surg Res,2015,193(2):807-15.
[9] Chen Y T,Sun C K,Lin Y C,et al.Adipose-derived mesenchymal stem cell protects kidneys against ischemia-reperfusion injury through suppressing oxidative stress and inflammatory reaction[J]. JTranslMed,2011,9:51.
[10]Pendurthi U R,Rao L V.Resveratrol suppresses agonist induced monocyte adbesion to ultured human endotbelia Jcells[J].Thromb Res,2002,106(4-5):243-8.
[11]Kadkhodaee M,Aryamanesh S,FaghihiM,etal.Protection of rat renal vitamin E levels by ischemic-preconditioning[J].BMC Nephrol,2004,5:6.
[12]Stentz F B,Umpierrez GE,Cuervo R,et al.Proinflammatory cytokines,markers of cardiovascular risks,oxidative stress,and lipid peroxidation in patients with hyperglycemic crises[J].Diabetes,2004,53(8):2079-86.
[13]Bhatia S,Shukla R,Venkata Madhu S,et al.Antioxidant status,lipidperoxidation and nitric oxide end products in patients of type2 diabetesmellitus with nephropathy[J].Clin Biochem,2003,36(7):557-62.
[14]王宇霆,周海燕,吕小翠.白藜芦醇对过氧化氢氧化应激损伤人脐静脉血管内皮细胞的保护作用[J].中华医学杂志,2013,93(15):1174-7.
[15]王春燕,黄 萍,张朕华.3β-双水杨酰薯蓣皂苷元对脑缺血/再灌注损伤大鼠的梗死体积及P13K/Akt信号通路的影响[J].中国药理学通报,2013,29(12):1672-5.
Resveratol protects on renal ischem ical-reperfusion injury in rats
Song Xianbing1,Zhang Bao2,Huang Yanping1,et al
(1Dept of Human Anatomy and Histology and Embryology,AnhuiMedical College,Hefei 230601;2Deptof Clinical Nutrition,The First Affiliated Hospital of AnhuiMedical University,Hefei 230022)
Objective To investigate the protective effects of resveratrol(RES)on renal ischemia-reperfusion(I/R)injury and explore its possible mechanisms in rats.MethodsThe SD rats were randomly divided into four groups:blank control group,I/R model group,RES pretreatment group and RES+IR model group.We detected the contents of serum creatinine(Cr),blood urea nitrogen(BUN)and renal pathology in rat serum.Superoxide dismutase(SOD)activity stress,malondialdehyde(MDA)and glutathione peroxidase(GSH-PX)kitwere used to detect renal SOD,MDA,GSH-PX contents.We detected the level of p-AKT protein in renal tissue by western blot.ResultsCompared to the blank control group,the contents of Cr and BUN were increased in I/R model group.But compared to the I/Rmodelgroup,the contents of Cr and BUN were decreased significantly in RES+I/Rmodel group.Pathology detection found that kidney damage reduced significantly in RES+I/Rmodel group compared with I/Rmodel group,such as glomerular structure presenting basically normal,stromal cells presenting a few infiltration and basement membrane slightly thickened.Compared to the blank control group,SOD,MDA,GSH-PX contentswere increased in I/Rmodel group.But compared to I/R model group,SOD,MDA,GSH-PX were decreased significantly in RES+I/R model group.Compared to the blank control group,the expression of p-AKTwas decreased in I/Rmodel group,and we also found that resveratrol could increase the level of AKT phosphorylation,the difference was statistically significant.ConclusionResveratrol protects I/R renal injury via oxidative stress,and themechanism may be related with the activation of PI3K/AKT signal pathway.
resveratol;ischemia reperfusion;oxidative stress;AKT
R 692
A
1000-1492(2015)08-1111-04

