对电解稀硫酸溶液得到氧气与氢气的体积比为1∶5且溶液变红的探究
龙见涛


【摘要】 电解水时,为了增强水的导电性,通常要在水中加入少量的稀硫酸或氢氧化钠溶液;电极材料通常用惰性材料为电极。本文就对我化学实验室使用学校自购的H型水电解器(仪器编号:26002)电解稀硫酸,得到氧气与氢气的体积比为1∶5且接电源正极的玻璃管内溶液变为紫红色的异常现象进行探究。
【关键词】 电解稀硫酸 电极材料 异常现象 探究
【中图分类号】 G633.8 【文献标识码】 A 【文章编号】 1992-7711(2015)06-027-02
0
众所周知,电解水得到氧气与氢气的体积比约为1∶2,实验数据与理论相符。然而,我们实验得到的结果说出来你都不信,但事实确实发生了(如图所示)。按照开学初拟定的实验教学计划,我们把普通高中新课程标准实验教科书化学必修1P13页科学探究——【电解水】选定为学生实验,我实验室使用学校自购的H型水电解器(仪器编号:26002)作为电解水装置,用1∶40的稀硫酸作为电解质溶液,学生实验前,我们实验教师已经进行过实验预演,使用的电解器是2000年“普实”配送的仪器(仪器编号:2606),无异常实验现象发生。但是,到学生实验时,无一台不是得到氧气与氢气的体积比为1∶5且接电源正极的玻璃管内溶液变为紫红色(类似稀的高锰酸钾溶液颜色),虽然实验教师敷衍搪塞的回答了学生的疑问,但是几位实验教师感到奇怪,课后我们几位实验教师立即对这两个异常现象展开实验探究。
一、对学生实验异常现象的探究
猜想1:可能是电解质的纯度、电解质溶液的浓度、溶液的酸碱度的影响。
设计实验方案一:
试剂和仪器
工业浓硫酸、分析纯浓硫酸、氢氧化钠固体、蒸馏水
烧杯、量筒(10mL200mL)、托盘天平、H型水电解器(26002型)等
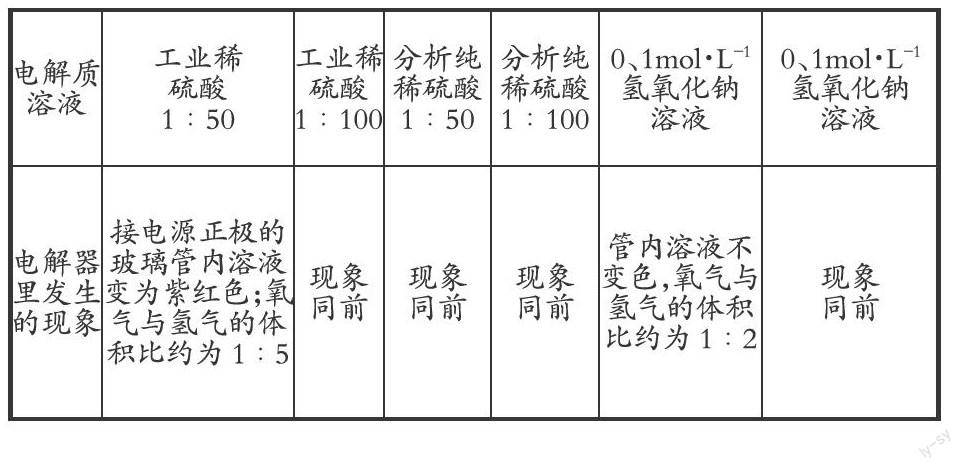
实验过程:分别用工业浓硫酸、分析纯浓硫酸各配制1∶50、1∶100稀硫酸200mL,配制0.1mol.L-1、0.2mol.L-1氢氧化钠溶液各200mL,将配制好的溶液分别注入6台H型水电解器(26002型)里,直流电压均为6V,接通直流电源,5分钟后比较水电解器内发生的现象,结果见表:
由实验现象可推知,使溶液变红、氧气与氢气的体积比约为1∶5的现象与电解质溶液显酸性有关,但是,在学生实验前教师用同样的酸进行过实验预演,实验现象无异常,不同的是使用的水电解器是2000年“普实”配送的仪器(仪器编号:2606),于是我们有如下猜想:
猜想2、可能是受电极材料的影响,才使溶液变红、氧气与氢气的体积比约为1∶5的现象。
设计实验方案二:该实验方案同于方案一,其它条件不变,改变电极材料,5分钟后比较水电解器内发生的现象,结果见表:
实验结果分析:
由实验一、二结果看,无论是用工业品硫酸还是分析纯硫酸作电解质,在电解器内发生的异常现象与电极材料有密切关系。
那么,我校实验室自购的这种水电解器里的电极材料是什么材料呢?有人猜想它是一种合金,可能含有铁、锰、铬等金属或合金,也有老师说:“看它的颜色是银白色的,硬度也大,可能是不锈钢”。于是,我们结合我校实验室现有的条件对电极材料组成成分进行肤浅的探究。
二、对电极材料组成成分的探究
实验1取出水电解器的电极材料放在桌面上,用磁铁吸引两根电极材料均被磁铁吸取,但吸引力较弱,说明电极材料是含铁或铬的合金。
实验2分别取出正、负极玻璃管内电解后的溶液约3毫升置于两支试管中,向试管中滴加0.05mol·L-1的硫氰化钾溶液,结果只有从接电源正极玻璃管内取出的溶液立即变得鲜红,实验说明溶液中含有Fe3+。再取正、负极管内的内溶液各5毫升置于试管中,使手电筒光从试管一侧照射溶液,可以看到从正极管内取出的红色液体形成一条光亮的“通路”(如图所示)。实验说明该溶液是胶体溶液。
实验1、2说明电极材料为铁的合金。
三、对学生实验中产生的溶液变红以及氧气与氢气的体积比约为1∶5的现象分析
假如该电极材料是铁的合金(不锈钢),不锈钢的主要成分是铁,用正极接钢发生正极反应Fe—2e→Fe2+,Fe2+易被氧气氧化成Fe3+,负极反应2H++2e→H2↑,因为是稀硫酸估计酸不够,马上负极反应就变成中性溶液中的反应O2+2H2O+4e→4OH-,OH-移动到正极管内发生反应:Fe3++3OH—→Fe(OH)3红褐色,少量不是沉淀是胶体,所以看到溶液变红。由于负极发生有氢气生成的电极反应,所以得到的氢气的体积增多。
实验启示:
做电解反应一般都用惰性材料做电极,如铂、石墨碳棒等,用氢氧化钠溶液来增强水的导电性;如果不明电极材料的成分,我们就电解氢氧化钠稀溶液,若要用不锈钢做电极也只能做负极问题倒不大。

