“点、线、面”三维视角认识离子积和溶度积曲线
王波 董厚方

离子积带数和溶度积常数是电解质溶液的难点,特别是离子积、溶度积曲线,既考查化学原理的理解,又渗透化学图像的分析。现结合典型试题,从“点、线、面”三个层面对离子积和溶度积曲线进行分析。
一、水的离子积曲线
水的离子积,水的离子积曲线是溶液中与关系的曲线。
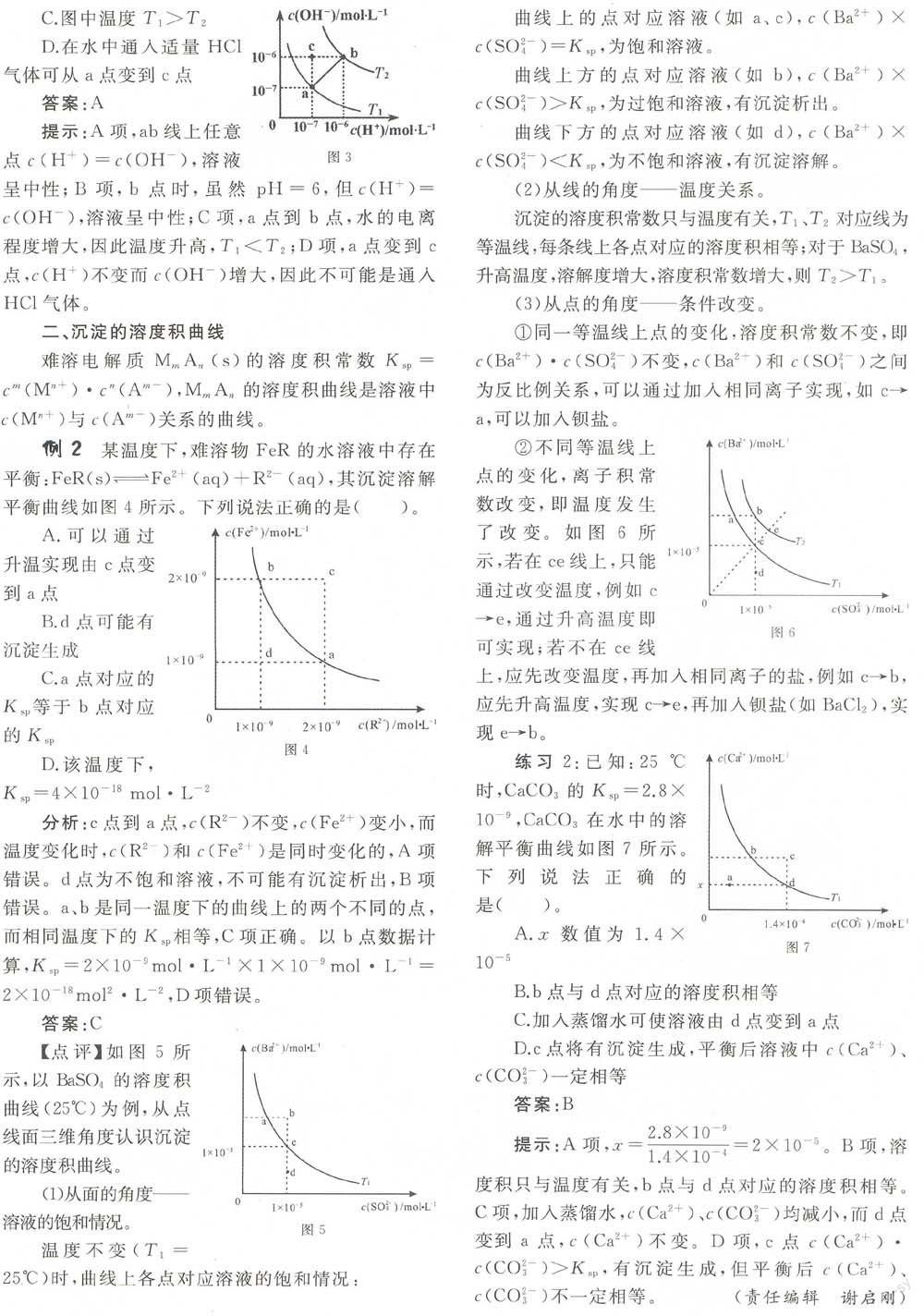
例1一定温度下,水溶液中H+和OH-的浓度变化曲线如图1,下列说法正确的是()。
A.升高温度.可能引起由c向1)的变化
B.该温度下,水的离子积常数为1.0×10”
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起m c向d的变化
分析:A项.图中曲线上的点代表某温度下的水的电离.升高温度,水的离子积常数发生改变,所以升温不可能引起由c向b的变化,错误。B项,b点对应的,错误。C项,水解显酸性,而图中a点,正确。D项,C和d的温度不同,所以稀释不会引起由c向d的变化,错误。
答案:C
【点评】如图2所示,从点线面三维角度认识水的咆离平衡曲线。
(1)从面的角度——溶液酸碱性。
ab线上,溶液呈中性,ab线以上,溶液呈碱性,ab线线以下,溶液呈酸性。
(2)从线的角度——温度关系。
水的离子积只与温度有关,T1、T2对应线为等温线,每条线上各点对应的离子积相等;水的电离吸热,升高温度,水的电离程度增大.水的离子积增大,则T2>T1,。
(3)从点的角度—一条件改变。
①同一等温线上点的变化,离子积常数不变,即不变,和之间为反比例关系,可以通过加入酸碱盐,如a→b可以加入HCL等酸或加入AICI3,等强酸弱碱盐。
②不同等温线上点的变化,离子积常数改变,即温度发生了改变。若在ab线上,只能通过改变温度,例如a→b.通过升高温度即可实现:若不在ab线上,应先改变温度,再加入酸、碱、盐,例如,应先升高温度,再加入NaOH等碱或等强碱弱酸盐。
练习1:图3表示水溶液中和的关系,下列说法正确的是()。
A.ab线上任意点溶液均显k 性
B.b点时,溶液的pH=6,显酸性
C.图中温度T1>T2
D.在水中通入适量HC1气体可从a点变到c点
答案:A
提示:A项,ab线上任意点,溶液呈中性;B项,b点时,虽然pH=6,但,溶液呈中性;C项,a点到b点,水的电离程度增大,因此温度升高,Tl二、沉淀的溶度积曲线
难溶电解质的溶度积常数的溶度积曲线是溶液中关系的曲线。
例2某温度下,难溶物FeR的水溶液中存在平衡:,其沉淀溶解平衡曲线如图4所示。下列说法正确的是()。
A.可以通过升温实现由c点变到a点
B.d点可能有沉淀生成
C.a点对应的Ksp等于b点对应的Ksp。
D.该温度下,
分析:c点到a点不变,c (Fe2+)变小,而温度变化时,c( R2-)和c(Fe2+)是同时变化的,A项错误。d点为不饱和溶液,不可能有沉淀析出,B项错误。a、b是同一温度下的曲线上的两个不同的点,而相同温度下的Ksp相等,C项正确。以b点数据计算,,D项错误。
答案:C
【点评】如图5所示,以BaS04的溶度积曲线(25℃)为例,从点线面三维角度认识沉淀的溶度积曲线。
(1)从面的角度——溶液的饱和情况。
温度不变(T1一25℃)时,曲线上各点对应溶液的饱和情况:
曲线上的点对应溶液(如a、c),为饱和溶液。
曲线上方的点对应溶液(如b),为过饱和溶液,有沉淀析出。
曲线下方的点对应溶液(如d),,为不饱和溶液,有沉淀溶解。
(2)从线的角度——温度关系。
沉淀的溶度积常数只与温度有关,T1、T2对应线为等温线,每条线上各点对应的溶度积相等;对于BaS04,升高温度,溶解度增大,溶度积常数增大,则T2 >T1。
(3)从点的角度——条件改变。
①同一等温线上点的变化,溶度积常数不变,即不变,和之间为反比例关系,可以通过加入相同离子实现,如c→a,可以加入钡盐。
②不同等温线上点的变化,离子积常数改变,即温度发生了改变。如图6所示,若在ce线上,只能通过改变温度,例如c→e,通过升高温度即可实现;若不在ce线上,应先改变温度,再加入相同离子的盐,例如c→b,应先升高温度,实现c→e,再加入钡盐(如BaCl2),实现e→b。
练习2:已知:25℃时,在水中的溶解平衡曲线如图7所示。下列说法正确的是()。
A.x数值为
B.b点与d点对应的溶度积相等
C.加入蒸馏水可使溶液由d点变到a点
D.c点将有沉淀生成,平衡后溶液一定相等
答案:B
提示:A项,B项,溶度积只与温度有关,b点与d点对应的溶度积相等。C项,加入蒸馏水,均减小,而d点变到a点,c(Ca2+)不变。D项,c点f(Ca2+).,有沉淀生成,但平衡后不一定相等。

